磷脂对高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出的影响
作者:李剑军 陈佩芳 吴满平 楼滨
单位:上海医科大学药学院生物化学教研室, 上海市 200032
关键词:巨噬细胞,;腹腔;胆固醇;卵磷脂;鞘磷脂;脂蛋白,高密度;大鼠
中国动脉硬化杂志000205[摘 要] 为了研究卵磷脂和鞘磷脂对高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出的影响,测定了细胞内胆固醇含量、磷脂含量及游离胆固醇-胆固醇酯平衡的变化。结果发现,各组细胞内胆固醇含量从79.75 μg/皿变为42.79、 37.16、 31.53 μg/皿; 高密度脂蛋白3组和卵磷脂组中卵磷脂磷含量分别为13.95和16.28 μg/皿;高密度脂蛋白和鞘磷脂组中鞘磷脂磷含量分别为5.03和7.01 μg/皿。细胞与BSA、卵磷脂、鞘磷脂单独孵育后,细胞内胆固醇含量分别为75.30、 74.65和73.09 μg/皿,游离胆固醇/总胆固醇比值分别为59.42%、56.95%和64.77%。结果提示卵磷脂和鞘磷脂均能促进高密度脂蛋白3介导细胞内胆固醇流出,后者强于前者,而卵磷脂和鞘磷脂单独不能促进细胞内胆固醇的流出。鞘磷脂促进细胞内胆固醇酯向游离胆固醇转化,卵磷脂促进细胞内游离胆固醇向胆固醇酯转化。
, 百拇医药
[中图分类号] Q548.1 [文献标识码] A
[文章编号] 1007-3949(2000)-02-0107-04
Effect of Phospholipids on the Cholesterol Efflux from Macrophages Mediated by High Density Lipoprotein-3
LI Jian-Jun, CHEN Pei-Fang, WU Man-Ping, and LOU Bin
(Department of Biochemistry, School of Pharmacy, Shanghai Medical University, Shanghai 200032, China)
ABSTRACT Aim To study the effect of phosphalipids on the cholesterol efflux from rat macrophages mediated by HDL3. Methods Measure the cholesterol content, cellular phospholipid content, and the balance between free cholesterol and cholesteryl ester when phosphatidylcholine (PC) or sphingomyelin (SPM) was added to the mediun. Results The cholesterol content changed from 79.95 μg/plate to 42.79, 37.16 and 31.53 in HDL3, HDL3+PC and HDL3+SPM group respectively. The cellular phosphorous content in PC (PC-p) were 13.95 and 16.28 μg/plate in HDL3 and HDL3+PC group respectively. The cellular phosphorous content in SPM (SPM-p) were 5.03 and 7.01 μg/plate in HDL3 and HDL3+SPM group respectively. After macrophages were incubated with BSA, PC and SPM alone, the cellular cholesterol content were 75.30, 74.65 and 73.09μg/plate respectively and the ratio of free cholesterol to total cholesterol were 59.42%, 56.95% and 64.77% respectively. Conclusion PC and SPM couldn't mediate directly cellular cholesterol efflux, but they could enhance cellular cholesterol efflux from macrophages mediated by HDL3, and the ability of SPM was stronger than PC. SPM could induce cholesteryl ester convert into free cholesterol. In macrophages and PC could induce free cholesterol convert into cholesteryl ester.
, 百拇医药
MeSH Macrophages, Peritoneal; Cholesterol; Phosphatidylcholine; Sphingomylin; Lipoprotein, HDL; Rat
高密度脂蛋白(high density lipoprotein, HDL)介导肝外细胞内胆固醇(cholesterol)的流出是胆固醇逆向转运过程中一个重要环节,从而使HDL呈现抗动脉粥样硬化作用[1,2]。我们实验室研究已证实HDL中载脂蛋白AI是介导细胞内胆固醇外流的主要物质[3]。但是关于胆固醇外流的调节至今研究很少,本实验将以大鼠腹腔巨噬细胞为研究对象,探讨卵磷脂(phosphatidylcholine,PC)和鞘磷脂(sphingomylin,SPM)对HDL3介导细胞内胆固醇流出的影响及其调节机理,以寻找防治动脉粥样硬化的有效药物。
1 材料与试剂
, http://www.100md.com
1.1 材 料
健康人血由上海市中心血站提供。Wistar大鼠由我校实验动物部提供。RPMI-1640培养基系GIBCO产品。胰蛋白酶系Difco进口分装。卵磷脂、鞘磷脂系Sigma产品。胆固醇酶联试剂盒系上海十八药厂产品。薄层层析硅胶板系山东烟台市芝罘黄务硅胶开发实验厂产品。超速离心机系Beckman产品。CO2培养箱系日本Tabaiespec公司产品。D-Hanks液(pH7.4)含0.8%NaCl、 0.04%KCl、 0.006%Na2HPO4.H2O、 0.006%KH2PO4、 0.035%NaHCO3和0.002%酚红。细胞培养基为含10%小牛血清、100 ku/L青霉素和100 mg/L链霉素的RPMI-1640液。
1.2 无载脂蛋白E-高密度脂蛋白3的制备与纯化
, http://www.100md.com
参照我室方法[3,4]。人新鲜血浆经超速离心后,取密度在1.125~1.210 kg/L部分,经肝素-Sepharose CL-4B亲和层析制备。本实验所用HDL3均为无载脂蛋白E-HDL3。
1.3 大鼠腹腔巨噬细胞制备
以85%普通饲料、2%胆固醇、0.5%胆酸钠和12.5%猪油配成的高脂饲料喂养老鼠,建立高脂模型。实验前4天,大鼠腹腔注射3%无菌硫代乙醇酸钠肉汤,诱导巨噬细胞产生。实验时将大鼠乙醚麻醉处死,用D-Hanks液腹腔灌洗收集腹腔巨噬细胞,1 000 r/min离心10 min,将沉淀用含10%小牛血清的RPMI-1640培养基制成悬液,调节细胞浓度3×109个/L,接种于直径35 mm培养皿中。置37℃、5%CO2孵箱中培养,3 h后洗去未贴壁的细胞,加入2 mL培养基,预培养24 h后加入各种样品。
, http://www.100md.com
1.4 细胞内游离胆固醇和胆固醇含量的测定
用1 mL 0.5%胰蛋白酶消化贴壁细胞,洗涤,超声波粉碎,离心后取上清液,按游离胆固醇-酶联法、胆固醇-酶联法测定游离胆固醇和胆固醇含量。
1.5 细胞内磷脂含量测定
取细胞,用无酚红D-Hanks液洗三遍,加入1 mL 50%甲醇使细胞脱离培养皿底,重复一次。用2 mL 100%甲醇回收细胞,重复一次。N2保护下超声波粉碎。加入10 mL CHCl3,充入N2,4℃过夜。弃上层,加入0.2倍体0.88% KCl洗涤。弃上层,N2保护下吹干,用0.2 mL CHCl3溶解,取10 μL用于薄层层析点样。对照品为分析纯卵磷脂和鞘磷脂,展开剂为氯仿/甲醇/冰醋酸/水(体积比65∶25∶8∶4),显色剂为碘蒸气。显色后将相应斑点刮下来,洗脱。沸水浴蒸干,加入消化剂,测定磷的含量。
, 百拇医药
1.6 磷脂对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响
取18皿细胞,分成三组,分别加入100 μg HDL3、100 μg HDL3+100 μg 卵磷脂、100 μg HDL3+100 μg 鞘磷脂。37℃培养24 h,测定细胞内胆固醇、卵磷脂的磷含量和鞘磷脂的磷含量。
1.7 磷脂对细胞内游离胆固醇-胆固醇酯平衡的影响
取18皿细胞,分成三组,分别加入100 μg BSA、100 μg卵磷脂、100 μg鞘磷脂。37℃培养24 h,测定细胞内游离胆固醇和胆固醇含量。同时测定培养前细胞内游离胆固醇和胆固醇的含量。
1.8 统计学处理
所有实验数据均以x±s表示,采用方差分析来分析组间平均数据的差异。
, 百拇医药
2 结 果
2.1 薄层层析图谱
细胞内磷脂经提取后薄层层析图谱见图1(Figure 1),可以见到卵磷脂和鞘磷脂得到很好的分离。
图1. 细胞内磷脂薄层层析图谱.
Figure 1. Separation of PC and SPM by thin-layer 胆固醇romatography. a: Standard PC; b: Standard SPM; c: Cell extract.
2.1 磷脂对高密度脂蛋白3介导细胞内胆固醇流出的影响
表1(Table 1)可见,HDL3中加入卵磷脂或鞘磷脂后,细胞内胆固醇含量从42.79 μg/皿降至37.16和31.53 μg/皿,统计检验均有显著性差异(P<0.05)。结果提示卵磷脂与鞘磷脂均能促进细胞内胆固醇的流出,且鞘磷脂作用比卵磷脂强。细胞与卵磷脂或鞘磷脂共育后细胞内卵磷脂的磷含量或卵磷脂的磷含量显著增加(P<0.05),提示卵磷脂与鞘磷脂能进入细胞内。
, http://www.100md.com
表1. 磷脂对高密度脂蛋白3介导细胞内胆固醇流出的影响.
Table 1. Effect of phospholipids on the cholesterol efflux from macrophages in the presence of HDL3 (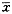 ±s,n=6). Groups
±s,n=6). Groups
before incubation (μg/plate)
after incubation (μg/plate)
cholesterol
PC-p
SPM-p
, 百拇医药
cholesterol
PC-p
SPM-p
HDL3
79.95±2.76
14.35±0.37
5.28±0.50
42.79±3.59
13.95±0.30
5.03±0.82
HDL3+PC
, 百拇医药
79.95±2.76
14.35±0.37
5.28±0.50
37.16±3.70a
16.28±0.61a
-
HDL3+SPM
79.95±2.76
14.35±0.37
5.28±0.50
31.53±3.49ab
, 百拇医药
-
7.01±0.63a
a: P<0.05, compared with HDL3 group, b: P<0.05,compared with HDL3+PC group.
2.2 磷脂对细胞内游离胆固醇-胆固醇酯平衡的影响
从表2 (Table 2)中可以看到,PC、SPM和BSA(对照组)分别与细胞共育24 h后,细胞内胆固醇含量分别为74.65、 73.09和75.30 μg/皿,统计检验无显著性差异(P>0.05)。细胞内游离胆固醇占总胆固醇的比例分别为56.95%、64.77%和59.42%,统计检验有显著性差异(P<0.05)。
表2. 磷脂对细胞内游离胆固醇/胆固醇酯平衡的影响.
, http://www.100md.com
Table 2. Effect of phospholipids on the balance between free cholesterol and cholesteryl ester (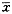 ±s,n=6). Groups
±s,n=6). Groups
FC (μg/plate)
TC (μg/plate)
FC/TC (%)
BSA
45.86±2.74
77.41±3.77
59.24
, 百拇医药
BSA
44.74±3.68
75.30±3.50
59.42
100 μg PC
42.51±3.47
74.65±3.71
56.95a
100 μg SPM
47.34±3.68
73.09±2.76
, http://www.100md.com 64.77ab
C group.
3 讨 论
磷脂可以直接与脂质和蛋白相结合。很多文献报道载脂蛋白与PC、SPM的重组体能有效介导细胞内胆固醇的流出。我们的实验结果(表1)也证明了这一点。向HDL3中加入PC和SPM,细胞内胆固醇含量从42.49 μg/皿降至37.16和31.53 μg/皿(P<0.05)。这说明HDL3能介导巨噬细胞内胆固醇流出,PC与SPM均能加强HDL3这一功能,且SPM作用显著强于PC。但PC与SPM单独并不具备促进细胞内胆固醇流出功能,即PC与SPM不能单独作为细胞流出胆固醇的接受体。细胞内胆固醇浓度与介质中胆固醇接受体的游离胆固醇/P比值有关,游离胆固醇/P的降低有利于细胞内胆固醇流出[5]。用磷脂酶A2处理HDL3,使游离胆固醇/P升高,从而引起胆固醇外流降低[6]。
, 百拇医药
胆固醇是以非酯化形式,即游离胆固醇形式离开细胞的。细胞内胆固醇处于游离胆固醇被酰基辅酶A胆固醇转移酶不断酯化成CE和CE被胆固醇酯酶不断水解成游离胆固醇的动态平衡之中。当细胞间液存在胆固醇接受体时,胆固醇外流,CE不断水解成游离胆固醇而流出细胞。有报道认为细胞内SPM是调节酰基辅酶A胆固醇转移酶活性阈值的重要物质[7]。细胞内SPM增加,酰基辅酶A胆固醇转移酶阈值上调,需更多的游离胆固醇才能激活酰基辅酶A胆固醇转移酶。本实验中细胞与PC、SPM共育后,细胞内游离胆固醇/胆固醇的比值分别为56.95%和64.77%,有显著性差异(P<0.05),这可能是SPM比PC更能促进细胞内胆固醇外流的原因。当细胞与PC或SPM共育后细胞内PC-p或SPM-p含量显著增加(P<0.05),说明PC与SPM能进入细胞内,通过影响酰基辅酶A胆固醇转移酶酶的活性而调节细胞内游离胆固醇-CE平衡,影响细胞内胆固醇流出。
[基金项目] 国家自然科学基金资助课题(基金编号39570158)
, http://www.100md.com
[作者简介] 李剑军,男,上海医科大学药学院生物化学教研室99届研究生。
参考文献
[1] Miller NE, Ville AL, Crook D. Direct evidence that reverse cholesterol transport is mediated by high density lipoprotein in rabbit [J]. Nature, 1985, 314: 109-111
[2] Oram JF, Mendez JA, Slotte JP, et al. HDL apolipoproteins mediated removal of sterol from intracellular pools but not from plasma membranes of cholesterol-loaded fibroblasts [J]. Arterioscler Thromb, 1991, 11: 403-413
, http://www.100md.com
[3] 成 安, 吴满平, 陈佩芳. HDL氧化修饰对大鼠巨噬细胞胆固醇流出影响及其机理探讨 [J]. 上海医科大学学报,1997,24: 335-337
[4] 魏 强, 吴满平, 陈佩芳, 等. HDL受体和肝性脂酶在肝选择性摄取HDL2-CE中的协同作用 [J]. 生物化学与生物物理学报, 1996, 28: 659-662
[5] Arbogast LY, Rothblat GH, Ceslie MH, et al. Cellular cholesteryl ester accumulation induced by free cholesterol-rich lipid dispersion [J]. Proc Natl Sci USA, 1976, 73: 3 680-690
[6] Slotte JP, Oram JF, Bierman EL, et al. Building of HDL to cell receptors promotes translocation of cholesterol from intracellular membranes to cell surface [J]. J Biol Chem, 1987, 262: 12 904-3 001
[7] Okwu AK, Xu XX, Shirator Y, et al. Regulation of the threshold for lipoprotein-induced acylcoA:cholesterol acyltransferase stimulation in macrophages by cellular sphingomylin cintent [J]. J Lipid Res, 1994, 35: 644-657
1999-12-06 收到
2000-05-03 修回, 百拇医药
单位:上海医科大学药学院生物化学教研室, 上海市 200032
关键词:巨噬细胞,;腹腔;胆固醇;卵磷脂;鞘磷脂;脂蛋白,高密度;大鼠
中国动脉硬化杂志000205[摘 要] 为了研究卵磷脂和鞘磷脂对高密度脂蛋白3介导大鼠腹腔巨噬细胞内胆固醇流出的影响,测定了细胞内胆固醇含量、磷脂含量及游离胆固醇-胆固醇酯平衡的变化。结果发现,各组细胞内胆固醇含量从79.75 μg/皿变为42.79、 37.16、 31.53 μg/皿; 高密度脂蛋白3组和卵磷脂组中卵磷脂磷含量分别为13.95和16.28 μg/皿;高密度脂蛋白和鞘磷脂组中鞘磷脂磷含量分别为5.03和7.01 μg/皿。细胞与BSA、卵磷脂、鞘磷脂单独孵育后,细胞内胆固醇含量分别为75.30、 74.65和73.09 μg/皿,游离胆固醇/总胆固醇比值分别为59.42%、56.95%和64.77%。结果提示卵磷脂和鞘磷脂均能促进高密度脂蛋白3介导细胞内胆固醇流出,后者强于前者,而卵磷脂和鞘磷脂单独不能促进细胞内胆固醇的流出。鞘磷脂促进细胞内胆固醇酯向游离胆固醇转化,卵磷脂促进细胞内游离胆固醇向胆固醇酯转化。
, 百拇医药
[中图分类号] Q548.1 [文献标识码] A
[文章编号] 1007-3949(2000)-02-0107-04
Effect of Phospholipids on the Cholesterol Efflux from Macrophages Mediated by High Density Lipoprotein-3
LI Jian-Jun, CHEN Pei-Fang, WU Man-Ping, and LOU Bin
(Department of Biochemistry, School of Pharmacy, Shanghai Medical University, Shanghai 200032, China)
ABSTRACT Aim To study the effect of phosphalipids on the cholesterol efflux from rat macrophages mediated by HDL3. Methods Measure the cholesterol content, cellular phospholipid content, and the balance between free cholesterol and cholesteryl ester when phosphatidylcholine (PC) or sphingomyelin (SPM) was added to the mediun. Results The cholesterol content changed from 79.95 μg/plate to 42.79, 37.16 and 31.53 in HDL3, HDL3+PC and HDL3+SPM group respectively. The cellular phosphorous content in PC (PC-p) were 13.95 and 16.28 μg/plate in HDL3 and HDL3+PC group respectively. The cellular phosphorous content in SPM (SPM-p) were 5.03 and 7.01 μg/plate in HDL3 and HDL3+SPM group respectively. After macrophages were incubated with BSA, PC and SPM alone, the cellular cholesterol content were 75.30, 74.65 and 73.09μg/plate respectively and the ratio of free cholesterol to total cholesterol were 59.42%, 56.95% and 64.77% respectively. Conclusion PC and SPM couldn't mediate directly cellular cholesterol efflux, but they could enhance cellular cholesterol efflux from macrophages mediated by HDL3, and the ability of SPM was stronger than PC. SPM could induce cholesteryl ester convert into free cholesterol. In macrophages and PC could induce free cholesterol convert into cholesteryl ester.
, 百拇医药
MeSH Macrophages, Peritoneal; Cholesterol; Phosphatidylcholine; Sphingomylin; Lipoprotein, HDL; Rat
高密度脂蛋白(high density lipoprotein, HDL)介导肝外细胞内胆固醇(cholesterol)的流出是胆固醇逆向转运过程中一个重要环节,从而使HDL呈现抗动脉粥样硬化作用[1,2]。我们实验室研究已证实HDL中载脂蛋白AI是介导细胞内胆固醇外流的主要物质[3]。但是关于胆固醇外流的调节至今研究很少,本实验将以大鼠腹腔巨噬细胞为研究对象,探讨卵磷脂(phosphatidylcholine,PC)和鞘磷脂(sphingomylin,SPM)对HDL3介导细胞内胆固醇流出的影响及其调节机理,以寻找防治动脉粥样硬化的有效药物。
1 材料与试剂
, http://www.100md.com
1.1 材 料
健康人血由上海市中心血站提供。Wistar大鼠由我校实验动物部提供。RPMI-1640培养基系GIBCO产品。胰蛋白酶系Difco进口分装。卵磷脂、鞘磷脂系Sigma产品。胆固醇酶联试剂盒系上海十八药厂产品。薄层层析硅胶板系山东烟台市芝罘黄务硅胶开发实验厂产品。超速离心机系Beckman产品。CO2培养箱系日本Tabaiespec公司产品。D-Hanks液(pH7.4)含0.8%NaCl、 0.04%KCl、 0.006%Na2HPO4.H2O、 0.006%KH2PO4、 0.035%NaHCO3和0.002%酚红。细胞培养基为含10%小牛血清、100 ku/L青霉素和100 mg/L链霉素的RPMI-1640液。
1.2 无载脂蛋白E-高密度脂蛋白3的制备与纯化
, http://www.100md.com
参照我室方法[3,4]。人新鲜血浆经超速离心后,取密度在1.125~1.210 kg/L部分,经肝素-Sepharose CL-4B亲和层析制备。本实验所用HDL3均为无载脂蛋白E-HDL3。
1.3 大鼠腹腔巨噬细胞制备
以85%普通饲料、2%胆固醇、0.5%胆酸钠和12.5%猪油配成的高脂饲料喂养老鼠,建立高脂模型。实验前4天,大鼠腹腔注射3%无菌硫代乙醇酸钠肉汤,诱导巨噬细胞产生。实验时将大鼠乙醚麻醉处死,用D-Hanks液腹腔灌洗收集腹腔巨噬细胞,1 000 r/min离心10 min,将沉淀用含10%小牛血清的RPMI-1640培养基制成悬液,调节细胞浓度3×109个/L,接种于直径35 mm培养皿中。置37℃、5%CO2孵箱中培养,3 h后洗去未贴壁的细胞,加入2 mL培养基,预培养24 h后加入各种样品。
, http://www.100md.com
1.4 细胞内游离胆固醇和胆固醇含量的测定
用1 mL 0.5%胰蛋白酶消化贴壁细胞,洗涤,超声波粉碎,离心后取上清液,按游离胆固醇-酶联法、胆固醇-酶联法测定游离胆固醇和胆固醇含量。
1.5 细胞内磷脂含量测定
取细胞,用无酚红D-Hanks液洗三遍,加入1 mL 50%甲醇使细胞脱离培养皿底,重复一次。用2 mL 100%甲醇回收细胞,重复一次。N2保护下超声波粉碎。加入10 mL CHCl3,充入N2,4℃过夜。弃上层,加入0.2倍体0.88% KCl洗涤。弃上层,N2保护下吹干,用0.2 mL CHCl3溶解,取10 μL用于薄层层析点样。对照品为分析纯卵磷脂和鞘磷脂,展开剂为氯仿/甲醇/冰醋酸/水(体积比65∶25∶8∶4),显色剂为碘蒸气。显色后将相应斑点刮下来,洗脱。沸水浴蒸干,加入消化剂,测定磷的含量。
, 百拇医药
1.6 磷脂对高密度脂蛋白3介导巨噬细胞内胆固醇流出的影响
取18皿细胞,分成三组,分别加入100 μg HDL3、100 μg HDL3+100 μg 卵磷脂、100 μg HDL3+100 μg 鞘磷脂。37℃培养24 h,测定细胞内胆固醇、卵磷脂的磷含量和鞘磷脂的磷含量。
1.7 磷脂对细胞内游离胆固醇-胆固醇酯平衡的影响
取18皿细胞,分成三组,分别加入100 μg BSA、100 μg卵磷脂、100 μg鞘磷脂。37℃培养24 h,测定细胞内游离胆固醇和胆固醇含量。同时测定培养前细胞内游离胆固醇和胆固醇的含量。
1.8 统计学处理
所有实验数据均以x±s表示,采用方差分析来分析组间平均数据的差异。
, 百拇医药
2 结 果
2.1 薄层层析图谱
细胞内磷脂经提取后薄层层析图谱见图1(Figure 1),可以见到卵磷脂和鞘磷脂得到很好的分离。

图1. 细胞内磷脂薄层层析图谱.
Figure 1. Separation of PC and SPM by thin-layer 胆固醇romatography. a: Standard PC; b: Standard SPM; c: Cell extract.
2.1 磷脂对高密度脂蛋白3介导细胞内胆固醇流出的影响
表1(Table 1)可见,HDL3中加入卵磷脂或鞘磷脂后,细胞内胆固醇含量从42.79 μg/皿降至37.16和31.53 μg/皿,统计检验均有显著性差异(P<0.05)。结果提示卵磷脂与鞘磷脂均能促进细胞内胆固醇的流出,且鞘磷脂作用比卵磷脂强。细胞与卵磷脂或鞘磷脂共育后细胞内卵磷脂的磷含量或卵磷脂的磷含量显著增加(P<0.05),提示卵磷脂与鞘磷脂能进入细胞内。
, http://www.100md.com
表1. 磷脂对高密度脂蛋白3介导细胞内胆固醇流出的影响.
Table 1. Effect of phospholipids on the cholesterol efflux from macrophages in the presence of HDL3 (
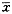 ±s,n=6). Groups
±s,n=6). Groupsbefore incubation (μg/plate)
after incubation (μg/plate)
cholesterol
PC-p
SPM-p
, 百拇医药
cholesterol
PC-p
SPM-p
HDL3
79.95±2.76
14.35±0.37
5.28±0.50
42.79±3.59
13.95±0.30
5.03±0.82
HDL3+PC
, 百拇医药
79.95±2.76
14.35±0.37
5.28±0.50
37.16±3.70a
16.28±0.61a
-
HDL3+SPM
79.95±2.76
14.35±0.37
5.28±0.50
31.53±3.49ab
, 百拇医药
-
7.01±0.63a
a: P<0.05, compared with HDL3 group, b: P<0.05,compared with HDL3+PC group.
2.2 磷脂对细胞内游离胆固醇-胆固醇酯平衡的影响
从表2 (Table 2)中可以看到,PC、SPM和BSA(对照组)分别与细胞共育24 h后,细胞内胆固醇含量分别为74.65、 73.09和75.30 μg/皿,统计检验无显著性差异(P>0.05)。细胞内游离胆固醇占总胆固醇的比例分别为56.95%、64.77%和59.42%,统计检验有显著性差异(P<0.05)。
表2. 磷脂对细胞内游离胆固醇/胆固醇酯平衡的影响.
, http://www.100md.com
Table 2. Effect of phospholipids on the balance between free cholesterol and cholesteryl ester (
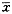 ±s,n=6). Groups
±s,n=6). GroupsFC (μg/plate)
TC (μg/plate)
FC/TC (%)
BSA
45.86±2.74
77.41±3.77
59.24
, 百拇医药
BSA
44.74±3.68
75.30±3.50
59.42
100 μg PC
42.51±3.47
74.65±3.71
56.95a
100 μg SPM
47.34±3.68
73.09±2.76
, http://www.100md.com 64.77ab
C group.
3 讨 论
磷脂可以直接与脂质和蛋白相结合。很多文献报道载脂蛋白与PC、SPM的重组体能有效介导细胞内胆固醇的流出。我们的实验结果(表1)也证明了这一点。向HDL3中加入PC和SPM,细胞内胆固醇含量从42.49 μg/皿降至37.16和31.53 μg/皿(P<0.05)。这说明HDL3能介导巨噬细胞内胆固醇流出,PC与SPM均能加强HDL3这一功能,且SPM作用显著强于PC。但PC与SPM单独并不具备促进细胞内胆固醇流出功能,即PC与SPM不能单独作为细胞流出胆固醇的接受体。细胞内胆固醇浓度与介质中胆固醇接受体的游离胆固醇/P比值有关,游离胆固醇/P的降低有利于细胞内胆固醇流出[5]。用磷脂酶A2处理HDL3,使游离胆固醇/P升高,从而引起胆固醇外流降低[6]。
, 百拇医药
胆固醇是以非酯化形式,即游离胆固醇形式离开细胞的。细胞内胆固醇处于游离胆固醇被酰基辅酶A胆固醇转移酶不断酯化成CE和CE被胆固醇酯酶不断水解成游离胆固醇的动态平衡之中。当细胞间液存在胆固醇接受体时,胆固醇外流,CE不断水解成游离胆固醇而流出细胞。有报道认为细胞内SPM是调节酰基辅酶A胆固醇转移酶活性阈值的重要物质[7]。细胞内SPM增加,酰基辅酶A胆固醇转移酶阈值上调,需更多的游离胆固醇才能激活酰基辅酶A胆固醇转移酶。本实验中细胞与PC、SPM共育后,细胞内游离胆固醇/胆固醇的比值分别为56.95%和64.77%,有显著性差异(P<0.05),这可能是SPM比PC更能促进细胞内胆固醇外流的原因。当细胞与PC或SPM共育后细胞内PC-p或SPM-p含量显著增加(P<0.05),说明PC与SPM能进入细胞内,通过影响酰基辅酶A胆固醇转移酶酶的活性而调节细胞内游离胆固醇-CE平衡,影响细胞内胆固醇流出。
[基金项目] 国家自然科学基金资助课题(基金编号39570158)
, http://www.100md.com
[作者简介] 李剑军,男,上海医科大学药学院生物化学教研室99届研究生。
参考文献
[1] Miller NE, Ville AL, Crook D. Direct evidence that reverse cholesterol transport is mediated by high density lipoprotein in rabbit [J]. Nature, 1985, 314: 109-111
[2] Oram JF, Mendez JA, Slotte JP, et al. HDL apolipoproteins mediated removal of sterol from intracellular pools but not from plasma membranes of cholesterol-loaded fibroblasts [J]. Arterioscler Thromb, 1991, 11: 403-413
, http://www.100md.com
[3] 成 安, 吴满平, 陈佩芳. HDL氧化修饰对大鼠巨噬细胞胆固醇流出影响及其机理探讨 [J]. 上海医科大学学报,1997,24: 335-337
[4] 魏 强, 吴满平, 陈佩芳, 等. HDL受体和肝性脂酶在肝选择性摄取HDL2-CE中的协同作用 [J]. 生物化学与生物物理学报, 1996, 28: 659-662
[5] Arbogast LY, Rothblat GH, Ceslie MH, et al. Cellular cholesteryl ester accumulation induced by free cholesterol-rich lipid dispersion [J]. Proc Natl Sci USA, 1976, 73: 3 680-690
[6] Slotte JP, Oram JF, Bierman EL, et al. Building of HDL to cell receptors promotes translocation of cholesterol from intracellular membranes to cell surface [J]. J Biol Chem, 1987, 262: 12 904-3 001
[7] Okwu AK, Xu XX, Shirator Y, et al. Regulation of the threshold for lipoprotein-induced acylcoA:cholesterol acyltransferase stimulation in macrophages by cellular sphingomylin cintent [J]. J Lipid Res, 1994, 35: 644-657
1999-12-06 收到
2000-05-03 修回, 百拇医药