重组融合蛋白Fab/IFN-αA体外抗HBV作用的实验研究
作者:田文 宋少柏 逮好英 郑伟 檀华 唐云 王琰 余燕星
单位:王琰(海军总医院,北京 100037);逮好英(军事医学科学院生物工程研究所,北京 100850);田文 宋少柏 郑伟 檀华 唐云 余燕星(解放军总医院普通外科,北京 100853)
关键词:HepG2.2.15;细胞系;抗HBV作用;乙型肝炎导向干扰素
军医进修学院学报000220 【摘要】目的:在体外细胞水平上观察重组融合蛋白(Fab/IFN-αA)对乙型肝炎病毒(HBV)基因表达的抑制作用。方法:应用HBV DNA转染细胞系(HepG2.2.15细胞)作模型,通过固相放射免疫方法检测Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化,结合细胞存活率来评价其抗HBV作用,并与α-干扰素(IFN-αA)进行比较。结果:经12 d作用,Fab/IFN-αA在细胞存活率、对HBsAg、HBeAg抑制率均优于IFN-αA,尤其在2500~5000 IU/ml 浓度下,其细胞存活率为82.41%~83.19%,HBsAg抑制率55.55%~68.18%,HBeAg抑制率45.07%~48.55%,而相应浓度IFN-αA的HBsAg、HBeAg抑制率均低于Fab/IFN-αA(P<0.01或P<0.05)。结论:具有抗体的导向作用和IFN的抗病毒作用的Fab/IFN-αA体外抗HBV作用优于IFN-αA,为进一步研制抗乙型病毒性肝炎的生物导向治疗的基因工程多肽类药物提供了依据。
, http://www.100md.com
中图号:R392.11 文献标识码:A
文章编号:1005-1139(2000)02-0141-03
Studies of the effect of a fusion protein Fab/IFN-αA on hepatitis B virus in vitro
TIAN Wen,SONG Shao-bai,LU Hao-ying,ZHENG Wei,TAN Hua,TANG Yun,WANG Yan,YU Yan-xing
(Department of General Surgery,PLA General Hospital,Beijing 100853)
【Abstract】Objective:To investigate the effect of a fusion protein (Fab/IFN-αA) consisting of anti-HBsAg antibody Fab and interferon-αA on hepatitis B virus (HBV) in vitro.Methods:Using a HBV DNA transfected cell line (HepG2.2.15 cell line) as the model,we examined the inhibitory effects on HBV expression of HBsAg and HBeAg by solid-phase radioimmunoassay (RIA),and also observed the cell survival rate by MTT colorimetric assays.Then we evaluated and compared the anti-HBV effects of Fab/IFN-αA and IFN.Results:After 12 days's treatment,the IFN's inhibitory rates of HBsAg and HBeAg and cell survival rate were Lower than that of Fab/IFN-αA.At 2500~5000 IU/ml concentration,the cell survival rate of Fab/IFN-αA was over 82.41%,the inhibitory rates of HBsAg and HBeAg were 55.55%-68.18% and 45.07%-48.55%,which were higher than that of IFN (P<0.01或P<0.05).Conclusion:The results proved that targeting IFN(Fab/IFN-αA) can enhance the anti-HBV effect of IFN.Fab/IFN-αA might take advantage of interacting both receptors of IFN and HBsAg,by Fab carried,IFN could be easier to get to the targeting cells.The results makes it possible to carry out further studies on targeted therapy polypeptide to HBV.
, http://www.100md.com
Key words:HepG2.2.15 cell line;anti-HBV effect;targeting IFN with Fab;in vitro
尽管目前抗乙型肝炎病毒(HBV)药物种类繁多,但尚缺少高效低毒副作用的理想药物。α-干扰素(IFN-αA)虽是治疗乙型病毒性肝炎有效药物,但由于其临床应用的副作用及持久应答率不超过 50%,限制了其疗效的发挥[1]。我们通过DNA重组技术和PCR技术将抗乙型肝炎表面抗原抗体片段Fab与IFN-αA在分子水平上进行重组,并表达了重组融合蛋白(Fab/IFN-αA)[2],以期提高干扰素疗效,实现感染细胞水平上的抗病毒性肝炎的生物导向治疗。本实验应用HBV DNA转染细胞系(HepG2.2.15 细胞系)作模型[3],通过检测Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化,结合细胞存活率来评价其抗HBV作用,并与IFN-αA进行了比较。
, http://www.100md.com
1 材料和方法
1.1 材料
1.1.1 药物和试剂 IFN-αA为沈阳三生制药公司生产,批号为 980602。含重组融合蛋白(Fab/IFN-αA)的培养上清液为我们利用基因重组技术构建人抗乙肝表面抗原抗体Fab片段αA-干扰素融合蛋白原核表达克隆载体,经异丙基硫代-β-D-半乳糖苷(IPGT)诱导实验所得,测其抗体片段Fab的活性在培养上清中为 2.8×105 IU/L,IFN-αA的生物活性为 3.1×107 IU/L[2]。4, 5,二甲基噻唑-2,5-二苯基四唑溴化物(MTT)购自华美生物工程公司。HBsAg、HBeAg固相放免测定试剂盒,购自北京北方生物技术研究所。
1.1.2 细胞 HepG2.2.15 细胞系为 302 医院分子生物室徐东平副教授惠赠。细胞培养基:DMEM液, 10% 胎牛血清, G418 380 μg/ml (购自华美生物工程公司), 1% 谷氨酰胺,青霉素 100 IU/ml,链霉素 100 IU/ml, 5% NaHCO3 调 pH 至 7.0。
, 百拇医药
1.2 方法
1.2.1 含药培养基配制 将含重组融合蛋白(Fab/IFN-αA)的培养上清液及IFN-αA按IFN-α活性 20000 IU/ml 为始量,用培养基倍比稀释 6 个浓度梯度,均新鲜配制作用。
1.2.2 操作流程 消化贴壁生长地HepG2.2.15 细胞,置入细胞培养基,均匀分散,调成 6×106 个/ml 的细胞悬液,分别接种 24 孔板 (1 ml/孔即 6×106 个/孔) 和 96 孔板 (200 μl/孔 即 1.2×106 个/孔)。 24 h 后细胞贴板后,再更换成不同浓度的含药培养基。 24 孔板每浓度 3 孔, 96 孔板每浓度 4 孔,均设对照组。每 4 d 更换一次同浓度的含药培养基。 12 d 后,收集 24 孔板上清液,-20 ℃ 保存,统一检测 HBsAg、HBeAg; 96 孔板用于检测细胞存活率。各浓度结果取均值。
, 百拇医药
1.2.3 细胞存活率测定 按Mosmann介绍的MTT法检测[4]。于 96 孔板内每孔加入无菌MTT液 (5 mg/ml) 10 μl, 37 ℃ 日温育 4 h,再加入含 0.04 mol/L 盐酸的异丙醇溶液 100 μl,充分混匀,用酶联仪分别检测各孔 570 nm 和 630 nm 波长下的OD值,计算公式:
细胞存活率%=(实验孔OD570-实验孔OD630)/(对照孔OD570-对照组OD630)
1.2.3 HBsAg、HBeAg检测 双抗体夹心法检测样品中每 30 s γ射线计数(P),与阴性对照(N)比较,得出P/N值。抑制率计算方法为[5]:
HBsAg或HBeAg抑制率%=(对照孔P/N-实验孔P/N)/(对照孔P/N)×100%
, 百拇医药
1.2.4 统计学分析 结果以x±s表示,组间比较应用t检验。
2 结 果
HG2.2.15细胞的传代周期为 12 d,其分泌HBsAg、HBeAg一般在传代的第 4 天达高峰, 12 d 后分泌逐渐减少,故选择 12 d 为一治疗周期。另外还采取结合细胞存活率来评价比较各种药物相同条件下的抗HBV效果。各组药物作用 12 d 后HBsAg、HBeAg的抑制率及相应细胞存活率的检测结果见附表。从附表显示随着Fab/IFN-αA与IFN-αA的药物浓度的增加,其细胞存活率下降,对HBsAg、HBeAg的抑制作用增强,Fab/IFN-αA对HBsAg、HBeAg的抑制率和细胞存活率均较IFN-αA为优。
附表 各组药物作用12d后HBsAg、HBeAg的抑制率(%)及相应细胞存活率(%)比较(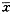 ±s) 药物浓度
±s) 药物浓度
, 百拇医药
IFN(IU/ml)
Fab/IFN-αA
IFN-αA
细胞存活率
HBsAg(%)
HBeAg的抑制率
细胞存活率
HBsAg(%)
HBeAg的抑制率
20 000
61.03
74.05±0.79
, 百拇医药
53.45±2.73
55.35
73.51±0.73
51.05±1.76
10 000
65.48
69.17±2.60
51.87±1.26
68.87
66.35±1.62
50.05±1.162
5 000
, 百拇医药
82.41
68.18±2.66*
48.55±1.55*
78.31
49.80±3.06
45.18±0.62
2 500
83.19
55.55±2.27*
45.07±2.98△
81.48
, 百拇医药
33.83±1.22
39.70±1.84
1 250
90.15
23.86±1.16△
30.67±2.01
88.24
21.76±1.20
29.12±1.01
625
99.38
6.43±1.25
, 百拇医药
20.25±0.99
98.44
5.87±0.92
18.85±0.95
*与IFN-αA比较,P<0.01;△与IFN-αA比较,P<0.05
3 讨 论
干扰素具有广谱抗病毒作用,它通过诱导释放胞内酶,如 2′5′-寡核苷酸合成酶和双股DNA-依赖蛋白的激酶引起病毒mRNA降解和抑制蛋白质合成,其抗HBV效果已被证实[6、7]。然而其半衰期短,在有效治疗剂量下存有许多不良反应,从而限制了IFN临床应用,真正治愈率不超过 50%[1、7]。为提高IFN抗HBV疗效,我们首次构建和表达了以人抗乙型肝炎表面抗原抗体片段Fab为导向作用,IFN-αA为治疗作用的重组融合蛋白(Fab/IFN-αA)。我们应用HepG2.2.15 作模型,通过检测经Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化来评价其抗HBV作用,并与IFN-αA进行比较。HepG2.2.15 为HepG2 肝癌细胞转染HBV-DNA后能稳定表达HBsAg、HBeAg、HBV-DNA以及Dane颗粒等细胞系,目前已广泛作为体外抗HBV病毒药物研究的模型[3、5、6]。通过固样放射免疫方法检测Fab/IFN-αA与IFN-αA作用 12 d 后细胞上清液的HBsAg、HBeAg水平,并通过MTT法检测相应的细胞存活率,可以明确Fab/IFN-αA对HBsAg、HBeAg的抑制率和细胞存活率均较IFN-αA为优。在浓度 2500~5000 IU/ml 下,Fab/IFN-αA细胞存活率为 83.19%~82.41%,而相同浓度的IFN-αA细胞存活率低于 82.41%~78.31%5;Fab/IFN-αA的HBsAg抑制率 55.55%~68.18%,HBeAg抑制率 45.07%~48.55%,而相应浓度IFN-αA的HBsAg、HBeAg抑制率均低于Fab/IFN-αA,两者比较均有显著性差异(P<0.01或P<0.05)。
, 百拇医药
本实验还观察到,随着干扰素剂量的增加,其抗HBV的HBsAg、HBeAg水平提高,另外对细胞的毒性影响也增加,细胞的存活率下降,这与Caselmann观察到IFN对细胞影响一致。这说明IFN副作用具有剂量依赖性,因此有必要对IFN进行构建以提高IFN抗病毒的作用,减少其毒副作用。Fab/IFN-αA与IFN-αA的不同在于Fab/IFN-αA具有导向作用Fab抗体,我们认为,这也是Fab/IFN-αA抗HBV效果优于IFN-αA的原因。利用抗体的导向性将α-干扰素输送到感染细胞局部,大大降低了α-干扰素的应用剂量,从而也减少了毒副作用。在HepG2.2.15细胞表面既存在一定数量的IFN受体[每细胞(1~4.5)×103][8],又有HBsAg结合位点[9],且抗HBsAg的Fab与靶细胞上的HBsAg间有着特异性结合作用,所以,Fab/IFN-αA利用这一作用,通过Fab的运载,使IFN-αA更易或更多与靶细胞表面IFN受体结合,从而更有效发挥IFN-αA抗HBV效果。张运涛等[10]在胃癌导向治疗研究中发现药物与特异性McAb的偶联物抗肿瘤效果优于游离药物或药物与非特异性McAb的偶联物,结果也支持我们的观点,即导向抗体与靶细胞的特异性结合作用是导向给药提高疗效的关键。体外实验证实Fab/IFN-αA抗HBV作用优于IFN-αA,为进一步研制抗乙型病毒性肝炎的生物导向治疗的基因工程多肽类药物提供了依据。
, 百拇医药
基金项目:国家自然科学基金资助项目(39670678)
作者简介:田文,男,1967-03-17生,浙江省永康市人,汉族,1996年军医进修学院硕士毕业,解放军总医院普通外科主治医师;发表论文9篇。电话:(010)66937217
参考文献
1,Foster GR,Goldin RD,Hay A et al.Expression of the terminal protein of Hepatitis B Virus is associated with failure to respond to interferon Therapy[J].Hepatology,1993,19(5):757-759.
2,郑 伟,檀 华,宋少柏 等.人抗乙肝表面抗原抗体Fab片段αA-干扰素融合蛋白原核表达载体的构建[J].军医进修学院学报,1998,19(3):161-163.
, http://www.100md.com
3,Sells M A,Chen M L,Acs G.Production of hepatitis B virus particle s in HepG2 cells transfected with cloned hepatitis B virus DNA[J].Proc Natl Acad Sci USA,1987,84(4):1005-1007.
4,Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays 高寿征主编.病毒性肝炎防治研究[M].北京:北京出版社,1993.605-608.
6,Hayashi Y,Kike K.Interferon inhibits hepatitis B virus replication in a stable expression system of transfected viral DNA[J].J Virol,1989,63(7):2936-2938.
, 百拇医药
7,Vrettou E,Zionfia V,Raptopoulou M et al.Changes of hepatitis B core antigen in liver biopsies of patients with chronic active hepatitis B treated with interferon[J].J Investig Allergol Clin Immunol,1995,5(2):108-109.
8,Caselmann WH,Meyer M,Scholz et al.Type I interferons inhibit hepatitis B virus replication and reduce hepatocellular gene expression in cultured liver cells[J].J Infect Dis.,1992,166(5):966-968.
9,姚志强,周永兴,冯雪梅等.荷瘤鼠用于乙型肝炎病毒的体内研究.第四军医大学学报[J],1995,16(2):141-143.
10,张运涛,王耐勤,李 农等.阿霉素与胃癌单克隆抗体交联物的体内外抗肿瘤作用[J].药学学报,1992,27(5):325-327.
收稿日期:1999-10-06
修回日期:1999-11-17, 百拇医药
单位:王琰(海军总医院,北京 100037);逮好英(军事医学科学院生物工程研究所,北京 100850);田文 宋少柏 郑伟 檀华 唐云 余燕星(解放军总医院普通外科,北京 100853)
关键词:HepG2.2.15;细胞系;抗HBV作用;乙型肝炎导向干扰素
军医进修学院学报000220 【摘要】目的:在体外细胞水平上观察重组融合蛋白(Fab/IFN-αA)对乙型肝炎病毒(HBV)基因表达的抑制作用。方法:应用HBV DNA转染细胞系(HepG2.2.15细胞)作模型,通过固相放射免疫方法检测Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化,结合细胞存活率来评价其抗HBV作用,并与α-干扰素(IFN-αA)进行比较。结果:经12 d作用,Fab/IFN-αA在细胞存活率、对HBsAg、HBeAg抑制率均优于IFN-αA,尤其在2500~5000 IU/ml 浓度下,其细胞存活率为82.41%~83.19%,HBsAg抑制率55.55%~68.18%,HBeAg抑制率45.07%~48.55%,而相应浓度IFN-αA的HBsAg、HBeAg抑制率均低于Fab/IFN-αA(P<0.01或P<0.05)。结论:具有抗体的导向作用和IFN的抗病毒作用的Fab/IFN-αA体外抗HBV作用优于IFN-αA,为进一步研制抗乙型病毒性肝炎的生物导向治疗的基因工程多肽类药物提供了依据。
, http://www.100md.com
中图号:R392.11 文献标识码:A
文章编号:1005-1139(2000)02-0141-03
Studies of the effect of a fusion protein Fab/IFN-αA on hepatitis B virus in vitro
TIAN Wen,SONG Shao-bai,LU Hao-ying,ZHENG Wei,TAN Hua,TANG Yun,WANG Yan,YU Yan-xing
(Department of General Surgery,PLA General Hospital,Beijing 100853)
【Abstract】Objective:To investigate the effect of a fusion protein (Fab/IFN-αA) consisting of anti-HBsAg antibody Fab and interferon-αA on hepatitis B virus (HBV) in vitro.Methods:Using a HBV DNA transfected cell line (HepG2.2.15 cell line) as the model,we examined the inhibitory effects on HBV expression of HBsAg and HBeAg by solid-phase radioimmunoassay (RIA),and also observed the cell survival rate by MTT colorimetric assays.Then we evaluated and compared the anti-HBV effects of Fab/IFN-αA and IFN.Results:After 12 days's treatment,the IFN's inhibitory rates of HBsAg and HBeAg and cell survival rate were Lower than that of Fab/IFN-αA.At 2500~5000 IU/ml concentration,the cell survival rate of Fab/IFN-αA was over 82.41%,the inhibitory rates of HBsAg and HBeAg were 55.55%-68.18% and 45.07%-48.55%,which were higher than that of IFN (P<0.01或P<0.05).Conclusion:The results proved that targeting IFN(Fab/IFN-αA) can enhance the anti-HBV effect of IFN.Fab/IFN-αA might take advantage of interacting both receptors of IFN and HBsAg,by Fab carried,IFN could be easier to get to the targeting cells.The results makes it possible to carry out further studies on targeted therapy polypeptide to HBV.
, http://www.100md.com
Key words:HepG2.2.15 cell line;anti-HBV effect;targeting IFN with Fab;in vitro
尽管目前抗乙型肝炎病毒(HBV)药物种类繁多,但尚缺少高效低毒副作用的理想药物。α-干扰素(IFN-αA)虽是治疗乙型病毒性肝炎有效药物,但由于其临床应用的副作用及持久应答率不超过 50%,限制了其疗效的发挥[1]。我们通过DNA重组技术和PCR技术将抗乙型肝炎表面抗原抗体片段Fab与IFN-αA在分子水平上进行重组,并表达了重组融合蛋白(Fab/IFN-αA)[2],以期提高干扰素疗效,实现感染细胞水平上的抗病毒性肝炎的生物导向治疗。本实验应用HBV DNA转染细胞系(HepG2.2.15 细胞系)作模型[3],通过检测Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化,结合细胞存活率来评价其抗HBV作用,并与IFN-αA进行了比较。
, http://www.100md.com
1 材料和方法
1.1 材料
1.1.1 药物和试剂 IFN-αA为沈阳三生制药公司生产,批号为 980602。含重组融合蛋白(Fab/IFN-αA)的培养上清液为我们利用基因重组技术构建人抗乙肝表面抗原抗体Fab片段αA-干扰素融合蛋白原核表达克隆载体,经异丙基硫代-β-D-半乳糖苷(IPGT)诱导实验所得,测其抗体片段Fab的活性在培养上清中为 2.8×105 IU/L,IFN-αA的生物活性为 3.1×107 IU/L[2]。4, 5,二甲基噻唑-2,5-二苯基四唑溴化物(MTT)购自华美生物工程公司。HBsAg、HBeAg固相放免测定试剂盒,购自北京北方生物技术研究所。
1.1.2 细胞 HepG2.2.15 细胞系为 302 医院分子生物室徐东平副教授惠赠。细胞培养基:DMEM液, 10% 胎牛血清, G418 380 μg/ml (购自华美生物工程公司), 1% 谷氨酰胺,青霉素 100 IU/ml,链霉素 100 IU/ml, 5% NaHCO3 调 pH 至 7.0。
, 百拇医药
1.2 方法
1.2.1 含药培养基配制 将含重组融合蛋白(Fab/IFN-αA)的培养上清液及IFN-αA按IFN-α活性 20000 IU/ml 为始量,用培养基倍比稀释 6 个浓度梯度,均新鲜配制作用。
1.2.2 操作流程 消化贴壁生长地HepG2.2.15 细胞,置入细胞培养基,均匀分散,调成 6×106 个/ml 的细胞悬液,分别接种 24 孔板 (1 ml/孔即 6×106 个/孔) 和 96 孔板 (200 μl/孔 即 1.2×106 个/孔)。 24 h 后细胞贴板后,再更换成不同浓度的含药培养基。 24 孔板每浓度 3 孔, 96 孔板每浓度 4 孔,均设对照组。每 4 d 更换一次同浓度的含药培养基。 12 d 后,收集 24 孔板上清液,-20 ℃ 保存,统一检测 HBsAg、HBeAg; 96 孔板用于检测细胞存活率。各浓度结果取均值。
, 百拇医药
1.2.3 细胞存活率测定 按Mosmann介绍的MTT法检测[4]。于 96 孔板内每孔加入无菌MTT液 (5 mg/ml) 10 μl, 37 ℃ 日温育 4 h,再加入含 0.04 mol/L 盐酸的异丙醇溶液 100 μl,充分混匀,用酶联仪分别检测各孔 570 nm 和 630 nm 波长下的OD值,计算公式:
细胞存活率%=(实验孔OD570-实验孔OD630)/(对照孔OD570-对照组OD630)
1.2.3 HBsAg、HBeAg检测 双抗体夹心法检测样品中每 30 s γ射线计数(P),与阴性对照(N)比较,得出P/N值。抑制率计算方法为[5]:
HBsAg或HBeAg抑制率%=(对照孔P/N-实验孔P/N)/(对照孔P/N)×100%
, 百拇医药
1.2.4 统计学分析 结果以x±s表示,组间比较应用t检验。
2 结 果
HG2.2.15细胞的传代周期为 12 d,其分泌HBsAg、HBeAg一般在传代的第 4 天达高峰, 12 d 后分泌逐渐减少,故选择 12 d 为一治疗周期。另外还采取结合细胞存活率来评价比较各种药物相同条件下的抗HBV效果。各组药物作用 12 d 后HBsAg、HBeAg的抑制率及相应细胞存活率的检测结果见附表。从附表显示随着Fab/IFN-αA与IFN-αA的药物浓度的增加,其细胞存活率下降,对HBsAg、HBeAg的抑制作用增强,Fab/IFN-αA对HBsAg、HBeAg的抑制率和细胞存活率均较IFN-αA为优。
附表 各组药物作用12d后HBsAg、HBeAg的抑制率(%)及相应细胞存活率(%)比较(
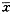 ±s) 药物浓度
±s) 药物浓度, 百拇医药
IFN(IU/ml)
Fab/IFN-αA
IFN-αA
细胞存活率
HBsAg(%)
HBeAg的抑制率
细胞存活率
HBsAg(%)
HBeAg的抑制率
20 000
61.03
74.05±0.79
, 百拇医药
53.45±2.73
55.35
73.51±0.73
51.05±1.76
10 000
65.48
69.17±2.60
51.87±1.26
68.87
66.35±1.62
50.05±1.162
5 000
, 百拇医药
82.41
68.18±2.66*
48.55±1.55*
78.31
49.80±3.06
45.18±0.62
2 500
83.19
55.55±2.27*
45.07±2.98△
81.48
, 百拇医药
33.83±1.22
39.70±1.84
1 250
90.15
23.86±1.16△
30.67±2.01
88.24
21.76±1.20
29.12±1.01
625
99.38
6.43±1.25
, 百拇医药
20.25±0.99
98.44
5.87±0.92
18.85±0.95
*与IFN-αA比较,P<0.01;△与IFN-αA比较,P<0.05
3 讨 论
干扰素具有广谱抗病毒作用,它通过诱导释放胞内酶,如 2′5′-寡核苷酸合成酶和双股DNA-依赖蛋白的激酶引起病毒mRNA降解和抑制蛋白质合成,其抗HBV效果已被证实[6、7]。然而其半衰期短,在有效治疗剂量下存有许多不良反应,从而限制了IFN临床应用,真正治愈率不超过 50%[1、7]。为提高IFN抗HBV疗效,我们首次构建和表达了以人抗乙型肝炎表面抗原抗体片段Fab为导向作用,IFN-αA为治疗作用的重组融合蛋白(Fab/IFN-αA)。我们应用HepG2.2.15 作模型,通过检测经Fab/IFN-αA作用后细胞上清液的HBsAg、HBeAg水平的变化来评价其抗HBV作用,并与IFN-αA进行比较。HepG2.2.15 为HepG2 肝癌细胞转染HBV-DNA后能稳定表达HBsAg、HBeAg、HBV-DNA以及Dane颗粒等细胞系,目前已广泛作为体外抗HBV病毒药物研究的模型[3、5、6]。通过固样放射免疫方法检测Fab/IFN-αA与IFN-αA作用 12 d 后细胞上清液的HBsAg、HBeAg水平,并通过MTT法检测相应的细胞存活率,可以明确Fab/IFN-αA对HBsAg、HBeAg的抑制率和细胞存活率均较IFN-αA为优。在浓度 2500~5000 IU/ml 下,Fab/IFN-αA细胞存活率为 83.19%~82.41%,而相同浓度的IFN-αA细胞存活率低于 82.41%~78.31%5;Fab/IFN-αA的HBsAg抑制率 55.55%~68.18%,HBeAg抑制率 45.07%~48.55%,而相应浓度IFN-αA的HBsAg、HBeAg抑制率均低于Fab/IFN-αA,两者比较均有显著性差异(P<0.01或P<0.05)。
, 百拇医药
本实验还观察到,随着干扰素剂量的增加,其抗HBV的HBsAg、HBeAg水平提高,另外对细胞的毒性影响也增加,细胞的存活率下降,这与Caselmann观察到IFN对细胞影响一致。这说明IFN副作用具有剂量依赖性,因此有必要对IFN进行构建以提高IFN抗病毒的作用,减少其毒副作用。Fab/IFN-αA与IFN-αA的不同在于Fab/IFN-αA具有导向作用Fab抗体,我们认为,这也是Fab/IFN-αA抗HBV效果优于IFN-αA的原因。利用抗体的导向性将α-干扰素输送到感染细胞局部,大大降低了α-干扰素的应用剂量,从而也减少了毒副作用。在HepG2.2.15细胞表面既存在一定数量的IFN受体[每细胞(1~4.5)×103][8],又有HBsAg结合位点[9],且抗HBsAg的Fab与靶细胞上的HBsAg间有着特异性结合作用,所以,Fab/IFN-αA利用这一作用,通过Fab的运载,使IFN-αA更易或更多与靶细胞表面IFN受体结合,从而更有效发挥IFN-αA抗HBV效果。张运涛等[10]在胃癌导向治疗研究中发现药物与特异性McAb的偶联物抗肿瘤效果优于游离药物或药物与非特异性McAb的偶联物,结果也支持我们的观点,即导向抗体与靶细胞的特异性结合作用是导向给药提高疗效的关键。体外实验证实Fab/IFN-αA抗HBV作用优于IFN-αA,为进一步研制抗乙型病毒性肝炎的生物导向治疗的基因工程多肽类药物提供了依据。
, 百拇医药
基金项目:国家自然科学基金资助项目(39670678)
作者简介:田文,男,1967-03-17生,浙江省永康市人,汉族,1996年军医进修学院硕士毕业,解放军总医院普通外科主治医师;发表论文9篇。电话:(010)66937217
参考文献
1,Foster GR,Goldin RD,Hay A et al.Expression of the terminal protein of Hepatitis B Virus is associated with failure to respond to interferon Therapy[J].Hepatology,1993,19(5):757-759.
2,郑 伟,檀 华,宋少柏 等.人抗乙肝表面抗原抗体Fab片段αA-干扰素融合蛋白原核表达载体的构建[J].军医进修学院学报,1998,19(3):161-163.
, http://www.100md.com
3,Sells M A,Chen M L,Acs G.Production of hepatitis B virus particle s in HepG2 cells transfected with cloned hepatitis B virus DNA[J].Proc Natl Acad Sci USA,1987,84(4):1005-1007.
4,Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays 高寿征主编.病毒性肝炎防治研究[M].北京:北京出版社,1993.605-608.
6,Hayashi Y,Kike K.Interferon inhibits hepatitis B virus replication in a stable expression system of transfected viral DNA[J].J Virol,1989,63(7):2936-2938.
, 百拇医药
7,Vrettou E,Zionfia V,Raptopoulou M et al.Changes of hepatitis B core antigen in liver biopsies of patients with chronic active hepatitis B treated with interferon[J].J Investig Allergol Clin Immunol,1995,5(2):108-109.
8,Caselmann WH,Meyer M,Scholz et al.Type I interferons inhibit hepatitis B virus replication and reduce hepatocellular gene expression in cultured liver cells[J].J Infect Dis.,1992,166(5):966-968.
9,姚志强,周永兴,冯雪梅等.荷瘤鼠用于乙型肝炎病毒的体内研究.第四军医大学学报[J],1995,16(2):141-143.
10,张运涛,王耐勤,李 农等.阿霉素与胃癌单克隆抗体交联物的体内外抗肿瘤作用[J].药学学报,1992,27(5):325-327.
收稿日期:1999-10-06
修回日期:1999-11-17, 百拇医药