缺血期膨胀肺对黑山羊在体肺温缺血再灌注损伤的保护作用
作者:张位星 陈胜喜 申建初 龙隆 张春芳
单位:张位星 陈胜喜 龙隆 张春芳(湖南医科大学附属湘雅医院心胸外科 410078);申建初(湘雅医院麻醉科)
关键词:连续膨肺;缺血再灌注损伤;羊肺
中国现代医学杂志000328 为研究缺血期连续膨肺对黑山羊在体肺温缺血再灌注损伤的保护作用及其机制。将18条杂种黑山羊随机分为3组,结扎左肺动脉做成左肺在体温缺血2 h及再灌2 h的模型,实验组在肺缺血期给予纯氧连续膨肺,对照组肺缺血期停止膨肺,观察左肺氧合功能(PaO2),肺含水量(w/d)及光镜下组织学改变,并测定肿瘤坏死因子(TNF-α)和白介素6(IL-6)含量。结果显示实验组肺缺血再灌注损伤无论是PaO2、w/d还是组织学改变均较对照组明显减轻,实验组IL-6明显高于对照组及假手术组,而对照组TNFα明显高于实验组和假手术组,而对照组TNFα明显高于实验组和假手术组,差异有显著性。结论:肺缺血期连续膨肺对羊在体温缺血再灌注损伤具有明显的保护作用,TNFα可引起缺血再灌注损伤,而IL-6通过抑制TNFα的转录和释放而减轻缺血再灌注损伤可能是其机制。
, 百拇医药
分类号 R-332
呼吸功能衰竭仍然是长时程、重症体外循环心内直视手术及肺移植术后致死并发症之一,而肺缺血再灌注损伤则是引起术后呼吸功能衰竭的主要原因[1]。但未见关于肺缺血期膨肺对在体常温下肺缺血再灌注损伤及保护作用的报道,本文旨在对此进行研究。
1 材料与方法
1.1 实验流程
本地黑山羊18条,雌雄不枸,体重10~12.5kg,3%戊巴比妥钠30mg/kg肌肉注射麻醉。气管插管人工呼吸,呼吸频率15次/min,潮气量15ml/kg,氧流量FiO2为1.0。经左第4肋间开胸,游离左主支气管、左肺动脉及左下肺静脉,套阻断带。阻左肺动脉前静脉注射肝素1mg/kg。
1.2 实验分组
, 百拇医药
随机分为3组,每组6条羊。A组为假手术组:不阻断左主支气管及左肺动脉,观察4h。B组为对照组:阻断左主支气管及左肺动脉造成左肺缺血,停止通气2h,再开放左主支气管及肺动脉观察2h。C组为实验组:阻断左肺动脉,不阻断左主支气管,连续通气,2h后开放左肺动脉观察2h。
1.3 观察指标
1.3.1 动脉血氧分压(PaO2) 在左肺缺血前(开胸后)、再灌30,60及120min时以左下肺静脉抽血1ml测PaO2,代表左肺氧合功能。
1.3.2 细胞因子测定 再灌120min取左下肺静脉血2ml,试剂盒购自深圳晶美公司,按说明书操作,测定TNFα和IT-6。
1.3.3 肺湿/干比(w/d) 代表肺含水量及肺水肿程度。再注120min时取左下肺背段组织2cm×3cm×1cm,用电子分析天平称湿重,70℃烤箱留置72h后称干重,求湿/干比。
, http://www.100md.com
1.3.4 组织学检查 观察肺泡内渗出情况。再灌120min时,取左下肺背段组织1cm×2cm×1cm,10%甲醛固定,由湘雅医院病理室常规HE染色,包埋,切片及阅片。
1.4 统计方法
数据采用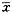 ±s表示,各组数据进行方差分析,用q检验进行比较,P<0.05代表有统计意义。
±s表示,各组数据进行方差分析,用q检验进行比较,P<0.05代表有统计意义。
2 结果
2.1 各组在体重、平均动脉压、心率、血温各方面均无显著性差异,均无严重心律失常及心功能不全表现,提示各组可比性良好。
2.2 PaO2 各组在缺血前的基础值差异无显著性。但在再灌30,60,120min时各组PaO2具有显著差异,详见表1。表1 各组PaO2(mmHg) 分组
, http://www.100md.com
缺血前
再灌30min
再灌60min
再灌120min
A
276.50±38.12
248.60±28.60
267.35±40.49
288.60±32.39
B
252.98±43.18
112.59±42.111)
, http://www.100md.com
175.20±36.742)
146.00±28.901)
C
234.67±31.16
212.72±37.343)
240.13±40.413)
223.52±42.823)
注:1)A与B比较P<0.01;2)A与B比较P<0.05;3)B与C比较P<0.05。
2.3 w/d及TNFα、IL-6:对照组w/d明显高于假手术组及实验组,而实验组w/d与假手术组比较也有显著性差异。
, 百拇医药
对照组TNFα明显高于假手术组及实验组(P<0.01)。
实验组IL-6明显高于对照组和假手术组(P<0.05),详见表2。
表2 各组w/d、TNAα、IL-6 分组
w/d
TNAα(PG/ml)
IL-6(PG/ml)
A
4.79±0.48
185.00±38.89
6.36±2.86
B
, 百拇医药
6.03±0.42
652.50±124.60
6.81±2.01
C
5.27±0.32
272.56±41.43
10.45±3.61
注:w/d A VS B及B VS C P<0.01
TNAα A VS C P<0.05 A VS B及B VSC P<0.01
IL-6 A VS C及B VS C P<0.05
, http://www.100md.com
2.4 组织学检查
对照组表现为肺泡内大量液体及细胞渗出,假手术组肺泡结构基本正常,而实验组仅有少量细胞渗出。
3 讨论
肺缺血再灌注损伤的特征性表现是肺毛细血管通透性增加,大量细胞及液体渗入肺泡内,形成肺水肿。本实验证实缺血期连续膨肺对羊在体温缺血再灌注具有明显保护作用,这与文献[2]的结果相似。
在肺缺血再灌注损伤的发病机制中,肺泡内积聚大量白细胞及其被激活起关键作用,而再灌注及再氧合时产生的氧自由基和激活的白细胞产生的细胞因子反过来又能促进上述过程[3]。
本文结果显示对照组肺缺血再灌注损伤明显比实验组严重,而对照组TNFα又明显高于实验组和假手术组,且实验组TNFα又明显比假手术组高,说明TNFα升高与肺缺血再灌注损伤有关,至少引起肺缺血再灌注损伤的因素之一。实验组IL-6明显高于对照组及假手术组,而实验组TNFα低于对照组提示IL-6能阻遏TNFα的诱导和抑制TNFα的释放[4],从而对肺缺血再灌注损伤起保护作用。可能这一途径就是肺缺血期连续膨肺对羊在体肺温缺血再灌注损伤的保护作用的机制之一。至于如何使IL-6水平升高则有待进一步研究。
, 百拇医药
参考文献:
1 Parquin F,Leroy Ladurie F,Cerrina J,et al.Outcome of immediate pulmonary edema after lung transplantation(abstract).Am J Respir crit care med,1994;149:A733
2 Hamvas A,Park CK,Palazo R,et al.Modifying pulmonary ischemia-reperfusion injury by altering ventilatory strategies during ischemia.J Appl physiol,1992;73:2112~219
3 Lo SK,Everitt J,Gu J,et al.Tumor necrosis factor modiates experimental pulmonary edema by ICAM-1 and CD18-dependent mechanisms.J Clin invest,1992;89:981~988
4 Schindler R,Mancilla J,Endres S,et al.Correlations and interations in the production of interlukin-6(IL-6),IL-1 and Tumor necrosis factor(TNF) in Human Blood mononuclear cells.IL-6 suppress IL-1 and TNF.Blood,1990;75:40~47
(1999-07-28收稿), 百拇医药
单位:张位星 陈胜喜 龙隆 张春芳(湖南医科大学附属湘雅医院心胸外科 410078);申建初(湘雅医院麻醉科)
关键词:连续膨肺;缺血再灌注损伤;羊肺
中国现代医学杂志000328 为研究缺血期连续膨肺对黑山羊在体肺温缺血再灌注损伤的保护作用及其机制。将18条杂种黑山羊随机分为3组,结扎左肺动脉做成左肺在体温缺血2 h及再灌2 h的模型,实验组在肺缺血期给予纯氧连续膨肺,对照组肺缺血期停止膨肺,观察左肺氧合功能(PaO2),肺含水量(w/d)及光镜下组织学改变,并测定肿瘤坏死因子(TNF-α)和白介素6(IL-6)含量。结果显示实验组肺缺血再灌注损伤无论是PaO2、w/d还是组织学改变均较对照组明显减轻,实验组IL-6明显高于对照组及假手术组,而对照组TNFα明显高于实验组和假手术组,而对照组TNFα明显高于实验组和假手术组,差异有显著性。结论:肺缺血期连续膨肺对羊在体温缺血再灌注损伤具有明显的保护作用,TNFα可引起缺血再灌注损伤,而IL-6通过抑制TNFα的转录和释放而减轻缺血再灌注损伤可能是其机制。
, 百拇医药
分类号 R-332
呼吸功能衰竭仍然是长时程、重症体外循环心内直视手术及肺移植术后致死并发症之一,而肺缺血再灌注损伤则是引起术后呼吸功能衰竭的主要原因[1]。但未见关于肺缺血期膨肺对在体常温下肺缺血再灌注损伤及保护作用的报道,本文旨在对此进行研究。
1 材料与方法
1.1 实验流程
本地黑山羊18条,雌雄不枸,体重10~12.5kg,3%戊巴比妥钠30mg/kg肌肉注射麻醉。气管插管人工呼吸,呼吸频率15次/min,潮气量15ml/kg,氧流量FiO2为1.0。经左第4肋间开胸,游离左主支气管、左肺动脉及左下肺静脉,套阻断带。阻左肺动脉前静脉注射肝素1mg/kg。
1.2 实验分组
, 百拇医药
随机分为3组,每组6条羊。A组为假手术组:不阻断左主支气管及左肺动脉,观察4h。B组为对照组:阻断左主支气管及左肺动脉造成左肺缺血,停止通气2h,再开放左主支气管及肺动脉观察2h。C组为实验组:阻断左肺动脉,不阻断左主支气管,连续通气,2h后开放左肺动脉观察2h。
1.3 观察指标
1.3.1 动脉血氧分压(PaO2) 在左肺缺血前(开胸后)、再灌30,60及120min时以左下肺静脉抽血1ml测PaO2,代表左肺氧合功能。
1.3.2 细胞因子测定 再灌120min取左下肺静脉血2ml,试剂盒购自深圳晶美公司,按说明书操作,测定TNFα和IT-6。
1.3.3 肺湿/干比(w/d) 代表肺含水量及肺水肿程度。再注120min时取左下肺背段组织2cm×3cm×1cm,用电子分析天平称湿重,70℃烤箱留置72h后称干重,求湿/干比。
, http://www.100md.com
1.3.4 组织学检查 观察肺泡内渗出情况。再灌120min时,取左下肺背段组织1cm×2cm×1cm,10%甲醛固定,由湘雅医院病理室常规HE染色,包埋,切片及阅片。
1.4 统计方法
数据采用
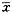 ±s表示,各组数据进行方差分析,用q检验进行比较,P<0.05代表有统计意义。
±s表示,各组数据进行方差分析,用q检验进行比较,P<0.05代表有统计意义。2 结果
2.1 各组在体重、平均动脉压、心率、血温各方面均无显著性差异,均无严重心律失常及心功能不全表现,提示各组可比性良好。
2.2 PaO2 各组在缺血前的基础值差异无显著性。但在再灌30,60,120min时各组PaO2具有显著差异,详见表1。表1 各组PaO2(mmHg) 分组
, http://www.100md.com
缺血前
再灌30min
再灌60min
再灌120min
A
276.50±38.12
248.60±28.60
267.35±40.49
288.60±32.39
B
252.98±43.18
112.59±42.111)
, http://www.100md.com
175.20±36.742)
146.00±28.901)
C
234.67±31.16
212.72±37.343)
240.13±40.413)
223.52±42.823)
注:1)A与B比较P<0.01;2)A与B比较P<0.05;3)B与C比较P<0.05。
2.3 w/d及TNFα、IL-6:对照组w/d明显高于假手术组及实验组,而实验组w/d与假手术组比较也有显著性差异。
, 百拇医药
对照组TNFα明显高于假手术组及实验组(P<0.01)。
实验组IL-6明显高于对照组和假手术组(P<0.05),详见表2。
表2 各组w/d、TNAα、IL-6 分组
w/d
TNAα(PG/ml)
IL-6(PG/ml)
A
4.79±0.48
185.00±38.89
6.36±2.86
B
, 百拇医药
6.03±0.42
652.50±124.60
6.81±2.01
C
5.27±0.32
272.56±41.43
10.45±3.61
注:w/d A VS B及B VS C P<0.01
TNAα A VS C P<0.05 A VS B及B VSC P<0.01
IL-6 A VS C及B VS C P<0.05
, http://www.100md.com
2.4 组织学检查
对照组表现为肺泡内大量液体及细胞渗出,假手术组肺泡结构基本正常,而实验组仅有少量细胞渗出。
3 讨论
肺缺血再灌注损伤的特征性表现是肺毛细血管通透性增加,大量细胞及液体渗入肺泡内,形成肺水肿。本实验证实缺血期连续膨肺对羊在体温缺血再灌注具有明显保护作用,这与文献[2]的结果相似。
在肺缺血再灌注损伤的发病机制中,肺泡内积聚大量白细胞及其被激活起关键作用,而再灌注及再氧合时产生的氧自由基和激活的白细胞产生的细胞因子反过来又能促进上述过程[3]。
本文结果显示对照组肺缺血再灌注损伤明显比实验组严重,而对照组TNFα又明显高于实验组和假手术组,且实验组TNFα又明显比假手术组高,说明TNFα升高与肺缺血再灌注损伤有关,至少引起肺缺血再灌注损伤的因素之一。实验组IL-6明显高于对照组及假手术组,而实验组TNFα低于对照组提示IL-6能阻遏TNFα的诱导和抑制TNFα的释放[4],从而对肺缺血再灌注损伤起保护作用。可能这一途径就是肺缺血期连续膨肺对羊在体肺温缺血再灌注损伤的保护作用的机制之一。至于如何使IL-6水平升高则有待进一步研究。
, 百拇医药
参考文献:
1 Parquin F,Leroy Ladurie F,Cerrina J,et al.Outcome of immediate pulmonary edema after lung transplantation(abstract).Am J Respir crit care med,1994;149:A733
2 Hamvas A,Park CK,Palazo R,et al.Modifying pulmonary ischemia-reperfusion injury by altering ventilatory strategies during ischemia.J Appl physiol,1992;73:2112~219
3 Lo SK,Everitt J,Gu J,et al.Tumor necrosis factor modiates experimental pulmonary edema by ICAM-1 and CD18-dependent mechanisms.J Clin invest,1992;89:981~988
4 Schindler R,Mancilla J,Endres S,et al.Correlations and interations in the production of interlukin-6(IL-6),IL-1 and Tumor necrosis factor(TNF) in Human Blood mononuclear cells.IL-6 suppress IL-1 and TNF.Blood,1990;75:40~47
(1999-07-28收稿), 百拇医药