缺血/再灌注所致心肌细胞凋亡的综合监测
作者:丁延峰 张蔓蔓 张爱子 何瑞荣
单位:(河北医科大学基础医学研究所生理学研究室 石家庄 050017)
关键词:再灌注损伤;代谢;心脏;基因;生理学;细胞死亡;生理学;流式细胞术;方法
河北医科大学学报000301
摘 要 目的 确定细胞凋亡参与心肌缺血/再灌注损伤,观察凋亡相关基因(Bcl-2、Bax和Fas)表达的变化。方法 在12 只雄性家兔心脏缺血/再灌注模型上,监测血流动力学、心外膜电图和心肌梗死范围。由原位末端标记法和凝胶电泳法确定心肌细胞凋亡;流式细胞分析法测定细胞凋亡率以及Bcl-2、Bax和Fas表达量。结果 在缺血/再灌注过程中,心率、血压和心肌耗氧量均持续性下降;心外膜电图ST段在缺血期明显抬高,再灌注时逐渐恢复正常。心肌梗死范围占缺血心肌的(57.7±2.0) %。原位末端标记法显示,缺血区存活心肌中有大量凋亡细胞,且缺血区心肌凝胶电泳上呈典型的云梯状,细胞凋亡率为(11.2±0.4) %,Bax和Fas表达较非缺血区增高。结论 缺血/再灌注可使心肌细胞发生凋亡,可能与Bax和Fas过量表达有关。
, 百拇医药
中图号 R541.1
INTEGRATED MEASUREMENTS FOR APOPTOSIS
OF CARDIOMYOCYTES
INDUCED BY ISCHEMIA/REPERFUSION
Ding Yanfeng Zhang Manman Zhang Aizi He Ruirong
Department of Physiology, Institute of Basic Medicine, Hebei Medical University
(Shijiazhuang 050017)
ABSTRACT Objective To determine the contribution of apoptosis to myocardial injury induced by ischemia/reperfusion and to observe the expression of Bcl-2, Bax and Fas which involved in apoptosis. Methods Twelve male rabbits were subjected to myocardial ischemia/reperfusion. The hemodynamics and epicardial electrography were recorded and myocardial infarct size was examined with nitro blue tetrazolium chloride. Apoptosis was detected with an in situ end-labeling method and DNA on agarose gel electrophorsis. Apoptosis rate and expression of Bcl-2, Bax and Fas were measured by flow cytometry. Results During the course of myocardial ischemia/reperfusion, heart rate, blood pressure and myocardial oxygen consumption decreased progressively. The epicardial electrographic ST segment was elevated significantly during ischemia, and recovered to baseline during reperfusion. The myocardial infarct size occupied (57.7±2.0) % of the ischemic myocardium. Apoptotic cardiomyocytes were found within the ischemic myocardium at risk. In ischemic myocardium, DNA ladder pattern was revealed by agrose gel electrophoresis, apoptosis rate was (11.2±0.4) % , and expression of Bax and Fas was higher than that in non-ischemic myocardium , but Bcl-2 expression had no change. Conclusion Myocardial ischemia/reperfusion induces apoptosis of cardiomyocyte, and the overexpression of Bax and Fas may accelerate the apoptosis.
, 百拇医药
MeSH reperfusion injury/metab;heart;genes/physiol;apoptosis/physiol;flow cytometry/methods▲
缺血/再灌注、缺血、缺氧等除引发心肌细胞坏死外,还使心肌细胞发生凋亡[1~6] 。细胞凋亡是不同于细胞坏死的1种细胞死亡形式,是在基因调控下所进行的主动有序的生理性死亡过程,具有细胞核染色质固缩、碎裂所形成凋亡小体的形态学特征以及核小体间脱氧核糖核酸分解所形成180~200 bp倍数DNA片段的生物化学特征。已有研究表明,Bcl-2是细胞凋亡的抑制基因,而Bax、Fas则是细胞凋亡的促进基因[4~8]。在缺血/再灌注所致心肌损伤中,有关细胞凋亡及其相关调控基因的系统研究还不多,且所采用的研究手段较单一。本实验旨在家兔心肌缺血再灌注模型上,采用血流动力学、电生理学、组织化学、流式细胞方法等多项技术,综合地观察心肌缺血/再灌注所致的细胞凋亡。
, 百拇医药
1 材料和方法
1.1 家兔心脏缺血/再灌注模型的制备: 12只雄性家兔,体质量2.5~3.5 kg,经氨基甲酸乙酯(0.8 g/kg)静脉麻醉后,取仰卧位固定,气管插管。沿胸骨左缘仔细开胸,剪开心包膜,暴露心脏,胸膜保持完好,动物能自主呼吸。在左冠状动脉左室支穿绕4-0丝线,其末端套一直径1.5 mm的聚氯乙烯管。通过拉紧丝线以阻断冠脉血流,松开丝线即可恢复灌流[9]。
1.2 血流动力学和心外膜电图描记: 左颈总动脉插管,连以血压换能器(MPU-0.5)输入载波放大器(AP-600G)监测血压,由血压脉动触发心率计(AT-600G)监测心率。在冠脉阻断点的周围选5点作为心外膜电图记录点,用自制的灯芯电极将心外膜电图信号输入生物放大器 (AB-620G)。由多道生理记录仪(RM-6000)同时记录血压、心率和心外膜电图,以血压-心率指数反映心肌耗氧量,由各点心外膜电图ST段抬高的平均值 (mean elevation of epicardial electrographic ST-segment,MST)和ST段抬高≥2 mV的点数(numbers of point with ST-segment elevation beyond 2 mV,NST)表示缺血的程度和范围[9]。
, 百拇医药
1.3 心肌缺血的确定: 冠脉阻断后,心脏表面出现青紫,松开丝线灌流,心脏表面表现明显充血,且ST段在缺血过程中明显抬高。缺血/再灌注结束后,结扎冠状动脉,从左心室腔注入1 % 伊文思蓝1 ml,可见未缺血心肌组织染成蓝色,缺血心肌不染色[1,2,9]。随后将动物随机分为2组:1组用于心肌梗死范围测定(n=6);另1组用作心肌细胞凋亡及相关基因的分析(n=6)。
1.4 心肌梗死范围测定: 实验结束后,迅速取下心脏,用冰冷生理盐水冲洗,留取左心室,依伊文思蓝染色区分缺血和非缺血心肌。将缺血心肌组织切成厚5 mm的组织片,放入37 ℃、1 % 的硝基四氮唑蓝的磷酸缓冲液中15 min ,可见存活心肌染成蓝色,坏死心肌不染色。以坏死心肌所占缺血心肌组织或左心室的质量比作为心肌梗死范围[9]。
1.5 原位组织化学方法确定细胞凋亡: 分别取正常和缺血区心肌组织,浸入10 % 中性福尔马林磷酸缓冲液中,4 ℃ 固定24 h。应用Boehringer Mannheim公司提供的细胞凋亡试剂盒,采用末端探针标记(Tdt-mediated dUTP nick end labeling ,TUNEL)方法检测心肌凋亡细胞[2]。
, 百拇医药
1.6 组织DNA提取和凝胶电泳: 取正常或缺血心肌组织 0.5 g, 低温下使组织匀浆,按Itoh等的方法进行DNA抽提和分离[10]。取DNA提取液于1.6 %琼脂糖凝胶电泳中进行电泳,经溴化乙锭染色,紫外灯下观察、照相。
1.7 流式细胞方法测定细胞凋亡率: 用机械法分散心肌组织,收集单细胞悬液 ,经300 目尼龙网过滤 ,以5 000 r/min离心沉淀2 min后,加生理盐水洗涤,再次离心沉淀,置于70 % 乙醇中备用。用溴化乙锭一步插入法进行DNA染色,由流式细胞仪(FACS420,Becton-Dicinson)测定。仪器事先用鸡红细胞标定使其变异系数 <5 %。所得数据输入计算机,经Bioconsort专用软件处理,分析细胞凋亡率[11]。
1.8 流式细胞方法测定基因蛋白表达: 用以上制备好的单细胞悬液,通过间接荧光方法进行标记。将1∶100的鼠抗兔Bcl-2、Bax和Fas蛋白抗体100 μl分别加入到含6×105细胞的离心管中混匀,37 ℃水浴孵育30 min,以PBS离心洗涤2次除去未结合抗体,加入1∶20羊抗鼠FITC-IgG (军事医学科学院微生物研究所)100 μl,37 ℃ 温育30 min, PBS冲洗未结合抗体,同时以PBS代替第一抗体作为阴性对照。在制备好的样品中加PBS 1 ml,并各取1滴涂片,荧光显微镜下观察。有Bcl-2、Bax蛋白存在的细胞浆内呈绿色荧光,有Fas蛋白表达的细胞膜则有绿色荧光。将样品上机进行流式细胞测定Bcl-2、Bax和Fas蛋白,将采集的数据输入计算机进行处理,以荧光指数表示蛋白的相对含量[11]。
, 百拇医药
1.9 统计学处理: 所有数据输入计算机进行统计学处理,结果用均数±标准误(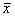 ±s)表示,组内数据应用配对t检验,以P<0.05 有统计学意义。
±s)表示,组内数据应用配对t检验,以P<0.05 有统计学意义。
2 结 果
2.1 血压、心率、心肌耗氧量和心外膜电图: 缺血/再灌注过程中,血压、心率和心肌耗氧量呈持续性下降,见表1;心外膜电图MST和NST在缺血时均明显增加,再灌注后又逐渐恢复到基础对照值(图1)。
表1 家兔缺血/再灌注时血压、心率和心肌耗氧量的变化
Table 1 Changes of blood pressure, heart rate and
myocardial oxygen consumption during myocardial
, 百拇医药
ischemia/reperfusion in rabbits
(n=12,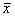 ±s) Time
±s) Time
Blood pressure
(p/kPa)
Heart rate
(beat/min)
Myocardial oxygen
consumption
(kPa.min-1.1000-1)
, 百拇医药
Pre-ischemia
12.23±0.71
311±20
3.82±0.36
Ischemia
5 min
10.85±0.85*
309±18
3.47±0.33*
15 min
10.98±0.50*
, 百拇医药
302±20
3.33±0.27*
30 min
10.29±0.55**
304±19
3.17±0.32**
45 min
10.00±0.54**
301±20
3.05±0.33**
, 百拇医药 Reperfusion
5 min
8.89±0.35**
298±18
2.66±0.21**
15 min
8.96±0.35**
291±16
2.62±0.19**
30 min
8.97±0.34**
, http://www.100md.com
291±16
2.63±0.21**
60 min
8.36±0.24**
287±17
2.41±0.16***
120 min
7.89±0.21**
278±17
2.03±0.14***
, http://www.100md.com
180 min
7.29±0.25***
268±21
1.97±0.21***
*P<0.05 **P<0.01 ***P<0.001 vs pre-ischemia by t test
图1 麻醉家兔心肌缺血/再灌注时心外膜的变化
Figure 1 Changes of epicardial electrographic ST-segment during myocardial ischemia/reperfusion in anesthetized rabbits
, 百拇医药
MST: mean elevation of epicardial electrographic ST-segment
NST: numbers of point with the ST-segment elevation beyond 2 mV
*P<0.05 **P<0.01 ***P<0.001
vs pre-ischemia by t test
2.2 心肌梗死范围: 经伊文思蓝染色确定,左心室缺血心肌组织占左心室的 (59.6±2.3) %。应用硝基四氮唑蓝染色法显示,坏死心肌占缺血心肌的 (57.7±2.0) %,占左心室的 (34.3±1.9) %。
2.3 心肌细胞凋亡: DNA凝胶电泳显示,6例动物缺血/再灌注心肌组织均有云梯状的DNA条带,非缺血心肌组织的DNA电泳呈1条整齐的条带(图2)。经TUNEL染色,可见凋亡细胞的核染成深棕色,非凋亡细胞的胞核不着色(图3)。正常心肌组织和坏死心肌组织无凋亡细胞,缺血未坏死的心肌有大量凋亡细胞 (图4)。 由流式细胞仪测得 6 例缺血/再灌注区的心肌细胞凋亡率为 (11.2±0.4) %,而非缺血心肌组织的凋亡率为 (0.8±0.1) %。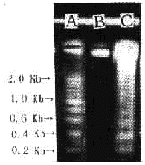
, http://www.100md.com
图2 DNA凝胶电泳分析
A DNA标准品 B 非缺血心肌 C 缺血心肌
Figure 2 electrophoretic analysis of DNA on agrose gel
A DNA ladder marker B non-ischemic myocardium
C ischemic myocardium
图3 缺血/再灌注所致心肌细胞凋亡
①非缺血心肌:无凋亡细胞 ②坏死心肌:无凋亡细胞
③缺血非坏死心肌(纵切)↓凋亡细胞核呈棕色卵圆形
, 百拇医药
④缺血非坏死心肌(横切)↓凋亡细胞核成棕色圆球形
Figure 3 Cardiomyocytic apoptosis induced by ischemia/reperfusion (TUNEL,×200)
①non-ischemic myocardium: no apoptotic cell ②necrotic myocardium: no apoptotic cell
③ischemic and non-necrotic myocardium(longitudiual)↓apoptotic cell with oval brown nucleus
④ischemic and non-necrotic myocardium(transverse)↓apoptotic cell with spherical nucleus
, 百拇医药
图4 流式细胞分析对心肌细胞凋亡率的测定----非缺血心肌 ——缺血心肌 ↓ 凋亡峰
Figure 4 Measurement of cardiomyocytic apoptosis rate by flow cytometry
non-ischemic myocardium
ischemic myocardium
↓ apoptotic peak
2.4 Bcl-2、Bax和Fas蛋白表达: 与非缺血心肌组织相比,缺血/再灌注后Bcl-2基因蛋白无明显变化,而缺血心肌组织中Bax和Fas蛋白表达都明显增高,见表2。
表2 家兔心肌组织中Bcl-2、Bax和Fas蛋白表达的荧光指数
, http://www.100md.com
Table 2 Fluorescence index of Bcl-2,Bax and Fas protein
expression in rabbit myocardium
(n=6,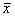 ±s) Tissues
±s) Tissues
Bcl-2
Bax
Fas
Non-ischemic myocardium
1.00
1.00
, 百拇医药
1.00
Ischemic myocardium
0.95±0.04
1.50±0.06
1.87±0.25
P<0.01 vs non-ischemic myocardium by t test3 讨 论
本实验在心肌缺血45 min和再灌注180 min的模型上观察到,缺血/再灌注可以诱发心肌坏死,与本研究室先前的报道相一致[9]。根据本实验琼脂糖凝胶电泳显示的典型DNA云梯状图谱、TUNEL法检测到的断裂DNA片段以及流式细胞测定的凋亡率等,均证明缺血/再灌注可诱发心肌细胞凋亡。Fliss等发现缺血/再灌注可引发大鼠心肌细胞凋亡[1];Gottlieb等观察到缺血/再灌注能诱发家兔心肌细胞凋亡,而单纯缺血则不能引发细胞凋亡[3];但Kajstura等发现单纯缺血可引发大鼠心肌细胞凋亡[4]。据Tanaka等的报道,缺氧可使培养的新生大鼠心肌细胞凋亡[5]。更重要的是,在急性心肌梗死患者的心肌组织上,也检测到凋亡细胞[10,12]。本实验应用流式细胞学观察到 ,缺血/再灌注所致心肌细胞的凋亡率为 11.3 %;而一些学者以每百个心肌细胞中的凋亡细胞数来计算细胞凋亡率,如Yaoita等报道缺血30 min和再灌注180 min大鼠心肌细胞的凋亡率为 11.1 %[2];Yue所测得的家兔缺血/再灌注心肌细胞凋亡率为 14.7 %[6];Olivetti等在人心肌梗死交界处计测的细胞凋亡率为12 %[12]。本实验结果与上述诸学者的基本一致。
, http://www.100md.com
业已证实,许多因素参与细胞凋亡的调控,其最终可能都通过凋亡相关基因(Bcl-2、Bax和Fas等)的调控。已知Fas是1种跨膜蛋白,属于肿瘤坏死因子受体家族的成员,它通过在细胞膜上表达而介导细胞凋亡[5~7]。Bcl-2是细胞凋亡的抑制基因,其过量表达可阻断细胞凋亡信号传递系统的最后通路,从而促进细胞存活;而Bax虽与Bcl-2有较高的同源性,但其过量表达可促进细胞凋亡。Bax与Bcl-2的比值将决定细胞是否发生凋亡[8]。Tanaka等发现,缺氧引起培养的新生大鼠心肌细胞发生凋亡的同时,伴有Fas蛋白 mRNA的过量表达[5]。Kajstura等观察到,单纯缺血诱发大鼠心肌细胞凋亡,Fas和Bcl-2基因蛋白均过量表达[4]。Yue等在家兔缺血/再灌注的心肌组织中Fas蛋白表达量显著升高[6]。而本实验结果显示,缺血/再灌注时细胞凋亡抑制基因Bcl-2表达虽无明显变化,但细胞凋亡的诱导基因Bax、Fas过量表达,终致心肌细胞凋亡。至于这些基因激活后引发细胞凋亡的具体机制尚有待于阐明。
, 百拇医药
综上所述,本研究表明,缺血/再灌注可引发家兔心肌细胞坏死和凋亡,其细胞凋亡的产生可能与Bax和Fas基因蛋白的过量表达有关。■
(本文图2、3见插页第1页)
参考文献
[1]Fliss H, Gatlinger D. Apoptosis in ischemic and reperfused rat myocardium. Circ Res,1996,79(5): 949
[2]Yaoita H, Ogawa K, Maehara K, et al. Attenuation of ischemia/reperfusion injury in rats by a caspase inhibitor. Circulation, 1998,97(3):276
, http://www.100md.com
[3]Gottlieb RA,Burleson KD, Kloner RA, et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes. J Clin Inves,1994,94(4):1621
[4]Kajstura J, Cheng W, Reiss K ,et al. Apoptotic and necrotic myocyte cell deaths are in dependent contributing variables of infarct size in rats. Lab Invest, 1996,74 (1): 86
[5]Tanaka M,Ito H, Adachi S, et al. Hypoxia induces apoptosis with enhanced expression of Fas antigen messenger RNA in cultured neonatal rat cardiomyocytes. Circ Res,1994,75(3):426
, 百拇医药
[6]Yue TL, Ma XL, Wang XK ,et al. Possible involvement of stress-activated protein kinase singnaling pathway and Fas receptor expression by carvediol. Circ Res,1998, 82(2):166
[7]Nagata S , Golistein P. The Fas death factor. Science,1995, 267 (5203): 1449
[8]Oltvai ZN, Millimau CL, Karsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell,1993, 74(4): 609
, 百拇医药
[9]丁延峰,李玉龙,何瑞荣. 缺血预处理和左旋精氨酸减小家兔心肌梗塞范围. 生理学报, 1996,48(6):564
[10]Itoh G, Tamura J, Suzuki M, et al. DNA fragmentation of human infarcted myocardial cell demonstrated by the nick end labeling method and DNA agarose gel electrophoresis. Am J Pathol, 1995, 146(6):1325
[11]左连富,主编. 流式细胞术与生物医学. 沈阳:辽宁科学技术出版社,1996.213~267
[12]Olivetti G, Quaini F, Sala R, et al. Acute myocardial infarction in humans is associated with activation of programmed myocyte cell death in the surviving portion of the heart. J Mol Cell Cardiol, 1994, 28 (9): 2005
收稿日期:1999-11-18, 百拇医药
单位:(河北医科大学基础医学研究所生理学研究室 石家庄 050017)
关键词:再灌注损伤;代谢;心脏;基因;生理学;细胞死亡;生理学;流式细胞术;方法
河北医科大学学报000301
摘 要 目的 确定细胞凋亡参与心肌缺血/再灌注损伤,观察凋亡相关基因(Bcl-2、Bax和Fas)表达的变化。方法 在12 只雄性家兔心脏缺血/再灌注模型上,监测血流动力学、心外膜电图和心肌梗死范围。由原位末端标记法和凝胶电泳法确定心肌细胞凋亡;流式细胞分析法测定细胞凋亡率以及Bcl-2、Bax和Fas表达量。结果 在缺血/再灌注过程中,心率、血压和心肌耗氧量均持续性下降;心外膜电图ST段在缺血期明显抬高,再灌注时逐渐恢复正常。心肌梗死范围占缺血心肌的(57.7±2.0) %。原位末端标记法显示,缺血区存活心肌中有大量凋亡细胞,且缺血区心肌凝胶电泳上呈典型的云梯状,细胞凋亡率为(11.2±0.4) %,Bax和Fas表达较非缺血区增高。结论 缺血/再灌注可使心肌细胞发生凋亡,可能与Bax和Fas过量表达有关。
, 百拇医药
中图号 R541.1
INTEGRATED MEASUREMENTS FOR APOPTOSIS
OF CARDIOMYOCYTES
INDUCED BY ISCHEMIA/REPERFUSION
Ding Yanfeng Zhang Manman Zhang Aizi He Ruirong
Department of Physiology, Institute of Basic Medicine, Hebei Medical University
(Shijiazhuang 050017)
ABSTRACT Objective To determine the contribution of apoptosis to myocardial injury induced by ischemia/reperfusion and to observe the expression of Bcl-2, Bax and Fas which involved in apoptosis. Methods Twelve male rabbits were subjected to myocardial ischemia/reperfusion. The hemodynamics and epicardial electrography were recorded and myocardial infarct size was examined with nitro blue tetrazolium chloride. Apoptosis was detected with an in situ end-labeling method and DNA on agarose gel electrophorsis. Apoptosis rate and expression of Bcl-2, Bax and Fas were measured by flow cytometry. Results During the course of myocardial ischemia/reperfusion, heart rate, blood pressure and myocardial oxygen consumption decreased progressively. The epicardial electrographic ST segment was elevated significantly during ischemia, and recovered to baseline during reperfusion. The myocardial infarct size occupied (57.7±2.0) % of the ischemic myocardium. Apoptotic cardiomyocytes were found within the ischemic myocardium at risk. In ischemic myocardium, DNA ladder pattern was revealed by agrose gel electrophoresis, apoptosis rate was (11.2±0.4) % , and expression of Bax and Fas was higher than that in non-ischemic myocardium , but Bcl-2 expression had no change. Conclusion Myocardial ischemia/reperfusion induces apoptosis of cardiomyocyte, and the overexpression of Bax and Fas may accelerate the apoptosis.
, 百拇医药
MeSH reperfusion injury/metab;heart;genes/physiol;apoptosis/physiol;flow cytometry/methods▲
缺血/再灌注、缺血、缺氧等除引发心肌细胞坏死外,还使心肌细胞发生凋亡[1~6] 。细胞凋亡是不同于细胞坏死的1种细胞死亡形式,是在基因调控下所进行的主动有序的生理性死亡过程,具有细胞核染色质固缩、碎裂所形成凋亡小体的形态学特征以及核小体间脱氧核糖核酸分解所形成180~200 bp倍数DNA片段的生物化学特征。已有研究表明,Bcl-2是细胞凋亡的抑制基因,而Bax、Fas则是细胞凋亡的促进基因[4~8]。在缺血/再灌注所致心肌损伤中,有关细胞凋亡及其相关调控基因的系统研究还不多,且所采用的研究手段较单一。本实验旨在家兔心肌缺血再灌注模型上,采用血流动力学、电生理学、组织化学、流式细胞方法等多项技术,综合地观察心肌缺血/再灌注所致的细胞凋亡。
, 百拇医药
1 材料和方法
1.1 家兔心脏缺血/再灌注模型的制备: 12只雄性家兔,体质量2.5~3.5 kg,经氨基甲酸乙酯(0.8 g/kg)静脉麻醉后,取仰卧位固定,气管插管。沿胸骨左缘仔细开胸,剪开心包膜,暴露心脏,胸膜保持完好,动物能自主呼吸。在左冠状动脉左室支穿绕4-0丝线,其末端套一直径1.5 mm的聚氯乙烯管。通过拉紧丝线以阻断冠脉血流,松开丝线即可恢复灌流[9]。
1.2 血流动力学和心外膜电图描记: 左颈总动脉插管,连以血压换能器(MPU-0.5)输入载波放大器(AP-600G)监测血压,由血压脉动触发心率计(AT-600G)监测心率。在冠脉阻断点的周围选5点作为心外膜电图记录点,用自制的灯芯电极将心外膜电图信号输入生物放大器 (AB-620G)。由多道生理记录仪(RM-6000)同时记录血压、心率和心外膜电图,以血压-心率指数反映心肌耗氧量,由各点心外膜电图ST段抬高的平均值 (mean elevation of epicardial electrographic ST-segment,MST)和ST段抬高≥2 mV的点数(numbers of point with ST-segment elevation beyond 2 mV,NST)表示缺血的程度和范围[9]。
, 百拇医药
1.3 心肌缺血的确定: 冠脉阻断后,心脏表面出现青紫,松开丝线灌流,心脏表面表现明显充血,且ST段在缺血过程中明显抬高。缺血/再灌注结束后,结扎冠状动脉,从左心室腔注入1 % 伊文思蓝1 ml,可见未缺血心肌组织染成蓝色,缺血心肌不染色[1,2,9]。随后将动物随机分为2组:1组用于心肌梗死范围测定(n=6);另1组用作心肌细胞凋亡及相关基因的分析(n=6)。
1.4 心肌梗死范围测定: 实验结束后,迅速取下心脏,用冰冷生理盐水冲洗,留取左心室,依伊文思蓝染色区分缺血和非缺血心肌。将缺血心肌组织切成厚5 mm的组织片,放入37 ℃、1 % 的硝基四氮唑蓝的磷酸缓冲液中15 min ,可见存活心肌染成蓝色,坏死心肌不染色。以坏死心肌所占缺血心肌组织或左心室的质量比作为心肌梗死范围[9]。
1.5 原位组织化学方法确定细胞凋亡: 分别取正常和缺血区心肌组织,浸入10 % 中性福尔马林磷酸缓冲液中,4 ℃ 固定24 h。应用Boehringer Mannheim公司提供的细胞凋亡试剂盒,采用末端探针标记(Tdt-mediated dUTP nick end labeling ,TUNEL)方法检测心肌凋亡细胞[2]。
, 百拇医药
1.6 组织DNA提取和凝胶电泳: 取正常或缺血心肌组织 0.5 g, 低温下使组织匀浆,按Itoh等的方法进行DNA抽提和分离[10]。取DNA提取液于1.6 %琼脂糖凝胶电泳中进行电泳,经溴化乙锭染色,紫外灯下观察、照相。
1.7 流式细胞方法测定细胞凋亡率: 用机械法分散心肌组织,收集单细胞悬液 ,经300 目尼龙网过滤 ,以5 000 r/min离心沉淀2 min后,加生理盐水洗涤,再次离心沉淀,置于70 % 乙醇中备用。用溴化乙锭一步插入法进行DNA染色,由流式细胞仪(FACS420,Becton-Dicinson)测定。仪器事先用鸡红细胞标定使其变异系数 <5 %。所得数据输入计算机,经Bioconsort专用软件处理,分析细胞凋亡率[11]。
1.8 流式细胞方法测定基因蛋白表达: 用以上制备好的单细胞悬液,通过间接荧光方法进行标记。将1∶100的鼠抗兔Bcl-2、Bax和Fas蛋白抗体100 μl分别加入到含6×105细胞的离心管中混匀,37 ℃水浴孵育30 min,以PBS离心洗涤2次除去未结合抗体,加入1∶20羊抗鼠FITC-IgG (军事医学科学院微生物研究所)100 μl,37 ℃ 温育30 min, PBS冲洗未结合抗体,同时以PBS代替第一抗体作为阴性对照。在制备好的样品中加PBS 1 ml,并各取1滴涂片,荧光显微镜下观察。有Bcl-2、Bax蛋白存在的细胞浆内呈绿色荧光,有Fas蛋白表达的细胞膜则有绿色荧光。将样品上机进行流式细胞测定Bcl-2、Bax和Fas蛋白,将采集的数据输入计算机进行处理,以荧光指数表示蛋白的相对含量[11]。
, 百拇医药
1.9 统计学处理: 所有数据输入计算机进行统计学处理,结果用均数±标准误(
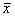 ±s)表示,组内数据应用配对t检验,以P<0.05 有统计学意义。
±s)表示,组内数据应用配对t检验,以P<0.05 有统计学意义。2 结 果
2.1 血压、心率、心肌耗氧量和心外膜电图: 缺血/再灌注过程中,血压、心率和心肌耗氧量呈持续性下降,见表1;心外膜电图MST和NST在缺血时均明显增加,再灌注后又逐渐恢复到基础对照值(图1)。
表1 家兔缺血/再灌注时血压、心率和心肌耗氧量的变化
Table 1 Changes of blood pressure, heart rate and
myocardial oxygen consumption during myocardial
, 百拇医药
ischemia/reperfusion in rabbits
(n=12,
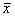 ±s) Time
±s) TimeBlood pressure
(p/kPa)
Heart rate
(beat/min)
Myocardial oxygen
consumption
(kPa.min-1.1000-1)
, 百拇医药
Pre-ischemia
12.23±0.71
311±20
3.82±0.36
Ischemia
5 min
10.85±0.85*
309±18
3.47±0.33*
15 min
10.98±0.50*
, 百拇医药
302±20
3.33±0.27*
30 min
10.29±0.55**
304±19
3.17±0.32**
45 min
10.00±0.54**
301±20
3.05±0.33**
, 百拇医药 Reperfusion
5 min
8.89±0.35**
298±18
2.66±0.21**
15 min
8.96±0.35**
291±16
2.62±0.19**
30 min
8.97±0.34**
, http://www.100md.com
291±16
2.63±0.21**
60 min
8.36±0.24**
287±17
2.41±0.16***
120 min
7.89±0.21**
278±17
2.03±0.14***
, http://www.100md.com
180 min
7.29±0.25***
268±21
1.97±0.21***
*P<0.05 **P<0.01 ***P<0.001 vs pre-ischemia by t test

图1 麻醉家兔心肌缺血/再灌注时心外膜的变化
Figure 1 Changes of epicardial electrographic ST-segment during myocardial ischemia/reperfusion in anesthetized rabbits
, 百拇医药
MST: mean elevation of epicardial electrographic ST-segment
NST: numbers of point with the ST-segment elevation beyond 2 mV
*P<0.05 **P<0.01 ***P<0.001
vs pre-ischemia by t test
2.2 心肌梗死范围: 经伊文思蓝染色确定,左心室缺血心肌组织占左心室的 (59.6±2.3) %。应用硝基四氮唑蓝染色法显示,坏死心肌占缺血心肌的 (57.7±2.0) %,占左心室的 (34.3±1.9) %。
2.3 心肌细胞凋亡: DNA凝胶电泳显示,6例动物缺血/再灌注心肌组织均有云梯状的DNA条带,非缺血心肌组织的DNA电泳呈1条整齐的条带(图2)。经TUNEL染色,可见凋亡细胞的核染成深棕色,非凋亡细胞的胞核不着色(图3)。正常心肌组织和坏死心肌组织无凋亡细胞,缺血未坏死的心肌有大量凋亡细胞 (图4)。 由流式细胞仪测得 6 例缺血/再灌注区的心肌细胞凋亡率为 (11.2±0.4) %,而非缺血心肌组织的凋亡率为 (0.8±0.1) %。

, http://www.100md.com
图2 DNA凝胶电泳分析
A DNA标准品 B 非缺血心肌 C 缺血心肌
Figure 2 electrophoretic analysis of DNA on agrose gel
A DNA ladder marker B non-ischemic myocardium
C ischemic myocardium

图3 缺血/再灌注所致心肌细胞凋亡
①非缺血心肌:无凋亡细胞 ②坏死心肌:无凋亡细胞
③缺血非坏死心肌(纵切)↓凋亡细胞核呈棕色卵圆形
, 百拇医药
④缺血非坏死心肌(横切)↓凋亡细胞核成棕色圆球形
Figure 3 Cardiomyocytic apoptosis induced by ischemia/reperfusion (TUNEL,×200)
①non-ischemic myocardium: no apoptotic cell ②necrotic myocardium: no apoptotic cell
③ischemic and non-necrotic myocardium(longitudiual)↓apoptotic cell with oval brown nucleus
④ischemic and non-necrotic myocardium(transverse)↓apoptotic cell with spherical nucleus

, 百拇医药
图4 流式细胞分析对心肌细胞凋亡率的测定----非缺血心肌 ——缺血心肌 ↓ 凋亡峰
Figure 4 Measurement of cardiomyocytic apoptosis rate by flow cytometry
non-ischemic myocardium
ischemic myocardium
↓ apoptotic peak
2.4 Bcl-2、Bax和Fas蛋白表达: 与非缺血心肌组织相比,缺血/再灌注后Bcl-2基因蛋白无明显变化,而缺血心肌组织中Bax和Fas蛋白表达都明显增高,见表2。
表2 家兔心肌组织中Bcl-2、Bax和Fas蛋白表达的荧光指数
, http://www.100md.com
Table 2 Fluorescence index of Bcl-2,Bax and Fas protein
expression in rabbit myocardium
(n=6,
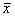 ±s) Tissues
±s) TissuesBcl-2
Bax
Fas
Non-ischemic myocardium
1.00
1.00
, 百拇医药
1.00
Ischemic myocardium
0.95±0.04
1.50±0.06
1.87±0.25
P<0.01 vs non-ischemic myocardium by t test3 讨 论
本实验在心肌缺血45 min和再灌注180 min的模型上观察到,缺血/再灌注可以诱发心肌坏死,与本研究室先前的报道相一致[9]。根据本实验琼脂糖凝胶电泳显示的典型DNA云梯状图谱、TUNEL法检测到的断裂DNA片段以及流式细胞测定的凋亡率等,均证明缺血/再灌注可诱发心肌细胞凋亡。Fliss等发现缺血/再灌注可引发大鼠心肌细胞凋亡[1];Gottlieb等观察到缺血/再灌注能诱发家兔心肌细胞凋亡,而单纯缺血则不能引发细胞凋亡[3];但Kajstura等发现单纯缺血可引发大鼠心肌细胞凋亡[4]。据Tanaka等的报道,缺氧可使培养的新生大鼠心肌细胞凋亡[5]。更重要的是,在急性心肌梗死患者的心肌组织上,也检测到凋亡细胞[10,12]。本实验应用流式细胞学观察到 ,缺血/再灌注所致心肌细胞的凋亡率为 11.3 %;而一些学者以每百个心肌细胞中的凋亡细胞数来计算细胞凋亡率,如Yaoita等报道缺血30 min和再灌注180 min大鼠心肌细胞的凋亡率为 11.1 %[2];Yue所测得的家兔缺血/再灌注心肌细胞凋亡率为 14.7 %[6];Olivetti等在人心肌梗死交界处计测的细胞凋亡率为12 %[12]。本实验结果与上述诸学者的基本一致。
, http://www.100md.com
业已证实,许多因素参与细胞凋亡的调控,其最终可能都通过凋亡相关基因(Bcl-2、Bax和Fas等)的调控。已知Fas是1种跨膜蛋白,属于肿瘤坏死因子受体家族的成员,它通过在细胞膜上表达而介导细胞凋亡[5~7]。Bcl-2是细胞凋亡的抑制基因,其过量表达可阻断细胞凋亡信号传递系统的最后通路,从而促进细胞存活;而Bax虽与Bcl-2有较高的同源性,但其过量表达可促进细胞凋亡。Bax与Bcl-2的比值将决定细胞是否发生凋亡[8]。Tanaka等发现,缺氧引起培养的新生大鼠心肌细胞发生凋亡的同时,伴有Fas蛋白 mRNA的过量表达[5]。Kajstura等观察到,单纯缺血诱发大鼠心肌细胞凋亡,Fas和Bcl-2基因蛋白均过量表达[4]。Yue等在家兔缺血/再灌注的心肌组织中Fas蛋白表达量显著升高[6]。而本实验结果显示,缺血/再灌注时细胞凋亡抑制基因Bcl-2表达虽无明显变化,但细胞凋亡的诱导基因Bax、Fas过量表达,终致心肌细胞凋亡。至于这些基因激活后引发细胞凋亡的具体机制尚有待于阐明。
, 百拇医药
综上所述,本研究表明,缺血/再灌注可引发家兔心肌细胞坏死和凋亡,其细胞凋亡的产生可能与Bax和Fas基因蛋白的过量表达有关。■
(本文图2、3见插页第1页)
参考文献
[1]Fliss H, Gatlinger D. Apoptosis in ischemic and reperfused rat myocardium. Circ Res,1996,79(5): 949
[2]Yaoita H, Ogawa K, Maehara K, et al. Attenuation of ischemia/reperfusion injury in rats by a caspase inhibitor. Circulation, 1998,97(3):276
, http://www.100md.com
[3]Gottlieb RA,Burleson KD, Kloner RA, et al. Reperfusion injury induces apoptosis in rabbit cardiomyocytes. J Clin Inves,1994,94(4):1621
[4]Kajstura J, Cheng W, Reiss K ,et al. Apoptotic and necrotic myocyte cell deaths are in dependent contributing variables of infarct size in rats. Lab Invest, 1996,74 (1): 86
[5]Tanaka M,Ito H, Adachi S, et al. Hypoxia induces apoptosis with enhanced expression of Fas antigen messenger RNA in cultured neonatal rat cardiomyocytes. Circ Res,1994,75(3):426
, 百拇医药
[6]Yue TL, Ma XL, Wang XK ,et al. Possible involvement of stress-activated protein kinase singnaling pathway and Fas receptor expression by carvediol. Circ Res,1998, 82(2):166
[7]Nagata S , Golistein P. The Fas death factor. Science,1995, 267 (5203): 1449
[8]Oltvai ZN, Millimau CL, Karsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell,1993, 74(4): 609
, 百拇医药
[9]丁延峰,李玉龙,何瑞荣. 缺血预处理和左旋精氨酸减小家兔心肌梗塞范围. 生理学报, 1996,48(6):564
[10]Itoh G, Tamura J, Suzuki M, et al. DNA fragmentation of human infarcted myocardial cell demonstrated by the nick end labeling method and DNA agarose gel electrophoresis. Am J Pathol, 1995, 146(6):1325
[11]左连富,主编. 流式细胞术与生物医学. 沈阳:辽宁科学技术出版社,1996.213~267
[12]Olivetti G, Quaini F, Sala R, et al. Acute myocardial infarction in humans is associated with activation of programmed myocyte cell death in the surviving portion of the heart. J Mol Cell Cardiol, 1994, 28 (9): 2005
收稿日期:1999-11-18, 百拇医药