血管内皮细胞生长因子诱导肝癌细胞转移的扫描电镜观察
作者:毛华 袁爱力 赵敏芳 彭齐荣 张亚历
单位:毛华(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515);袁爱力(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515);赵敏芳(珠江医院放疗科,广东 广州 510282);彭齐荣(解放军458医院全军传染病中心,广东 广州 510032);张亚历(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515)
关键词:血管内皮细胞生长因子;肝癌细胞株;转移;伪足
第一军医大学学报000324 摘要:目的 研究血管内皮细胞生长因子(VEGF)诱导肝癌转移作用时肝癌细胞表面形态学变化与转移的关系。方法 采用扫描电子显微镜观察VEGF诱导肝癌细胞HepG2转移前后肝癌细胞形态以及肝癌细胞转移能力的改变。结果 5 mg/L VEGF培养5 h,向下室浸润肝癌细胞数为 4×107/L,高于对照组(3.25×106/L,P<0.001)。对照组扫描电镜显示肝癌细胞呈梭形,表面有细而稀疏的突起,VEGF诱导后肝癌细胞成椭圆,细胞表面伪足增多、变粗。结论 VEGF促进肝癌细胞转移与诱导细胞伪足增多、变粗及细胞的迁移能力增强有关。
, http://www.100md.com
中图分类号:R735.7 文献标识码:A 文章编号:1000-2588(2000)03-0254-03
Observation of hepatic carcinoma metastasis induced by vascular endothelial growth factor with scanning electron microscope
MAO Hua1, YUAN Ai-li 1, ZHAO Min-fang2, PENG Qi-rong3, ZHANG Ya-li1
(1Institute of Digestive Diseases, Nanfang Hospital, First Military Medical University, Guangzhou 510515; 2 Tumor Center of Zhujiang Hospital , First Military Medical University, Guangzhou 510282, China; 3 Center of Infectious Diseases, 458 Hospital of PLA, Guangzhou 510032, China)Abstract: Objective To study the relationship between morphological change of the surface of hepatic carcinoma cells and metastasis induced by vascular endothelial growth factor (VEGF). Methods The morphologic changes and metastatic capacity of hepatocellular carcinoma cells before and after the treatment with VEGF were observed using scanning electron microscope. Results The number of cells in lower chamber cultured for 5 h with 5 ng/ml VEGF exceeded that of control cells (4´ 104/ml vs 3.25´ 103/ml, P<0.01). Tiny and sparse pseudopodia on the hepatic carcinoma cellular surface were observed by scanning electron microscope, and the cells took spindle-shaped profile in the control group, which became ellipse with more and thicker pseudopodia on the cellular surface after VEGF treatment. Conclusion VEGF promotes metastasis of hepatic carcinoma cells, which can be attributed to increased pseudopodium and enhanced cell migration.
, 百拇医药
Key words: vascular endothelial growth factor; hepatic carcinoma line; metastasis; pseudopod
血管内皮细胞生长因子(VEGF)是重要的血管形成因子,可诱导肿瘤血管形成,刺激血管内皮细胞的增殖。在肿瘤组织中有较高表达,与肿瘤浸润和转移密切相关[1~3]。目前关于VEGF对肿瘤细胞形态学的影响以及肿瘤细胞形态改变后运动能力的变化研究甚少。我们在应用VEGF诱导肝癌细胞转移时,观察VEGF对肝癌细胞超微结构改变以及对肝癌细胞转移能力的影响。
1 材料和方法
1.1 试剂
RPMI-1640购自Sigma,小牛血清购自杭州四季青公司,VEGF为美国Pepro Tech 产品。配制10 mg/L无血清RPMI-1640培养液,置于-20℃保存待用。牛血清白蛋白(BSA)为Sigma公司产品,用无血清RPMI-1640培养液配制成10 mg/L,置于4℃冰箱保存。
, http://www.100md.com
1.2 制备羊膜
取新鲜胎盘剥离羊膜,修剪后用无菌盐水及
取新鲜胎盘剥离羊膜,修剪后用无菌盐水及PBS-PSF液(0.01 mol/L PBS,含青霉素800 mg/L、链霉素500 mg/L、二性霉素5 mg/L)浸泡清洗。将羊膜反复冻融3次,置于0.5 mol/L NaOH室温下作用1~ 2 h,刮除上皮细胞后,再用含6 mg/L的无菌盐水反复清洗至溶液不变色,置于4℃冰箱待用。
1.3 肝癌细胞转移实验
利用具有上下室的Boden chamber(广东峻丰实业有限公司惠赠)分析人肝癌细胞株HepG2的转移能力[4]。将洗净烘干的Boden chamber上、下室置于紫外线下照射30 min。设BSA10 mg/L对照组、VEGF终浓度1 mg/L 、5 mg/L 、10 mg/L 4组,每组Boden chamber下室盛满混有VEGF的10%小牛血清RPMI-1640培养液200 μl。将完整的羊膜铺满下室表面,套紧上室,使羊膜将上下室分开。在上室中加入2×109/L的肝癌细胞株HepG2 1 ml。设2、5、12 h 3个不同时间组,置于37℃、5% CO2孵育箱中培养。培养结束后,计算下室浸润的肝癌细胞数,细胞数越多,说明肝癌细胞转移能力越强,下室浸润的肝癌细胞数取3次实验的平均值。
, 百拇医药
1.4 VEGF诱导的肝癌细胞扫描电镜观察
经过消毒处理的盖玻片置于6孔培养板中,调整肝癌细胞株HepG2 细胞浓度为107/L,每孔中加入2 ml。置于37℃、5% CO2孵育箱中培养24~48 h,每24 h换培养液1次。待肝癌细胞盖玻片铺满后,设置对照组,分别加入终浓度为1 mg/L、5 mg/L、10 mg/L的VEGF,继续培养6 h,弃去培养液。将铺满肝癌细胞的盖玻片用0.01mol/L PBS缓冲液洗涤两遍后,置于2%戊二醛-millonig固定液中固定24~ 48 h。样品常规丙酮脱水,临界点干燥后,进行真空镀膜,在HITACH-600型扫描电子显微镜下进行观察。
1.5 统计学处理
采用多组间计数资料比较
采用多组间计数资料比较F检验。
, 百拇医药
2 结果
对照组培养2、5、12 h后下室肝癌细胞数比较无显著性差异(P>0.05)。1 mg/L、5 mg/L、10 mg/L VEGF组培养2、5 h后下室肝癌细胞数与12 h组比较,有显著或非常显著性差异(P<0.05或P<0.01);5 mg/LVEGF组培养2、5 h组下室肝癌细胞数与1 mg/L VEGF组、10 mg/L VEGF组差异有显著性(P<0.05);上述各组培养2与5 h下室肝癌细胞数之间比较,差异无显著性(P>0.05,图1)。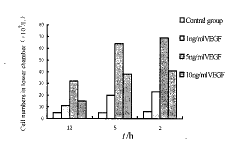
图1 不同浓度VEGF和不同培养时间BodyenChamber下室肝癌细胞数
Fig.1 Number of hepatic carcinoma cells cultured in VEGF of
, http://www.100md.com
various concentrations with different culture time in lower chamber
扫描电镜观察对照组肝癌细胞呈梭型,细胞表面丝状伪足细而短(图2),VEGF诱导后,肝癌细胞表面出现大量的伪足,与VEGF浓度呈正相关(VEGF 1 mg/L见图3、VEGF 5 mg/L 见图4),有的可见二级分叉及末端膨大的结构(图5)。
图 2 对照组肝细胞呈梭形,细胞表面丝状伪足细而短 (×4000)
Fig.2 Tiny and sparse pseudopodia on the surface of spindle-shaped
hepatic carcinoma cells in control group (×4000)
, http://www.100md.com
图3 1 mg/L VEGF 诱导后肝癌细胞表面伪足增多变长 (×4 000)
Fig.3 The hepatic carcinoma cells became ellipse with more and
thick pseudopodium after the treatment with 1 mg/L VEGF (×4000)
图4 5 mg/L VEGF 诱导后肝癌细胞表面伪足增多变长 (×4000)
Fig.4 The hepatic carcinoma cells became ellipse with more and
thick pseudopodium after the treatment with 5 mg/L VEGF (×4000)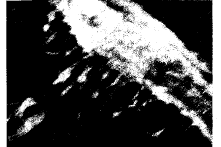
, http://www.100md.com
图5 VEGF诱导后肝癌细胞表面伪足出现二级分叉及末端膨大
的结构 (×4 000)
Fig.5 Secondary furcation and bulgy structure at
the extremity of the pseudopodia on the hepatic carcinoma cellular
surface induced by VEGF (×4 000)
3 讨论
实体肿瘤在血管未生成以前,肿瘤的增值、生长有限,几乎不发生肿瘤的转移。当肿瘤诱发宿主微血管内皮细胞增值时,肿瘤细胞迅速增长,体积增大,并且具有潜在的转移倾向[5]。VEGF与受体后可以增加血管内皮细胞膜的通透性,促进血管内皮细胞的分裂、增值,从而促进肿瘤血管生成,增加肿瘤组织的营养供应,促进肿瘤转移。研究发现,肝癌患者组织内VEGF表达增高,癌栓组及包膜不完整组高于包膜完整组,大肝癌组高于小肝癌组,并与肿瘤患者预后有关[6]。VEGF与flk-1/KDR受体结合后引起血管内皮细胞的分裂、增殖和迁移。采用RT-PCR方法从牛肝细胞提取RNA并得到VEGF cDNA,通过基因表达获得VEGF,作用于培养的牛大动脉内皮细胞后发现,VEGF诱导皮细胞增殖比平滑肌细胞高4~5倍,并可明显增加内皮细胞的移动性[7]。我们研究发现,VEGF可以增加肝癌细胞的运动能力,呈剂量效应关系。1 ng/ml、5 ng/ml、10 ng/ml VEGF组培养2、5 h后,Boyden chamber 下室肝癌细胞数与对照组比较,P<0.05或P<0.01,说明VEGF可以促进肝癌细胞的运动、迁移能力,导致肿瘤细胞转移[8]。文献报道[9,10],肿瘤细胞的丝状伪足能够使癌细胞牢固地固定于器官表面前并沿器官表面移动及沿细胞之间的间隙向器官内侵袭;部分癌细胞丝状伪足与器官表面突起部分连接,或与靶细胞直接粘附;还有部分癌细胞丝状伪足吞噬靶细胞,使癌细胞的迁移能力增加,导致肿瘤转移。VEGF促进肝癌细胞转移能力增加与VEGF诱导肝癌细胞丝状伪足增多、增长,使癌细胞的侵袭和运动能力增强有关。
, http://www.100md.com
毛华(1963-),男,江西省安义人,1984年毕业于江西医学院,在读博士研究生
参考文献
[1] Kitamura M, Toi M, Arai K et al. Concentrations of vascular endothelial growth factor in the sera of gastric cancer patients[J]. Oncol Rep, 1998, 5(6): 1419~ 24.
[2] Tayahashi Y, Tucker SL, Kitadai Y et al. Vessel counts and expression of vascular endothelial growth factor as prognostic factors in node-negative colon cancer[J]. Arch Suger, 1997,132(5): 541~ 6.
, http://www.100md.com
[3] Linderholm B, Tavelin B, Grankvist K et al. Vascular endothelial growth factor is of high prognostic value in node-negative breast carcinoma[J]. J Clin Oncol, 1998, 16(9): 3121~ 8.
[4] Denekman J. Angiogenesis, neovascular proliferation and vascular pathophysiology as targets for cancer therapy[J]. Br J Radiol,1993,66(1):181~ 5.
[5] 毛 华, 袁爱力, 陈 宏. 血管内皮细胞生长因子及其受体研究进展[J]. 医学综述, 1999, 5 (6) : 241~ 2.
, 百拇医药
[6] Li XM, Tang ZY, Zhou G et al. Significance of vascular endothelial growth factor mRNA expression in invasion and metastasis of hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 1998, 17(1): 13~ 7.
[7] Brock TA, Dwrarh F, Senger DR et al. tumor–secreted vascular permeability factor increased cytosolic Ca++ and Von Willebrand factor release in human endothelial cells[J]. Am J Pathol, 1991, 138(1): 213~ 6.
[8] 毛 华, 袁爱力, 赵敏芳等. 分裂原激活蛋白激酶p38信号通路在VEGF诱导肝癌转移中的作用[J]. 中华消化杂志, 2000, 20 (1) : 14~ 6.
[9] 韩立群, 董化一, 高 进等. 整装培养人鼻咽癌细胞系的胞质和伪足内质网的电镜观察[J]. 中华病理学杂志, 1994, 12 (23) : 344~ 6.
[10] 高 进, 杨 简, 李宝贵等. 在扫描电镜下观察培养不同时间的人鼻咽癌细胞株(CNE)表面特殊结构变化过程[J]. 解剖学报, 1984, 15(2): 189~ 91.
1999-09-07, 百拇医药
单位:毛华(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515);袁爱力(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515);赵敏芳(珠江医院放疗科,广东 广州 510282);彭齐荣(解放军458医院全军传染病中心,广东 广州 510032);张亚历(第一军医大学1南方医院全军消化疾病研究所,广东 广州 510515)
关键词:血管内皮细胞生长因子;肝癌细胞株;转移;伪足
第一军医大学学报000324 摘要:目的 研究血管内皮细胞生长因子(VEGF)诱导肝癌转移作用时肝癌细胞表面形态学变化与转移的关系。方法 采用扫描电子显微镜观察VEGF诱导肝癌细胞HepG2转移前后肝癌细胞形态以及肝癌细胞转移能力的改变。结果 5 mg/L VEGF培养5 h,向下室浸润肝癌细胞数为 4×107/L,高于对照组(3.25×106/L,P<0.001)。对照组扫描电镜显示肝癌细胞呈梭形,表面有细而稀疏的突起,VEGF诱导后肝癌细胞成椭圆,细胞表面伪足增多、变粗。结论 VEGF促进肝癌细胞转移与诱导细胞伪足增多、变粗及细胞的迁移能力增强有关。
, http://www.100md.com
中图分类号:R735.7 文献标识码:A 文章编号:1000-2588(2000)03-0254-03
Observation of hepatic carcinoma metastasis induced by vascular endothelial growth factor with scanning electron microscope
MAO Hua1, YUAN Ai-li 1, ZHAO Min-fang2, PENG Qi-rong3, ZHANG Ya-li1
(1Institute of Digestive Diseases, Nanfang Hospital, First Military Medical University, Guangzhou 510515; 2 Tumor Center of Zhujiang Hospital , First Military Medical University, Guangzhou 510282, China; 3 Center of Infectious Diseases, 458 Hospital of PLA, Guangzhou 510032, China)Abstract: Objective To study the relationship between morphological change of the surface of hepatic carcinoma cells and metastasis induced by vascular endothelial growth factor (VEGF). Methods The morphologic changes and metastatic capacity of hepatocellular carcinoma cells before and after the treatment with VEGF were observed using scanning electron microscope. Results The number of cells in lower chamber cultured for 5 h with 5 ng/ml VEGF exceeded that of control cells (4´ 104/ml vs 3.25´ 103/ml, P<0.01). Tiny and sparse pseudopodia on the hepatic carcinoma cellular surface were observed by scanning electron microscope, and the cells took spindle-shaped profile in the control group, which became ellipse with more and thicker pseudopodia on the cellular surface after VEGF treatment. Conclusion VEGF promotes metastasis of hepatic carcinoma cells, which can be attributed to increased pseudopodium and enhanced cell migration.
, 百拇医药
Key words: vascular endothelial growth factor; hepatic carcinoma line; metastasis; pseudopod
血管内皮细胞生长因子(VEGF)是重要的血管形成因子,可诱导肿瘤血管形成,刺激血管内皮细胞的增殖。在肿瘤组织中有较高表达,与肿瘤浸润和转移密切相关[1~3]。目前关于VEGF对肿瘤细胞形态学的影响以及肿瘤细胞形态改变后运动能力的变化研究甚少。我们在应用VEGF诱导肝癌细胞转移时,观察VEGF对肝癌细胞超微结构改变以及对肝癌细胞转移能力的影响。
1 材料和方法
1.1 试剂
RPMI-1640购自Sigma,小牛血清购自杭州四季青公司,VEGF为美国Pepro Tech 产品。配制10 mg/L无血清RPMI-1640培养液,置于-20℃保存待用。牛血清白蛋白(BSA)为Sigma公司产品,用无血清RPMI-1640培养液配制成10 mg/L,置于4℃冰箱保存。
, http://www.100md.com
1.2 制备羊膜
取新鲜胎盘剥离羊膜,修剪后用无菌盐水及
取新鲜胎盘剥离羊膜,修剪后用无菌盐水及PBS-PSF液(0.01 mol/L PBS,含青霉素800 mg/L、链霉素500 mg/L、二性霉素5 mg/L)浸泡清洗。将羊膜反复冻融3次,置于0.5 mol/L NaOH室温下作用1~ 2 h,刮除上皮细胞后,再用含6 mg/L的无菌盐水反复清洗至溶液不变色,置于4℃冰箱待用。
1.3 肝癌细胞转移实验
利用具有上下室的Boden chamber(广东峻丰实业有限公司惠赠)分析人肝癌细胞株HepG2的转移能力[4]。将洗净烘干的Boden chamber上、下室置于紫外线下照射30 min。设BSA10 mg/L对照组、VEGF终浓度1 mg/L 、5 mg/L 、10 mg/L 4组,每组Boden chamber下室盛满混有VEGF的10%小牛血清RPMI-1640培养液200 μl。将完整的羊膜铺满下室表面,套紧上室,使羊膜将上下室分开。在上室中加入2×109/L的肝癌细胞株HepG2 1 ml。设2、5、12 h 3个不同时间组,置于37℃、5% CO2孵育箱中培养。培养结束后,计算下室浸润的肝癌细胞数,细胞数越多,说明肝癌细胞转移能力越强,下室浸润的肝癌细胞数取3次实验的平均值。
, 百拇医药
1.4 VEGF诱导的肝癌细胞扫描电镜观察
经过消毒处理的盖玻片置于6孔培养板中,调整肝癌细胞株HepG2 细胞浓度为107/L,每孔中加入2 ml。置于37℃、5% CO2孵育箱中培养24~48 h,每24 h换培养液1次。待肝癌细胞盖玻片铺满后,设置对照组,分别加入终浓度为1 mg/L、5 mg/L、10 mg/L的VEGF,继续培养6 h,弃去培养液。将铺满肝癌细胞的盖玻片用0.01mol/L PBS缓冲液洗涤两遍后,置于2%戊二醛-millonig固定液中固定24~ 48 h。样品常规丙酮脱水,临界点干燥后,进行真空镀膜,在HITACH-600型扫描电子显微镜下进行观察。
1.5 统计学处理
采用多组间计数资料比较
采用多组间计数资料比较F检验。
, 百拇医药
2 结果
对照组培养2、5、12 h后下室肝癌细胞数比较无显著性差异(P>0.05)。1 mg/L、5 mg/L、10 mg/L VEGF组培养2、5 h后下室肝癌细胞数与12 h组比较,有显著或非常显著性差异(P<0.05或P<0.01);5 mg/LVEGF组培养2、5 h组下室肝癌细胞数与1 mg/L VEGF组、10 mg/L VEGF组差异有显著性(P<0.05);上述各组培养2与5 h下室肝癌细胞数之间比较,差异无显著性(P>0.05,图1)。

图1 不同浓度VEGF和不同培养时间BodyenChamber下室肝癌细胞数
Fig.1 Number of hepatic carcinoma cells cultured in VEGF of
, http://www.100md.com
various concentrations with different culture time in lower chamber
扫描电镜观察对照组肝癌细胞呈梭型,细胞表面丝状伪足细而短(图2),VEGF诱导后,肝癌细胞表面出现大量的伪足,与VEGF浓度呈正相关(VEGF 1 mg/L见图3、VEGF 5 mg/L 见图4),有的可见二级分叉及末端膨大的结构(图5)。

图 2 对照组肝细胞呈梭形,细胞表面丝状伪足细而短 (×4000)
Fig.2 Tiny and sparse pseudopodia on the surface of spindle-shaped
hepatic carcinoma cells in control group (×4000)

, http://www.100md.com
图3 1 mg/L VEGF 诱导后肝癌细胞表面伪足增多变长 (×4 000)
Fig.3 The hepatic carcinoma cells became ellipse with more and
thick pseudopodium after the treatment with 1 mg/L VEGF (×4000)

图4 5 mg/L VEGF 诱导后肝癌细胞表面伪足增多变长 (×4000)
Fig.4 The hepatic carcinoma cells became ellipse with more and
thick pseudopodium after the treatment with 5 mg/L VEGF (×4000)

, http://www.100md.com
图5 VEGF诱导后肝癌细胞表面伪足出现二级分叉及末端膨大
的结构 (×4 000)
Fig.5 Secondary furcation and bulgy structure at
the extremity of the pseudopodia on the hepatic carcinoma cellular
surface induced by VEGF (×4 000)
3 讨论
实体肿瘤在血管未生成以前,肿瘤的增值、生长有限,几乎不发生肿瘤的转移。当肿瘤诱发宿主微血管内皮细胞增值时,肿瘤细胞迅速增长,体积增大,并且具有潜在的转移倾向[5]。VEGF与受体后可以增加血管内皮细胞膜的通透性,促进血管内皮细胞的分裂、增值,从而促进肿瘤血管生成,增加肿瘤组织的营养供应,促进肿瘤转移。研究发现,肝癌患者组织内VEGF表达增高,癌栓组及包膜不完整组高于包膜完整组,大肝癌组高于小肝癌组,并与肿瘤患者预后有关[6]。VEGF与flk-1/KDR受体结合后引起血管内皮细胞的分裂、增殖和迁移。采用RT-PCR方法从牛肝细胞提取RNA并得到VEGF cDNA,通过基因表达获得VEGF,作用于培养的牛大动脉内皮细胞后发现,VEGF诱导皮细胞增殖比平滑肌细胞高4~5倍,并可明显增加内皮细胞的移动性[7]。我们研究发现,VEGF可以增加肝癌细胞的运动能力,呈剂量效应关系。1 ng/ml、5 ng/ml、10 ng/ml VEGF组培养2、5 h后,Boyden chamber 下室肝癌细胞数与对照组比较,P<0.05或P<0.01,说明VEGF可以促进肝癌细胞的运动、迁移能力,导致肿瘤细胞转移[8]。文献报道[9,10],肿瘤细胞的丝状伪足能够使癌细胞牢固地固定于器官表面前并沿器官表面移动及沿细胞之间的间隙向器官内侵袭;部分癌细胞丝状伪足与器官表面突起部分连接,或与靶细胞直接粘附;还有部分癌细胞丝状伪足吞噬靶细胞,使癌细胞的迁移能力增加,导致肿瘤转移。VEGF促进肝癌细胞转移能力增加与VEGF诱导肝癌细胞丝状伪足增多、增长,使癌细胞的侵袭和运动能力增强有关。
, http://www.100md.com
毛华(1963-),男,江西省安义人,1984年毕业于江西医学院,在读博士研究生
参考文献
[1] Kitamura M, Toi M, Arai K et al. Concentrations of vascular endothelial growth factor in the sera of gastric cancer patients[J]. Oncol Rep, 1998, 5(6): 1419~ 24.
[2] Tayahashi Y, Tucker SL, Kitadai Y et al. Vessel counts and expression of vascular endothelial growth factor as prognostic factors in node-negative colon cancer[J]. Arch Suger, 1997,132(5): 541~ 6.
, http://www.100md.com
[3] Linderholm B, Tavelin B, Grankvist K et al. Vascular endothelial growth factor is of high prognostic value in node-negative breast carcinoma[J]. J Clin Oncol, 1998, 16(9): 3121~ 8.
[4] Denekman J. Angiogenesis, neovascular proliferation and vascular pathophysiology as targets for cancer therapy[J]. Br J Radiol,1993,66(1):181~ 5.
[5] 毛 华, 袁爱力, 陈 宏. 血管内皮细胞生长因子及其受体研究进展[J]. 医学综述, 1999, 5 (6) : 241~ 2.
, 百拇医药
[6] Li XM, Tang ZY, Zhou G et al. Significance of vascular endothelial growth factor mRNA expression in invasion and metastasis of hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 1998, 17(1): 13~ 7.
[7] Brock TA, Dwrarh F, Senger DR et al. tumor–secreted vascular permeability factor increased cytosolic Ca++ and Von Willebrand factor release in human endothelial cells[J]. Am J Pathol, 1991, 138(1): 213~ 6.
[8] 毛 华, 袁爱力, 赵敏芳等. 分裂原激活蛋白激酶p38信号通路在VEGF诱导肝癌转移中的作用[J]. 中华消化杂志, 2000, 20 (1) : 14~ 6.
[9] 韩立群, 董化一, 高 进等. 整装培养人鼻咽癌细胞系的胞质和伪足内质网的电镜观察[J]. 中华病理学杂志, 1994, 12 (23) : 344~ 6.
[10] 高 进, 杨 简, 李宝贵等. 在扫描电镜下观察培养不同时间的人鼻咽癌细胞株(CNE)表面特殊结构变化过程[J]. 解剖学报, 1984, 15(2): 189~ 91.
1999-09-07, 百拇医药