1,25-二羟基维生素D3对小鼠骨髓细胞形成破骨细胞样细胞及其骨吸收效应的影响
作者:李铁军 于世凤 王晓敏 庞淑珍
单位:李铁军(100081 北京医科大学口腔医院);于世凤(100081 北京医科大学口腔医院);王晓敏(100081 北京医科大学口腔医院);庞淑珍(100081 北京医科大学口腔医院)
关键词:骨吸收;1,25-二羟基维生素D3;NH小鼠;骨髓细胞培养
中国骨质疏松杂志000304 [摘要] 目的 动态观察1,25-二羟基维生素D3[1,25-(OH)2D3]对NH小鼠骨髓细胞培养在体外形成破骨细胞及其骨吸收的剂量效应和作用时象。方法 收集NH小鼠骨髓细胞于含10%胎牛血清的α-MEM培养基中行体外培养,设置不同的1,25-(OH)2D3浓度组和给药时间组,并于培养第3、6、9、12天观察记录抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)阳性多核巨细胞[或破骨细胞样细胞(osteroblast-like cell,OLC)]以及骨磨片上骨吸收陷窝的数目。结果 高于10-9mmol/L的1,25-(OH)2D3单一刺激可于培养第6天诱导TRAP阳性OLC形成,并且可在骨磨片上观察到骨吸收陷窝;随1,25-(OH)2D3浓度的增高,OLC和骨吸收陷窝数目均随之增加;各浓度组OLC数目于培养第9天达最高值,随后则趋于减少,而骨吸收陷窝数于培养第9和第12天均有所增加;采用单一1,25-(OH)2D3浓度(10-8mmol/L),TRAP阳性OLC和骨吸收陷窝见于培养3 d后用药和全程用药组,而仅在培养前3 d用药则不能诱导OLC和骨吸收陷窝的形成。结论 1,25-(OH)2D3可在体外诱导骨髓单核细胞分化形成OLC并使其具有破骨活性,诱导作用的强弱与1,25-(OH)2D3的浓度相关,而且其作用时象可能是在培养3 d以后。
, http://www.100md.com
Effects of 1,25-dihydroxyvitamin D3 on stimulation of osteoclast-like cell formation and bone resorption in primary murine marrow cell culture
Li Tiejun,Yu Shifeng,Wang Xiaomin
(Oral Pathology Laboratory,School of Stomatology,Beijing Medical University,Beijing 100081,China)
[Abstract] Objective To clarify the events involved in 1,25-(OH)2D3-induced osteoclast-like cell (OLC) formation and bone resorption,we have characterized the concentration effect and the timing of 1,25-(OH)2D3 stimulation in primary murine marrow cell culture. Methods Marrow cells from NH mouse were harvested and cultured in α-MEM with 10% fetal bovine serum.The appearance of tartrate-resistant acid phosphatase (TRAP)-staining multinuclear cells (or OLCs) and formation of bone resorption pits were measured after 3,6,9 and 12 day exposure to various concentrations of 1,25-(OH)2D3 in culture. Results 1,25-(OH)2D3 (concentration higher than 10-9mol/L) could induce recruitment of OLCs and their bone resorption activity in a dose-dependent manner.Formation of TRAP+ve OLCs was first observed on day 6,reached to its peak on day 9 and reduced in number after the day 9 time point.The number of bone resorption pits on the bone slices in culture showed a consistent increase on day 9 and day 12.In cultures to which 1,25-(OH)2D3 (10-8mol/L) was added only for the first 3 days,TRAP+ve OLCs and bone resorption pits were not present on day 6,whereas continuous treatment with 1,25-(OH)2D3 starting from the beginning or from day 3 of the experiment invariably stimulated OLC formation and bone resorption activity. Conclusions 1,25-(OH)2D3 can induce OLC formation and bone resorption in murine marrow cell culture.The induction effect is dose dependent and is likely to occur after 3 days of culture.
, 百拇医药
[Key words] bone resorption; 1,25-Dihydroxyvitamin D3; NH mice; Bone marrow cell culture
骨组织的局部重建(remodeling)调控机制取决于多种因素的影响,其中甲状旁腺激素、前列腺素E2和1,25-二羟基维生素D3[1,25-(OH)2D3]等是促进破骨细胞形成、增强骨吸收的主要刺激因子。研究证实1,25-(OH)2D3可促使多种细胞类型沿巨噬细胞通路进一步分化,其中包括诱导骨髓干细胞分化形成破骨细胞样细胞(OLC)[1,2]。我室首次在国内应用1,25-(OH)2D3成功地在体外诱导SD大鼠骨髓细胞分化形成OLC,并对其特性作了初步观察[3]。本研究旨在动态观察1,25-(OH)2D3对NH小鼠骨髓细胞培养的剂量效应和作用时象,明确其对OLC的分化和形成以及继而引起骨吸收作用的影响。
, http://www.100md.com
1 材料和方法
1.1 动物与试剂
本实验选用的3~4周NH雄性小鼠购自国家计生委动物室;1,25-(OH)2D3由北京协和医院内分泌科馈赠;α-MEM培养基和胎牛血清分别购自Sigma和Gibco公司。
1.2 盖玻片和骨磨片的制备
用玻璃刀将盖玻片分切成1cm×1cm,经高压灭菌后备用。收集新鲜牛股骨,以金钢砂片将皮质骨分切成1cm×1cm、厚约200μm的小骨片,再用金钢磨石将其磨成厚约20μm的骨磨片;在去离子水中超声清洗3次,每次5min,然后浸泡于含抗菌素(青霉素1 000U/ml,链霉素1 000U/ml)的D-Hanks液中过液,使用前再浸泡于新鲜配制的α-MEM培养液中15min。
, 百拇医药 1.3 小鼠骨髓细胞的体外培养
在乙醚麻醉下,将小鼠断颈处死,于75%酒精中浸泡3min,无菌条件下取四肢长骨,在D-Hanks液中去净附着在骨表面的软组织,并暴露髓腔,再以一次性注射器吸取α-MEM全培养液[10%胎牛血清,青霉素100U/ml,链霉素100U/ml,25mmol/L HEPES,1,25-(OH)2D3按不同浓度分组加入]冲洗髓腔,冲洗液经筛网过滤后注入培养皿内静置1h,收集未附壁的细胞悬液以1ml/孔分别加入24孔培养板(每孔细胞数约为106个),并按分组分别在培养板各孔内放置处理后的骨磨片和盖玻片,置于37℃ CO2孵箱内培养,每3天更换培养液1次。
1.4 分组设计
为检测1,25-(OH)2D3对本培养系统的剂量效应和作用时相,我们设计了两组实验。实验一:依1,25-(OH)2D3的不同浓度分设:0、10-6、10-7、10-8、10-9和10-10mol/L共6组,除空白对照外,其他5组在实验开始和每次换液时加入上述浓度的1,25-(OH)2D3;实验二:采用单一维生素D3浓度(10-8mol/L),以实验第3天换液为界,分设前3 d用药组[即在第3天换液时不再加入1,25-(OH)2D3]、3 d后用药组[即在第3天换液时才加入1,25-(OH)2D3]以及全程用药组。上述两组实验均于培养第3、6、9、12 d取出盖玻片染色,并在倒置相差显微镜下观察、记录骨片上的骨吸收陷窝。
, http://www.100md.com
1.5 OLC及骨陷窝的检测方法
各组盖玻片取出后,于10%中性福尔马林固定15min,分别行HE和抗酒石酸酸性磷酸酶(TRAP)染色,其中TRAP染色采用Sigma公司提供的试剂盒。光镜下观察,含2个胞核以上且呈TRAP染色阳性的多核巨细胞被判定为OLC。OLC的计数是在200倍光镜下进行的,每例玻片任选5个视野,记录其计数均值;对骨磨片上吸收陷窝的观察是在倒置相差显微镜下进行的,依据上述实验设计,定期观察骨吸收陷窝的形成情况,并在150倍放大倍数下,每例骨片任选5个视野,记录其计数均值。采用Mann-Whitney U检验(StatView-4.02软件)对各组计数资料作统计学处理。
2 结果
1,25-(OH)2D3浓度梯度实验表明:细胞悬液和玻片共同培养6 d后,玻片上开始出现数目不等的TRAP阳性OLC,这些细胞为多核、胞浆丰富、TRAP染色呈颗粒状紫红色着色(图1),而未加入1,25-(OH)2D3的空白对照则未能在培养中形成TRAP阳性多核细胞;随1,25-(OH)2D3浓度的增加,TRAP阳性OLC计数值呈递增趋势(图2),其中10-9mol/L与10-10mol/L组之间以及10-6mol/L与10-7mol/L组之间差异无显著性(P>0.05),但它们与其他浓度组间的差异均具有显著性(表1)。各浓度组随实验时间的推移,TRAP阳性OLC计数值也呈递增趋势(图2),于培养第9天达最高值,随后阳性细胞数则趋于减少。倒置显微镜观察细胞悬液和骨磨片的共同培养,在最低浓度组(10-10mol/L)培养的各时相均未能观察到骨吸收陷窝,但其他各浓度组分别于培养第6天骨磨片上形成骨吸收陷窝(图3),陷窝数于第9和第12天均有所增加(图2),且大多数浓度组间的骨吸收陷窝计数均值存在显著性差异(表2)。采用单一1,25-(OH)2D3浓度(10-8mol/L)培养,TRAP阳性OLC仅见于3 d后用药组和全程用药组,且其阳性细胞计数、骨吸收陷窝计数及其各时相递增趋势之间无显著差异(表2);但在前3 d用药组的培养中,未能观察到TRAP阳性OLC和骨磨片上的骨吸收陷窝。
, http://www.100md.com
图1 体外培养6d后,小鼠骨髓细胞可在
1,25-(OH)2D3的诱导下形成胞浆丰富的
多核巨细胞(a,HE染色,×200);酶组化
染色呈抗酒石酸酸性磷酸酶阳性
的OLC(b,TRAP染色,×220)
图2 不同1,25-(OH)2D3浓度组TRAP阳性细胞
计数(a)和骨吸收陷窝形成(b)的动态变化
, http://www.100md.com
图3 体外培养第9天,OLC在骨磨片上形成的
骨吸收陷窝(相差显微镜,×150)
3 讨论
以往研究证实1,25-(OH)2D3可以诱导骨髓单核细胞形成TRAP阳性多核细胞,并且使其具有骨吸收功能[1-3]。骨髓基质细胞中的成骨细胞具有1, 25-(OH)2D3受体,但破骨细胞自身却缺乏这种受体,因此1,25-(OH)2D3对破骨细胞分化成熟的诱导作用很可能是通过成骨细胞来实现的[4,5]。本研究采用的NH小鼠骨髓细胞混合培养为观察1,25-(OH)2D3对TRAP阳性破骨细胞样细胞的形成及其骨吸收活性的影响提供了必要条件。
, 百拇医药
表1 各浓度组TRAP阳性OLC和骨吸收陷窝计数值间的统计学处理(P值) 浓度组(mol/L)
TRAP阳性OLC计数
骨吸收陷窝计数
6 d组
9 d组
12 d组
6 d组
9 d组
12 d组
10-10/10-9
>0.05
, http://www.100md.com
>0.05
>0.9
—
—
—
10-10/10-8
<0.01
<0.01
<0.01
—
—
—
10-10/10-7
, http://www.100md.com
<0.01
<0.01
<0.01
—
—
—
10-10/10-6
<0.01
<0.01
<0.01
—
—
—
, 百拇医药
10-9/10-8
<0.01
<0.01
<0.02
<0.01
<0.01
<0.01
10-9/10-7
<0.01
<0.01
<0.01
, 百拇医药 <0.01
<0.01
<0.01
10-9/10-6
<0.01
<0.01
<0.01
<0.01
<0.01
<0.01
10-8/10-7
<0.03
, 百拇医药
<0.03
<0.6
<0.1
<0.01
<0.01
10-8/10-6
<0.02
<0.03
<0.4
<0.01
<0.01
<0.01
, 百拇医药
10-7/10-6
>0>0.1
>0.9
>0.6
>0.1
>0.6
<0.01
注:Mann Whitney U检验,10-10mol/L组各时象均未见骨吸收陷窝形成,故未与其他浓度组比较表2 不同用药时间组的TRAP阳性OLC和骨吸收陷窝计数 培养时间(d)
TRAP阳性OLC(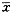 ±s)
±s)
, 百拇医药
骨吸收陷窝(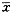 ±s)
±s)
第3天用药组
3天后用药组
全程用药组
第3天用药组
3天后用药组
全程用药组
3
0
0
0
0
, http://www.100md.com
0
0
6
0
4±0.71
3.8±0.84
0
3.6±1.14
3.90±0.92
9
0
5.6±0.55
5.8±0.84
, http://www.100md.com
0
4.8±0.84
5.8±0.45
12
0
4±1.0
3.8±1.30
0
5.6±0.55
5.6±0.55
注:3天后用药组和全程用药组间的各对应计数值之间差异无显著性(P>0.05)
本研究结果表明:在高于10-9mol/L 1,25-(OH)2D3浓度的单一刺激下,骨髓细胞的混合培养可于第6天分化形成TRAP阳性多核巨细胞,这些细胞具有破骨细胞的特征,即含多核、呈TRAP阳性反应以及可在骨磨片上形成骨吸收陷窝。低浓度1,25-(OH)2D3 (1010mol/L)的培养中虽可诱导形成较少数量的TRAP阳性多核细胞,但却不足以使其具备骨吸收功能。在骨髓细胞培养中,单核前体细胞募集、融合并形成OLC的能力与1,25-(OH)2D3的浓度(10-6~10-10mol/L)呈正相关,即1,25-(OH)2D3的浓度越高,其诱导的OLC形成的数目和骨吸收活性也随之增加。TRAP阳性OLC于培养第6天开始出现,数目于培养第9天增至最高值,随后则开始减少;共同培养的骨磨片上骨吸收陷窝的出现也始于实验第6天,其数目于培养第9和第12天均有所增加,提示本培养系统所诱导OLC的破骨活性主要发生于培养第6~9天。
, 百拇医药
本研究还证实:仅在培养前3天施加1,25-(OH)2D3,不足以诱导培养骨髓细胞分化形成OLC,而于培养第3天后再添加1,25-(OH)2D3与全程用药的诱导作用相似。这一方面反映了1,25-(OH)2D3的持续刺激对维持破骨细胞样细胞分化的必要性,同时也证实1,25-(OH)2D3对NH小鼠骨髓培养的作用时象是在培养3天以后。由于在小鼠骨髓培养中,破骨细胞前体细胞的增殖和聚集主要发生培养第3~4天,随后则发生在这些前体细胞的融合并形成OLC[6],因此从1,25-(OH)2D3对骨髓培养的作用时象来看,其对培养中单核细胞的增殖和OLC的分化均具有促进作用。基金项目:国家自然科学基金资助项目(39330220);中华医学基金专项人才基金(ORF9809);卫生部优秀青年科技人才专项科研基金资助课题项目(9821)
, 百拇医药
参考文献
1,Gray TY,Cohen MS.Vitamin D,phagocyte differentiation and immune function.Surv Immunol Res,1985,4:200.
2,Roodman GD,Ibboson KJ,Macdonald BR,et al.1,25-Dihydroxyvitamin D causes formation of multinucleated cells with several osteoclast characteristics in cultures of primate marrow.Proc Natl Acad Sci,USA,1985,82:8213.
3,王晓敏,于世凤.阿仑磷酸盐促进体外培养鼠破骨细胞凋亡的研究.北京医科大学学报,1999.
, 百拇医药
4,Merke J,Klaus G,Hugel U,et al.No 1,25-dihydroxyvitamin D3 receptors on osteoclasts of calcium-deficient chicken despite demonstrable receptors on circulating monocytes.J Clin Invest,1986,77:312.
5,Udagawa N,Takahashi N,Akatasu T,et al.The bone marrow derived stroma cell lines MC3T3-G2/PA6 and ST2 support osteoclast-like cell differentiation in cocultures with mouse spleen cells.Endocrinology,1989,125:1805.
6,Biskobing DM,Fan X,Rubin J.Characterizatoin of MCSF-induced proliferation and subsequent osteoclast formation in murine marrow culture.J Bone Miner Res,1995,10:1025., 百拇医药
单位:李铁军(100081 北京医科大学口腔医院);于世凤(100081 北京医科大学口腔医院);王晓敏(100081 北京医科大学口腔医院);庞淑珍(100081 北京医科大学口腔医院)
关键词:骨吸收;1,25-二羟基维生素D3;NH小鼠;骨髓细胞培养
中国骨质疏松杂志000304 [摘要] 目的 动态观察1,25-二羟基维生素D3[1,25-(OH)2D3]对NH小鼠骨髓细胞培养在体外形成破骨细胞及其骨吸收的剂量效应和作用时象。方法 收集NH小鼠骨髓细胞于含10%胎牛血清的α-MEM培养基中行体外培养,设置不同的1,25-(OH)2D3浓度组和给药时间组,并于培养第3、6、9、12天观察记录抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)阳性多核巨细胞[或破骨细胞样细胞(osteroblast-like cell,OLC)]以及骨磨片上骨吸收陷窝的数目。结果 高于10-9mmol/L的1,25-(OH)2D3单一刺激可于培养第6天诱导TRAP阳性OLC形成,并且可在骨磨片上观察到骨吸收陷窝;随1,25-(OH)2D3浓度的增高,OLC和骨吸收陷窝数目均随之增加;各浓度组OLC数目于培养第9天达最高值,随后则趋于减少,而骨吸收陷窝数于培养第9和第12天均有所增加;采用单一1,25-(OH)2D3浓度(10-8mmol/L),TRAP阳性OLC和骨吸收陷窝见于培养3 d后用药和全程用药组,而仅在培养前3 d用药则不能诱导OLC和骨吸收陷窝的形成。结论 1,25-(OH)2D3可在体外诱导骨髓单核细胞分化形成OLC并使其具有破骨活性,诱导作用的强弱与1,25-(OH)2D3的浓度相关,而且其作用时象可能是在培养3 d以后。
, http://www.100md.com
Effects of 1,25-dihydroxyvitamin D3 on stimulation of osteoclast-like cell formation and bone resorption in primary murine marrow cell culture
Li Tiejun,Yu Shifeng,Wang Xiaomin
(Oral Pathology Laboratory,School of Stomatology,Beijing Medical University,Beijing 100081,China)
[Abstract] Objective To clarify the events involved in 1,25-(OH)2D3-induced osteoclast-like cell (OLC) formation and bone resorption,we have characterized the concentration effect and the timing of 1,25-(OH)2D3 stimulation in primary murine marrow cell culture. Methods Marrow cells from NH mouse were harvested and cultured in α-MEM with 10% fetal bovine serum.The appearance of tartrate-resistant acid phosphatase (TRAP)-staining multinuclear cells (or OLCs) and formation of bone resorption pits were measured after 3,6,9 and 12 day exposure to various concentrations of 1,25-(OH)2D3 in culture. Results 1,25-(OH)2D3 (concentration higher than 10-9mol/L) could induce recruitment of OLCs and their bone resorption activity in a dose-dependent manner.Formation of TRAP+ve OLCs was first observed on day 6,reached to its peak on day 9 and reduced in number after the day 9 time point.The number of bone resorption pits on the bone slices in culture showed a consistent increase on day 9 and day 12.In cultures to which 1,25-(OH)2D3 (10-8mol/L) was added only for the first 3 days,TRAP+ve OLCs and bone resorption pits were not present on day 6,whereas continuous treatment with 1,25-(OH)2D3 starting from the beginning or from day 3 of the experiment invariably stimulated OLC formation and bone resorption activity. Conclusions 1,25-(OH)2D3 can induce OLC formation and bone resorption in murine marrow cell culture.The induction effect is dose dependent and is likely to occur after 3 days of culture.
, 百拇医药
[Key words] bone resorption; 1,25-Dihydroxyvitamin D3; NH mice; Bone marrow cell culture
骨组织的局部重建(remodeling)调控机制取决于多种因素的影响,其中甲状旁腺激素、前列腺素E2和1,25-二羟基维生素D3[1,25-(OH)2D3]等是促进破骨细胞形成、增强骨吸收的主要刺激因子。研究证实1,25-(OH)2D3可促使多种细胞类型沿巨噬细胞通路进一步分化,其中包括诱导骨髓干细胞分化形成破骨细胞样细胞(OLC)[1,2]。我室首次在国内应用1,25-(OH)2D3成功地在体外诱导SD大鼠骨髓细胞分化形成OLC,并对其特性作了初步观察[3]。本研究旨在动态观察1,25-(OH)2D3对NH小鼠骨髓细胞培养的剂量效应和作用时象,明确其对OLC的分化和形成以及继而引起骨吸收作用的影响。
, http://www.100md.com
1 材料和方法
1.1 动物与试剂
本实验选用的3~4周NH雄性小鼠购自国家计生委动物室;1,25-(OH)2D3由北京协和医院内分泌科馈赠;α-MEM培养基和胎牛血清分别购自Sigma和Gibco公司。
1.2 盖玻片和骨磨片的制备
用玻璃刀将盖玻片分切成1cm×1cm,经高压灭菌后备用。收集新鲜牛股骨,以金钢砂片将皮质骨分切成1cm×1cm、厚约200μm的小骨片,再用金钢磨石将其磨成厚约20μm的骨磨片;在去离子水中超声清洗3次,每次5min,然后浸泡于含抗菌素(青霉素1 000U/ml,链霉素1 000U/ml)的D-Hanks液中过液,使用前再浸泡于新鲜配制的α-MEM培养液中15min。
, 百拇医药 1.3 小鼠骨髓细胞的体外培养
在乙醚麻醉下,将小鼠断颈处死,于75%酒精中浸泡3min,无菌条件下取四肢长骨,在D-Hanks液中去净附着在骨表面的软组织,并暴露髓腔,再以一次性注射器吸取α-MEM全培养液[10%胎牛血清,青霉素100U/ml,链霉素100U/ml,25mmol/L HEPES,1,25-(OH)2D3按不同浓度分组加入]冲洗髓腔,冲洗液经筛网过滤后注入培养皿内静置1h,收集未附壁的细胞悬液以1ml/孔分别加入24孔培养板(每孔细胞数约为106个),并按分组分别在培养板各孔内放置处理后的骨磨片和盖玻片,置于37℃ CO2孵箱内培养,每3天更换培养液1次。
1.4 分组设计
为检测1,25-(OH)2D3对本培养系统的剂量效应和作用时相,我们设计了两组实验。实验一:依1,25-(OH)2D3的不同浓度分设:0、10-6、10-7、10-8、10-9和10-10mol/L共6组,除空白对照外,其他5组在实验开始和每次换液时加入上述浓度的1,25-(OH)2D3;实验二:采用单一维生素D3浓度(10-8mol/L),以实验第3天换液为界,分设前3 d用药组[即在第3天换液时不再加入1,25-(OH)2D3]、3 d后用药组[即在第3天换液时才加入1,25-(OH)2D3]以及全程用药组。上述两组实验均于培养第3、6、9、12 d取出盖玻片染色,并在倒置相差显微镜下观察、记录骨片上的骨吸收陷窝。
, http://www.100md.com
1.5 OLC及骨陷窝的检测方法
各组盖玻片取出后,于10%中性福尔马林固定15min,分别行HE和抗酒石酸酸性磷酸酶(TRAP)染色,其中TRAP染色采用Sigma公司提供的试剂盒。光镜下观察,含2个胞核以上且呈TRAP染色阳性的多核巨细胞被判定为OLC。OLC的计数是在200倍光镜下进行的,每例玻片任选5个视野,记录其计数均值;对骨磨片上吸收陷窝的观察是在倒置相差显微镜下进行的,依据上述实验设计,定期观察骨吸收陷窝的形成情况,并在150倍放大倍数下,每例骨片任选5个视野,记录其计数均值。采用Mann-Whitney U检验(StatView-4.02软件)对各组计数资料作统计学处理。
2 结果
1,25-(OH)2D3浓度梯度实验表明:细胞悬液和玻片共同培养6 d后,玻片上开始出现数目不等的TRAP阳性OLC,这些细胞为多核、胞浆丰富、TRAP染色呈颗粒状紫红色着色(图1),而未加入1,25-(OH)2D3的空白对照则未能在培养中形成TRAP阳性多核细胞;随1,25-(OH)2D3浓度的增加,TRAP阳性OLC计数值呈递增趋势(图2),其中10-9mol/L与10-10mol/L组之间以及10-6mol/L与10-7mol/L组之间差异无显著性(P>0.05),但它们与其他浓度组间的差异均具有显著性(表1)。各浓度组随实验时间的推移,TRAP阳性OLC计数值也呈递增趋势(图2),于培养第9天达最高值,随后阳性细胞数则趋于减少。倒置显微镜观察细胞悬液和骨磨片的共同培养,在最低浓度组(10-10mol/L)培养的各时相均未能观察到骨吸收陷窝,但其他各浓度组分别于培养第6天骨磨片上形成骨吸收陷窝(图3),陷窝数于第9和第12天均有所增加(图2),且大多数浓度组间的骨吸收陷窝计数均值存在显著性差异(表2)。采用单一1,25-(OH)2D3浓度(10-8mol/L)培养,TRAP阳性OLC仅见于3 d后用药组和全程用药组,且其阳性细胞计数、骨吸收陷窝计数及其各时相递增趋势之间无显著差异(表2);但在前3 d用药组的培养中,未能观察到TRAP阳性OLC和骨磨片上的骨吸收陷窝。

, http://www.100md.com
图1 体外培养6d后,小鼠骨髓细胞可在
1,25-(OH)2D3的诱导下形成胞浆丰富的
多核巨细胞(a,HE染色,×200);酶组化
染色呈抗酒石酸酸性磷酸酶阳性
的OLC(b,TRAP染色,×220)

图2 不同1,25-(OH)2D3浓度组TRAP阳性细胞
计数(a)和骨吸收陷窝形成(b)的动态变化

, http://www.100md.com
图3 体外培养第9天,OLC在骨磨片上形成的
骨吸收陷窝(相差显微镜,×150)
3 讨论
以往研究证实1,25-(OH)2D3可以诱导骨髓单核细胞形成TRAP阳性多核细胞,并且使其具有骨吸收功能[1-3]。骨髓基质细胞中的成骨细胞具有1, 25-(OH)2D3受体,但破骨细胞自身却缺乏这种受体,因此1,25-(OH)2D3对破骨细胞分化成熟的诱导作用很可能是通过成骨细胞来实现的[4,5]。本研究采用的NH小鼠骨髓细胞混合培养为观察1,25-(OH)2D3对TRAP阳性破骨细胞样细胞的形成及其骨吸收活性的影响提供了必要条件。
, 百拇医药
表1 各浓度组TRAP阳性OLC和骨吸收陷窝计数值间的统计学处理(P值) 浓度组(mol/L)
TRAP阳性OLC计数
骨吸收陷窝计数
6 d组
9 d组
12 d组
6 d组
9 d组
12 d组
10-10/10-9
>0.05
, http://www.100md.com
>0.05
>0.9
—
—
—
10-10/10-8
<0.01
<0.01
<0.01
—
—
—
10-10/10-7
, http://www.100md.com
<0.01
<0.01
<0.01
—
—
—
10-10/10-6
<0.01
<0.01
<0.01
—
—
—
, 百拇医药
10-9/10-8
<0.01
<0.01
<0.02
<0.01
<0.01
<0.01
10-9/10-7
<0.01
<0.01
<0.01
, 百拇医药 <0.01
<0.01
<0.01
10-9/10-6
<0.01
<0.01
<0.01
<0.01
<0.01
<0.01
10-8/10-7
<0.03
, 百拇医药
<0.03
<0.6
<0.1
<0.01
<0.01
10-8/10-6
<0.02
<0.03
<0.4
<0.01
<0.01
<0.01
, 百拇医药
10-7/10-6
>0>0.1
>0.9
>0.6
>0.1
>0.6
<0.01
注:Mann Whitney U检验,10-10mol/L组各时象均未见骨吸收陷窝形成,故未与其他浓度组比较表2 不同用药时间组的TRAP阳性OLC和骨吸收陷窝计数 培养时间(d)
TRAP阳性OLC(
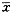 ±s)
±s), 百拇医药
骨吸收陷窝(
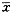 ±s)
±s)第3天用药组
3天后用药组
全程用药组
第3天用药组
3天后用药组
全程用药组
3
0
0
0
0
, http://www.100md.com
0
0
6
0
4±0.71
3.8±0.84
0
3.6±1.14
3.90±0.92
9
0
5.6±0.55
5.8±0.84
, http://www.100md.com
0
4.8±0.84
5.8±0.45
12
0
4±1.0
3.8±1.30
0
5.6±0.55
5.6±0.55
注:3天后用药组和全程用药组间的各对应计数值之间差异无显著性(P>0.05)
本研究结果表明:在高于10-9mol/L 1,25-(OH)2D3浓度的单一刺激下,骨髓细胞的混合培养可于第6天分化形成TRAP阳性多核巨细胞,这些细胞具有破骨细胞的特征,即含多核、呈TRAP阳性反应以及可在骨磨片上形成骨吸收陷窝。低浓度1,25-(OH)2D3 (1010mol/L)的培养中虽可诱导形成较少数量的TRAP阳性多核细胞,但却不足以使其具备骨吸收功能。在骨髓细胞培养中,单核前体细胞募集、融合并形成OLC的能力与1,25-(OH)2D3的浓度(10-6~10-10mol/L)呈正相关,即1,25-(OH)2D3的浓度越高,其诱导的OLC形成的数目和骨吸收活性也随之增加。TRAP阳性OLC于培养第6天开始出现,数目于培养第9天增至最高值,随后则开始减少;共同培养的骨磨片上骨吸收陷窝的出现也始于实验第6天,其数目于培养第9和第12天均有所增加,提示本培养系统所诱导OLC的破骨活性主要发生于培养第6~9天。
, 百拇医药
本研究还证实:仅在培养前3天施加1,25-(OH)2D3,不足以诱导培养骨髓细胞分化形成OLC,而于培养第3天后再添加1,25-(OH)2D3与全程用药的诱导作用相似。这一方面反映了1,25-(OH)2D3的持续刺激对维持破骨细胞样细胞分化的必要性,同时也证实1,25-(OH)2D3对NH小鼠骨髓培养的作用时象是在培养3天以后。由于在小鼠骨髓培养中,破骨细胞前体细胞的增殖和聚集主要发生培养第3~4天,随后则发生在这些前体细胞的融合并形成OLC[6],因此从1,25-(OH)2D3对骨髓培养的作用时象来看,其对培养中单核细胞的增殖和OLC的分化均具有促进作用。基金项目:国家自然科学基金资助项目(39330220);中华医学基金专项人才基金(ORF9809);卫生部优秀青年科技人才专项科研基金资助课题项目(9821)
, 百拇医药
参考文献
1,Gray TY,Cohen MS.Vitamin D,phagocyte differentiation and immune function.Surv Immunol Res,1985,4:200.
2,Roodman GD,Ibboson KJ,Macdonald BR,et al.1,25-Dihydroxyvitamin D causes formation of multinucleated cells with several osteoclast characteristics in cultures of primate marrow.Proc Natl Acad Sci,USA,1985,82:8213.
3,王晓敏,于世凤.阿仑磷酸盐促进体外培养鼠破骨细胞凋亡的研究.北京医科大学学报,1999.
, 百拇医药
4,Merke J,Klaus G,Hugel U,et al.No 1,25-dihydroxyvitamin D3 receptors on osteoclasts of calcium-deficient chicken despite demonstrable receptors on circulating monocytes.J Clin Invest,1986,77:312.
5,Udagawa N,Takahashi N,Akatasu T,et al.The bone marrow derived stroma cell lines MC3T3-G2/PA6 and ST2 support osteoclast-like cell differentiation in cocultures with mouse spleen cells.Endocrinology,1989,125:1805.
6,Biskobing DM,Fan X,Rubin J.Characterizatoin of MCSF-induced proliferation and subsequent osteoclast formation in murine marrow culture.J Bone Miner Res,1995,10:1025., 百拇医药