实验性糖尿病肺细胞外基质免疫组织化学研究
http://www.100md.com
中国糖尿病杂志 2000年第3期第8卷 论著
沈兴平(重庆医科大学附属第二医院内分泌科 邮政编码 400010);舒昌达 何军(重庆医科大学附属第一医院内分泌科) 沈兴平 舒昌达 何军
关键词:糖尿病,实验性;肺;细胞外基质
摘要:
中国糖尿病杂志000313 摘要 目的 观察糖尿病4周大鼠肺细胞外基质的变化。方法 采用特殊染色、免疫组织化学方法和图像分析技术,了解肺细胞外基质变化。结果 糖尿病肺弹性纤维、胶原纤维和网状纤维增多、增粗;Ⅳ型胶原呈索状或丛状分布于肺泡隔、细支气管基底膜和毛细血管基底膜;层粘连蛋白呈线状或索状分布于肺泡隔、肺泡上皮、小血管及细支气管上皮基底膜。图像分析表明,糖尿病肺弹性纤维、胶原纤维、网状纤维、Ⅳ型胶原和层粘连蛋白的着色面积、积分光密度和相对含量均高于对照组。结论 提示糖尿病早期已存在肺细胞外基质异常变化。
A immunohistochemical study on extracellular matrix in experimental diabetic rat lung
, http://www.100md.com
Shen Xingping,Shu Changda,He Jun
(Department of Endocrinology,The Second College of Clinical Medicine,Chongqing University of Medical Sciences,Chongqing 400010)
Abstract Objective To evaluate the change of extracellular matrix (ECM) in diabetic rat lungs.Methods Using special staining,immunohistochemical method and imaging analysis,the changes of distribution,area,integral optial density and relative contents of lung ECM in diabetic rats were studied.Results The distributions of elastic fibres,collagenic fibres and reticular fibres increased and roughened.The type Ⅳ collagen strong staining was localized in alveolar septum,the basement membranes of bronchiole and capillary,and distributed in cordal,plexiform.Laminin was strong stained and found in alveolar septum,epithelial cells of alveolar,and the basement membranes of bronchiole and pulmonary vessels in cordal and linear distribution.Image analysis showed the area,integral optical density and relative contents of elastic fibres,collagenic fibres,reticular fibres,type Ⅳ collagen and laminin were larger in diabetic rat lungs than in control groups.Conclusion These results showed that the changes of ECM in early diabetic rat lungs were abnormal.
, 百拇医药
Key words Diabetes mellitus,experimental Lung Extracellular matrix
细胞外基质(extracellular matrix,ECM)具有多种生理功能,可参与细胞粘附、伸展、分化及细胞骨架的变化,刺激增殖和诱导基因表达等。糖尿病(DM)高糖状态可增加ECM蛋白非酶糖基化,导致ECM蛋白合成和降解障碍[1],引起ECM代谢紊乱,功能受损。本研究拟通过对DM 4周大鼠肺ECM进行特殊染色、免疫组织化学染色,并行图像分析,以探讨DM肺病变的发生机制。
材料与方法
一、动物模型的建立及取材
雄性Wistar大鼠20只(重庆医科大学实验动物中心提供),重150~180g,随机分为DM组与对照组,每组10只。DM组大鼠予四氧嘧啶(按200mg/kg体重,重庆医科大学临床学院人工细胞室提供)一次性腹腔内注射,对照组注射等量生理盐水。注射药物后第三天,空腹血糖(邻甲苯胺法)>13.90mmol/L为DM模型成立。所有大鼠均自由饮水、进食。DM模型成立4周时(空腹血糖>13.90mmol/L),股动脉放血处死大鼠,剪开胸腔,速取右下肺,立即用1%中性缓冲福尔马林液固定,常规脱水、包埋,待检。
, 百拇医药
二、肺ECM的特殊染色法
1.弹性纤维:采用Weigert间苯二酚复红染色法。
2.胶原纤维:采用Siriured染色法。
3.网状纤维:采用Gomori银染色法。
三、免疫组织化学法[2]
1.主要试剂:①鼠抗Ⅳ型胶原抗体(DAKO),稀释度为1∶100;②兔抗纤维粘连蛋白抗体(DAKO),稀释度为1∶400;③兔抗层粘连蛋白抗体(SIGMA),稀释度为1∶1000;④生物素化羊抗兔IgG(VECTOR);⑤LSAB试剂盒(DAKO)。
2.LSAB法(labelled streptavidin biotin method):按试剂盒说明书方法进行。
, 百拇医药
四、对照试验
1.空白对照:用PBS代替一抗;
2.阴性对照:分别用正常鼠、兔血清取代一抗。
五、图像分析
采用MD20型彩色图像分析系统(Leitz),对特殊染色和免疫组化染色切片进行图像测量、修正及分析。每张切片选上、下、中、左、右5个视野。16倍物镜下测量阳性着色面积、积分光密度(IOD)和肺泡腔面积,并以阳性着色面积与肺泡腔面积之比表示相对含量[3]。
六、统计学处理
实验数据以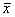 ±s表示,组间差异采用t检验。
±s表示,组间差异采用t检验。
, 百拇医药
结 果
一、肺ECM特殊染色
DM大鼠肺弹性纤维较粗,连续分布于肺泡间隔,有分支,着色深;DM大鼠肺泡隔胶原纤维明显增多,出现分支且互相交织,呈连续分布,着色深,肺泡上皮细胞浆可见较多着色深的胶原纤维分布;DM大鼠肺网状纤维明显增多、增粗,有大的分支并交织成网状,着色深(图1,2)。
二、肺ECM免疫组织化学染色
DM大鼠肺泡隔、细支气管基底膜及毛细血管基底膜Ⅳ型胶原纤维着色深,呈索状或丛状分布,肺泡上皮细胞浆内可见Ⅳ型胶原分布,着色深(图3,4)。
对照组和DM组大鼠肺泡隔、细支气管及小血管内膜下纤维粘连蛋白(fibronectin,FN)呈连续细线状分布,在肌性动脉、静脉、细支气管平滑肌细胞周围和肺间隔成纤维细胞中可见FN。两组大鼠肺FN分布无显著性差异。
, 百拇医药
DM大鼠肺泡隔内层粘连蛋白(laminin,LN)呈线状或索状分布,着色较深,肺泡上皮、小血管及细支气管上皮基底膜可见着色深的LN分布(图5,6)。
三、对照实验
所有空白及阴性对照实验均为阴性。
四、图像分析
DM大鼠肺弹性纤维、胶原纤维、网状纤维、Ⅳ型胶原纤维和LN的着色面积、IOD和相对含量均高于对照组大鼠,而FN的着色面积、IOD和相对含量与对照组无显著性差异(表1,2)。
图1 DM大鼠肺泡隔胶原纤维增多,连续分布,呈鲜红色。
Sirius red胶原纤维染色法×400
, 百拇医药
图2 DM大鼠肺网状纤维增粗,增多,交织成网状呈炭黑色。
Gomori银染色法×400
讨 论
胶原是一类结构复杂的蛋白,其中Ⅰ、Ⅱ、Ⅲ和Ⅴ型胶原是间质组织的非细胞成分[4]。本研究表明,DM 4周大鼠肺胶原纤维和网状纤维分布及相对含量均高于对照组,且Ⅳ型胶原免疫组化显示肺泡隔、细支气管及血管基底膜着色深。其原因是在高糖状态下,肺胶原分解代谢的酶活性明显下降[5],胶原蛋白非酶糖基化作用使胶原对蛋白水解酶的抵抗增强,以及循环中胶原酶抑制物质(如α2巨球蛋白、α1抗胰蛋白酶)含量增加,致胶原降解减弱,胶原积聚;此外,DM 4周大鼠肺Ⅱ型细胞生物合成途径改变,也有利于胶原积聚。由于胞外基质蛋白多为半衰期长的蛋白质,在高糖状态下胶原积聚的同时,其非酶糖基化作用也增加并进一步形成晚期糖化终末产物(advanced glycation end products,AGEs)。AGEs可作用于肺ECM Ⅰ型胶原,使其分子间空隙增大,可溶性蛋白质的稳定性增加[6];AGEs作用于Ⅳ型胶原,可使其分子内共价交联增加,富含螺旋的结构减少,引起胶原弹性下降和变硬[7],导致胶原和弹性蛋白的交叉连接损害,使肺弹性下降。临床上表现为DM患者肺总量和肺活量下降。
, 百拇医药
图3 DM大鼠肺Ⅳ型胶原呈索状分布于肺泡隔,着色深。
LSAB×400(Ⅳ型胶原呈深棕色)
图4 正常大鼠肺Ⅳ型胶原分布于肺泡隔,着色浅。
LSAB×400(Ⅳ型胶原呈棕色)
图5 DM大鼠肺LN分布于肺泡隔,呈线状或索状,着色深。
LSAB×400(LN呈深棕色)
图6 正常大鼠肺LN分布于肺泡隔,着色浅。
, 百拇医药
LSAB×400(LN呈棕色)
肺基底膜是由Ⅳ型胶原、LN和蛋白多糖的多聚体相互构成的,其中Ⅳ型胶原的网状构造是基底膜的支架。本组DM大鼠肺Ⅳ型胶原分布和相对含量增加,导致基底膜成分发生变化,肺上皮细胞基底膜和肺血管基底膜增厚,肺弥散功能障碍。应用99Tc-DTPA吸入测定肺消散时间的实验中也证实了DM患者存在肺弥散功能减退。Ⅳ型胶原增加的原因推测与DM肺基底膜损害致硫酸肝素糖蛋白丢失,引起其它基底膜糖蛋白的代偿性生物合成增加有关。另外,DM肺网状纤维增加,提示肺ECM中Ⅲ型胶原含量增加,DM肺间质组织损害涉及多种类型胶原。
表1 对照组与DM组大鼠肺弹性纤维、胶原纤维和网状纤维图像分析结果(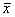 ±s,n=10) 项目
±s,n=10) 项目
弹性纤维
, 百拇医药
胶原纤维
网状纤维
对照组
DM组
对照组
DM组
对照组
DM组
着色面积(μm2)
809±305
2684±485***
862±297
, 百拇医药
1182±244*
1872±1114
3307±1361*
IOD
1904±854
5421±976***
614±202
862±197*
2804±1118
4581±1245**
, 百拇医药 相对含量
0.013±0.008
0.042±0.007***
0.012±0.003
0.021±0.002***
0.029±0.016
0.048±0.013**
与对照组相比 *P<0.05,**P<0.01,***P<0.001表2 对照组与DM组大鼠肺Ⅳ型胶原纤维、FN和LN图像分析结果(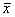 ±s,n=10) 项目
±s,n=10) 项目
, 百拇医药
Ⅳ型胶原纤维
FN
LN
对照组
DM组
对照组
DM组
对照组
DM组
着色面积(μm2)
10709±2905
21979±3084***
, 百拇医药
24546±2977
24398±3190
7496±1547
11933±1378***
IOD
9060±1627
14262±2163***
18233±2168
17780±2563
3987±1289
5015±758*
, http://www.100md.com
相对含量
0.129±0.026
0.305±0.056**
0.352±0.055
0.350±0.056
0.091±0.015
0.150±0.014**
与对照组相比 *P<0.05,**P<0.01,***P<0.001
体外研究发现,衰老的成纤维细胞FN mRNA表达增加[8]。DM大鼠肺FN与对照组大鼠肺FN在分布、相对含量等方面无显著性差异,这可能与DM早期(4周)肺老化过程现象不明显有关。
, 百拇医药
肺LN由Ⅱ型肺上皮细胞和肺血管内皮细胞所分泌。本研究发现DM肺LN的分布和相对含量均明显高于对照组,可能与DM早期肺Ⅱ型细胞生物合成的变化有关[1],具体机制不详。推测在高糖状态下LN的非酶糖基化作用增加,可直接减少肝素、Ⅳ型胶原与LN的结合,使肺基底膜构成成分发生变化,致基底膜增厚,影响肺弥散功能。
本研究发现DM大鼠肺弹性纤维较粗,连续分布于肺泡隔,着色明显增强,相对含量增高。其原因可能是在DM时赖氨酰氧化酶增加,使弹性蛋白合成增加[4];同时,弹性蛋白对蛋白水解酶降解的抵抗性增强,弹性蛋白积聚。在长期高血糖状态下,随着弹性蛋白非酶糖基化,弹性蛋白与胶原交叉连接受到损害,导致肺的生理功能障碍,这或许是随着DM病程延长,肺弹性功能呈不同程度下降的病理基础。
参 考 文 献
1,Kreisberg JI.Hyperglycemia and microangiopathy.Direct regulation by glucose of microvascular cells.Lab Invest,1992,67:416.
, 百拇医药
2,梁英杰,凌启波.一种快速高敏感的免疫组织化学染色法——LSAB法.中华病理学杂志,1993,22:269.
3,许祖德,张月娥,陈忠年,等.博莱霉素诱发大鼠肺纤维化时肺内Ⅴ型胶原病理变化及意义.上海医科大学学报,1994,21:101.
4,Dunsmore SE,Rannds DE.Extracellular matrix biology in the lung.Am J Physiol,1996,270:L3.
5,Rajkumar L,Srinivasan N,Balasubramanian K,et al.Decreased degradation of pulmonary collagen in adult diabetic rats.Med Sci Res,1991,19:753.
6,Brownlee M.Glycation and diabetic complications.Diabetes,1994,43:836.
, 百拇医药
7,Tsilbary EC,Charonis AS,Reger LA,et al.The effect of nonenzymatic glucosylation on the binding of the main noncollagenous NCl domain to type Ⅳ collagen.J Biol Chem,1990,263:4302.
8,Smith JR,Pereira-Smith OM.Altered gene expression during cellular aging.Genome,1989,31:386.
(收稿:1998-12-25 修回:1999-05-24), 百拇医药
关键词:糖尿病,实验性;肺;细胞外基质
摘要:
中国糖尿病杂志000313 摘要 目的 观察糖尿病4周大鼠肺细胞外基质的变化。方法 采用特殊染色、免疫组织化学方法和图像分析技术,了解肺细胞外基质变化。结果 糖尿病肺弹性纤维、胶原纤维和网状纤维增多、增粗;Ⅳ型胶原呈索状或丛状分布于肺泡隔、细支气管基底膜和毛细血管基底膜;层粘连蛋白呈线状或索状分布于肺泡隔、肺泡上皮、小血管及细支气管上皮基底膜。图像分析表明,糖尿病肺弹性纤维、胶原纤维、网状纤维、Ⅳ型胶原和层粘连蛋白的着色面积、积分光密度和相对含量均高于对照组。结论 提示糖尿病早期已存在肺细胞外基质异常变化。
A immunohistochemical study on extracellular matrix in experimental diabetic rat lung
, http://www.100md.com
Shen Xingping,Shu Changda,He Jun
(Department of Endocrinology,The Second College of Clinical Medicine,Chongqing University of Medical Sciences,Chongqing 400010)
Abstract Objective To evaluate the change of extracellular matrix (ECM) in diabetic rat lungs.Methods Using special staining,immunohistochemical method and imaging analysis,the changes of distribution,area,integral optial density and relative contents of lung ECM in diabetic rats were studied.Results The distributions of elastic fibres,collagenic fibres and reticular fibres increased and roughened.The type Ⅳ collagen strong staining was localized in alveolar septum,the basement membranes of bronchiole and capillary,and distributed in cordal,plexiform.Laminin was strong stained and found in alveolar septum,epithelial cells of alveolar,and the basement membranes of bronchiole and pulmonary vessels in cordal and linear distribution.Image analysis showed the area,integral optical density and relative contents of elastic fibres,collagenic fibres,reticular fibres,type Ⅳ collagen and laminin were larger in diabetic rat lungs than in control groups.Conclusion These results showed that the changes of ECM in early diabetic rat lungs were abnormal.
, 百拇医药
Key words Diabetes mellitus,experimental Lung Extracellular matrix
细胞外基质(extracellular matrix,ECM)具有多种生理功能,可参与细胞粘附、伸展、分化及细胞骨架的变化,刺激增殖和诱导基因表达等。糖尿病(DM)高糖状态可增加ECM蛋白非酶糖基化,导致ECM蛋白合成和降解障碍[1],引起ECM代谢紊乱,功能受损。本研究拟通过对DM 4周大鼠肺ECM进行特殊染色、免疫组织化学染色,并行图像分析,以探讨DM肺病变的发生机制。
材料与方法
一、动物模型的建立及取材
雄性Wistar大鼠20只(重庆医科大学实验动物中心提供),重150~180g,随机分为DM组与对照组,每组10只。DM组大鼠予四氧嘧啶(按200mg/kg体重,重庆医科大学临床学院人工细胞室提供)一次性腹腔内注射,对照组注射等量生理盐水。注射药物后第三天,空腹血糖(邻甲苯胺法)>13.90mmol/L为DM模型成立。所有大鼠均自由饮水、进食。DM模型成立4周时(空腹血糖>13.90mmol/L),股动脉放血处死大鼠,剪开胸腔,速取右下肺,立即用1%中性缓冲福尔马林液固定,常规脱水、包埋,待检。
, 百拇医药
二、肺ECM的特殊染色法
1.弹性纤维:采用Weigert间苯二酚复红染色法。
2.胶原纤维:采用Siriured染色法。
3.网状纤维:采用Gomori银染色法。
三、免疫组织化学法[2]
1.主要试剂:①鼠抗Ⅳ型胶原抗体(DAKO),稀释度为1∶100;②兔抗纤维粘连蛋白抗体(DAKO),稀释度为1∶400;③兔抗层粘连蛋白抗体(SIGMA),稀释度为1∶1000;④生物素化羊抗兔IgG(VECTOR);⑤LSAB试剂盒(DAKO)。
2.LSAB法(labelled streptavidin biotin method):按试剂盒说明书方法进行。
, 百拇医药
四、对照试验
1.空白对照:用PBS代替一抗;
2.阴性对照:分别用正常鼠、兔血清取代一抗。
五、图像分析
采用MD20型彩色图像分析系统(Leitz),对特殊染色和免疫组化染色切片进行图像测量、修正及分析。每张切片选上、下、中、左、右5个视野。16倍物镜下测量阳性着色面积、积分光密度(IOD)和肺泡腔面积,并以阳性着色面积与肺泡腔面积之比表示相对含量[3]。
六、统计学处理
实验数据以
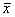 ±s表示,组间差异采用t检验。
±s表示,组间差异采用t检验。, 百拇医药
结 果
一、肺ECM特殊染色
DM大鼠肺弹性纤维较粗,连续分布于肺泡间隔,有分支,着色深;DM大鼠肺泡隔胶原纤维明显增多,出现分支且互相交织,呈连续分布,着色深,肺泡上皮细胞浆可见较多着色深的胶原纤维分布;DM大鼠肺网状纤维明显增多、增粗,有大的分支并交织成网状,着色深(图1,2)。
二、肺ECM免疫组织化学染色
DM大鼠肺泡隔、细支气管基底膜及毛细血管基底膜Ⅳ型胶原纤维着色深,呈索状或丛状分布,肺泡上皮细胞浆内可见Ⅳ型胶原分布,着色深(图3,4)。
对照组和DM组大鼠肺泡隔、细支气管及小血管内膜下纤维粘连蛋白(fibronectin,FN)呈连续细线状分布,在肌性动脉、静脉、细支气管平滑肌细胞周围和肺间隔成纤维细胞中可见FN。两组大鼠肺FN分布无显著性差异。
, 百拇医药
DM大鼠肺泡隔内层粘连蛋白(laminin,LN)呈线状或索状分布,着色较深,肺泡上皮、小血管及细支气管上皮基底膜可见着色深的LN分布(图5,6)。
三、对照实验
所有空白及阴性对照实验均为阴性。
四、图像分析
DM大鼠肺弹性纤维、胶原纤维、网状纤维、Ⅳ型胶原纤维和LN的着色面积、IOD和相对含量均高于对照组大鼠,而FN的着色面积、IOD和相对含量与对照组无显著性差异(表1,2)。

图1 DM大鼠肺泡隔胶原纤维增多,连续分布,呈鲜红色。
Sirius red胶原纤维染色法×400

, 百拇医药
图2 DM大鼠肺网状纤维增粗,增多,交织成网状呈炭黑色。
Gomori银染色法×400
讨 论
胶原是一类结构复杂的蛋白,其中Ⅰ、Ⅱ、Ⅲ和Ⅴ型胶原是间质组织的非细胞成分[4]。本研究表明,DM 4周大鼠肺胶原纤维和网状纤维分布及相对含量均高于对照组,且Ⅳ型胶原免疫组化显示肺泡隔、细支气管及血管基底膜着色深。其原因是在高糖状态下,肺胶原分解代谢的酶活性明显下降[5],胶原蛋白非酶糖基化作用使胶原对蛋白水解酶的抵抗增强,以及循环中胶原酶抑制物质(如α2巨球蛋白、α1抗胰蛋白酶)含量增加,致胶原降解减弱,胶原积聚;此外,DM 4周大鼠肺Ⅱ型细胞生物合成途径改变,也有利于胶原积聚。由于胞外基质蛋白多为半衰期长的蛋白质,在高糖状态下胶原积聚的同时,其非酶糖基化作用也增加并进一步形成晚期糖化终末产物(advanced glycation end products,AGEs)。AGEs可作用于肺ECM Ⅰ型胶原,使其分子间空隙增大,可溶性蛋白质的稳定性增加[6];AGEs作用于Ⅳ型胶原,可使其分子内共价交联增加,富含螺旋的结构减少,引起胶原弹性下降和变硬[7],导致胶原和弹性蛋白的交叉连接损害,使肺弹性下降。临床上表现为DM患者肺总量和肺活量下降。

, 百拇医药
图3 DM大鼠肺Ⅳ型胶原呈索状分布于肺泡隔,着色深。
LSAB×400(Ⅳ型胶原呈深棕色)

图4 正常大鼠肺Ⅳ型胶原分布于肺泡隔,着色浅。
LSAB×400(Ⅳ型胶原呈棕色)

图5 DM大鼠肺LN分布于肺泡隔,呈线状或索状,着色深。
LSAB×400(LN呈深棕色)

图6 正常大鼠肺LN分布于肺泡隔,着色浅。
, 百拇医药
LSAB×400(LN呈棕色)
肺基底膜是由Ⅳ型胶原、LN和蛋白多糖的多聚体相互构成的,其中Ⅳ型胶原的网状构造是基底膜的支架。本组DM大鼠肺Ⅳ型胶原分布和相对含量增加,导致基底膜成分发生变化,肺上皮细胞基底膜和肺血管基底膜增厚,肺弥散功能障碍。应用99Tc-DTPA吸入测定肺消散时间的实验中也证实了DM患者存在肺弥散功能减退。Ⅳ型胶原增加的原因推测与DM肺基底膜损害致硫酸肝素糖蛋白丢失,引起其它基底膜糖蛋白的代偿性生物合成增加有关。另外,DM肺网状纤维增加,提示肺ECM中Ⅲ型胶原含量增加,DM肺间质组织损害涉及多种类型胶原。
表1 对照组与DM组大鼠肺弹性纤维、胶原纤维和网状纤维图像分析结果(
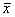 ±s,n=10) 项目
±s,n=10) 项目弹性纤维
, 百拇医药
胶原纤维
网状纤维
对照组
DM组
对照组
DM组
对照组
DM组
着色面积(μm2)
809±305
2684±485***
862±297
, 百拇医药
1182±244*
1872±1114
3307±1361*
IOD
1904±854
5421±976***
614±202
862±197*
2804±1118
4581±1245**
, 百拇医药 相对含量
0.013±0.008
0.042±0.007***
0.012±0.003
0.021±0.002***
0.029±0.016
0.048±0.013**
与对照组相比 *P<0.05,**P<0.01,***P<0.001表2 对照组与DM组大鼠肺Ⅳ型胶原纤维、FN和LN图像分析结果(
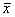 ±s,n=10) 项目
±s,n=10) 项目, 百拇医药
Ⅳ型胶原纤维
FN
LN
对照组
DM组
对照组
DM组
对照组
DM组
着色面积(μm2)
10709±2905
21979±3084***
, 百拇医药
24546±2977
24398±3190
7496±1547
11933±1378***
IOD
9060±1627
14262±2163***
18233±2168
17780±2563
3987±1289
5015±758*
, http://www.100md.com
相对含量
0.129±0.026
0.305±0.056**
0.352±0.055
0.350±0.056
0.091±0.015
0.150±0.014**
与对照组相比 *P<0.05,**P<0.01,***P<0.001
体外研究发现,衰老的成纤维细胞FN mRNA表达增加[8]。DM大鼠肺FN与对照组大鼠肺FN在分布、相对含量等方面无显著性差异,这可能与DM早期(4周)肺老化过程现象不明显有关。
, 百拇医药
肺LN由Ⅱ型肺上皮细胞和肺血管内皮细胞所分泌。本研究发现DM肺LN的分布和相对含量均明显高于对照组,可能与DM早期肺Ⅱ型细胞生物合成的变化有关[1],具体机制不详。推测在高糖状态下LN的非酶糖基化作用增加,可直接减少肝素、Ⅳ型胶原与LN的结合,使肺基底膜构成成分发生变化,致基底膜增厚,影响肺弥散功能。
本研究发现DM大鼠肺弹性纤维较粗,连续分布于肺泡隔,着色明显增强,相对含量增高。其原因可能是在DM时赖氨酰氧化酶增加,使弹性蛋白合成增加[4];同时,弹性蛋白对蛋白水解酶降解的抵抗性增强,弹性蛋白积聚。在长期高血糖状态下,随着弹性蛋白非酶糖基化,弹性蛋白与胶原交叉连接受到损害,导致肺的生理功能障碍,这或许是随着DM病程延长,肺弹性功能呈不同程度下降的病理基础。
参 考 文 献
1,Kreisberg JI.Hyperglycemia and microangiopathy.Direct regulation by glucose of microvascular cells.Lab Invest,1992,67:416.
, 百拇医药
2,梁英杰,凌启波.一种快速高敏感的免疫组织化学染色法——LSAB法.中华病理学杂志,1993,22:269.
3,许祖德,张月娥,陈忠年,等.博莱霉素诱发大鼠肺纤维化时肺内Ⅴ型胶原病理变化及意义.上海医科大学学报,1994,21:101.
4,Dunsmore SE,Rannds DE.Extracellular matrix biology in the lung.Am J Physiol,1996,270:L3.
5,Rajkumar L,Srinivasan N,Balasubramanian K,et al.Decreased degradation of pulmonary collagen in adult diabetic rats.Med Sci Res,1991,19:753.
6,Brownlee M.Glycation and diabetic complications.Diabetes,1994,43:836.
, 百拇医药
7,Tsilbary EC,Charonis AS,Reger LA,et al.The effect of nonenzymatic glucosylation on the binding of the main noncollagenous NCl domain to type Ⅳ collagen.J Biol Chem,1990,263:4302.
8,Smith JR,Pereira-Smith OM.Altered gene expression during cellular aging.Genome,1989,31:386.
(收稿:1998-12-25 修回:1999-05-24), 百拇医药