人类胎盘碱性磷酸酶在脲变性时构象与活力的变化
作者:耿芳宋 王秀丽 童家明 刘洪明
单位:耿芳宋 王秀丽 童家明(青岛大学医学院 生物化学教研室,山东 青岛 266021);刘洪明(青岛大学医学院 物理教研室,山东 青岛 266021)
关键词:碱性磷酸酶;脲;变性;构象;活力
中国医学物理学杂志000318摘要: 目的:研究脲对人胎盘碱性磷酸酶构象与活力的影响。方法:用分光法测定不同浓度脲溶液中的紫外差光谱及活力;荧光18法测其荧光光谱。结果:低浓度脲(<2.0 mol/L),酶的差光谱在262 nm出现负峰;荧光强度下降,发射峰位蓝移;脲浓度为0.5 mol/L时,酶活力仍维持在原有水平,此后随脲浓度增加,酶活力下降。继续提高脲浓度,差光谱在276 nm出现正峰;荧光强度回升,发射峰位红移;酶活力迅速下降。当脲浓度高达8.0 mol/L时,差光谱在262 nm又出现负峰;荧光强度继续增强,发射峰位还在红移;酶仍有部分活力。结论:酶活力变化慢于其构象变化,但酶活性部位较整个分子而言更易受到脲的扰乱
, 百拇医药
中图分类号: Q566 文献标识码: A 文章编号: 1005-202X(2000)03-0165-03
The changes of conformation and catalytic activity of human placental alkaline phosphatase during urea denaturation
GENG Fang-song,WANG Xiu-li,TONG Jia-ming,LIU Hong-ming
(Department of Biochemistry,Qingdao Medical College,Qingdao 266021,China)
Abstract:PurposeTo study the effect of urea on the conformation and activity of human placental alkaline phosphatasePLAP,E.C.3.1.3.1.Method:pectrophotometry was used to measuer the activity and ultraviolet difference spectra,fluorometry was used to observe flurescence spectra of PLAP in urea solutions of different concentrations. Results:Urea concentrations lower than 2.0 mol/L,the difference spectra show a negative peak around 262 nmthe fluorescence intensity decreases with a blue shift of emission maximum while the enzyme activity decreased after a stagnant stage below 0.5 mol/L of urea,during this stage,the emzyme activity maintained the original level. A urea concentrations higher than 2.0mol/L,the difference spectra show a positive peak around 276 nm the fluorescence emission maximum of PLAP red shifts with increasing intensity in urea solutions of increasing concentrations,and PLAP activity rapidly decreased. When urea concentration is 8.0 mol/L,the difference spectra shows a deep negative peak around 262nmthe fluorescence intensity and red shift of emission maximum continuously increased,and PLAP residual activity is 5.8%.Conclusion:The activity site of PLAP is more sensitive to urea than the molecule as a whole.
, 百拇医药
Key words:alkaine phosphatase;urea;denaturation;activity;conformation
研究生物大分子的结构与功能是生物大分子研究中的一个核心问题;观测酶蛋白变性时的构象改变与活力变化的关系,乃是阐明酶的结构与功能及其作用机制的好方法,盐酸胍和脲是两种最常用的蛋白质变性剂[1~2]。应用这种方法,我们已对人类胎盘碱性磷酸酶PLAP,E.C.3.1.3.1在盐酸胍变性时的构象改变与活力变化的关系进行了研究,结果表明,酶活力的变化明显快于其整体构象的变化[3];提示酶活性部位位于酶分子上有限的柔性区域,这就为邹承鲁提出的酶活性部位的柔性理论[4~5]提供了又一个有力证据。关于脲对PLAP的构象与活力有何影响尚未见报道,为此我们以紫外差光谱和荧光光谱为检测手段,观察了PLAP在不同浓度脲溶液中的构象,同时测定了酶活力,以期获得PLAP构象改变与活力变化的信息,旨在进一步探讨PLAP结构与功能的关系以及脲对其作用的分子机制。
, 百拇医药
1 材料与方法
1.1 试剂
DEAE-纤维素为上海试剂二厂产品;DEAE-Sephadex A-50为Pharmacia公司产品;Tris为Sigma公司产品;对硝基酚磷酸二钠PNPP为Merck公司产品;脲为上海试剂一厂产品,分析纯;其他试剂均为国产分析纯,用双蒸水配制。
1.2 PLAP的分离纯化和纯度鉴定
PLAP的分离纯化按文献[6]的方法进行。纯化酶经SDS-聚丙烯酰胺凝胶电泳SDS-PAGE鉴定为单一区带;反相高效液相层析(HPLC)分析为单一对称峰。纯化酶的比活力为6.44 mmol/min/mg。酶浓度用紫外吸收法[6](ε2 8 0=1.0 mg/ml/cm)测定。
1.3 酶的脲变性
, 百拇医药
变性体系中含0.112 mg/ml酶、100 mmol/L,pH 9.9的 Tris-HCl缓冲液及指定浓度的脲,混匀,20 ℃保温24小时,使酶达到稳定。测其构象与活力。
1.4 酶构象的检测
酶紫外差吸收光谱的测定在岛津UV-260型分光光度计上进行,25 ℃恒温下,检测200~320 nm的紫外吸收光谱,测得经脲处理的PLAP紫外吸收光谱减去未处理的PLAP紫外吸收光谱,即为紫外差光谱;酶的终浓度为0.112 mg/ml。酶荧光发射光谱在LS-50型荧光光度计上测定,激发波长为280 nm,激发和发射狭缝均为5 nm,25 ℃恒温下,检测300~400 nm的荧光发射光谱;酶的终浓度为22.4 μg/ml。测定时用含相应浓度的脲缓冲液进行校正。
1.5 酶活力的测定
MgCl2及指定浓度的脲于25 ℃恒温下,用岛津UV-260型分光光度计测定,比色皿光径为1 cm,测定波长为405 nm。酶的终浓度为0.672 μg/ml。测定时,测活体系于25℃保温5 min,加入变性的酶液后,混匀,检测其吸光度的变化,按其吸光度的变化值计算酶活力。
, 百拇医药
2 结 果
2.1 PLAP在不同浓度脲溶液中紫外差光谱的变化
酶经不同浓度脲变性后的紫外差光谱测定结果如图1所示。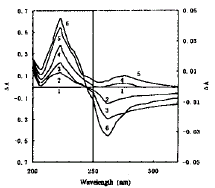
图1 不同浓度的脲溶液中,20℃保温24小时后紫外差光谱
PLAP浓度:22.4 μg/ml,激发波长:280 nm,曲线1-6脲浓度分别为:0.0,1.0,2.0,4.0,6.0和8.0 mol/L
结果表明,变性酶的紫外差光谱在222 nm有正峰,其峰值随脲浓度的增加而增大;低浓度的脲(<2.0 mol/L),在250320 nm出现负峰,峰位在262 nm;当脲浓度为4.0~6.0 mol/L时,在250~320 nm出现正峰,峰位红移至276 nm;当脲浓度高达8.0 mol/L时,在250~320 nm又出现宽大的负峰,峰位又蓝移至262 nm。
, 百拇医药
2.2 PLAP在不同浓度脲溶液中荧光光谱的变化
图2 不同浓度脲溶液中,20℃保温24小时后的PLAP荧光发射光谱
PLAP 浓度:22.4 0μg/ml. 激发波长:280 nm,曲线1-6脲浓度分别为:0.0,0.5,1.0,2.0,4.0,6.0和8.0 mol/L
图2表示PLAP分别在0.0,0.5,1.0,2.0,4.0,6.0,8.0 mol/L脲溶液中,20 ℃保温24小时,测得酶的内源荧光发射光谱。
由图2可见,当脲浓度<1.0 mol/L时,酶的内源荧光强度迅速下降,最大发射峰位由天然酶的333.5 nm蓝移至331.0 nm;当脲浓度为2.0 mol/L时,荧光强度略有下降,发射峰位仍为331.0 nm。继续提高脲浓度,酶的内源荧光强度不仅不再下降,反而逐渐增强,发射峰位逐渐红移;当脲浓度为8.0 mol/L时,发射峰位由331.0 nm红移至349.0 nm。
, 百拇医药
2.3 PLAP活力与构象变化的比较
PLAP在指定的不同浓度脲溶液中,20℃保温24小时后,所测得的酶活力、荧光强度与最大发射波长的变化如图3所示。
图3 不同浓度脲溶液中,20℃保温24小时后的PLAP活力、荧光强度
与最大发射波长的关系。 曲线1:酶相对活力的变化,曲线2:酶相对荧光强度的变化, 曲线3:酶最大发射波长的变化
由图3明显看出,脲浓度为0.5 mol/L时,酶荧光强度迅速下降,峰位略有蓝移,此时酶活力不变,仍维持在原有水平;脲浓度为1.0 mol/L时,荧光强度继续下降,发射峰位蓝移至最大为331.0 nm,此时酶活力开始迅速下降,但酶活力下降略慢于其荧光强度的下降;脲浓度为2.0 mol/L时,酶活力与荧光强度稍有下降,发射峰位不变;此后随着脲浓度的提高,荧光强度逐渐增加,发射峰位逐渐红移,酶活力又迅速下降;当脲浓度高达8.0 mol/L时,荧光强度继续增加,发射峰位还在红移,此时酶仍有5.8%的活力。
, http://www.100md.com
3 讨 论
紫外差光谱及荧光光谱的变化反映酶蛋白在变性过程中与Tyr、Trp等残基有关的构象变化。一般认为在230 nm以下的差光谱反映酶蛋白主链构象的改变,240~300 nm范围内的差光谱主要是Trp286 nm,293 nm,Tyr276 nm,286 nm以及-S-S-和Phe265 nm的贡献[7~8];用280 nm波长激发所得的荧光光谱主要是Trp和Tyr残基的贡献[3]。PLAP脲变性差光谱在222 nm出现正峰,这是由于酶分子中氢键的破坏导致二级结构变化的结果,并且这种变化随脲浓度的增大而加剧。低浓度的脲<2.0 mol/L使荧光强度迅速下降,发射峰位略有蓝移,在250~320 nm出现负差光谱峰,则可能是由于低浓度脲微扰了酶活性部位的构象,导致酶分子紧缩,Trp和Tyr残基由极性环境转变成非极性环境,使解离状态的Tyr转变为非解离状态,导致荧光的淬灭,紫外光吸收的减少,而Trp微环境的非极性化则导致发射峰位蓝移,也可使紫外光吸收减少。继续提高脲浓度,荧光强度显著增大,发射峰位明显红移,在250~320 nm出现正差光谱峰;这是由于高浓度的脲破坏了酶分子的整体构象,肽链伸展,使内埋的Trp和Tyr残基由非极性环境暴露到极性环境所致。至于8.0 mol/L脲使酶在250~320 nm出现宽大的负差光谱峰,可能由于伸展的肽链,暴露后的Trp、Tyr、Phe和-S-S-共同作用的结果。紫外差光谱及荧光光谱的变化结果提示,部分的Trp和Tyr位于酶分子表面,部分则隐蔽于其分子内部;PLAP分子中有4个Trp残基Trp-12,Trp-168,Trp-237及Trp-248,根据其一级结构[9]推断Trp-168残基可能位于酶活性部位附近,因该残基与活性部位内必需的Arg-166残基相邻。由于PLAP活性部位附近含有Trp和Tyr残基,故观测这些残基所产生的荧光变化,可作为该酶活性部位构象变化的一个标志。
, 百拇医药
PLAP活力与构象变化的比较结果表明,PLAP脲变性是一个渐变的复杂过程。低浓度的脲(<2.0 mol/L)微扰了酶活性部位的构象,使其由松散有序结构转变为紧缩结构,此种结构不利于酶的催化,故使酶活力迅速下降,至于脲浓度为0.5 mol/L时,酶活力仍维持在原有水平,则可能是因为该浓度的脲使酶活性部位构象的改变尚未影响到其催化活力所致。但是脲浓度为2.0 mol/L时,酶活力与荧光强度略有降低,发射峰位不变,可能是因为1.0 mol/L脲使酶活性部位构象的变化已趋完全,而2.0 mol/L脲还不能使酶分子整体构象发生变化,即酶在1.0~2.0 mol/L的脲溶液中呈现变性中间态所致。继续提高脲浓度,荧光强度增加,发射峰位红移,这是该酶整体构象破坏,肽链伸展的结果[3];由于酶的整体构象发生了破坏,故酶活力再次迅速下降直至丧失。然而,PLAP在8.0 mol/L脲溶液中尚有部分活力,可能是底物对酶有修复作用,亦可能是酶的整体构象尚未完全破坏,有文献报道PLAP对脲有抗性,能抵抗脲的抑制作用[10],关于这个问题有待进一步探讨。
, http://www.100md.com
综上所述,PLAP在脲变性时的活力变化与以内源荧光变化为标志的构象变化相比较,其活力的变化慢于其构象的变化。但若酶活性部位的构象与以荧光强度增加及发射峰位红移为标志的整体构象变化相比较,其活性部位构象的变化明显快于其整体构象的变化。支持酶活性部位的柔性理论[5]。
基金项目:山东省卫生厅资助项目(95036)
作者简介:耿芳宋(1948- ),男,山东平度人,青岛大学医学院生化教授,硕士研究生导师,酶学方向
参考文献:
1,Yao Q,Tian M,Tsou C L. Comparison of the rates of inactivation and conformational changes of creatine kinase during urea denaturation[J]. Biochemistry,1984,23(12):2740.
, 百拇医药
2,Rao N M,Nagaraj R. Anomalous stimulation of Escherichia coli alkaline phosphatase activity in guanidinium cloride[J]. J. Biol.Chem.,1991,266(8):5018.
3,耿芳宋,王秀丽,童家明,等.盐酸胍对人类胎盘碱性磷酸酶构象与活力的影响[J],生物物理学报,1998,14(3):385.
4,Tsou C L. Location of the active sites of some enzymes in limited and flexible molecular regions[J].Trend in Biochemical Sciences,1986,11(10):427.
5,Tsou C L. Conformational flexibility of enzyme active sites [J]. Science,1993,262:380.
, http://www.100md.com
6,耿芳宋,王秀丽,张金玉,等.人类胎盘碱性磷酸酶的分离纯化[J].青岛医学院学报,1998,3(2):84.
7,Miggiano G A D,Mordente A,Pischiutta M G,et al.Early conformational changes and activity modulation induced by guanidinium chloride on intestinal alkaline phosphatase[J]. Biochem. J.,1987,284:551.
8,林沁瑛,黄灿灿,黄守勤等.恒定直流磁场对中华猕猴桃蛋白酶生物效应初探[J].生物化学与生物物理学报,1992,24(3):253
9,Millan J L. Molecular cloning and sequence analysis of human placental alkaline phophatase[J].J.Biol.Chem.,1986,261(7):3112.
10,Birkett DJ,Conyers RAJ,Neale FC,et al. Action of urea on human alkaline phosphatases with a description of some automated techniques for the study of enzyme Kinetics[J].Arch Biochem Biophys,1967,124:470.
收稿日期:1999-05-25, 百拇医药
单位:耿芳宋 王秀丽 童家明(青岛大学医学院 生物化学教研室,山东 青岛 266021);刘洪明(青岛大学医学院 物理教研室,山东 青岛 266021)
关键词:碱性磷酸酶;脲;变性;构象;活力
中国医学物理学杂志000318摘要: 目的:研究脲对人胎盘碱性磷酸酶构象与活力的影响。方法:用分光法测定不同浓度脲溶液中的紫外差光谱及活力;荧光18法测其荧光光谱。结果:低浓度脲(<2.0 mol/L),酶的差光谱在262 nm出现负峰;荧光强度下降,发射峰位蓝移;脲浓度为0.5 mol/L时,酶活力仍维持在原有水平,此后随脲浓度增加,酶活力下降。继续提高脲浓度,差光谱在276 nm出现正峰;荧光强度回升,发射峰位红移;酶活力迅速下降。当脲浓度高达8.0 mol/L时,差光谱在262 nm又出现负峰;荧光强度继续增强,发射峰位还在红移;酶仍有部分活力。结论:酶活力变化慢于其构象变化,但酶活性部位较整个分子而言更易受到脲的扰乱
, 百拇医药
中图分类号: Q566 文献标识码: A 文章编号: 1005-202X(2000)03-0165-03
The changes of conformation and catalytic activity of human placental alkaline phosphatase during urea denaturation
GENG Fang-song,WANG Xiu-li,TONG Jia-ming,LIU Hong-ming
(Department of Biochemistry,Qingdao Medical College,Qingdao 266021,China)
Abstract:PurposeTo study the effect of urea on the conformation and activity of human placental alkaline phosphatasePLAP,E.C.3.1.3.1.Method:pectrophotometry was used to measuer the activity and ultraviolet difference spectra,fluorometry was used to observe flurescence spectra of PLAP in urea solutions of different concentrations. Results:Urea concentrations lower than 2.0 mol/L,the difference spectra show a negative peak around 262 nmthe fluorescence intensity decreases with a blue shift of emission maximum while the enzyme activity decreased after a stagnant stage below 0.5 mol/L of urea,during this stage,the emzyme activity maintained the original level. A urea concentrations higher than 2.0mol/L,the difference spectra show a positive peak around 276 nm the fluorescence emission maximum of PLAP red shifts with increasing intensity in urea solutions of increasing concentrations,and PLAP activity rapidly decreased. When urea concentration is 8.0 mol/L,the difference spectra shows a deep negative peak around 262nmthe fluorescence intensity and red shift of emission maximum continuously increased,and PLAP residual activity is 5.8%.Conclusion:The activity site of PLAP is more sensitive to urea than the molecule as a whole.
, 百拇医药
Key words:alkaine phosphatase;urea;denaturation;activity;conformation
研究生物大分子的结构与功能是生物大分子研究中的一个核心问题;观测酶蛋白变性时的构象改变与活力变化的关系,乃是阐明酶的结构与功能及其作用机制的好方法,盐酸胍和脲是两种最常用的蛋白质变性剂[1~2]。应用这种方法,我们已对人类胎盘碱性磷酸酶PLAP,E.C.3.1.3.1在盐酸胍变性时的构象改变与活力变化的关系进行了研究,结果表明,酶活力的变化明显快于其整体构象的变化[3];提示酶活性部位位于酶分子上有限的柔性区域,这就为邹承鲁提出的酶活性部位的柔性理论[4~5]提供了又一个有力证据。关于脲对PLAP的构象与活力有何影响尚未见报道,为此我们以紫外差光谱和荧光光谱为检测手段,观察了PLAP在不同浓度脲溶液中的构象,同时测定了酶活力,以期获得PLAP构象改变与活力变化的信息,旨在进一步探讨PLAP结构与功能的关系以及脲对其作用的分子机制。
, 百拇医药
1 材料与方法
1.1 试剂
DEAE-纤维素为上海试剂二厂产品;DEAE-Sephadex A-50为Pharmacia公司产品;Tris为Sigma公司产品;对硝基酚磷酸二钠PNPP为Merck公司产品;脲为上海试剂一厂产品,分析纯;其他试剂均为国产分析纯,用双蒸水配制。
1.2 PLAP的分离纯化和纯度鉴定
PLAP的分离纯化按文献[6]的方法进行。纯化酶经SDS-聚丙烯酰胺凝胶电泳SDS-PAGE鉴定为单一区带;反相高效液相层析(HPLC)分析为单一对称峰。纯化酶的比活力为6.44 mmol/min/mg。酶浓度用紫外吸收法[6](ε2 8 0=1.0 mg/ml/cm)测定。
1.3 酶的脲变性
, 百拇医药
变性体系中含0.112 mg/ml酶、100 mmol/L,pH 9.9的 Tris-HCl缓冲液及指定浓度的脲,混匀,20 ℃保温24小时,使酶达到稳定。测其构象与活力。
1.4 酶构象的检测
酶紫外差吸收光谱的测定在岛津UV-260型分光光度计上进行,25 ℃恒温下,检测200~320 nm的紫外吸收光谱,测得经脲处理的PLAP紫外吸收光谱减去未处理的PLAP紫外吸收光谱,即为紫外差光谱;酶的终浓度为0.112 mg/ml。酶荧光发射光谱在LS-50型荧光光度计上测定,激发波长为280 nm,激发和发射狭缝均为5 nm,25 ℃恒温下,检测300~400 nm的荧光发射光谱;酶的终浓度为22.4 μg/ml。测定时用含相应浓度的脲缓冲液进行校正。
1.5 酶活力的测定
MgCl2及指定浓度的脲于25 ℃恒温下,用岛津UV-260型分光光度计测定,比色皿光径为1 cm,测定波长为405 nm。酶的终浓度为0.672 μg/ml。测定时,测活体系于25℃保温5 min,加入变性的酶液后,混匀,检测其吸光度的变化,按其吸光度的变化值计算酶活力。
, 百拇医药
2 结 果
2.1 PLAP在不同浓度脲溶液中紫外差光谱的变化
酶经不同浓度脲变性后的紫外差光谱测定结果如图1所示。

图1 不同浓度的脲溶液中,20℃保温24小时后紫外差光谱
PLAP浓度:22.4 μg/ml,激发波长:280 nm,曲线1-6脲浓度分别为:0.0,1.0,2.0,4.0,6.0和8.0 mol/L
结果表明,变性酶的紫外差光谱在222 nm有正峰,其峰值随脲浓度的增加而增大;低浓度的脲(<2.0 mol/L),在250320 nm出现负峰,峰位在262 nm;当脲浓度为4.0~6.0 mol/L时,在250~320 nm出现正峰,峰位红移至276 nm;当脲浓度高达8.0 mol/L时,在250~320 nm又出现宽大的负峰,峰位又蓝移至262 nm。
, 百拇医药
2.2 PLAP在不同浓度脲溶液中荧光光谱的变化

图2 不同浓度脲溶液中,20℃保温24小时后的PLAP荧光发射光谱
PLAP 浓度:22.4 0μg/ml. 激发波长:280 nm,曲线1-6脲浓度分别为:0.0,0.5,1.0,2.0,4.0,6.0和8.0 mol/L
图2表示PLAP分别在0.0,0.5,1.0,2.0,4.0,6.0,8.0 mol/L脲溶液中,20 ℃保温24小时,测得酶的内源荧光发射光谱。
由图2可见,当脲浓度<1.0 mol/L时,酶的内源荧光强度迅速下降,最大发射峰位由天然酶的333.5 nm蓝移至331.0 nm;当脲浓度为2.0 mol/L时,荧光强度略有下降,发射峰位仍为331.0 nm。继续提高脲浓度,酶的内源荧光强度不仅不再下降,反而逐渐增强,发射峰位逐渐红移;当脲浓度为8.0 mol/L时,发射峰位由331.0 nm红移至349.0 nm。
, 百拇医药
2.3 PLAP活力与构象变化的比较
PLAP在指定的不同浓度脲溶液中,20℃保温24小时后,所测得的酶活力、荧光强度与最大发射波长的变化如图3所示。

图3 不同浓度脲溶液中,20℃保温24小时后的PLAP活力、荧光强度
与最大发射波长的关系。 曲线1:酶相对活力的变化,曲线2:酶相对荧光强度的变化, 曲线3:酶最大发射波长的变化
由图3明显看出,脲浓度为0.5 mol/L时,酶荧光强度迅速下降,峰位略有蓝移,此时酶活力不变,仍维持在原有水平;脲浓度为1.0 mol/L时,荧光强度继续下降,发射峰位蓝移至最大为331.0 nm,此时酶活力开始迅速下降,但酶活力下降略慢于其荧光强度的下降;脲浓度为2.0 mol/L时,酶活力与荧光强度稍有下降,发射峰位不变;此后随着脲浓度的提高,荧光强度逐渐增加,发射峰位逐渐红移,酶活力又迅速下降;当脲浓度高达8.0 mol/L时,荧光强度继续增加,发射峰位还在红移,此时酶仍有5.8%的活力。
, http://www.100md.com
3 讨 论
紫外差光谱及荧光光谱的变化反映酶蛋白在变性过程中与Tyr、Trp等残基有关的构象变化。一般认为在230 nm以下的差光谱反映酶蛋白主链构象的改变,240~300 nm范围内的差光谱主要是Trp286 nm,293 nm,Tyr276 nm,286 nm以及-S-S-和Phe265 nm的贡献[7~8];用280 nm波长激发所得的荧光光谱主要是Trp和Tyr残基的贡献[3]。PLAP脲变性差光谱在222 nm出现正峰,这是由于酶分子中氢键的破坏导致二级结构变化的结果,并且这种变化随脲浓度的增大而加剧。低浓度的脲<2.0 mol/L使荧光强度迅速下降,发射峰位略有蓝移,在250~320 nm出现负差光谱峰,则可能是由于低浓度脲微扰了酶活性部位的构象,导致酶分子紧缩,Trp和Tyr残基由极性环境转变成非极性环境,使解离状态的Tyr转变为非解离状态,导致荧光的淬灭,紫外光吸收的减少,而Trp微环境的非极性化则导致发射峰位蓝移,也可使紫外光吸收减少。继续提高脲浓度,荧光强度显著增大,发射峰位明显红移,在250~320 nm出现正差光谱峰;这是由于高浓度的脲破坏了酶分子的整体构象,肽链伸展,使内埋的Trp和Tyr残基由非极性环境暴露到极性环境所致。至于8.0 mol/L脲使酶在250~320 nm出现宽大的负差光谱峰,可能由于伸展的肽链,暴露后的Trp、Tyr、Phe和-S-S-共同作用的结果。紫外差光谱及荧光光谱的变化结果提示,部分的Trp和Tyr位于酶分子表面,部分则隐蔽于其分子内部;PLAP分子中有4个Trp残基Trp-12,Trp-168,Trp-237及Trp-248,根据其一级结构[9]推断Trp-168残基可能位于酶活性部位附近,因该残基与活性部位内必需的Arg-166残基相邻。由于PLAP活性部位附近含有Trp和Tyr残基,故观测这些残基所产生的荧光变化,可作为该酶活性部位构象变化的一个标志。
, 百拇医药
PLAP活力与构象变化的比较结果表明,PLAP脲变性是一个渐变的复杂过程。低浓度的脲(<2.0 mol/L)微扰了酶活性部位的构象,使其由松散有序结构转变为紧缩结构,此种结构不利于酶的催化,故使酶活力迅速下降,至于脲浓度为0.5 mol/L时,酶活力仍维持在原有水平,则可能是因为该浓度的脲使酶活性部位构象的改变尚未影响到其催化活力所致。但是脲浓度为2.0 mol/L时,酶活力与荧光强度略有降低,发射峰位不变,可能是因为1.0 mol/L脲使酶活性部位构象的变化已趋完全,而2.0 mol/L脲还不能使酶分子整体构象发生变化,即酶在1.0~2.0 mol/L的脲溶液中呈现变性中间态所致。继续提高脲浓度,荧光强度增加,发射峰位红移,这是该酶整体构象破坏,肽链伸展的结果[3];由于酶的整体构象发生了破坏,故酶活力再次迅速下降直至丧失。然而,PLAP在8.0 mol/L脲溶液中尚有部分活力,可能是底物对酶有修复作用,亦可能是酶的整体构象尚未完全破坏,有文献报道PLAP对脲有抗性,能抵抗脲的抑制作用[10],关于这个问题有待进一步探讨。
, http://www.100md.com
综上所述,PLAP在脲变性时的活力变化与以内源荧光变化为标志的构象变化相比较,其活力的变化慢于其构象的变化。但若酶活性部位的构象与以荧光强度增加及发射峰位红移为标志的整体构象变化相比较,其活性部位构象的变化明显快于其整体构象的变化。支持酶活性部位的柔性理论[5]。
基金项目:山东省卫生厅资助项目(95036)
作者简介:耿芳宋(1948- ),男,山东平度人,青岛大学医学院生化教授,硕士研究生导师,酶学方向
参考文献:
1,Yao Q,Tian M,Tsou C L. Comparison of the rates of inactivation and conformational changes of creatine kinase during urea denaturation[J]. Biochemistry,1984,23(12):2740.
, 百拇医药
2,Rao N M,Nagaraj R. Anomalous stimulation of Escherichia coli alkaline phosphatase activity in guanidinium cloride[J]. J. Biol.Chem.,1991,266(8):5018.
3,耿芳宋,王秀丽,童家明,等.盐酸胍对人类胎盘碱性磷酸酶构象与活力的影响[J],生物物理学报,1998,14(3):385.
4,Tsou C L. Location of the active sites of some enzymes in limited and flexible molecular regions[J].Trend in Biochemical Sciences,1986,11(10):427.
5,Tsou C L. Conformational flexibility of enzyme active sites [J]. Science,1993,262:380.
, http://www.100md.com
6,耿芳宋,王秀丽,张金玉,等.人类胎盘碱性磷酸酶的分离纯化[J].青岛医学院学报,1998,3(2):84.
7,Miggiano G A D,Mordente A,Pischiutta M G,et al.Early conformational changes and activity modulation induced by guanidinium chloride on intestinal alkaline phosphatase[J]. Biochem. J.,1987,284:551.
8,林沁瑛,黄灿灿,黄守勤等.恒定直流磁场对中华猕猴桃蛋白酶生物效应初探[J].生物化学与生物物理学报,1992,24(3):253
9,Millan J L. Molecular cloning and sequence analysis of human placental alkaline phophatase[J].J.Biol.Chem.,1986,261(7):3112.
10,Birkett DJ,Conyers RAJ,Neale FC,et al. Action of urea on human alkaline phosphatases with a description of some automated techniques for the study of enzyme Kinetics[J].Arch Biochem Biophys,1967,124:470.
收稿日期:1999-05-25, 百拇医药