携带DT390-VEGF165或DT390-VEGFexon7融合基因的真核表达载体的构建及表达
作者:潘欣 柯重伟 潘卫 曹广文 戚中田
单位:潘欣 柯重伟 潘卫 曹广文 戚中田(第二军医大学微生物学教研室 上海 200433)
关键词:白喉毒素;血管内皮细胞生长因子;融合基因;真核表达载体;基因治疗
中国肿瘤生物治疗杂志000316 《中国图书资料分类法》 分类号 R730.59
抑制血管再生可能是治疗实体瘤的有效途径。肿瘤血管生成的主要调控者是血管内皮细胞生长因子(VEGF)。VEGF 的5种异构体中VEGF165是表达丰度最高的异构体,KDR和Flt-1为VEGF的高亲和受体。1996年Soker等在各种肿瘤细胞系上发现了仅与VEGF165外显子7编码的结构域结合的受体,即VEGF165R[1]。目前将细菌毒素的跨膜结构域和酶性结构域与细胞因子或抗体构成的融合蛋白靶向杀伤各型细胞的研究已有大量报道,但这些融合毒素仅对某些类型的肿瘤有效。为扩大癌症治疗范围,我们选择VEGF165和VEGFexon7取代白喉毒素的受体结合结构域而与其跨膜结构域和酶性结构域融合以选择性毒杀肿瘤血管。
, 百拇医药
本研究中,我们构建了携带DT390-VEGF及DT390-VEGFexon7基因的真核表达载体,转基因后结果显示,融合基因表达的蛋白质可以杀死肿瘤细胞。本研究为继续开展组织特异性基因治疗工作打下了基础。
1 材料与方法
1.1 质粒、菌种及细胞
pET15b-DT由美国Collier博士惠赠;pcDNA3.1(+)真核表达载体由美国FDA李忠民博士惠赠; pcDNA3.1(+)-EGFP质粒本室构建;PCR产物克隆载体pMD18-T为TaKaRa公司产品;工程菌DH5α及人宫颈癌Hela细胞为本室保存。
1.2 PCR引物均由TaKaRa公司合成
引物1为5′-GGAAGCTTGCCGCCACCAT GGGCGCTGATGATGTTGTTGA-3′; 引物2为5′-GACGCGTAAGAAA TGGTTGCGT-3′; 引物1,2为DT390引物。引物3为5′-GACGCGTATGAACTTTCTGC-3′; 引物4为5′-GAAGCTTT CACCGCCTCGGCTTGTC-3′; 引物3,4为VEGF165引物。引物5为5′-GACGCGTCCCTGTGGGCCTTG-3′; 引物6为5′-GAAGCTTTCAACATCTGCAAGTACGT-3′;引物5,6为VEGFexon7引物。
, 百拇医药
1.3 目的基因克隆
DT390基因的PCR引物根据Collier博士提供的DT基因序列设计,引物1引入HindⅢ位点和Kozak序列, 引物2引入MluⅠ位点。VEGF165及VEGFexon7基因的PCR引物根据David等发表的VEGF基因序列设计, 引物3和引物5引入MluⅠ位点和Kozak序列, 引物4和引物6引入强终止信号和HindⅢ位点。PCR产物经纯化后, 分别克隆到pMD18-T PCR产物克隆载体上, 进行DNA自动测序。
1.4 真核表达载体的构建
用HindⅢ/MluⅠ分别将DT390,VEGF165,VEGFexon7从携带目的基因的pMD18-T 载体上游离下来,用HindⅢ酶切pcDNA3.1(+)载体并去磷酸化, 用T4DNA连接酶将线性化的pcDNA3.1(+)分别与HindⅢ-MluⅠDT390片段和MluⅠ-HindⅢ VEGF165片段以及HindⅢ-MluⅠDT390片段和MluⅠ-HindⅢVEGFexon7片段进行连接; 以HindⅢ酶切鉴定阳性克隆,以载体上的MluⅠ位点(距起始位点228 bp)同插入片段上的MluⅠ位点联合酶切鉴定插入方向, 同时进行DNA自动测序以确认读框正确。
, http://www.100md.com
1.5 绿色荧光蛋白EGFP基因在人宫颈癌Hela细胞的表达
细胞培养、转染和G418筛选均按常规方法[2]。3周后获得抗性克隆,用一次性自吸式医用微量吸管吸出发绿色荧光的克隆,继续培养15 d, 在荧光显微镜下选择出5瓶(5个克隆)全瓶细胞均发绿色荧光的继续传代培养。
1.6 DT390-VEGF165及DT390-VEGFexon7融合基因在携带绿色荧光蛋白EGFP基因的Hela细胞中表达
在24孔板中按5×105个细胞/孔接种表达EGFP的人宫颈癌Hela细胞, pcDNA3.1(+)-DT390-VEGF165 DNA或pcDNA3.1(+)-DT390-VEGFexon7 DNA按上述方法转染;对照为反向插入的pcDNA3.1(+)-DT390-VEGFexon7R, 转染后继续培养至90 h, 在荧光显微镜下拍照记录结果。
, 百拇医药
2 结果与讨论
为使融合分子DT390-VEGF165及DT390-VEGFexon7中的白喉毒素和VEGF165 或VEGFexon7分子能自由折叠,在DT390的3′端和VEGF165或VEGFexon7的5′端加入MluⅠ位点, 也即增加了两个氨基酸残基,TR[3], 构建过程及质粒酶切鉴定见图1。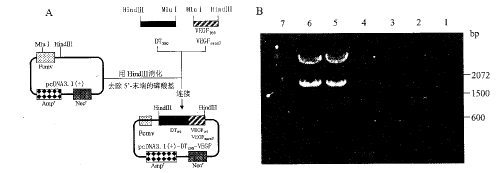
图1 pcDNA3.1(+)-DT390-VEGF165/ VEGFexon7构建流程、PCR 扩增及限制性酶切图谱
A: pcDNA3.1(+)-DT390-VEGF165/VEGFexon7构建流程;
, 百拇医药
B: 1: 100 bp ladder DNA marker; 2: PCR 扩增1.17 kb DT390 DNA; 3:PCR 扩增0.57 kb VEGF165 DNA;
4:PCR 扩增0.13 kb VEGFexon7 DNA; 5:pcDNA3.1(+)-DT390-VEGF165 DNA (MluⅠ);
6: pcDNA3.1(+)-DT390-VEGFexon7 DNA (MluⅠ); 7:pcDNA3.1(+)-DT390-VEGFexon7R DNA (MluⅠ)
测序结果与原序列相比,所得DT390基因序列中第148位的Glu(gaa)→Ser(tcc),第377位的Arg(cgt) →Arg(agg), 第378位的Pro(ccc) →Pro(cct), 该结果不影响DTA酶活性;VEGF165基因序列中第15位的Leu(ctc)→Leu(ctt),第130位的Cys(tgc)→Cys(tgt),该结果不影响VEGF165活性;VEGFexon7基因序列与原序列完全相同,为132 bp;正反向插入序列在pcDNA3.1(+)载体中的测序结果表明融合分子在接头处读框正确。
, http://www.100md.com
观察含EGFP的人宫颈癌Hela细胞转染融合基因后的生长状况。90 h后转VEGF毒素基因细胞大多皱缩死亡,荧光显微镜下可见死亡细胞已不发荧光,活细胞或濒死细胞尚发绿色荧光,见图2。结果表明,融合基因在细胞中得到了表达,且有明显的细胞毒性。本实验表明,表达的融合蛋白活性发挥正常,DT390与 VEGF165或VEGFexon7之间没有构象上的互相干扰。融合基因的详细生物活性正在进一步检测之中。
图2 表达EGFP 的 Hela细胞转染融合基因90 h的情况
转染(A)pcDNA3.1(+)-DT390-VEGFexon7或(B)pcDNA3.1(+)-DT390-VEGF16590 h后细胞出现溶解;
, 百拇医药
(C)对照(pcDNA3.1(+)-DT390-VEGFexon7R)
本课题受国家自然科学基金项目(39770834)资助
参 考 文 献
1,潘 欣, 曹广文, 柯重伟, 等. 血管内皮细胞生长因子及其相关蛋白的结构与功能, 生物化学与生物物理学报, 1999, 31: 111
2,杜宝恒, 治疗的原理和实践. 天津: 天津科学技术出版社, 2000. 90
3,Arora N, Massood R, Zheng T, et al. Vascular endothelial growth factor chimeric Toxin is highly active against endothelial cells. Cancer Res, 1999, 59: 183
(1999-10-28收稿; 2000-01-14修回), http://www.100md.com
单位:潘欣 柯重伟 潘卫 曹广文 戚中田(第二军医大学微生物学教研室 上海 200433)
关键词:白喉毒素;血管内皮细胞生长因子;融合基因;真核表达载体;基因治疗
中国肿瘤生物治疗杂志000316 《中国图书资料分类法》 分类号 R730.59
抑制血管再生可能是治疗实体瘤的有效途径。肿瘤血管生成的主要调控者是血管内皮细胞生长因子(VEGF)。VEGF 的5种异构体中VEGF165是表达丰度最高的异构体,KDR和Flt-1为VEGF的高亲和受体。1996年Soker等在各种肿瘤细胞系上发现了仅与VEGF165外显子7编码的结构域结合的受体,即VEGF165R[1]。目前将细菌毒素的跨膜结构域和酶性结构域与细胞因子或抗体构成的融合蛋白靶向杀伤各型细胞的研究已有大量报道,但这些融合毒素仅对某些类型的肿瘤有效。为扩大癌症治疗范围,我们选择VEGF165和VEGFexon7取代白喉毒素的受体结合结构域而与其跨膜结构域和酶性结构域融合以选择性毒杀肿瘤血管。
, 百拇医药
本研究中,我们构建了携带DT390-VEGF及DT390-VEGFexon7基因的真核表达载体,转基因后结果显示,融合基因表达的蛋白质可以杀死肿瘤细胞。本研究为继续开展组织特异性基因治疗工作打下了基础。
1 材料与方法
1.1 质粒、菌种及细胞
pET15b-DT由美国Collier博士惠赠;pcDNA3.1(+)真核表达载体由美国FDA李忠民博士惠赠; pcDNA3.1(+)-EGFP质粒本室构建;PCR产物克隆载体pMD18-T为TaKaRa公司产品;工程菌DH5α及人宫颈癌Hela细胞为本室保存。
1.2 PCR引物均由TaKaRa公司合成
引物1为5′-GGAAGCTTGCCGCCACCAT GGGCGCTGATGATGTTGTTGA-3′; 引物2为5′-GACGCGTAAGAAA TGGTTGCGT-3′; 引物1,2为DT390引物。引物3为5′-GACGCGTATGAACTTTCTGC-3′; 引物4为5′-GAAGCTTT CACCGCCTCGGCTTGTC-3′; 引物3,4为VEGF165引物。引物5为5′-GACGCGTCCCTGTGGGCCTTG-3′; 引物6为5′-GAAGCTTTCAACATCTGCAAGTACGT-3′;引物5,6为VEGFexon7引物。
, 百拇医药
1.3 目的基因克隆
DT390基因的PCR引物根据Collier博士提供的DT基因序列设计,引物1引入HindⅢ位点和Kozak序列, 引物2引入MluⅠ位点。VEGF165及VEGFexon7基因的PCR引物根据David等发表的VEGF基因序列设计, 引物3和引物5引入MluⅠ位点和Kozak序列, 引物4和引物6引入强终止信号和HindⅢ位点。PCR产物经纯化后, 分别克隆到pMD18-T PCR产物克隆载体上, 进行DNA自动测序。
1.4 真核表达载体的构建
用HindⅢ/MluⅠ分别将DT390,VEGF165,VEGFexon7从携带目的基因的pMD18-T 载体上游离下来,用HindⅢ酶切pcDNA3.1(+)载体并去磷酸化, 用T4DNA连接酶将线性化的pcDNA3.1(+)分别与HindⅢ-MluⅠDT390片段和MluⅠ-HindⅢ VEGF165片段以及HindⅢ-MluⅠDT390片段和MluⅠ-HindⅢVEGFexon7片段进行连接; 以HindⅢ酶切鉴定阳性克隆,以载体上的MluⅠ位点(距起始位点228 bp)同插入片段上的MluⅠ位点联合酶切鉴定插入方向, 同时进行DNA自动测序以确认读框正确。
, http://www.100md.com
1.5 绿色荧光蛋白EGFP基因在人宫颈癌Hela细胞的表达
细胞培养、转染和G418筛选均按常规方法[2]。3周后获得抗性克隆,用一次性自吸式医用微量吸管吸出发绿色荧光的克隆,继续培养15 d, 在荧光显微镜下选择出5瓶(5个克隆)全瓶细胞均发绿色荧光的继续传代培养。
1.6 DT390-VEGF165及DT390-VEGFexon7融合基因在携带绿色荧光蛋白EGFP基因的Hela细胞中表达
在24孔板中按5×105个细胞/孔接种表达EGFP的人宫颈癌Hela细胞, pcDNA3.1(+)-DT390-VEGF165 DNA或pcDNA3.1(+)-DT390-VEGFexon7 DNA按上述方法转染;对照为反向插入的pcDNA3.1(+)-DT390-VEGFexon7R, 转染后继续培养至90 h, 在荧光显微镜下拍照记录结果。
, 百拇医药
2 结果与讨论
为使融合分子DT390-VEGF165及DT390-VEGFexon7中的白喉毒素和VEGF165 或VEGFexon7分子能自由折叠,在DT390的3′端和VEGF165或VEGFexon7的5′端加入MluⅠ位点, 也即增加了两个氨基酸残基,TR[3], 构建过程及质粒酶切鉴定见图1。

图1 pcDNA3.1(+)-DT390-VEGF165/ VEGFexon7构建流程、PCR 扩增及限制性酶切图谱
A: pcDNA3.1(+)-DT390-VEGF165/VEGFexon7构建流程;
, 百拇医药
B: 1: 100 bp ladder DNA marker; 2: PCR 扩增1.17 kb DT390 DNA; 3:PCR 扩增0.57 kb VEGF165 DNA;
4:PCR 扩增0.13 kb VEGFexon7 DNA; 5:pcDNA3.1(+)-DT390-VEGF165 DNA (MluⅠ);
6: pcDNA3.1(+)-DT390-VEGFexon7 DNA (MluⅠ); 7:pcDNA3.1(+)-DT390-VEGFexon7R DNA (MluⅠ)
测序结果与原序列相比,所得DT390基因序列中第148位的Glu(gaa)→Ser(tcc),第377位的Arg(cgt) →Arg(agg), 第378位的Pro(ccc) →Pro(cct), 该结果不影响DTA酶活性;VEGF165基因序列中第15位的Leu(ctc)→Leu(ctt),第130位的Cys(tgc)→Cys(tgt),该结果不影响VEGF165活性;VEGFexon7基因序列与原序列完全相同,为132 bp;正反向插入序列在pcDNA3.1(+)载体中的测序结果表明融合分子在接头处读框正确。
, http://www.100md.com
观察含EGFP的人宫颈癌Hela细胞转染融合基因后的生长状况。90 h后转VEGF毒素基因细胞大多皱缩死亡,荧光显微镜下可见死亡细胞已不发荧光,活细胞或濒死细胞尚发绿色荧光,见图2。结果表明,融合基因在细胞中得到了表达,且有明显的细胞毒性。本实验表明,表达的融合蛋白活性发挥正常,DT390与 VEGF165或VEGFexon7之间没有构象上的互相干扰。融合基因的详细生物活性正在进一步检测之中。

图2 表达EGFP 的 Hela细胞转染融合基因90 h的情况
转染(A)pcDNA3.1(+)-DT390-VEGFexon7或(B)pcDNA3.1(+)-DT390-VEGF16590 h后细胞出现溶解;
, 百拇医药
(C)对照(pcDNA3.1(+)-DT390-VEGFexon7R)
本课题受国家自然科学基金项目(39770834)资助
参 考 文 献
1,潘 欣, 曹广文, 柯重伟, 等. 血管内皮细胞生长因子及其相关蛋白的结构与功能, 生物化学与生物物理学报, 1999, 31: 111
2,杜宝恒, 治疗的原理和实践. 天津: 天津科学技术出版社, 2000. 90
3,Arora N, Massood R, Zheng T, et al. Vascular endothelial growth factor chimeric Toxin is highly active against endothelial cells. Cancer Res, 1999, 59: 183
(1999-10-28收稿; 2000-01-14修回), http://www.100md.com