FK506对人淋巴细胞CD69、CD25表达的影响
作者:邓文锋 苏泽轩 于立新
单位:邓文锋(第一军医大学南方医院肾移植科, 广东 广州510515);苏泽轩(暨南大学华侨医院泌尿外科,广东 广州510632);于立新(第一军医大学南方医院肾移植科, 广东 广州510515)
关键词:FK506;淋巴细胞;CD69 ;CD25
第一军医大学学报000414 摘要:目的 研究FK506对淋巴细胞活化分子表达的影响。方法 实验分3组,(1)对照组:血标本;(2)PHA组:血标本+PHA(20μg/ml);(3)FK506+PHA组:血标本+FK506(1μg/ml)+PHA(20μg/ml)。随机取16例健康成人新鲜血,每例按上述3组行全血培养,流式细胞仪检测培养后的淋巴细胞活化分子CD69 、CD25 的表达。结果 培养后对照组、PHA组、FK506+PHA组24 h CD69表达率分别为(2.38±0.47)%、(9.45±2.23)%、(4.71±1.29)%; 72 h CD25表达率分别为(2.60±0.47)%、(20.39±1.78)%、(6.88±1.66)%。经GB-State统计软件分析,FK506+PHA组与PHA 组的CD69、CD25表达率比较存在显著差异(P<0.01)。结论 FK506能明显减少淋巴细胞活化分子CD69 、CD25的表达,即明显抑制淋巴细胞的活化。
, 百拇医药
中图分类号:R392.4 文献标志码:A
文章编号:1000-2588(2000)04-0361-02
Effect of FK506 on expression of CD69 and CD25 on human lymphocytes
DENG Wen-feng,YU Li-xin
(Department of Kidney Transplantation, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
SU Ze-xuan
(Department of Urological Surgery, Huaqiao Hospital, Ji-nan University, Guangzhou 510632, China)Abstract: Objective To study the effect of FK506 on expression of CD69 and CD25 on human lymphocytes. Method Fresh blood was taken from 16 randomly selected healthy adults, added to control, phytohaemagglutinin-A (PHA) and FK506+PHA groups separately, and then cultured. Expressions of CD69 and CD25 on lymphocytes were detected by flow cytometry. Results After the samples were cultured for 24 h, expressions of CD69 were 2.38±0.47% in control, 9.45±2.23% in PHA, 4.71±1.29% in FK506+PHA group. After 72 h cultured, expressions of CD25 in the three groups were 2.60±0.47%, 20.39±1.78%,6.88±1.66%,respectively. GB-State software was used for statistical analysis,and significant statistical difference was found between PHA and Fk506+PHA (P<0.01). Conclusion FK506 could significantly inhibit the expressions of activated molecules CD69 and CD25 on lymphocytes and suppress the activation of lymphocytes.
, http://www.100md.com
Key words:FK506; lymphocyte; CD69; CD25
FK506是一种新型的免疫抑制剂,是由日本藤泽(Fujisawa)公司的筑波探索研究所于1984年从链霉菌中分离出来的一种大环内酯类抗生素[1、7]。它具有强大的免疫抑制功能,其免疫机制与环孢素-A相类似,抑制T淋巴细胞活化是通过抑制多细胞因子的产生与表达而实现[2、8]。本实验通过FK506对PHA(phytohaemagglutinin-A)刺激的淋巴细胞活化标记CD69、CD25 表达的影响,探讨FK506对淋巴细胞活化的影响。
1 材料与方法
1.1.实验材料
1.1.1试剂 (1)健康成人新鲜血(肝素20 U/ml抗凝);(2)PRMI-1640培养液干粉(美国Gibco公司);(3)PHA(美国Sigma公司);(4)FK506(日本大坂Fujisawa制药厂出品);(5)小鼠抗人CD69、CD25单克隆抗体,羊抗小鼠IgG-FITC荧光二抗(丹麦DAKO公司);(6)自制裂解液:氯化胺0.155 mol/L、EDTA-2Na 0.1 mmol/L、碳酸氢钠0.1 mol/L,pH7.2±0.2
, http://www.100md.com
1.1.2主要仪器 超净工作台(SW-CJ-IC,苏州净化设备厂);CO2培养箱(WJ-12D,日本平尺制作所);流式细胞仪(Coulter,美国)。
1.2 实验方法
1.2.1实验分组 (1)对照组:血标本;(2)PHA组:血标本+PHA(20 μg/ml);(3)FK506+PHA组:血标本+FK506(1μg/ml)+PHA(20 μg/ml)。
1.2.2细胞培养 取健康成人新鲜血3 ml,抗凝。每组1 ml血标本中加入2 ml PRMI-1640全培养液(内含20%小牛血清;5×10-5mol/L 2-巯基乙醇;15 mmol/L HEPES;100 U/ml青霉素;100μg/ml链霉素),然后按实验分组要求加入PHA和FK506,混匀后置37 ℃、5% CO2 细胞培养箱中培养。定时观察细胞形态、生长情况及有无微生物污染,并轻轻摇动数次使细胞充分混匀,以防贴壁。
, 百拇医药
1.2.3流式细胞仪检测标本的制备 于培养后24 h从各组中取样30 μl,分别置于流式细胞仪专用管中,加入CD69单克隆一抗10 μl,混匀,室温下作用30 min;加入1 ml裂解液混匀,充分溶血约30 s(至样品透明),2 000 r/min离心5 min,PBS (含0.1%叠氮钠)洗涤,共3次;加入IgG-FITC荧光二抗10 μl,混匀,室温下染色30 min,避光。PBS(含0.1%叠氮钠)洗涤、离心(2 000 r/min,5 min)共3次;去上清后加入300 μl 1%多聚甲醛固定液,混匀,避光待测。72 h样品加CD25单抗按同法制成待测标本。
1.2.4 流式细胞仪的检测、分析 应用Coulter激光流式细胞仪,采用框定淋巴细胞,计数10 000个细胞中染色阳性的细胞百分数,进行单标流式细胞分析。
1.2.5 统计学分析 数据以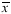 ±s表达。用GB-State统计分析软件进行统计学分析,P<0.01为有显著性差异。
±s表达。用GB-State统计分析软件进行统计学分析,P<0.01为有显著性差异。
, http://www.100md.com
2 结果
应用流式细胞仪检测淋巴细胞表面活化分子CD69或CD25的阳性表达率,结果见表1。PHA刺激后CD69、CD25的表达率明显升高,与对照组比较存在显著相差(P<0.01)。FK506能降低PHA刺激后CD69或CD25的表达,与PHA组比较有显著性差异(P<0.01)。本实验中培养72 h后各例的淋巴细胞成活率均在95%以上。
表1 各组CD69和CD25的表达情况 (n=16,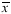 ±s)
±s)
Tab.1 Expressions of CD69 and CD25 in different groups
(n=16, Mean±SD)
Group
, 百拇医药
CD69
CD25
Control
2.38±0.47
2.60±0.47
PHA
9.45±2.23*
20.39±1.78*
FK506+PHA
4.71±1.29**
6.88±1.66**
* P<0.01 vs control; ** P<0.01 vs PHA
, 百拇医药
3 讨论
淋巴细胞活化是器官移植排斥反应中发生免疫反应的重要环节,许多免疫抑制剂就是通过不同的途径、不同的机制影响淋巴细胞活化,从而达到免疫抑制的效果。PHA是常用的促有丝分裂原,能专一地刺激淋巴细胞活化。CD69是细胞活化时表达较早的活化标记,是一个多功能的免疫调节分子,其重要性表现在对整个血液系统细胞的活化和分化上。不但有丝分裂原或CD3介导的活化,而且CD2或CD28介导的活化过程都伴有CD69的表达[3、4]。CD25即白细胞介素2(IL-2)受体,也称Tac抗原,是活化细胞的具有的抗原。同种异体抗原或植物血凝素刺激后,CD25也是淋巴细胞表面表达相对较早的标记。它是各种细胞接触IL-2后发挥生物学效应的关键分子[5]。
FK506通过与受体淋巴细胞内的FK506结合蛋白(FK506-BP)结合形成复合物后,再与神经钙调素结合而抑制后者的磷酸化酶特性,从而干扰基因转录的主要核因子NF-AT的组装,使转录IL-2、IL-2R、IFN-γ等的基因受到阻遏[6、8]。本实验结果显示,PHA刺激能诱导、增加淋巴细胞活化标志CD69、CD25分子的表达,而FK506则能明显抑制PHA刺激后CD69、CD25分子的表达,表明FK506可明显抑制淋巴细胞活化。
, 百拇医药
作者简介:邓文锋(1966-),男,湖南武冈人,1996年毕业于暨南大学医学院,硕士,主治医师,讲师,电话:85147043
参考文献:
1,Goto T, Kino T, Halanaka H, et al. Discovery of FK506, a noval immunosupprasant isolated from streptomyces tsukubaensis[J]. Transplant Proc, 1987, 19(1):4-8.
2,Starzl TE. First international workshop on FK506: a potential break -through in immunosuppression[J]. Transplant Proc, 1987, 19(1):101-4.
, http://www.100md.com
3,Ziegler SF, Ramsdell F, Alderson MR, et al. The activatin antigen CD69[J]. Stem Cells, 1994, 12(5):456-65.
4,Risso A, Smilovich D, Capra MC, et al. CD69 inresting and activated T lymphocytes. It assosiation with a GTP binding protein and biochemical requirements for it expression[J]. J Immunol, 1991, 146(12):4105-14.
5,Roland S, Harald S ed. Cluster report: CD25 leucocyte typing IV-white cell differentiation Antigens[M]. OxFord: OxFord university press, 1989. 399-403.
, http://www.100md.com
6,荆 彤,陈哲生. FK506和环孢素的研究进展[J]. 国外医学× 免疫学分册, 1994, 18(1):102-4.
7,余传霖,叶天星,陆德源. 现代医学免疫学[M]. 上海:上海医科大学出版社, 1998.1194.
8,Undre NA, Stevenson P, Schafer A. Pharmacokinetics of tacrolimus: clinically relevant aspects[J]. Transplant Proc, 1999, 31(7A):21s-24s.
收稿日期:1999-10-25, 百拇医药
单位:邓文锋(第一军医大学南方医院肾移植科, 广东 广州510515);苏泽轩(暨南大学华侨医院泌尿外科,广东 广州510632);于立新(第一军医大学南方医院肾移植科, 广东 广州510515)
关键词:FK506;淋巴细胞;CD69 ;CD25
第一军医大学学报000414 摘要:目的 研究FK506对淋巴细胞活化分子表达的影响。方法 实验分3组,(1)对照组:血标本;(2)PHA组:血标本+PHA(20μg/ml);(3)FK506+PHA组:血标本+FK506(1μg/ml)+PHA(20μg/ml)。随机取16例健康成人新鲜血,每例按上述3组行全血培养,流式细胞仪检测培养后的淋巴细胞活化分子CD69 、CD25 的表达。结果 培养后对照组、PHA组、FK506+PHA组24 h CD69表达率分别为(2.38±0.47)%、(9.45±2.23)%、(4.71±1.29)%; 72 h CD25表达率分别为(2.60±0.47)%、(20.39±1.78)%、(6.88±1.66)%。经GB-State统计软件分析,FK506+PHA组与PHA 组的CD69、CD25表达率比较存在显著差异(P<0.01)。结论 FK506能明显减少淋巴细胞活化分子CD69 、CD25的表达,即明显抑制淋巴细胞的活化。
, 百拇医药
中图分类号:R392.4 文献标志码:A
文章编号:1000-2588(2000)04-0361-02
Effect of FK506 on expression of CD69 and CD25 on human lymphocytes
DENG Wen-feng,YU Li-xin
(Department of Kidney Transplantation, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
SU Ze-xuan
(Department of Urological Surgery, Huaqiao Hospital, Ji-nan University, Guangzhou 510632, China)Abstract: Objective To study the effect of FK506 on expression of CD69 and CD25 on human lymphocytes. Method Fresh blood was taken from 16 randomly selected healthy adults, added to control, phytohaemagglutinin-A (PHA) and FK506+PHA groups separately, and then cultured. Expressions of CD69 and CD25 on lymphocytes were detected by flow cytometry. Results After the samples were cultured for 24 h, expressions of CD69 were 2.38±0.47% in control, 9.45±2.23% in PHA, 4.71±1.29% in FK506+PHA group. After 72 h cultured, expressions of CD25 in the three groups were 2.60±0.47%, 20.39±1.78%,6.88±1.66%,respectively. GB-State software was used for statistical analysis,and significant statistical difference was found between PHA and Fk506+PHA (P<0.01). Conclusion FK506 could significantly inhibit the expressions of activated molecules CD69 and CD25 on lymphocytes and suppress the activation of lymphocytes.
, http://www.100md.com
Key words:FK506; lymphocyte; CD69; CD25
FK506是一种新型的免疫抑制剂,是由日本藤泽(Fujisawa)公司的筑波探索研究所于1984年从链霉菌中分离出来的一种大环内酯类抗生素[1、7]。它具有强大的免疫抑制功能,其免疫机制与环孢素-A相类似,抑制T淋巴细胞活化是通过抑制多细胞因子的产生与表达而实现[2、8]。本实验通过FK506对PHA(phytohaemagglutinin-A)刺激的淋巴细胞活化标记CD69、CD25 表达的影响,探讨FK506对淋巴细胞活化的影响。
1 材料与方法
1.1.实验材料
1.1.1试剂 (1)健康成人新鲜血(肝素20 U/ml抗凝);(2)PRMI-1640培养液干粉(美国Gibco公司);(3)PHA(美国Sigma公司);(4)FK506(日本大坂Fujisawa制药厂出品);(5)小鼠抗人CD69、CD25单克隆抗体,羊抗小鼠IgG-FITC荧光二抗(丹麦DAKO公司);(6)自制裂解液:氯化胺0.155 mol/L、EDTA-2Na 0.1 mmol/L、碳酸氢钠0.1 mol/L,pH7.2±0.2
, http://www.100md.com
1.1.2主要仪器 超净工作台(SW-CJ-IC,苏州净化设备厂);CO2培养箱(WJ-12D,日本平尺制作所);流式细胞仪(Coulter,美国)。
1.2 实验方法
1.2.1实验分组 (1)对照组:血标本;(2)PHA组:血标本+PHA(20 μg/ml);(3)FK506+PHA组:血标本+FK506(1μg/ml)+PHA(20 μg/ml)。
1.2.2细胞培养 取健康成人新鲜血3 ml,抗凝。每组1 ml血标本中加入2 ml PRMI-1640全培养液(内含20%小牛血清;5×10-5mol/L 2-巯基乙醇;15 mmol/L HEPES;100 U/ml青霉素;100μg/ml链霉素),然后按实验分组要求加入PHA和FK506,混匀后置37 ℃、5% CO2 细胞培养箱中培养。定时观察细胞形态、生长情况及有无微生物污染,并轻轻摇动数次使细胞充分混匀,以防贴壁。
, 百拇医药
1.2.3流式细胞仪检测标本的制备 于培养后24 h从各组中取样30 μl,分别置于流式细胞仪专用管中,加入CD69单克隆一抗10 μl,混匀,室温下作用30 min;加入1 ml裂解液混匀,充分溶血约30 s(至样品透明),2 000 r/min离心5 min,PBS (含0.1%叠氮钠)洗涤,共3次;加入IgG-FITC荧光二抗10 μl,混匀,室温下染色30 min,避光。PBS(含0.1%叠氮钠)洗涤、离心(2 000 r/min,5 min)共3次;去上清后加入300 μl 1%多聚甲醛固定液,混匀,避光待测。72 h样品加CD25单抗按同法制成待测标本。
1.2.4 流式细胞仪的检测、分析 应用Coulter激光流式细胞仪,采用框定淋巴细胞,计数10 000个细胞中染色阳性的细胞百分数,进行单标流式细胞分析。
1.2.5 统计学分析 数据以
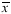 ±s表达。用GB-State统计分析软件进行统计学分析,P<0.01为有显著性差异。
±s表达。用GB-State统计分析软件进行统计学分析,P<0.01为有显著性差异。, http://www.100md.com
2 结果
应用流式细胞仪检测淋巴细胞表面活化分子CD69或CD25的阳性表达率,结果见表1。PHA刺激后CD69、CD25的表达率明显升高,与对照组比较存在显著相差(P<0.01)。FK506能降低PHA刺激后CD69或CD25的表达,与PHA组比较有显著性差异(P<0.01)。本实验中培养72 h后各例的淋巴细胞成活率均在95%以上。
表1 各组CD69和CD25的表达情况 (n=16,
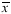 ±s)
±s)Tab.1 Expressions of CD69 and CD25 in different groups
(n=16, Mean±SD)
Group
, 百拇医药
CD69
CD25
Control
2.38±0.47
2.60±0.47
PHA
9.45±2.23*
20.39±1.78*
FK506+PHA
4.71±1.29**
6.88±1.66**
* P<0.01 vs control; ** P<0.01 vs PHA
, 百拇医药
3 讨论
淋巴细胞活化是器官移植排斥反应中发生免疫反应的重要环节,许多免疫抑制剂就是通过不同的途径、不同的机制影响淋巴细胞活化,从而达到免疫抑制的效果。PHA是常用的促有丝分裂原,能专一地刺激淋巴细胞活化。CD69是细胞活化时表达较早的活化标记,是一个多功能的免疫调节分子,其重要性表现在对整个血液系统细胞的活化和分化上。不但有丝分裂原或CD3介导的活化,而且CD2或CD28介导的活化过程都伴有CD69的表达[3、4]。CD25即白细胞介素2(IL-2)受体,也称Tac抗原,是活化细胞的具有的抗原。同种异体抗原或植物血凝素刺激后,CD25也是淋巴细胞表面表达相对较早的标记。它是各种细胞接触IL-2后发挥生物学效应的关键分子[5]。
FK506通过与受体淋巴细胞内的FK506结合蛋白(FK506-BP)结合形成复合物后,再与神经钙调素结合而抑制后者的磷酸化酶特性,从而干扰基因转录的主要核因子NF-AT的组装,使转录IL-2、IL-2R、IFN-γ等的基因受到阻遏[6、8]。本实验结果显示,PHA刺激能诱导、增加淋巴细胞活化标志CD69、CD25分子的表达,而FK506则能明显抑制PHA刺激后CD69、CD25分子的表达,表明FK506可明显抑制淋巴细胞活化。
, 百拇医药
作者简介:邓文锋(1966-),男,湖南武冈人,1996年毕业于暨南大学医学院,硕士,主治医师,讲师,电话:85147043
参考文献:
1,Goto T, Kino T, Halanaka H, et al. Discovery of FK506, a noval immunosupprasant isolated from streptomyces tsukubaensis[J]. Transplant Proc, 1987, 19(1):4-8.
2,Starzl TE. First international workshop on FK506: a potential break -through in immunosuppression[J]. Transplant Proc, 1987, 19(1):101-4.
, http://www.100md.com
3,Ziegler SF, Ramsdell F, Alderson MR, et al. The activatin antigen CD69[J]. Stem Cells, 1994, 12(5):456-65.
4,Risso A, Smilovich D, Capra MC, et al. CD69 inresting and activated T lymphocytes. It assosiation with a GTP binding protein and biochemical requirements for it expression[J]. J Immunol, 1991, 146(12):4105-14.
5,Roland S, Harald S ed. Cluster report: CD25 leucocyte typing IV-white cell differentiation Antigens[M]. OxFord: OxFord university press, 1989. 399-403.
, http://www.100md.com
6,荆 彤,陈哲生. FK506和环孢素的研究进展[J]. 国外医学× 免疫学分册, 1994, 18(1):102-4.
7,余传霖,叶天星,陆德源. 现代医学免疫学[M]. 上海:上海医科大学出版社, 1998.1194.
8,Undre NA, Stevenson P, Schafer A. Pharmacokinetics of tacrolimus: clinically relevant aspects[J]. Transplant Proc, 1999, 31(7A):21s-24s.
收稿日期:1999-10-25, 百拇医药