氯化甲基汞对大鼠大脑即早基因表达的影响
作者:李国君 邓一夫 褚金花 吴萍 吴德生
单位:吴德生(华西医科大学公共卫生学院);李国君 邓一夫 褚金花 吴萍(首都医科大学预防医学系环卫教研室,北京 100054)
关键词:氯化甲基汞;即早基因;神经毒理
卫生毒理学杂志000402 摘要 【目的】 研究即早基因(IEG)在氯化甲基汞神经毒性机制中的作用。【方法】 应用Fos和Jun蛋白免疫组织化学方法,对腹腔注射氯化甲基汞(0.6 mg/kg及6.0 mg/kg)的大鼠不同脑区c-fos,c-jun表达水平进行观察。【结果】 经图像分析及统计检验结果显示,急性染汞2 h后,大鼠脑组织皮层、海马CA3区及小脑的Fos、Jun表达的阳性面积比[Aa(%)]、平均灰度和阳性细胞个数(n)3个参数与对照组相比,差异有显著性(P<0.05),即染汞组IEG表达高于对照组。例如:高剂量组、低剂量组和对照组在海马CA3区的Fos表达的平均灰度分别为136±8,149±14,178±15。【结论】 提示第三信使IEG作为转录调控因子参与了氯化甲基汞对中枢神经损害的毒性过程。这对深入阐明汞神经毒性的分子机制提供了一定的实验依据。并建议将IEG作为氯化甲基汞神经毒性检测和评价的效应指标。
, http://www.100md.com
Effects of chloro methylmercury on the expression of immediate early genes in rat brain
LI Guo-jun,DENG Yi-fu,CHU Jin-hua
(Department of preventive Medicine,Capital University of Medical Sciences,Beijing 100054,China)
Abstract:【Objective】 To study the role of immediate early genes(IEG) in the neurotoxic mechanism of chloro methylmercury.【Methods】 Expression of Fos and Jun in different brain regions of rats treated with chloro methylmercury(0^6 mg/kg and 6^0 mg/kg)was observed by using immunohistochemical methods.【Results】 The observation and image analysis showed that after rats treated by chloro methylmercury for 2 hours,the expression of Fos and Jun in cortex,CA-3 area of hippocampus and cerebellum of rats was more higher than that of controls (P<0^05).For example,the average gray levels of Fos expression in the CA-3 area of hippocampus were 136±8,149±14,178±15 in groups of high and low doses of chloro methylmercury and controls respectively.【Conclusion】 The results indicated that IEG,as a transcription regular factor,could participate in the process of neurotoxicity induced by chloro methylmercury.The study may provide experimental basis for expounding molecular neurotoxic mechanism of chloro methylmercury and suggest IEG as an effect index of detection and assessment in the neurotoxicology of methylmercury.
, 百拇医药
Key words:Chloro methylmercury; Immediate early genes; Neurotoxicity
甲基汞是一种具有神经毒性的环境污染物。50年代日本水俣事件后的几十年中,许多学者从形态学、生理学和生物化学等方面对甲基汞神经毒作用机制进行了大量研究,相继提出了一些学说[1,2],但迄今在分子水平上甲基汞神经毒作用机制仍不十分清楚。近几年在分子神经生物学研究中,即刻早期基因(immediate-early genes,IEG)因其在神经系统的生理及病理过程中所起的重要调节作用日渐受到关注。正常情况下,IEG参与神经细胞的生长、分化、信息传递、学习和记忆等生理过程。当有外界伤害性刺激时,IEG(主要包括c-fos,c-jun)可作为刺激激活神经元的第二信使与目的基因表达间的信息传递中介物而被认为是神经元的一种“第三信使”[3]。现应用Fos和Jun免疫组织化学方法研究氯化甲基汞急性中毒时大鼠脑组织中第三信使IEG表达的改变,为深入探讨甲基汞神经毒性的分子机制及危险度评价提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 试剂与仪器 氯化甲基汞(MMC,日本和光纯药工药株式会社),兔抗鼠FOS、JUN多克隆抗体(美国Santa Cruz公司),SP-Kit(抗兔,美国Zymed公司),石蜡切片机(德国产Leitz 1515型)。
1.2 染毒方法及剂量 SD雄性健康大鼠,体重220~240 g,随机分为3组,每组5~6只,一次性腹腔注射受试物进行染毒。低剂量组、高剂量组分别注射剂量为0.6及6.0 mg/kg的氯化甲基汞溶液,对照组注射质量浓度为0.009 kg/L的NaCl。各组实验时间尽可能一致,染毒2 h后灌注固定并取材。
1.3 灌注固定 大鼠染毒2 h后,给予戊巴比妥钠(60 mg/kg,ip)深麻醉。打开胸腔,夹闭腹主动脉,经左心室插管,剪开右心耳,用37 ℃生理盐水100 ml快速冲洗,继之以4 ℃的质量浓度为0.04 kg/L的多聚甲醛(pH7.4)100 ml灌注,持续0.5~1 h。
, 百拇医药
1.4 取材切片 灌注完毕后断头,迅速钳除颅骨,剥离硬脑膜及软脑膜,取出完整脑组织。沿矢状面方向从正中将脑组织切成左右两半,置4 ℃的0.04 kg/L多聚甲醛中继续固定12~24 h。修块、脱水、石蜡包埋,矢状方向切片,片厚5 μm。
1.5 免疫组化反应程序 切片脱蜡至水,加体积分数为0.03的H2O2-甲醇(30 min),加质量浓度为0.001 kg/L的胰蛋白酶(37 ℃,15 min),加质量浓度为0.02 kg/L的BSA(37 ℃,1 h),加Fos(或Jun)一抗(工作浓度1∶200,4 ℃)过夜,加生物素化二抗(工作浓度1∶100),37 ℃,20 min,加S-A/HRP(工作浓度1∶100),37 ℃,20 min。各步骤间用0.01 mol/L PBS(pH7.4)洗涤3×5 min,DAB显色,PBS终止反应,脱水,透明,封片。
1.6 结果判断 海马等部位的辨认参照包新民等著《大鼠脑立体定位图谱》[4]。以Fos,Jun阳性的癫痫大鼠脑组织切片为阳性对照,以正常羊血清代替Fos,Jun一抗作为替代对照,以0.01 mol/LPBS(pH7.4)代替Fos,Jun一抗作为空白对照。
, 百拇医药
1.7 显微照相 用日本产OLYMPUS BH1型显微照相系统。
1.8 图像分析 用Mias-2000图象分析系统,对免疫组化反应切片进行定量分析。每张切片分别对大脑皮层、海马CA3区和小脑观察2个视野。视场面积为46 151.811 17 μm2,分别测定阳性面积比[Aa(%)]、平均灰度及阳性细胞个数(n)等参数。
1.9 统计学处理 采有PEMS Ver.2.1进行方差分析。
2 结果
2.1 氯化甲基汞对大鼠不同脑区Fos蛋白表达的影响 光镜下观察,染汞组大鼠脑组织中Fos蛋白免疫组织化学反应物质呈棕黄色颗粒状,位于神经细胞及部分胶质细胞核内,胞浆亦有部分表达。海马CA-3区Fos染色阳性的锥体细胞分布密集,胞体大,呈多角形,阳性着色的核呈圆形或椭圆形,着色深(图1);小脑Fos染色阳性的蒲肯野氏细胞呈单层排列,胞体大,着色较深(图2);皮层阳性神经细胞呈散在分布,皮层的不同层阳性细胞形态各异。正常对照组相应部位仅见少数细胞Fos阳性表达,着色浅(图3)。替代对照及空白对照均未见阳性表达。
, 百拇医药
在图象分析系统下,测定各组Fos表达的阳性面积比[Aa(%)],平均灰度及阳性细胞个数(n)等参数,见表1。经统计学检验,在大脑皮层,低剂量组和高剂量组Aa(%)及n均高于对照组(P<0.05)。在海马CA3区,低剂量组平均灰度及高剂量组Aa(%)和平均灰度与对照组比较,差异有显著性(P<0.05)。在小脑蒲细胞区,低剂量组和高剂量组的平均灰度均低于对照组(P<0.05及P<0.01),Aa(%)高于对照组(P<0.05)。以上结果表明染汞组Fos表达在数量及强度上均高于对照组。
表1 氯化甲基汞对小鼠不同脑区Fos蛋白表达的影响(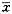 ±s) 组别
±s) 组别
大脑皮层
海马CA3区
小脑蒲细胞
, 百拇医药
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
高剂量组
8.45±2.55*
171±2*
, 百拇医药
47±8*
15.17±7.83
136±8
32±13
4.42±0.50Δ
160±13**Δ
9±2
低剂量组
6.66±1.24
189±8
40±6
, 百拇医药
7.27±3.78
149±14
23±10
2.95±0.35
180±7*
8±2
对照组
1.84±1.03
194±12
29±3
3.68±0.93
178±15
, 百拇医药
26±5
2.15±0.49
208±5
5±1
低剂量组:0.6 mg/kg的氯化甲基汞; 高剂量组:6.0 mg/kg的氯化甲基汞; Aa(%):阳性面积比; n:阳性细胞数
与对照组比较,P<0.05,P<0.01; 与低剂量组比较,ΔP<0.05表2 氯化甲基汞对大鼠不同脑区Jun蛋白表达的影响(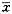 ±s) 组别
±s) 组别
大脑皮层
海马CA3区
, 百拇医药
小脑蒲细胞
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
高剂量组
6.76±4.30
166±6*
, 百拇医药
28±1
9.60±2.42
149±10*
30±9
3.37±0.68
158±8ΔΔ
8
±
2
低剂量组
4.54±1.82
175±14*
, 百拇医药
23±2
7.66±2.94
156±12*
28±11
3.16±1.79
184±9
9
±
3
对照组
2.92±1.98
198±12
, http://www.100md.com
26±8
4.42±1.02
174±11
26±8
2.28±0.14
202±2
6
±
1
与对照组比较,P<0.05,P<0.01;与低剂量组比较,ΔP<0.05
2.2 氯化甲基汞对大鼠不同脑区Jun蛋白表达的影响 光镜下观察,各组Jun的表达特点同Fos(图4~6)。经统计学检验,在大脑皮层,低剂量组与高剂量组的平均灰度与对照组相比,差异有显著性(P<0.05)。其他部位Jun的表达规律基本同Fos(见表2)。以上结果表明染汞组Jun的表达在数量及强度上均高于对照组。
, http://www.100md.com
3 讨论
3.1 甲基汞的毒作用及对IEG表达影响的特点 甲基汞属于高神经毒物质,具脂溶性,易透过血脑屏障或胎盘屏障进入成人或胎儿脑组织,引起急性或慢性甲基汞中毒。如1953年在日本发现的“水俣病”。60年代,我国松花江流域的沿江居民也出现过程度不等的甲基汞中毒的表现。甲基汞在脑组织中以原型蓄积,使脑细胞出现退行性变。损害最为严重的部位是小脑和大脑两半球。临床上表现为小脑性共济失调、视野缩小、语言、感觉、听力障碍等。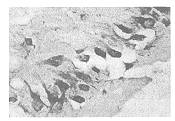
图1 高汞组海马CA-3区Fos表达(×400)
图2 低汞组小脑Fos表达(×400)
, 百拇医药
图3 对照组海马CA-3区Fos表达(×400)
图4 高汞组海马CA-3区Jun表达(×400)
图5 低汞组小脑Jun表达(×400)
图6 对照组小脑Jun表达(×400)
本实验采用腹腔注射染毒,观察氯化甲基汞对大鼠脑组织即刻早期基因(IEG,包括Fos,Jun等)表达的影响及特点。结果显示:(1)甲基汞可较广泛地作用于各主要脑区,如大脑皮层、海马区、小脑区等,正常对照组上述脑区中IEG的表达量很微小,但在甲基汞作用下,这些脑区的Fos,Jun的表达在数量及强度上均明显增高,且具有统计学意义(P<0.05)。(2)甲基汞主要作用于各脑区的神经细胞和部分胶质细胞,使这些细胞核内的Fos,Jun蛋白呈现高表达。(3)随着甲基汞染毒剂量的增高,Fos和Jun的表达也有不同程度的增高,尤其在小脑区,这种增高有统计学意义(P<0.05)。在本实验条件下表现出一定的剂量-反应(效应)关系。上述结果说明甲基汞可诱导大鼠脑组织中c-fos和c-jun基因的蛋白表达。
, 百拇医药
3.2 甲基汞对IEG表达影响的可能过程和机制 本实验观察的结果提示,甲基汞可诱导Fos,Jun蛋白质的合成产生进一步的神经毒性作用。已有的研究表明,c-fos和c-jun是原癌基因中的两种即早基因(IEG),在正常情况下,神经细胞中有低水平表达。表达产物Fos和Jun蛋白是真核细胞的主要转录因子,两者通过亮氨酸拉链形成异源二聚体激活蛋白-1(AP-1),后者作为转录因子与许多基因的AP-1结合位点或佛波脂(TPA)反应序列结合,影响晚期靶基因的表达,因而,c-fos,c-jun的激活和表达可作为神经活动和基因活动的功能标志[5]。在病理状态下,多种刺激因素如疼痛、禁水、癫痫或脑损伤等伤害性刺激均可引起中枢神经元c-fos,c-jun基因的表达。c-fos mRNA表达高峰在1h,Fos蛋白免疫组化反应最大值在2h[6]。Fos/Jun作为第三信使,通过激活AP-1结合位点完成了从第二信使到晚期基因表达的信号转导。
而c-fos和c-jun的诱导表达本身也经历了比较复杂的一系列级联磷酸化反应。据有关文献报道,在生长因子或分裂素的作用下,可诱导c-fos和c-jun的生成。其过程为:酪氨酸激酶受体可直接影响磷酸酯酶C-γ1(PLC-γ1)的磷酸化;一旦PLC-γ1的特定残基发生磷酸化,即可将磷脂酰肌醇二磷酸盐(PIP2)水解成三磷酸肌醇(IP3)和二酰基甘油酯(DAG);IP3引起胞内储Ca2+释放增加,细胞内游离Ca2+增多,与此同时,Ca2+和DAG均可激活蛋白激酶C(PKC)[7];PKC进一步使Raf-1磷酸化而被激活;活性Raf-1作用于MAPK-K(mitogen-activated protein kinase-kinase),使之磷酸化[8],活性的MAPK-K通过催化Erk酪氨酸和苏氨酸残基磷酸化,而使分裂素激活的蛋白激酶(MAPK)发生活化[9];MAPK促使转录因子p62TCF磷酸化,进一步导致包含有p62TCF的三元复合物(TCF)增高,并诱导表达c-fos和c-jun[8,10]。
, 百拇医药
以往关于汞的研究中已见报道,应用彗星试验可检测出氯化甲基汞和二氯化汞具有DNA损伤作用;而且甲基汞可引起细胞内游离Ca2+增加,IP3生成增多[11]。结合本试验观察到的结果,可初步判断,汞对c-fos和c-jun的诱导是其分子水平毒性作用的重要环节之一,而汞对c-fos和c-jun的诱导过程可能与上述文献的报道的生长因子诱导c-fos和c-jun过程相类似,但其详细机制仍有待于进一步研究证实。
3.3 甲基汞诱导IEG表达的意义及IEG的应用前景 c-fos形态学显示法通常被作为神经系功能活动的形态定位指标,具有检测方便、分辨率高(达单个细胞水平)等优点[12]。但基本上未在神经毒物机制研究和评价中发挥其理想作用。本研究发现IEG的诱导表达既可用于探索甲基汞毒性作用的靶细胞,又有助于定量探讨剂量-效应(反应)关系。提示我们在甲基汞的研究和评价中,IEG具有比较重要的理论意义和潜在的应用价值。
, 百拇医药
此外,在铅神经毒性机制的研究中,也发现IEG可显示铅作用的脑部位和靶细胞,而且随着染铅剂量的增高,IEG的表达也呈增高趋势[13];c-fos,c-jun的表达是铅进一步引起神经细胞凋亡的主要促发因素之一[14]。由此可见,IEG在一些重金属神经毒物的毒性作用过程中,具有不可忽视的影响和作用。而在多种神经毒物毒性评价中,生物标志物(biological markers)的选择和建立是很关键的,且取决于毒性作用机制的研究情况。
根据本研究的结果及目前已探知的IEG诱导表达的机制,本实验室建议,将IEG作为甲基汞神经毒性检测和评价的效应指标,为今后对甲基汞等神经毒物进行危险度评价奠定一定的基础。但其灵敏度、特异度尚需进一步验证。
参考文献
[1] 张遵真,吴德生.氯化甲基汞对大鼠脑毒蕈碱受体的影响.华西医科大学学报,1994,25:388-392.
, 百拇医药
[2] Yangama H,Horigome T,Ichimura T,et al.Differential effects of methylmercury on the phosphorylation of protein species in the brain of acutely intoxicated rats.Toxicology,1994,92:101.
[3] Morgan S,Greenberg ME.The regulation and function of c-fos and other immediate early genes in the nervous system.Neuron,1990,4:477-485.
[4] 包新民,舒斯云著.大鼠脑立体定位图谱.北京:人民卫生出版社,1991.40-135.
[5] 陈宜张,主编.分子神经生物学.北京:人民军医出版社,1995.43.
, 百拇医药
[6] MacDonald MC,Robertson HA,Wilkinson M.Age-and dose-related NMDA induction of FOS-like immunoreactivity and c-fos mRNA in the arcuate nucleus of immature female rats.Dev Brain Res,1993,73:193-198.
[7] Berridge MJ.Inositol trisphosphate and calcium signalling.Nature,1993,361:315-325.
[8] Kolch W,Heldecker G,Kochs G,et al.Protein kinase Ca activates RAF-1 by direct phophorylation.Nature,1993,364:249-252.
, 百拇医药
[9] Kyriakis JM,App H,Zhang XF,et al.Raf-1 activates MAP kinase-kinase.Nature,1992,358:417-421.
[10] Gille H,Sharrocks AD, Shaw PE.Phophorylation of transcription factor p62TCF by MAP kinase stimulates ternary complex formation at c-fos promoter.Nature,1992,358:414-417.
[11] Sarafian TA.Methylmercury increase intracellular Ca2+ and inositol phosphate level in cultured cerebellar granule neurons.J Neurochem,1993,61:648.
[12] 韩济生,主编.神经科学纲要.北京:北京医科大学中国医科大学联合出版社,1993.23-24,272-285.
[13] 李国君,吴德生,肖邦良,等.铅对大鼠不同脑区IEG表达的影响.卫生研究,1999,28:65-69.
[14] 李国君,吴德生,等.铅对中枢神经系统c-Fos,c-Jun及细胞凋亡的影响研究.癌变.畸变.突变,1999:11.322-323.
(收稿日期:2000-01-05), http://www.100md.com
单位:吴德生(华西医科大学公共卫生学院);李国君 邓一夫 褚金花 吴萍(首都医科大学预防医学系环卫教研室,北京 100054)
关键词:氯化甲基汞;即早基因;神经毒理
卫生毒理学杂志000402 摘要 【目的】 研究即早基因(IEG)在氯化甲基汞神经毒性机制中的作用。【方法】 应用Fos和Jun蛋白免疫组织化学方法,对腹腔注射氯化甲基汞(0.6 mg/kg及6.0 mg/kg)的大鼠不同脑区c-fos,c-jun表达水平进行观察。【结果】 经图像分析及统计检验结果显示,急性染汞2 h后,大鼠脑组织皮层、海马CA3区及小脑的Fos、Jun表达的阳性面积比[Aa(%)]、平均灰度和阳性细胞个数(n)3个参数与对照组相比,差异有显著性(P<0.05),即染汞组IEG表达高于对照组。例如:高剂量组、低剂量组和对照组在海马CA3区的Fos表达的平均灰度分别为136±8,149±14,178±15。【结论】 提示第三信使IEG作为转录调控因子参与了氯化甲基汞对中枢神经损害的毒性过程。这对深入阐明汞神经毒性的分子机制提供了一定的实验依据。并建议将IEG作为氯化甲基汞神经毒性检测和评价的效应指标。
, http://www.100md.com
Effects of chloro methylmercury on the expression of immediate early genes in rat brain
LI Guo-jun,DENG Yi-fu,CHU Jin-hua
(Department of preventive Medicine,Capital University of Medical Sciences,Beijing 100054,China)
Abstract:【Objective】 To study the role of immediate early genes(IEG) in the neurotoxic mechanism of chloro methylmercury.【Methods】 Expression of Fos and Jun in different brain regions of rats treated with chloro methylmercury(0^6 mg/kg and 6^0 mg/kg)was observed by using immunohistochemical methods.【Results】 The observation and image analysis showed that after rats treated by chloro methylmercury for 2 hours,the expression of Fos and Jun in cortex,CA-3 area of hippocampus and cerebellum of rats was more higher than that of controls (P<0^05).For example,the average gray levels of Fos expression in the CA-3 area of hippocampus were 136±8,149±14,178±15 in groups of high and low doses of chloro methylmercury and controls respectively.【Conclusion】 The results indicated that IEG,as a transcription regular factor,could participate in the process of neurotoxicity induced by chloro methylmercury.The study may provide experimental basis for expounding molecular neurotoxic mechanism of chloro methylmercury and suggest IEG as an effect index of detection and assessment in the neurotoxicology of methylmercury.
, 百拇医药
Key words:Chloro methylmercury; Immediate early genes; Neurotoxicity
甲基汞是一种具有神经毒性的环境污染物。50年代日本水俣事件后的几十年中,许多学者从形态学、生理学和生物化学等方面对甲基汞神经毒作用机制进行了大量研究,相继提出了一些学说[1,2],但迄今在分子水平上甲基汞神经毒作用机制仍不十分清楚。近几年在分子神经生物学研究中,即刻早期基因(immediate-early genes,IEG)因其在神经系统的生理及病理过程中所起的重要调节作用日渐受到关注。正常情况下,IEG参与神经细胞的生长、分化、信息传递、学习和记忆等生理过程。当有外界伤害性刺激时,IEG(主要包括c-fos,c-jun)可作为刺激激活神经元的第二信使与目的基因表达间的信息传递中介物而被认为是神经元的一种“第三信使”[3]。现应用Fos和Jun免疫组织化学方法研究氯化甲基汞急性中毒时大鼠脑组织中第三信使IEG表达的改变,为深入探讨甲基汞神经毒性的分子机制及危险度评价提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 试剂与仪器 氯化甲基汞(MMC,日本和光纯药工药株式会社),兔抗鼠FOS、JUN多克隆抗体(美国Santa Cruz公司),SP-Kit(抗兔,美国Zymed公司),石蜡切片机(德国产Leitz 1515型)。
1.2 染毒方法及剂量 SD雄性健康大鼠,体重220~240 g,随机分为3组,每组5~6只,一次性腹腔注射受试物进行染毒。低剂量组、高剂量组分别注射剂量为0.6及6.0 mg/kg的氯化甲基汞溶液,对照组注射质量浓度为0.009 kg/L的NaCl。各组实验时间尽可能一致,染毒2 h后灌注固定并取材。
1.3 灌注固定 大鼠染毒2 h后,给予戊巴比妥钠(60 mg/kg,ip)深麻醉。打开胸腔,夹闭腹主动脉,经左心室插管,剪开右心耳,用37 ℃生理盐水100 ml快速冲洗,继之以4 ℃的质量浓度为0.04 kg/L的多聚甲醛(pH7.4)100 ml灌注,持续0.5~1 h。
, 百拇医药
1.4 取材切片 灌注完毕后断头,迅速钳除颅骨,剥离硬脑膜及软脑膜,取出完整脑组织。沿矢状面方向从正中将脑组织切成左右两半,置4 ℃的0.04 kg/L多聚甲醛中继续固定12~24 h。修块、脱水、石蜡包埋,矢状方向切片,片厚5 μm。
1.5 免疫组化反应程序 切片脱蜡至水,加体积分数为0.03的H2O2-甲醇(30 min),加质量浓度为0.001 kg/L的胰蛋白酶(37 ℃,15 min),加质量浓度为0.02 kg/L的BSA(37 ℃,1 h),加Fos(或Jun)一抗(工作浓度1∶200,4 ℃)过夜,加生物素化二抗(工作浓度1∶100),37 ℃,20 min,加S-A/HRP(工作浓度1∶100),37 ℃,20 min。各步骤间用0.01 mol/L PBS(pH7.4)洗涤3×5 min,DAB显色,PBS终止反应,脱水,透明,封片。
1.6 结果判断 海马等部位的辨认参照包新民等著《大鼠脑立体定位图谱》[4]。以Fos,Jun阳性的癫痫大鼠脑组织切片为阳性对照,以正常羊血清代替Fos,Jun一抗作为替代对照,以0.01 mol/LPBS(pH7.4)代替Fos,Jun一抗作为空白对照。
, 百拇医药
1.7 显微照相 用日本产OLYMPUS BH1型显微照相系统。
1.8 图像分析 用Mias-2000图象分析系统,对免疫组化反应切片进行定量分析。每张切片分别对大脑皮层、海马CA3区和小脑观察2个视野。视场面积为46 151.811 17 μm2,分别测定阳性面积比[Aa(%)]、平均灰度及阳性细胞个数(n)等参数。
1.9 统计学处理 采有PEMS Ver.2.1进行方差分析。
2 结果
2.1 氯化甲基汞对大鼠不同脑区Fos蛋白表达的影响 光镜下观察,染汞组大鼠脑组织中Fos蛋白免疫组织化学反应物质呈棕黄色颗粒状,位于神经细胞及部分胶质细胞核内,胞浆亦有部分表达。海马CA-3区Fos染色阳性的锥体细胞分布密集,胞体大,呈多角形,阳性着色的核呈圆形或椭圆形,着色深(图1);小脑Fos染色阳性的蒲肯野氏细胞呈单层排列,胞体大,着色较深(图2);皮层阳性神经细胞呈散在分布,皮层的不同层阳性细胞形态各异。正常对照组相应部位仅见少数细胞Fos阳性表达,着色浅(图3)。替代对照及空白对照均未见阳性表达。
, 百拇医药
在图象分析系统下,测定各组Fos表达的阳性面积比[Aa(%)],平均灰度及阳性细胞个数(n)等参数,见表1。经统计学检验,在大脑皮层,低剂量组和高剂量组Aa(%)及n均高于对照组(P<0.05)。在海马CA3区,低剂量组平均灰度及高剂量组Aa(%)和平均灰度与对照组比较,差异有显著性(P<0.05)。在小脑蒲细胞区,低剂量组和高剂量组的平均灰度均低于对照组(P<0.05及P<0.01),Aa(%)高于对照组(P<0.05)。以上结果表明染汞组Fos表达在数量及强度上均高于对照组。
表1 氯化甲基汞对小鼠不同脑区Fos蛋白表达的影响(
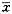 ±s) 组别
±s) 组别大脑皮层
海马CA3区
小脑蒲细胞
, 百拇医药
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
高剂量组
8.45±2.55*
171±2*
, 百拇医药
47±8*
15.17±7.83
136±8
32±13
4.42±0.50Δ
160±13**Δ
9±2
低剂量组
6.66±1.24
189±8
40±6
, 百拇医药
7.27±3.78
149±14
23±10
2.95±0.35
180±7*
8±2
对照组
1.84±1.03
194±12
29±3
3.68±0.93
178±15
, 百拇医药
26±5
2.15±0.49
208±5
5±1
低剂量组:0.6 mg/kg的氯化甲基汞; 高剂量组:6.0 mg/kg的氯化甲基汞; Aa(%):阳性面积比; n:阳性细胞数
与对照组比较,P<0.05,P<0.01; 与低剂量组比较,ΔP<0.05表2 氯化甲基汞对大鼠不同脑区Jun蛋白表达的影响(
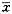 ±s) 组别
±s) 组别大脑皮层
海马CA3区
, 百拇医药
小脑蒲细胞
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
Aa(%)
平均灰度
n
高剂量组
6.76±4.30
166±6*
, 百拇医药
28±1
9.60±2.42
149±10*
30±9
3.37±0.68
158±8ΔΔ
8
±
2
低剂量组
4.54±1.82
175±14*
, 百拇医药
23±2
7.66±2.94
156±12*
28±11
3.16±1.79
184±9
9
±
3
对照组
2.92±1.98
198±12
, http://www.100md.com
26±8
4.42±1.02
174±11
26±8
2.28±0.14
202±2
6
±
1
与对照组比较,P<0.05,P<0.01;与低剂量组比较,ΔP<0.05
2.2 氯化甲基汞对大鼠不同脑区Jun蛋白表达的影响 光镜下观察,各组Jun的表达特点同Fos(图4~6)。经统计学检验,在大脑皮层,低剂量组与高剂量组的平均灰度与对照组相比,差异有显著性(P<0.05)。其他部位Jun的表达规律基本同Fos(见表2)。以上结果表明染汞组Jun的表达在数量及强度上均高于对照组。
, http://www.100md.com
3 讨论
3.1 甲基汞的毒作用及对IEG表达影响的特点 甲基汞属于高神经毒物质,具脂溶性,易透过血脑屏障或胎盘屏障进入成人或胎儿脑组织,引起急性或慢性甲基汞中毒。如1953年在日本发现的“水俣病”。60年代,我国松花江流域的沿江居民也出现过程度不等的甲基汞中毒的表现。甲基汞在脑组织中以原型蓄积,使脑细胞出现退行性变。损害最为严重的部位是小脑和大脑两半球。临床上表现为小脑性共济失调、视野缩小、语言、感觉、听力障碍等。

图1 高汞组海马CA-3区Fos表达(×400)

图2 低汞组小脑Fos表达(×400)

, 百拇医药
图3 对照组海马CA-3区Fos表达(×400)

图4 高汞组海马CA-3区Jun表达(×400)

图5 低汞组小脑Jun表达(×400)

图6 对照组小脑Jun表达(×400)
本实验采用腹腔注射染毒,观察氯化甲基汞对大鼠脑组织即刻早期基因(IEG,包括Fos,Jun等)表达的影响及特点。结果显示:(1)甲基汞可较广泛地作用于各主要脑区,如大脑皮层、海马区、小脑区等,正常对照组上述脑区中IEG的表达量很微小,但在甲基汞作用下,这些脑区的Fos,Jun的表达在数量及强度上均明显增高,且具有统计学意义(P<0.05)。(2)甲基汞主要作用于各脑区的神经细胞和部分胶质细胞,使这些细胞核内的Fos,Jun蛋白呈现高表达。(3)随着甲基汞染毒剂量的增高,Fos和Jun的表达也有不同程度的增高,尤其在小脑区,这种增高有统计学意义(P<0.05)。在本实验条件下表现出一定的剂量-反应(效应)关系。上述结果说明甲基汞可诱导大鼠脑组织中c-fos和c-jun基因的蛋白表达。
, 百拇医药
3.2 甲基汞对IEG表达影响的可能过程和机制 本实验观察的结果提示,甲基汞可诱导Fos,Jun蛋白质的合成产生进一步的神经毒性作用。已有的研究表明,c-fos和c-jun是原癌基因中的两种即早基因(IEG),在正常情况下,神经细胞中有低水平表达。表达产物Fos和Jun蛋白是真核细胞的主要转录因子,两者通过亮氨酸拉链形成异源二聚体激活蛋白-1(AP-1),后者作为转录因子与许多基因的AP-1结合位点或佛波脂(TPA)反应序列结合,影响晚期靶基因的表达,因而,c-fos,c-jun的激活和表达可作为神经活动和基因活动的功能标志[5]。在病理状态下,多种刺激因素如疼痛、禁水、癫痫或脑损伤等伤害性刺激均可引起中枢神经元c-fos,c-jun基因的表达。c-fos mRNA表达高峰在1h,Fos蛋白免疫组化反应最大值在2h[6]。Fos/Jun作为第三信使,通过激活AP-1结合位点完成了从第二信使到晚期基因表达的信号转导。
而c-fos和c-jun的诱导表达本身也经历了比较复杂的一系列级联磷酸化反应。据有关文献报道,在生长因子或分裂素的作用下,可诱导c-fos和c-jun的生成。其过程为:酪氨酸激酶受体可直接影响磷酸酯酶C-γ1(PLC-γ1)的磷酸化;一旦PLC-γ1的特定残基发生磷酸化,即可将磷脂酰肌醇二磷酸盐(PIP2)水解成三磷酸肌醇(IP3)和二酰基甘油酯(DAG);IP3引起胞内储Ca2+释放增加,细胞内游离Ca2+增多,与此同时,Ca2+和DAG均可激活蛋白激酶C(PKC)[7];PKC进一步使Raf-1磷酸化而被激活;活性Raf-1作用于MAPK-K(mitogen-activated protein kinase-kinase),使之磷酸化[8],活性的MAPK-K通过催化Erk酪氨酸和苏氨酸残基磷酸化,而使分裂素激活的蛋白激酶(MAPK)发生活化[9];MAPK促使转录因子p62TCF磷酸化,进一步导致包含有p62TCF的三元复合物(TCF)增高,并诱导表达c-fos和c-jun[8,10]。
, 百拇医药
以往关于汞的研究中已见报道,应用彗星试验可检测出氯化甲基汞和二氯化汞具有DNA损伤作用;而且甲基汞可引起细胞内游离Ca2+增加,IP3生成增多[11]。结合本试验观察到的结果,可初步判断,汞对c-fos和c-jun的诱导是其分子水平毒性作用的重要环节之一,而汞对c-fos和c-jun的诱导过程可能与上述文献的报道的生长因子诱导c-fos和c-jun过程相类似,但其详细机制仍有待于进一步研究证实。
3.3 甲基汞诱导IEG表达的意义及IEG的应用前景 c-fos形态学显示法通常被作为神经系功能活动的形态定位指标,具有检测方便、分辨率高(达单个细胞水平)等优点[12]。但基本上未在神经毒物机制研究和评价中发挥其理想作用。本研究发现IEG的诱导表达既可用于探索甲基汞毒性作用的靶细胞,又有助于定量探讨剂量-效应(反应)关系。提示我们在甲基汞的研究和评价中,IEG具有比较重要的理论意义和潜在的应用价值。
, 百拇医药
此外,在铅神经毒性机制的研究中,也发现IEG可显示铅作用的脑部位和靶细胞,而且随着染铅剂量的增高,IEG的表达也呈增高趋势[13];c-fos,c-jun的表达是铅进一步引起神经细胞凋亡的主要促发因素之一[14]。由此可见,IEG在一些重金属神经毒物的毒性作用过程中,具有不可忽视的影响和作用。而在多种神经毒物毒性评价中,生物标志物(biological markers)的选择和建立是很关键的,且取决于毒性作用机制的研究情况。
根据本研究的结果及目前已探知的IEG诱导表达的机制,本实验室建议,将IEG作为甲基汞神经毒性检测和评价的效应指标,为今后对甲基汞等神经毒物进行危险度评价奠定一定的基础。但其灵敏度、特异度尚需进一步验证。
参考文献
[1] 张遵真,吴德生.氯化甲基汞对大鼠脑毒蕈碱受体的影响.华西医科大学学报,1994,25:388-392.
, 百拇医药
[2] Yangama H,Horigome T,Ichimura T,et al.Differential effects of methylmercury on the phosphorylation of protein species in the brain of acutely intoxicated rats.Toxicology,1994,92:101.
[3] Morgan S,Greenberg ME.The regulation and function of c-fos and other immediate early genes in the nervous system.Neuron,1990,4:477-485.
[4] 包新民,舒斯云著.大鼠脑立体定位图谱.北京:人民卫生出版社,1991.40-135.
[5] 陈宜张,主编.分子神经生物学.北京:人民军医出版社,1995.43.
, 百拇医药
[6] MacDonald MC,Robertson HA,Wilkinson M.Age-and dose-related NMDA induction of FOS-like immunoreactivity and c-fos mRNA in the arcuate nucleus of immature female rats.Dev Brain Res,1993,73:193-198.
[7] Berridge MJ.Inositol trisphosphate and calcium signalling.Nature,1993,361:315-325.
[8] Kolch W,Heldecker G,Kochs G,et al.Protein kinase Ca activates RAF-1 by direct phophorylation.Nature,1993,364:249-252.
, 百拇医药
[9] Kyriakis JM,App H,Zhang XF,et al.Raf-1 activates MAP kinase-kinase.Nature,1992,358:417-421.
[10] Gille H,Sharrocks AD, Shaw PE.Phophorylation of transcription factor p62TCF by MAP kinase stimulates ternary complex formation at c-fos promoter.Nature,1992,358:414-417.
[11] Sarafian TA.Methylmercury increase intracellular Ca2+ and inositol phosphate level in cultured cerebellar granule neurons.J Neurochem,1993,61:648.
[12] 韩济生,主编.神经科学纲要.北京:北京医科大学中国医科大学联合出版社,1993.23-24,272-285.
[13] 李国君,吴德生,肖邦良,等.铅对大鼠不同脑区IEG表达的影响.卫生研究,1999,28:65-69.
[14] 李国君,吴德生,等.铅对中枢神经系统c-Fos,c-Jun及细胞凋亡的影响研究.癌变.畸变.突变,1999:11.322-323.
(收稿日期:2000-01-05), http://www.100md.com