国产司帕沙星两种制剂的生物等效性研究
作者:苗佳 洪诤 梁德荣 徐楠 张辉明 蔡永宁 郑莉 沈奇
单位:华西医科大学附属第一医院临床药理研究所,成都 610041
关键词:司帕沙星;颗粒剂;胶囊剂;生物等效性;RP-HPLC
中国抗生素杂志000417 摘要:12例健康男性志愿受试者采用随机交叉给药方案,分别单剂口服国产司帕沙星颗粒剂和胶囊剂400mg,进行生物等效性研究。用RP-HPLC法测定血清中司帕沙星浓度,试验结果表明:血药浓度-时间数据经3p97程序自动拟合,符合一室模型。颗粒剂和胶囊剂的达峰时间分别为(4.79±0.40)和(4.79±0.33)h,峰浓度分别为(1.55±0.35)和(1.54±0.46)mg/L,AUC0-96分别为(55.31±11.89)和(52.52±13.60)(mg.h)/L。以上药代动力学参数经方差分析无显著性差异(P>0.05)和双单侧t检验(P<0.05),两种制剂具有生物等效性。司帕沙星颗粒剂对胶囊剂的相对生物利用度为106.7%。
, 百拇医药
中图分类号:R969.1 文献标识码:A
文章编号:1001-8689(2000)04-0298-04
Bioequivalent study of two formulations of domestic sparfloxacin
Miao Jia, Hong Zheng, Liang De-rong, Xu Nan, Zhang Hui-ming,Cai Yong-ning, Zheng Li and Sheng Qi
(Institute of Clinical Pharmacology, The First Affiliated Hospital,West China University of Medical Sciences, Chengdu 610041)
, 百拇医药
ABSTRACT The pharmacokinetics of sparfloxacin granule and capsule were determined following a single oral dose of 400mg given to 12 healthy volunteers in an open randomized crossover study. The sparfloxacin concentrations in serum were measured by RP-HPLC. The pharmacokinetic parameters were calculated on the basis of one-compartment model by using 3P97 program. Tmax of domestic sparfloxacin granule and capsule were (4.79±0.40) and (4.79±0.33)h; Cmax were (1.55±0.35) and (1.54±0.46)mg/L; AUC0-96 were (55.31±11.89) and (52.52±13.60)(mg.h)/L respectively. The pharmacokinetic parameters obtained from our studies showed no significant differences between two products. The relative bioavailability of sparfloxacin granule to capsule was 106.7%, so it demonstrated that both formulations were bioequivalent.
, 百拇医药
KEY WORDS Sparfloxacin; Granule; Capsule; Bioequivalence; RP-HPLC
司帕沙星(sparfloxacin,SPLX)是新型广谱氟喹诺酮类抗菌药,具有口服吸收良好,组织分布广泛,血浆蛋白结合力低,细胞内渗透性强,消除半衰期长等药动学特点。它不仅对革兰氏阴性菌有强大抗菌活性,对包括耐甲氧西林金葡球菌(MRSA)和肺炎链球菌的革兰氏阳性菌也有效,还对一些非典型病原菌如厌氧菌、嗜肺军团菌、枝原体、衣原体、结核杆菌及非定型抗酸杆菌等也显示出很强的抗菌效力[1,2]。国产SPLX胶囊和片剂已用于临床,为掩盖药物苦味,四川省健益医药工业研究所与浙江海正药业股份有限公司又研制了包衣速释颗粒剂。本文采用RP-HPLC法,测定了12例健康男性志愿受试者口服SPLX颗粒剂与胶囊剂400mg后血浆中药物浓度,计算其主要药代动力学参数和相对生物利用度,以进行生物等效性评价。
1 材料与方法
, http://www.100md.com
1.1 受试对象
12名健康男性志愿受试者,年龄(20.92±0.67)岁,体重(66.00±5.22)kg,身高(170.42±4.83)cm;经全面健康体检合格;血尿常规、肝肾功能和心电图检查均正常;签署知情同意书后纳入本研究。受试者既往体健,无药物过敏史,无吸烟、嗜酒及经常用药史,四周内未参加其它药物试验,三月内未用过已知对脏器有损害的药物,无其它影响药物吸收、分布、排泄等因素。试验方案经华西医科大学附属第一医院医学伦理委员会批准。
1.2 试验药品与试剂
SPLX颗粒剂,每包100mg,四川省健益医药工业研究所与浙江海正药业股份有限公司研制,批号980802,有效期一年半。SPLX胶囊,每粒100mg,成都倍特药业有限公司生产,批号980202,有效期一年半。SPLX标准对照品,由成都倍特药业有限公司提供,纯度98.9%,批号A30-980506。
, 百拇医药
所用试剂乙酸铵、乙腈、冰乙酸均为分析纯。
1.3 研究方法
采用随机自身交叉对照试验,将12例受试者随机均分为两组,交叉口服SPLX颗粒剂与胶囊剂400mg,两次给药时间间隔两周。受试者于试验前日晚7时后禁食,次日晨空腹用200ml温开水顿服药物,服药后3h始能进食,服药当日均统一用低脂标准餐。受试期间禁止吸烟、饮酒及饮用含酒精、咖啡因类饮料,禁止剧烈活动。试验前两周内及试验期间禁服一切非试验药物。
1.4 样品采集与处理
每例受试者均于服药前0.5h在前臂静脉安置留置针,抽取空白血样3ml。并分别于服药后0.5、2、3、4、4.5、5、5.5、6、8、12、24、48、72、96h采血3ml,血标本收集于肝素抗凝管内,室温静置后离心分离血浆,血浆样本置-20℃低温冰箱避光保存备测。
, http://www.100md.com
1.5 血药浓度测定
1.5.1 仪器与色谱条件 高效液相色谱仪为日本岛津LC-6A型,包括LC-6A高压泵、7125型进样阀附20μl进样环、SPD-6AV可变波长紫外检测器及CTO-6AV恒温箱,CR-3A色谱数据处理机。
色谱柱:Spherisorb C18色谱柱(200mm×4.6mm,5μm)由大连化学物理所生产,柱温40℃。流动相:0.2mol/L乙酸铵溶液(用冰乙酸调pH为2.57)∶乙腈(70∶30),流速1.0ml/min。紫外检测波长298nm。
1.5.2 血浆样品测定 取血浆标本0.5ml置10ml具塞试管中,加入乙腈0.5ml于旋涡混合器上混合1min以沉淀蛋白,离心(3000r/min)10min,上清液经针头式滤膜过滤后,取20μl滤液直接进样分析,以外标法峰面积定量。色谱图见图1。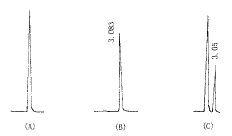
, http://www.100md.com
A:空白血样色谱图; B:标准对照品(2.1mg/L)色谱图;
C:志愿受试者服药后5h血样色谱图
图1 SPLX血样色谱图
1.5.3 标准曲线 精密称定SPLX标准对照品适量,用流动相稀释成标准贮备液,用空白血浆制成每1ml浓度分别为0.07、0.14、0.35、0.70、1.40、2.10和2.80mg/L的样品,按血浆样本处理与测定,其回归方程为Y=-97.25+7680.52X,r=0.9999,线性范围为0.07~2.8mg/L(图2)。血样最低检出浓度为0.02mg/L。
图2 SPLX血浆标准曲线
1.5.4 方法回收率与精密度实验 本法血浆样本方法回收率为94.28%~101.24%,平均99.03%,日内变异系数为1.08%~3.39%,日间变异系数为0.99%~5.44%(表1)。
, http://www.100md.com
表1 血浆中SPLX测定的方法回收率与精密度 浓度
(mg/L)
回收率(n=5)
(%)
日内偏差(n=5)
日间偏差(n=5)
RSD (%)
RSD (%)
0.14
94.28
3.39
5.44
, 百拇医药
0.35
98.86
1.08
2.45
1.40
101.00
1.38
2.02
2.10
101.24
1.08
1.43
2.80
, http://www.100md.com
99.78
1.31
0.99
1.6 数据处理
采用中国药理学会数学药理专业委员会编制的3P97药代动力学计算程序,对血药浓度-时间数据进行药代动力学参数计算,以梯形法计算药时曲线下面积(AUC0-96),求出司帕沙星颗粒剂对胶囊剂的相对生物利用度(F):
通过方差分析和双单侧t检验,对经对数转换的主要药代动力学参数进行统计学处理,以评价两种制剂的生物等效性[3]。
2 结果
, http://www.100md.com
2.1 药代动力学研究
12例健康志愿受试者交叉单剂口服国产司帕沙星颗粒剂或胶囊剂400mg后,其平均血药浓度-时间数据经3P97程序自动拟合,符合一室模型(图3)。两种制剂血药浓度-时间曲线基本一致。
图3 志愿受试者口服SPLX 400mg后血药浓度-时间曲线
1:SPLX颗粒剂; 2:SPLX胶囊
受试者口服SPLX颗粒剂和胶囊剂400mg后,分别经(4.79±0.40)和(4.79±0.33)h达峰浓度(1.55±0.35)和(1.54±0.46)mg/L,消除半衰期分别为(22.78±5.08)和(23.82±3.39)h,用梯形法计算,AUC0-96分别为(55.31±11.89)和(52.52±13.60)(mg.h)/L。主要药代动力学参数见表2,数据值与文献报道值相近[4~6]。
, 百拇医药
表2 志愿受试者口服SPLX 400mg后药代动力学参数
药代动力学参数
司帕沙星颗粒剂
司帕沙星胶囊
t1/2ka(h)
1.83±0.42
1.28±0.34
t1/2ke(h)
22.78±5.08
23.82±3.39
tlag(h)
, 百拇医药
0.27±0.13
0.25±0.13
Tmax(h)
4.79±0.40
4.79±0.33
Cmax(mg/L)
1.55±0.35
1.54±0.46
AUC0-96[(mg.h)/L]
55.31±11.89
, http://www.100md.com 52.52±13.60
AUC0-inf (mg.h)/L]
56.74±11.81
54.72±13.57
V/Fc(L)
234.71±52.16
269.89±87.87
CLs(L/h)
7.38±2.10
7.85±2.31
2.2 相对生物利用度结果
, http://www.100md.com
受试者交叉口服SPLX颗粒剂和胶囊剂400mg后,用血药浓度-时间曲线下面积AUC0-96计算相对生物利用度。 由每名受试者计算的SPLX颗粒剂的相对生物利用度平均为(106.7±8.4)%(96.1%~120.5%)。由AUC0-96均数直接算得的生物利用度为105.31%,两者基本相同。
2.3 统计分析
将SPLX颗粒剂和胶囊剂的AUC0-96、Cmax和Tmax值经对数转换后进行多因素方差分析、双单侧t检验及等效界值法计算,结果表明两种制剂间方差分析无显著性差异,lnAUC:F=0.2832,F0.05=5.591;lnCmax:F=0.6189,F0.05=5.591;lnTmax:F=0.0017,F0.05=5.591。双单侧t检验合格,lnAUC:t1=12.211,t2=6.912;lnCmax:t1=6.854,t2=5.271;lnTmax:t1=9.087,t2=9.172,均大于t0.05(1.812)。AUC0-96、Cmax和Tmax的90%置信区间分别为102.0%~111.0%、96.3%~110.0%和95.6%~104.4%,均符合80%~125%范围,故可认为两种制剂生物等效。
, 百拇医药
3 讨论
SPLX作为近年研制的新型广谱、长效氟喹诺酮类抗菌药,由于在母核氧代喹啉骨架的5位引入了氨基,6、8位有氟,7位引入了3,5-二甲基哌嗪基,使该药在保持对革兰氏阴性菌显著抗菌活性的基础上,对革兰氏阳性菌的抗菌活性亦明显增强。本品对包括MRSA的葡萄球菌属、肺炎链球菌、嗜肺军团菌、厌氧菌、枝原体、衣原体及结核分枝杆菌等均显示出很强的抗菌活性,并具有口服吸收好、组织分布广、消除半衰期长等良好的药代动力学特点[2]。
国外人体药代动力学研究资料显示[4~6],健康志愿受试者空腹单剂口服SPLX 400mg后,于2.05~5h达血药峰浓度1.18~1.60mg/L,消除半衰期为15.4~24.1h,药-时曲线下面积为(32.3~41.6)(mg.h)/L。本文12例健康志愿受试者空腹单剂口服国产SPLX颗粒剂与胶囊剂400mg后,其体内过程符合一室模型,主要药代动力学参数与国外文献一致,分别经(4.79±0.40)和(4.79±0.33)h达峰浓度(1.55±0.35)和(1.54±0.46)mg/L,消除半衰期分别为(22.78±5.08)和(23.82±3.39)h。且两种制剂间比较无显著性差异,表明两者在人体内吸收、分布、消除等性质较接近。
, http://www.100md.com
单剂口服SPLX颗粒剂与胶囊400mg后药时曲线下面积(AUC0-96)分别为(55.31±11.89)和(52.52±13.60)(mg*h)/L。SPLX颗粒剂相对于胶囊的生物利用度为(106.7±8.4)%,经方差分析和双单侧t检验证明两种制剂在人体具有生物等效性。
作者简介:苗佳:女,生于1971年,主治医师
参考文献
[1] 吴永乐. 新氟喹诺酮抗菌药[J]. 国外医药抗生素分册,1996;17(1):51
[2] 许铁男. 长半衰期新喹诺酮类抗菌剂司帕沙星[J]. 国外医药抗生素分册,1995;16(3):238
[3] 黄圣凯,韩可勤. 生物等效性评价的几种方法[J]. 中国临床药理学杂志,1993;9:43
, 百拇医药
[4] Shimada J, Nogita T, Ishibashi Y. Clinical pharmacokinetics of sparfloxacin [J]. Clin Pharmacokinet,1993;25(5):358
[5] Montay G, Bruno R, Vergniol J C, et al. Pharmacokinetics of sparfloxacin in humans after single oral administration at doses of 200, 400, 600, and 800mg [J]. J Clin Pharmacol,1994;34:1071
[6] Goa K L, Bryson H M, Markham A. Sparfloxacin: a review of its antibacterial activity, pharmacokinetic properties, clinical efficacy and tolerability in lower respiratory tract infections [J]. Drugs,1997;53(4):700
收稿日期:1999-11-24, http://www.100md.com
单位:华西医科大学附属第一医院临床药理研究所,成都 610041
关键词:司帕沙星;颗粒剂;胶囊剂;生物等效性;RP-HPLC
中国抗生素杂志000417 摘要:12例健康男性志愿受试者采用随机交叉给药方案,分别单剂口服国产司帕沙星颗粒剂和胶囊剂400mg,进行生物等效性研究。用RP-HPLC法测定血清中司帕沙星浓度,试验结果表明:血药浓度-时间数据经3p97程序自动拟合,符合一室模型。颗粒剂和胶囊剂的达峰时间分别为(4.79±0.40)和(4.79±0.33)h,峰浓度分别为(1.55±0.35)和(1.54±0.46)mg/L,AUC0-96分别为(55.31±11.89)和(52.52±13.60)(mg.h)/L。以上药代动力学参数经方差分析无显著性差异(P>0.05)和双单侧t检验(P<0.05),两种制剂具有生物等效性。司帕沙星颗粒剂对胶囊剂的相对生物利用度为106.7%。
, 百拇医药
中图分类号:R969.1 文献标识码:A
文章编号:1001-8689(2000)04-0298-04
Bioequivalent study of two formulations of domestic sparfloxacin
Miao Jia, Hong Zheng, Liang De-rong, Xu Nan, Zhang Hui-ming,Cai Yong-ning, Zheng Li and Sheng Qi
(Institute of Clinical Pharmacology, The First Affiliated Hospital,West China University of Medical Sciences, Chengdu 610041)
, 百拇医药
ABSTRACT The pharmacokinetics of sparfloxacin granule and capsule were determined following a single oral dose of 400mg given to 12 healthy volunteers in an open randomized crossover study. The sparfloxacin concentrations in serum were measured by RP-HPLC. The pharmacokinetic parameters were calculated on the basis of one-compartment model by using 3P97 program. Tmax of domestic sparfloxacin granule and capsule were (4.79±0.40) and (4.79±0.33)h; Cmax were (1.55±0.35) and (1.54±0.46)mg/L; AUC0-96 were (55.31±11.89) and (52.52±13.60)(mg.h)/L respectively. The pharmacokinetic parameters obtained from our studies showed no significant differences between two products. The relative bioavailability of sparfloxacin granule to capsule was 106.7%, so it demonstrated that both formulations were bioequivalent.
, 百拇医药
KEY WORDS Sparfloxacin; Granule; Capsule; Bioequivalence; RP-HPLC
司帕沙星(sparfloxacin,SPLX)是新型广谱氟喹诺酮类抗菌药,具有口服吸收良好,组织分布广泛,血浆蛋白结合力低,细胞内渗透性强,消除半衰期长等药动学特点。它不仅对革兰氏阴性菌有强大抗菌活性,对包括耐甲氧西林金葡球菌(MRSA)和肺炎链球菌的革兰氏阳性菌也有效,还对一些非典型病原菌如厌氧菌、嗜肺军团菌、枝原体、衣原体、结核杆菌及非定型抗酸杆菌等也显示出很强的抗菌效力[1,2]。国产SPLX胶囊和片剂已用于临床,为掩盖药物苦味,四川省健益医药工业研究所与浙江海正药业股份有限公司又研制了包衣速释颗粒剂。本文采用RP-HPLC法,测定了12例健康男性志愿受试者口服SPLX颗粒剂与胶囊剂400mg后血浆中药物浓度,计算其主要药代动力学参数和相对生物利用度,以进行生物等效性评价。
1 材料与方法
, http://www.100md.com
1.1 受试对象
12名健康男性志愿受试者,年龄(20.92±0.67)岁,体重(66.00±5.22)kg,身高(170.42±4.83)cm;经全面健康体检合格;血尿常规、肝肾功能和心电图检查均正常;签署知情同意书后纳入本研究。受试者既往体健,无药物过敏史,无吸烟、嗜酒及经常用药史,四周内未参加其它药物试验,三月内未用过已知对脏器有损害的药物,无其它影响药物吸收、分布、排泄等因素。试验方案经华西医科大学附属第一医院医学伦理委员会批准。
1.2 试验药品与试剂
SPLX颗粒剂,每包100mg,四川省健益医药工业研究所与浙江海正药业股份有限公司研制,批号980802,有效期一年半。SPLX胶囊,每粒100mg,成都倍特药业有限公司生产,批号980202,有效期一年半。SPLX标准对照品,由成都倍特药业有限公司提供,纯度98.9%,批号A30-980506。
, 百拇医药
所用试剂乙酸铵、乙腈、冰乙酸均为分析纯。
1.3 研究方法
采用随机自身交叉对照试验,将12例受试者随机均分为两组,交叉口服SPLX颗粒剂与胶囊剂400mg,两次给药时间间隔两周。受试者于试验前日晚7时后禁食,次日晨空腹用200ml温开水顿服药物,服药后3h始能进食,服药当日均统一用低脂标准餐。受试期间禁止吸烟、饮酒及饮用含酒精、咖啡因类饮料,禁止剧烈活动。试验前两周内及试验期间禁服一切非试验药物。
1.4 样品采集与处理
每例受试者均于服药前0.5h在前臂静脉安置留置针,抽取空白血样3ml。并分别于服药后0.5、2、3、4、4.5、5、5.5、6、8、12、24、48、72、96h采血3ml,血标本收集于肝素抗凝管内,室温静置后离心分离血浆,血浆样本置-20℃低温冰箱避光保存备测。
, http://www.100md.com
1.5 血药浓度测定
1.5.1 仪器与色谱条件 高效液相色谱仪为日本岛津LC-6A型,包括LC-6A高压泵、7125型进样阀附20μl进样环、SPD-6AV可变波长紫外检测器及CTO-6AV恒温箱,CR-3A色谱数据处理机。
色谱柱:Spherisorb C18色谱柱(200mm×4.6mm,5μm)由大连化学物理所生产,柱温40℃。流动相:0.2mol/L乙酸铵溶液(用冰乙酸调pH为2.57)∶乙腈(70∶30),流速1.0ml/min。紫外检测波长298nm。
1.5.2 血浆样品测定 取血浆标本0.5ml置10ml具塞试管中,加入乙腈0.5ml于旋涡混合器上混合1min以沉淀蛋白,离心(3000r/min)10min,上清液经针头式滤膜过滤后,取20μl滤液直接进样分析,以外标法峰面积定量。色谱图见图1。

, http://www.100md.com
A:空白血样色谱图; B:标准对照品(2.1mg/L)色谱图;
C:志愿受试者服药后5h血样色谱图
图1 SPLX血样色谱图
1.5.3 标准曲线 精密称定SPLX标准对照品适量,用流动相稀释成标准贮备液,用空白血浆制成每1ml浓度分别为0.07、0.14、0.35、0.70、1.40、2.10和2.80mg/L的样品,按血浆样本处理与测定,其回归方程为Y=-97.25+7680.52X,r=0.9999,线性范围为0.07~2.8mg/L(图2)。血样最低检出浓度为0.02mg/L。

图2 SPLX血浆标准曲线
1.5.4 方法回收率与精密度实验 本法血浆样本方法回收率为94.28%~101.24%,平均99.03%,日内变异系数为1.08%~3.39%,日间变异系数为0.99%~5.44%(表1)。
, http://www.100md.com
表1 血浆中SPLX测定的方法回收率与精密度 浓度
(mg/L)
回收率(n=5)
(%)
日内偏差(n=5)
日间偏差(n=5)
RSD (%)
RSD (%)
0.14
94.28
3.39
5.44
, 百拇医药
0.35
98.86
1.08
2.45
1.40
101.00
1.38
2.02
2.10
101.24
1.08
1.43
2.80
, http://www.100md.com
99.78
1.31
0.99
1.6 数据处理
采用中国药理学会数学药理专业委员会编制的3P97药代动力学计算程序,对血药浓度-时间数据进行药代动力学参数计算,以梯形法计算药时曲线下面积(AUC0-96),求出司帕沙星颗粒剂对胶囊剂的相对生物利用度(F):

通过方差分析和双单侧t检验,对经对数转换的主要药代动力学参数进行统计学处理,以评价两种制剂的生物等效性[3]。
2 结果
, http://www.100md.com
2.1 药代动力学研究
12例健康志愿受试者交叉单剂口服国产司帕沙星颗粒剂或胶囊剂400mg后,其平均血药浓度-时间数据经3P97程序自动拟合,符合一室模型(图3)。两种制剂血药浓度-时间曲线基本一致。

图3 志愿受试者口服SPLX 400mg后血药浓度-时间曲线
1:SPLX颗粒剂; 2:SPLX胶囊
受试者口服SPLX颗粒剂和胶囊剂400mg后,分别经(4.79±0.40)和(4.79±0.33)h达峰浓度(1.55±0.35)和(1.54±0.46)mg/L,消除半衰期分别为(22.78±5.08)和(23.82±3.39)h,用梯形法计算,AUC0-96分别为(55.31±11.89)和(52.52±13.60)(mg.h)/L。主要药代动力学参数见表2,数据值与文献报道值相近[4~6]。
, 百拇医药
表2 志愿受试者口服SPLX 400mg后药代动力学参数
药代动力学参数
司帕沙星颗粒剂
司帕沙星胶囊
t1/2ka(h)
1.83±0.42
1.28±0.34
t1/2ke(h)
22.78±5.08
23.82±3.39
tlag(h)
, 百拇医药
0.27±0.13
0.25±0.13
Tmax(h)
4.79±0.40
4.79±0.33
Cmax(mg/L)
1.55±0.35
1.54±0.46
AUC0-96[(mg.h)/L]
55.31±11.89
, http://www.100md.com 52.52±13.60
AUC0-inf (mg.h)/L]
56.74±11.81
54.72±13.57
V/Fc(L)
234.71±52.16
269.89±87.87
CLs(L/h)
7.38±2.10
7.85±2.31
2.2 相对生物利用度结果
, http://www.100md.com
受试者交叉口服SPLX颗粒剂和胶囊剂400mg后,用血药浓度-时间曲线下面积AUC0-96计算相对生物利用度。 由每名受试者计算的SPLX颗粒剂的相对生物利用度平均为(106.7±8.4)%(96.1%~120.5%)。由AUC0-96均数直接算得的生物利用度为105.31%,两者基本相同。
2.3 统计分析
将SPLX颗粒剂和胶囊剂的AUC0-96、Cmax和Tmax值经对数转换后进行多因素方差分析、双单侧t检验及等效界值法计算,结果表明两种制剂间方差分析无显著性差异,lnAUC:F=0.2832,F0.05=5.591;lnCmax:F=0.6189,F0.05=5.591;lnTmax:F=0.0017,F0.05=5.591。双单侧t检验合格,lnAUC:t1=12.211,t2=6.912;lnCmax:t1=6.854,t2=5.271;lnTmax:t1=9.087,t2=9.172,均大于t0.05(1.812)。AUC0-96、Cmax和Tmax的90%置信区间分别为102.0%~111.0%、96.3%~110.0%和95.6%~104.4%,均符合80%~125%范围,故可认为两种制剂生物等效。
, 百拇医药
3 讨论
SPLX作为近年研制的新型广谱、长效氟喹诺酮类抗菌药,由于在母核氧代喹啉骨架的5位引入了氨基,6、8位有氟,7位引入了3,5-二甲基哌嗪基,使该药在保持对革兰氏阴性菌显著抗菌活性的基础上,对革兰氏阳性菌的抗菌活性亦明显增强。本品对包括MRSA的葡萄球菌属、肺炎链球菌、嗜肺军团菌、厌氧菌、枝原体、衣原体及结核分枝杆菌等均显示出很强的抗菌活性,并具有口服吸收好、组织分布广、消除半衰期长等良好的药代动力学特点[2]。
国外人体药代动力学研究资料显示[4~6],健康志愿受试者空腹单剂口服SPLX 400mg后,于2.05~5h达血药峰浓度1.18~1.60mg/L,消除半衰期为15.4~24.1h,药-时曲线下面积为(32.3~41.6)(mg.h)/L。本文12例健康志愿受试者空腹单剂口服国产SPLX颗粒剂与胶囊剂400mg后,其体内过程符合一室模型,主要药代动力学参数与国外文献一致,分别经(4.79±0.40)和(4.79±0.33)h达峰浓度(1.55±0.35)和(1.54±0.46)mg/L,消除半衰期分别为(22.78±5.08)和(23.82±3.39)h。且两种制剂间比较无显著性差异,表明两者在人体内吸收、分布、消除等性质较接近。
, http://www.100md.com
单剂口服SPLX颗粒剂与胶囊400mg后药时曲线下面积(AUC0-96)分别为(55.31±11.89)和(52.52±13.60)(mg*h)/L。SPLX颗粒剂相对于胶囊的生物利用度为(106.7±8.4)%,经方差分析和双单侧t检验证明两种制剂在人体具有生物等效性。
作者简介:苗佳:女,生于1971年,主治医师
参考文献
[1] 吴永乐. 新氟喹诺酮抗菌药[J]. 国外医药抗生素分册,1996;17(1):51
[2] 许铁男. 长半衰期新喹诺酮类抗菌剂司帕沙星[J]. 国外医药抗生素分册,1995;16(3):238
[3] 黄圣凯,韩可勤. 生物等效性评价的几种方法[J]. 中国临床药理学杂志,1993;9:43
, 百拇医药
[4] Shimada J, Nogita T, Ishibashi Y. Clinical pharmacokinetics of sparfloxacin [J]. Clin Pharmacokinet,1993;25(5):358
[5] Montay G, Bruno R, Vergniol J C, et al. Pharmacokinetics of sparfloxacin in humans after single oral administration at doses of 200, 400, 600, and 800mg [J]. J Clin Pharmacol,1994;34:1071
[6] Goa K L, Bryson H M, Markham A. Sparfloxacin: a review of its antibacterial activity, pharmacokinetic properties, clinical efficacy and tolerability in lower respiratory tract infections [J]. Drugs,1997;53(4):700
收稿日期:1999-11-24, http://www.100md.com