缺氧时肺动脉内皮细胞生长状态的变化
作者:洪欣 尹昭云 孙兴斌 昝俊平 谢印芝 吕永达
单位:军事医学科学院卫生学环境医学研究所,天津 300050
关键词:缺氧;脉动脉;内皮细胞;细胞周期;因子Ⅷ;抗原;生长曲线
航天医学与医学工程000413摘要: 目的 研究低氧时内皮细胞生长状态的变化,以揭示缺氧性肺水肿的发生机制。 方法 利用体外培养的肺动脉内皮细胞(PAEC),观察了在缺氧条件(3%O2)下,PAEC的生长曲线、细胞周期及细胞内特征性蛋白因子的变化,对PAEC的生长状态进行了质和量综合评价。 结果 在观察的48 h范围内,缺氧对PAEC的生长数量无明显影响(P>0.05)。细胞的S期在缺氧2 h时出现了一过性的增加,同时G0/G1期出现了一过性的降低(P<0.05)。但随着缺氧时间的延长,PAEC的各个生长周期均无明显变化(P>0.05)。因子Ⅷ相关抗原(ⅧR:Ag)阳性细胞数在缺氧过程中均呈明显下降(P<0.05或P<0.01)。 结论 缺氧时,虽然PAEC在生长数量和生长周期上无明显变化,但生长质量出现了明显的下降,这将影响其功能状态,降低血管屏障作用的发挥。
, 百拇医药
中图分类号:R364.4,R852.11 文献标识码:A 文章编号:1002-0837(2000)04-0290-04
Effects of Hypoxia on the Growth of Pulmonary Artery Endothelial Cell
HONG Xin YIN Zhao-yun SUN Xing-bin JIU Jun-ping XIE Yin-zhi LU Yong-da
(Institute of Hygiene and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050,China)
Abstract: Objective To study the effects of hypoxia on the growth of pulmonary artery endothelialcell(PAEC). Method Growth number, growth cycle phase, and the characteristics of endothelial cells(factor Ⅷ related antigen) of PAEC were investigated during hypoxia using the PAEC cultured in vitro as a model. Result No difference was found between growth numbers of PAEC under hypoxia and that under normoxia conditions during the culture of 48 h(P>0.05). The numbers of positive immunofluoescence PAEC of factor Ⅷ related antigen in hypoxic groups were lower than those in normoxic groups.The cell cycle phase figures showed that the DNA synthetic phase (S phase) in hypoxia 2 hour group was increased significantly, while the pre-synthetic phase(G0/G1) was decreased as compared with that of normoxic group. However, the S,G2M(gap2 and mitotic phase) or G1/G0 stage of hypoxia for 12, 24 or 48 hours group all had no change as compared with those of normoxic group. Conclusion Growth of the PAEC changed significantly during hypoxia. Although the quantity and the growth cycle of PAEC showed little change, the quality was degraded seriously that its function as a permeability barrier would be affected.
, 百拇医药
Key words: hypoxia;pulmonary artery;endothelial cells;growth cycle;factor Ⅷ;antigen;growth curve
内皮细胞是覆衬于全身血管和淋巴管内面的单层扁平细胞,具有多种生理功能,它做为组织与血液间的第一道屏障在血管通透性调节中发挥重要作用[1,2]。内皮细胞生长状态的好坏是其能否执行这些功能的先决条件。所以,在缺氧条件下,研究内皮细胞尤其是肺动脉内皮细胞(PAEC)的生长状态变化,对于探讨缺氧血管通透性改变相关疾病如缺氧性肺水肿的发病机制具有重要意义。以往研究多集中在细胞数量上,很少注意细胞生长质量的内在变化[3,4]。本文在观察细胞生长数量的同时,研究了细胞周期和内皮细胞特征性蛋白因子的变化,对PAEC在缺氧状态下的生长状态进行了较为全面系统的评价。
方 法
, http://www.100md.com
PAEC的体外培养[5] 选用肉联厂检疫合格的健康成年猪,1.0~1.5岁,体重100~150 kg,雌雄不限,活杀后,在相对无菌条件下分离肺动脉,并将游离下来的血管放入无菌D-Hank's液,4℃保存,2~3 h内培养。以0.25%胰蛋白酶消化内皮细胞,750 g,离心消化液10 min。弃上清,向离心管加入M199培养液(含有20%胎牛血清,10 mmol/l HEPES,双抗1 ml/dl, pH 7.0)将细胞制成悬液,吸取0.2 ml细胞悬液用0.4%台盼蓝染色后,计活细胞数,调整细胞浓度至105 cells/ml接种于培养瓶中,放入37℃、5%CO2、饱和湿度的CO2培养箱内培养。定时换液并观察细胞生长情况,长成单层后及时传代。在相差显微镜下从形态学上对细胞进行鉴定,同时根据Jaff法从免疫学上对细胞进一步鉴定[7]。
实验分组 选取5~10代生长良好融合单层的PAEC,以105 cells/ml密度接种于培养瓶中,待细胞长成融合单层时,更换含10%胎牛血清的培养液,随机分为缺氧组和对照组,分别观察2、12、24和48 h PAEC生长曲线、ⅧR:Ag和细胞周期的变化。缺氧组的实验条件为3%O2、92%N2、5%CO2、饱和湿度;对照组的实验条件为21%O2、74%N2,其余条件与缺氧组相同。生长曲线测定:取各时间点的内皮细胞,消化制成细胞悬液,染色计数,求出均值。以培养天数为横坐标,细胞数为纵坐标,绘出生长曲线。
, 百拇医药
ⅧR:Ag的测定 根据Jaff法对ⅧR:Ag进行荧光染色,细胞终浓度不小于106 cells/ml。检测前用300目尼龙滤网过滤,将细胞制成单细胞悬液,用流式细胞仪测定PAEC的ⅧR:Ag荧光阳性细胞数。仪器条件:FACS-440型流式细胞仪(美国Becton-Dickinson公司),SW氩离子激光器,输出功率0.26 W,激发光波长488 nm。前置滤光片,使光电倍增管接收绿色免疫荧光,用戊二醛固定的鸡血细胞校正仪器,使仪器CV值稳定在3%以内。改变前向角以去除细胞碎片的干扰,每个样品记数1万个细胞,从中分析大小形态在正常范围内的8700左右内皮细胞,采用PDP11/73计算机Log单参数1024道直方图实时收集处理数据。
细胞周期测定 真核细胞的细胞周期主要分为4个时期,即DNA合成前期(G1期)、合成期(S)、合成后期(G2期)和分裂期(M期),此外还有G0期,G0期的细胞暂不分裂。在细胞周期中,G0、G1期细胞的DNA含量是相同的,都是二倍体。G2与M期的DNA含量也是相同的都是四倍体,S期介于两者之间。通常在一个非同步生长的细胞群体中,总是G1期细胞最多,S期次之, G2、M期细胞最少。细胞所在的周期不同,细胞内染色体DNA含量不同,流式细胞仪根据DNA荧光强度来分析DNA的含量,从而确定各细胞周期的细胞所占比例。首先将各组的细胞悬液用70%洒精固定,碘化丙啶(PI)对细胞内DNA染色流式细胞仪分析细胞时,前置不同的滤光片,使光电倍增管接受PI发出的红色荧光。每个样品采集1万个细胞,根据每个细胞的荧光强度绘制出荧光强度频数分布图,计算机统计G0 /G1,S,G2 、M期等细胞周期中,各类细胞所占的百分比。
, 百拇医药
结 果
生长曲线的变化 在各培养时间取出细胞,对细胞进行计数后,绘出细胞生长曲线(图1)。无论是在缺氧或是常氧条件下,两组细胞在48 h观察范围内生长数量无明显差异(P>0.05)。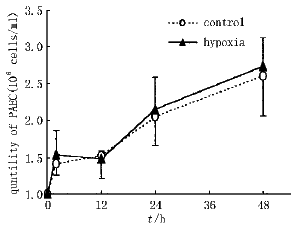
摘要: 目的 研究低氧时内皮细胞生长状态的变化,以揭示缺氧性肺水肿的发生机制。 方法 利用体外培养的肺动脉内皮细胞(PAEC),观察了在缺氧条件(3%O2)下,PAEC的生长曲线、细胞周期及细胞内特征性蛋白因子的变化,对PAEC的生长状态进行了质和量综合评价。 结果 在观察的48 h范围内,缺氧对PAEC的生长数量无明显影响(P>0.05)。细胞的S期在缺氧2 h时出现了一过性的增加,同时G0/G1期出现了一过性的降低(P<0.05)。但随着缺氧时间的延长,PAEC的各个生长周期均无明显变化(P>0.05)。因子Ⅷ相关抗原(ⅧR:Ag)阳性细胞数在缺氧过程中均呈明显下降(P<0.05或P<0.01)。 结论 缺氧时,虽然PAEC在生长数量和生长周期上无明显变化,但生长质量出现了明显的下降,这将影响其功能状态,降低血管屏障作用的发挥。
, http://www.100md.com
中图分类号:R364.4,R852.11 文献标识码:A 文章编号:1002-0837(2000)04-0290-04
Effects of Hypoxia on the Growth of Pulmonary Artery Endothelial Cell
HONG Xin YIN Zhao-yun SUN Xing-bin JIU Jun-ping XIE Yin-zhi LU Yong-da
(Institute of Hygiene and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050,China)
Abstract: Objective To study the effects of hypoxia on the growth of pulmonary artery endothelialcell(PAEC). Method Growth number, growth cycle phase, and the characteristics of endothelial cells(factor Ⅷ related antigen) of PAEC were investigated during hypoxia using the PAEC cultured in vitro as a model. Result No difference was found between growth numbers of PAEC under hypoxia and that under normoxia conditions during the culture of 48 h(P>0.05). The numbers of positive immunofluoescence PAEC of factor Ⅷ related antigen in hypoxic groups were lower than those in normoxic groups.The cell cycle phase figures showed that the DNA synthetic phase (S phase) in hypoxia 2 hour group was increased significantly, while the pre-synthetic phase(G0/G1) was decreased as compared with that of normoxic group. However, the S,G2M(gap2 and mitotic phase) or G1/G0 stage of hypoxia for 12, 24 or 48 hours group all had no change as compared with those of normoxic group. Conclusion Growth of the PAEC changed significantly during hypoxia. Although the quantity and the growth cycle of PAEC showed little change, the quality was degraded seriously that its function as a permeability barrier would be affected.
, 百拇医药
Key words: hypoxia;pulmonary artery;endothelial cells;growth cycle;factor Ⅷ;antigen;growth curve
内皮细胞是覆衬于全身血管和淋巴管内面的单层扁平细胞,具有多种生理功能,它做为组织与血液间的第一道屏障在血管通透性调节中发挥重要作用[1,2]。内皮细胞生长状态的好坏是其能否执行这些功能的先决条件。所以,在缺氧条件下,研究内皮细胞尤其是肺动脉内皮细胞(PAEC)的生长状态变化,对于探讨缺氧血管通透性改变相关疾病如缺氧性肺水肿的发病机制具有重要意义。以往研究多集中在细胞数量上,很少注意细胞生长质量的内在变化[3,4]。本文在观察细胞生长数量的同时,研究了细胞周期和内皮细胞特征性蛋白因子的变化,对PAEC在缺氧状态下的生长状态进行了较为全面系统的评价。
方 法
, 百拇医药
PAEC的体外培养[5] 选用肉联厂检疫合格的健康成年猪,1.0~1.5岁,体重100~150 kg,雌雄不限,活杀后,在相对无菌条件下分离肺动脉,并将游离下来的血管放入无菌D-Hank's液,4℃保存,2~3 h内培养。以0.25%胰蛋白酶消化内皮细胞,750 g,离心消化液10 min。弃上清,向离心管加入M199培养液(含有20%胎牛血清,10 mmol/l HEPES,双抗1 ml/dl, pH 7.0)将细胞制成悬液,吸取0.2 ml细胞悬液用0.4%台盼蓝染色后,计活细胞数,调整细胞浓度至105 cells/ml接种于培养瓶中,放入37℃、5%CO2、饱和湿度的CO2培养箱内培养。定时换液并观察细胞生长情况,长成单层后及时传代。在相差显微镜下从形态学上对细胞进行鉴定,同时根据Jaff法从免疫学上对细胞进一步鉴定[7]。
实验分组 选取5~10代生长良好融合单层的PAEC,以105 cells/ml密度接种于培养瓶中,待细胞长成融合单层时,更换含10%胎牛血清的培养液,随机分为缺氧组和对照组,分别观察2、12、24和48 h PAEC生长曲线、ⅧR:Ag和细胞周期的变化。缺氧组的实验条件为3%O2、92%N2、5%CO2、饱和湿度;对照组的实验条件为21%O2、74%N2,其余条件与缺氧组相同。生长曲线测定:取各时间点的内皮细胞,消化制成细胞悬液,染色计数,求出均值。以培养天数为横坐标,细胞数为纵坐标,绘出生长曲线。
, http://www.100md.com
ⅧR:Ag的测定 根据Jaff法对ⅧR:Ag进行荧光染色,细胞终浓度不小于106 cells/ml。检测前用300目尼龙滤网过滤,将细胞制成单细胞悬液,用流式细胞仪测定PAEC的ⅧR:Ag荧光阳性细胞数。仪器条件:FACS-440型流式细胞仪(美国Becton-Dickinson公司),SW氩离子激光器,输出功率0.26 W,激发光波长488 nm。前置滤光片,使光电倍增管接收绿色免疫荧光,用戊二醛固定的鸡血细胞校正仪器,使仪器CV值稳定在3%以内。改变前向角以去除细胞碎片的干扰,每个样品记数1万个细胞,从中分析大小形态在正常范围内的8700左右内皮细胞,采用PDP11/73计算机Log单参数1024道直方图实时收集处理数据。
细胞周期测定 真核细胞的细胞周期主要分为4个时期,即DNA合成前期(G1期)、合成期(S)、合成后期(G2期)和分裂期(M期),此外还有G0期,G0期的细胞暂不分裂。在细胞周期中,G0、G1期细胞的DNA含量是相同的,都是二倍体。G2与M期的DNA含量也是相同的都是四倍体,S期介于两者之间。通常在一个非同步生长的细胞群体中,总是G1期细胞最多,S期次之, G2、M期细胞最少。细胞所在的周期不同,细胞内染色体DNA含量不同,流式细胞仪根据DNA荧光强度来分析DNA的含量,从而确定各细胞周期的细胞所占比例。首先将各组的细胞悬液用70%洒精固定,碘化丙啶(PI)对细胞内DNA染色流式细胞仪分析细胞时,前置不同的滤光片,使光电倍增管接受PI发出的红色荧光。每个样品采集1万个细胞,根据每个细胞的荧光强度绘制出荧光强度频数分布图,计算机统计G0 /G1,S,G2 、M期等细胞周期中,各类细胞所占的百分比。
, http://www.100md.com
结 果
生长曲线的变化 在各培养时间取出细胞,对细胞进行计数后,绘出细胞生长曲线(图1)。无论是在缺氧或是常氧条件下,两组细胞在48 h观察范围内生长数量无明显差异(P>0.05)。 group
n
2 h
12 h
24 h
48 h
control
8
88.70±3.85
84.59±3.73
, http://www.100md.com
82.86±4.24
87.93±7.13
hypoxia
8
76.68±12.50*
61.18±4.40**
67.05±3.68**
57.12±8.29**
Note:*P<0.05,**P<0.01,as compared with the same time control表2 不同缺氧时间PAEC细胞周期(%)的变化(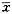 ±s)
±s)
, 百拇医药
Table 2 Change of growth cycle phase(%) in PAEC during hypoxia(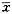 ±s) cycle
±s) cycle
phase
control
hypoxia
2 h
12 h
24 h
48 h
2 h
12 h
, 百拇医药
24 h
48 h
G0/G1
54.50±1.56
48.57±2.94
48.17±5.78
46.00±7.69
43.60±2.60*
52.67±2.96
47.50±6.28
44.75±7.45
, 百拇医药
S
31.67±1.68
39.90±1.78
41.60±3.52
40.90±7.07
42.10±1.04*
32.67±5.92
41.93±6.48
45.70±6.93
G2、M
13.83±2.20
, 百拇医药
11.43±3.04
11.23±1.74
13.10±9.76
14.33±2.74
14.70±3.00
11.58±1.98
9.25±0.07
Note:*P<0.05,as compared with the same time control
讨 论
良好的生长状态是内皮细胞实现各种功能的保证[1,2]。缺氧条件下,内皮细胞生长状态的改变也必将对其功能产生影响,从而产生各种病理后果。以往内皮细胞生长状态的研究多数只注意观察了内皮细胞生长数量上的变化,而很少注意细胞质量的上的改变[3,4]。为此本实验从细胞的质和量以及细胞的生长周期等方面入手,对PAEC在缺氧时的生长状态作了比较全面的观察。实验结果表明,缺氧条件下培养的PAEC在生长数量上与常氧状态下无明显差别。有人观察到[4],PAEC在无氧条件下只提供糖代谢底物,细胞可耐受48 h以上,但不增殖。由此推测,缺氧时PAEC能够保持一定的缺氧耐受性的原因可能与糖酵解有关。
, 百拇医药
PAEC在数量上无明显的变化,这一结果是否由PAEC的生长周期决定的呢? 研究结果表明,PAEC的细胞周期在缺氧2 h出现了明显的变化,G0/G1明显减少,细胞的S期明显增加,G2、M无明显变化,说明静息的PAEC明显减少,而进入DNA扩增,染色体复制的细胞群明显增加。这可能是缺氧开始刺激了PAEC,使PAEC增殖活跃。但随缺氧时间的延长,PAEC在缺氧12 h时,细胞的S期减少了7%,但细胞的G2、M期却增加了4%,这样增殖的细胞群和静息的细胞群与对照组比基本无明显变化。说明缺氧过程,细胞的增殖在缺氧12 h开始趋于稳定,与常氧无明显差别。这与细胞生长数量上的变化基本吻合。
缺氧对PAEC生长数目以及生长周期均无明显影响,但这不能说明缺氧对细胞生长的质量没有影响。有研究表明[6],飞行员在吸入低氧混合气体之后,循环内皮细胞数目和形态发生明显改变,其中年轻的内皮细胞明显增多,说明内皮细胞脱落生长状态受到影响,但缺乏直接的证据。实验中以ⅧR:Ag作为衡量指标观察了PAEC生长质量的变化。ⅧR:Ag是内皮细胞合成并释放的一种高分子糖蛋白(>1200 kD),是内皮细胞特异性标志之一[7],正常的血管内皮细胞含有一定量的ⅧR:Ag,而在血管内皮细胞受到外来刺激或某些血管损伤性疾病中[8],内皮细胞上的ⅧR:Ag明显降低,血中ⅧR:Ag含量增加。所以在缺氧过程中观察PAEC上ⅧR:Ag的变化可以间接反映PAEC的质量和功能状态。Cunha-Ribeiro[8]将人脐静脉内皮细胞暴露在14 mmHg的氧分压12~72 h后,用Elisa检测内皮细胞释放到培养液中的vWF因子,发现vWF含量明显增加。本实验通过流式细胞计对PAEC上vWF因子检测结果表明,缺氧2 h,PAEC的ⅧR:Ag阳性率下降10%左右,说明PAEC对缺氧感受十分敏感,2 h即可引起变化。缺氧12 h后,ⅧR:Ag的阳性率进一步下降,但基本稳定与24 h下降幅度大致相同,均下降20%左右,这可能是PAEC对缺氧已有代偿而不继续下降。ⅧR:Ag是一种高分子糖蛋白,它释放入血的机制上不十分清楚,缺氧过程中,PAEC上的ⅧR:Ag的大量丢失,可能是缺氧使细胞膜的通透性增加,细胞内ⅧR:Ag释放到细胞外。同时也有可能是缺氧所导致的功能不全细胞数增加,含有ⅧR:Ag的正常细胞数量下降。这极有可能影响肺血管内皮的完整性,容易发生细胞内和细胞外水肿。其机理尚需进一步探讨。
, 百拇医药
[参考文献]
[1] Haler H. Endothelial function general considerations[J]. Drugs,1997, 53(Suppl 1):1~10
[2] Lum H, Malik A. Mechanisms of increased endothelial permeability[J]. Can J Physiol Pharmacol,1996,74(7):787~800
[3] WANG Peiyong,SUN Bingyong. The effect of hypoxia on CAMP and cacium concentrations in pulmonary artery endothelial cells[J]. Chin J Pathophysiol 1996, 12(4):337~340
, 百拇医药
王培勇,孙秉庸. 缺氧对肺动脉内皮细胞生长特性、细胞内游离钙及CAMP浓度的影响[J]. 中国病理生理杂志,1996,12(4):337~340
[4] Lee SL, Fanburg BL. Glycolytic activity and enchance of serotonin uptake by endotheolial cell exposed to hypoxia and anoxia[J]. Circ Res, 1987,60(5):653~660
[5] 鄂 征.组织培养和细胞分子生物学技术[M].北京:北京出版社出版,1995:78~92
[6] CHEN Jianhe,YU Raorong,DONG Qi et al.Change of endothelial cell count and morphology after inhalation of low oxygen gas mixture[J]. Space Medical & Medicine Engineering,1996,9(5):313~316
, 百拇医药
陈建和,俞尧荣,董 颀等.吸低氧混合气后循环内皮细胞数目及形态学的变化[J].航天医学与医学工程,1996,9(5):313~316
[7] Jaffe EA, Nachman RL,Becher CG et al.Culture of human endothelial cells derived from umbilical vein. Identification by morphologic and immunologic critia[J]. J Clin Invest,1973,52(10):2745~2756
[8] Cunha-Ribeiro LM,Sakariassen KS. Modulation of vascular properties of cultured human endothelium by hypoxia and reoxygenation[M]. New York:Plenum Press,1996,281:260
收稿日期:1999-09-27, 百拇医药
单位:军事医学科学院卫生学环境医学研究所,天津 300050
关键词:缺氧;脉动脉;内皮细胞;细胞周期;因子Ⅷ;抗原;生长曲线
航天医学与医学工程000413摘要: 目的 研究低氧时内皮细胞生长状态的变化,以揭示缺氧性肺水肿的发生机制。 方法 利用体外培养的肺动脉内皮细胞(PAEC),观察了在缺氧条件(3%O2)下,PAEC的生长曲线、细胞周期及细胞内特征性蛋白因子的变化,对PAEC的生长状态进行了质和量综合评价。 结果 在观察的48 h范围内,缺氧对PAEC的生长数量无明显影响(P>0.05)。细胞的S期在缺氧2 h时出现了一过性的增加,同时G0/G1期出现了一过性的降低(P<0.05)。但随着缺氧时间的延长,PAEC的各个生长周期均无明显变化(P>0.05)。因子Ⅷ相关抗原(ⅧR:Ag)阳性细胞数在缺氧过程中均呈明显下降(P<0.05或P<0.01)。 结论 缺氧时,虽然PAEC在生长数量和生长周期上无明显变化,但生长质量出现了明显的下降,这将影响其功能状态,降低血管屏障作用的发挥。
, 百拇医药
中图分类号:R364.4,R852.11 文献标识码:A 文章编号:1002-0837(2000)04-0290-04
Effects of Hypoxia on the Growth of Pulmonary Artery Endothelial Cell
HONG Xin YIN Zhao-yun SUN Xing-bin JIU Jun-ping XIE Yin-zhi LU Yong-da
(Institute of Hygiene and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050,China)
Abstract: Objective To study the effects of hypoxia on the growth of pulmonary artery endothelialcell(PAEC). Method Growth number, growth cycle phase, and the characteristics of endothelial cells(factor Ⅷ related antigen) of PAEC were investigated during hypoxia using the PAEC cultured in vitro as a model. Result No difference was found between growth numbers of PAEC under hypoxia and that under normoxia conditions during the culture of 48 h(P>0.05). The numbers of positive immunofluoescence PAEC of factor Ⅷ related antigen in hypoxic groups were lower than those in normoxic groups.The cell cycle phase figures showed that the DNA synthetic phase (S phase) in hypoxia 2 hour group was increased significantly, while the pre-synthetic phase(G0/G1) was decreased as compared with that of normoxic group. However, the S,G2M(gap2 and mitotic phase) or G1/G0 stage of hypoxia for 12, 24 or 48 hours group all had no change as compared with those of normoxic group. Conclusion Growth of the PAEC changed significantly during hypoxia. Although the quantity and the growth cycle of PAEC showed little change, the quality was degraded seriously that its function as a permeability barrier would be affected.
, 百拇医药
Key words: hypoxia;pulmonary artery;endothelial cells;growth cycle;factor Ⅷ;antigen;growth curve
内皮细胞是覆衬于全身血管和淋巴管内面的单层扁平细胞,具有多种生理功能,它做为组织与血液间的第一道屏障在血管通透性调节中发挥重要作用[1,2]。内皮细胞生长状态的好坏是其能否执行这些功能的先决条件。所以,在缺氧条件下,研究内皮细胞尤其是肺动脉内皮细胞(PAEC)的生长状态变化,对于探讨缺氧血管通透性改变相关疾病如缺氧性肺水肿的发病机制具有重要意义。以往研究多集中在细胞数量上,很少注意细胞生长质量的内在变化[3,4]。本文在观察细胞生长数量的同时,研究了细胞周期和内皮细胞特征性蛋白因子的变化,对PAEC在缺氧状态下的生长状态进行了较为全面系统的评价。
方 法
, http://www.100md.com
PAEC的体外培养[5] 选用肉联厂检疫合格的健康成年猪,1.0~1.5岁,体重100~150 kg,雌雄不限,活杀后,在相对无菌条件下分离肺动脉,并将游离下来的血管放入无菌D-Hank's液,4℃保存,2~3 h内培养。以0.25%胰蛋白酶消化内皮细胞,750 g,离心消化液10 min。弃上清,向离心管加入M199培养液(含有20%胎牛血清,10 mmol/l HEPES,双抗1 ml/dl, pH 7.0)将细胞制成悬液,吸取0.2 ml细胞悬液用0.4%台盼蓝染色后,计活细胞数,调整细胞浓度至105 cells/ml接种于培养瓶中,放入37℃、5%CO2、饱和湿度的CO2培养箱内培养。定时换液并观察细胞生长情况,长成单层后及时传代。在相差显微镜下从形态学上对细胞进行鉴定,同时根据Jaff法从免疫学上对细胞进一步鉴定[7]。
实验分组 选取5~10代生长良好融合单层的PAEC,以105 cells/ml密度接种于培养瓶中,待细胞长成融合单层时,更换含10%胎牛血清的培养液,随机分为缺氧组和对照组,分别观察2、12、24和48 h PAEC生长曲线、ⅧR:Ag和细胞周期的变化。缺氧组的实验条件为3%O2、92%N2、5%CO2、饱和湿度;对照组的实验条件为21%O2、74%N2,其余条件与缺氧组相同。生长曲线测定:取各时间点的内皮细胞,消化制成细胞悬液,染色计数,求出均值。以培养天数为横坐标,细胞数为纵坐标,绘出生长曲线。
, 百拇医药
ⅧR:Ag的测定 根据Jaff法对ⅧR:Ag进行荧光染色,细胞终浓度不小于106 cells/ml。检测前用300目尼龙滤网过滤,将细胞制成单细胞悬液,用流式细胞仪测定PAEC的ⅧR:Ag荧光阳性细胞数。仪器条件:FACS-440型流式细胞仪(美国Becton-Dickinson公司),SW氩离子激光器,输出功率0.26 W,激发光波长488 nm。前置滤光片,使光电倍增管接收绿色免疫荧光,用戊二醛固定的鸡血细胞校正仪器,使仪器CV值稳定在3%以内。改变前向角以去除细胞碎片的干扰,每个样品记数1万个细胞,从中分析大小形态在正常范围内的8700左右内皮细胞,采用PDP11/73计算机Log单参数1024道直方图实时收集处理数据。
细胞周期测定 真核细胞的细胞周期主要分为4个时期,即DNA合成前期(G1期)、合成期(S)、合成后期(G2期)和分裂期(M期),此外还有G0期,G0期的细胞暂不分裂。在细胞周期中,G0、G1期细胞的DNA含量是相同的,都是二倍体。G2与M期的DNA含量也是相同的都是四倍体,S期介于两者之间。通常在一个非同步生长的细胞群体中,总是G1期细胞最多,S期次之, G2、M期细胞最少。细胞所在的周期不同,细胞内染色体DNA含量不同,流式细胞仪根据DNA荧光强度来分析DNA的含量,从而确定各细胞周期的细胞所占比例。首先将各组的细胞悬液用70%洒精固定,碘化丙啶(PI)对细胞内DNA染色流式细胞仪分析细胞时,前置不同的滤光片,使光电倍增管接受PI发出的红色荧光。每个样品采集1万个细胞,根据每个细胞的荧光强度绘制出荧光强度频数分布图,计算机统计G0 /G1,S,G2 、M期等细胞周期中,各类细胞所占的百分比。
, 百拇医药
结 果
生长曲线的变化 在各培养时间取出细胞,对细胞进行计数后,绘出细胞生长曲线(图1)。无论是在缺氧或是常氧条件下,两组细胞在48 h观察范围内生长数量无明显差异(P>0.05)。

摘要: 目的 研究低氧时内皮细胞生长状态的变化,以揭示缺氧性肺水肿的发生机制。 方法 利用体外培养的肺动脉内皮细胞(PAEC),观察了在缺氧条件(3%O2)下,PAEC的生长曲线、细胞周期及细胞内特征性蛋白因子的变化,对PAEC的生长状态进行了质和量综合评价。 结果 在观察的48 h范围内,缺氧对PAEC的生长数量无明显影响(P>0.05)。细胞的S期在缺氧2 h时出现了一过性的增加,同时G0/G1期出现了一过性的降低(P<0.05)。但随着缺氧时间的延长,PAEC的各个生长周期均无明显变化(P>0.05)。因子Ⅷ相关抗原(ⅧR:Ag)阳性细胞数在缺氧过程中均呈明显下降(P<0.05或P<0.01)。 结论 缺氧时,虽然PAEC在生长数量和生长周期上无明显变化,但生长质量出现了明显的下降,这将影响其功能状态,降低血管屏障作用的发挥。
, http://www.100md.com
中图分类号:R364.4,R852.11 文献标识码:A 文章编号:1002-0837(2000)04-0290-04
Effects of Hypoxia on the Growth of Pulmonary Artery Endothelial Cell
HONG Xin YIN Zhao-yun SUN Xing-bin JIU Jun-ping XIE Yin-zhi LU Yong-da
(Institute of Hygiene and Environmental Medicine, Academy of Military Medical Sciences, Tianjin 300050,China)
Abstract: Objective To study the effects of hypoxia on the growth of pulmonary artery endothelialcell(PAEC). Method Growth number, growth cycle phase, and the characteristics of endothelial cells(factor Ⅷ related antigen) of PAEC were investigated during hypoxia using the PAEC cultured in vitro as a model. Result No difference was found between growth numbers of PAEC under hypoxia and that under normoxia conditions during the culture of 48 h(P>0.05). The numbers of positive immunofluoescence PAEC of factor Ⅷ related antigen in hypoxic groups were lower than those in normoxic groups.The cell cycle phase figures showed that the DNA synthetic phase (S phase) in hypoxia 2 hour group was increased significantly, while the pre-synthetic phase(G0/G1) was decreased as compared with that of normoxic group. However, the S,G2M(gap2 and mitotic phase) or G1/G0 stage of hypoxia for 12, 24 or 48 hours group all had no change as compared with those of normoxic group. Conclusion Growth of the PAEC changed significantly during hypoxia. Although the quantity and the growth cycle of PAEC showed little change, the quality was degraded seriously that its function as a permeability barrier would be affected.
, 百拇医药
Key words: hypoxia;pulmonary artery;endothelial cells;growth cycle;factor Ⅷ;antigen;growth curve
内皮细胞是覆衬于全身血管和淋巴管内面的单层扁平细胞,具有多种生理功能,它做为组织与血液间的第一道屏障在血管通透性调节中发挥重要作用[1,2]。内皮细胞生长状态的好坏是其能否执行这些功能的先决条件。所以,在缺氧条件下,研究内皮细胞尤其是肺动脉内皮细胞(PAEC)的生长状态变化,对于探讨缺氧血管通透性改变相关疾病如缺氧性肺水肿的发病机制具有重要意义。以往研究多集中在细胞数量上,很少注意细胞生长质量的内在变化[3,4]。本文在观察细胞生长数量的同时,研究了细胞周期和内皮细胞特征性蛋白因子的变化,对PAEC在缺氧状态下的生长状态进行了较为全面系统的评价。
方 法
, 百拇医药
PAEC的体外培养[5] 选用肉联厂检疫合格的健康成年猪,1.0~1.5岁,体重100~150 kg,雌雄不限,活杀后,在相对无菌条件下分离肺动脉,并将游离下来的血管放入无菌D-Hank's液,4℃保存,2~3 h内培养。以0.25%胰蛋白酶消化内皮细胞,750 g,离心消化液10 min。弃上清,向离心管加入M199培养液(含有20%胎牛血清,10 mmol/l HEPES,双抗1 ml/dl, pH 7.0)将细胞制成悬液,吸取0.2 ml细胞悬液用0.4%台盼蓝染色后,计活细胞数,调整细胞浓度至105 cells/ml接种于培养瓶中,放入37℃、5%CO2、饱和湿度的CO2培养箱内培养。定时换液并观察细胞生长情况,长成单层后及时传代。在相差显微镜下从形态学上对细胞进行鉴定,同时根据Jaff法从免疫学上对细胞进一步鉴定[7]。
实验分组 选取5~10代生长良好融合单层的PAEC,以105 cells/ml密度接种于培养瓶中,待细胞长成融合单层时,更换含10%胎牛血清的培养液,随机分为缺氧组和对照组,分别观察2、12、24和48 h PAEC生长曲线、ⅧR:Ag和细胞周期的变化。缺氧组的实验条件为3%O2、92%N2、5%CO2、饱和湿度;对照组的实验条件为21%O2、74%N2,其余条件与缺氧组相同。生长曲线测定:取各时间点的内皮细胞,消化制成细胞悬液,染色计数,求出均值。以培养天数为横坐标,细胞数为纵坐标,绘出生长曲线。
, http://www.100md.com
ⅧR:Ag的测定 根据Jaff法对ⅧR:Ag进行荧光染色,细胞终浓度不小于106 cells/ml。检测前用300目尼龙滤网过滤,将细胞制成单细胞悬液,用流式细胞仪测定PAEC的ⅧR:Ag荧光阳性细胞数。仪器条件:FACS-440型流式细胞仪(美国Becton-Dickinson公司),SW氩离子激光器,输出功率0.26 W,激发光波长488 nm。前置滤光片,使光电倍增管接收绿色免疫荧光,用戊二醛固定的鸡血细胞校正仪器,使仪器CV值稳定在3%以内。改变前向角以去除细胞碎片的干扰,每个样品记数1万个细胞,从中分析大小形态在正常范围内的8700左右内皮细胞,采用PDP11/73计算机Log单参数1024道直方图实时收集处理数据。
细胞周期测定 真核细胞的细胞周期主要分为4个时期,即DNA合成前期(G1期)、合成期(S)、合成后期(G2期)和分裂期(M期),此外还有G0期,G0期的细胞暂不分裂。在细胞周期中,G0、G1期细胞的DNA含量是相同的,都是二倍体。G2与M期的DNA含量也是相同的都是四倍体,S期介于两者之间。通常在一个非同步生长的细胞群体中,总是G1期细胞最多,S期次之, G2、M期细胞最少。细胞所在的周期不同,细胞内染色体DNA含量不同,流式细胞仪根据DNA荧光强度来分析DNA的含量,从而确定各细胞周期的细胞所占比例。首先将各组的细胞悬液用70%洒精固定,碘化丙啶(PI)对细胞内DNA染色流式细胞仪分析细胞时,前置不同的滤光片,使光电倍增管接受PI发出的红色荧光。每个样品采集1万个细胞,根据每个细胞的荧光强度绘制出荧光强度频数分布图,计算机统计G0 /G1,S,G2 、M期等细胞周期中,各类细胞所占的百分比。
, http://www.100md.com
结 果
生长曲线的变化 在各培养时间取出细胞,对细胞进行计数后,绘出细胞生长曲线(图1)。无论是在缺氧或是常氧条件下,两组细胞在48 h观察范围内生长数量无明显差异(P>0.05)。 group
n
2 h
12 h
24 h
48 h
control
8
88.70±3.85
84.59±3.73
, http://www.100md.com
82.86±4.24
87.93±7.13
hypoxia
8
76.68±12.50*
61.18±4.40**
67.05±3.68**
57.12±8.29**
Note:*P<0.05,**P<0.01,as compared with the same time control表2 不同缺氧时间PAEC细胞周期(%)的变化(
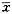 ±s)
±s), 百拇医药
Table 2 Change of growth cycle phase(%) in PAEC during hypoxia(
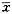 ±s) cycle
±s) cyclephase
control
hypoxia
2 h
12 h
24 h
48 h
2 h
12 h
, 百拇医药
24 h
48 h
G0/G1
54.50±1.56
48.57±2.94
48.17±5.78
46.00±7.69
43.60±2.60*
52.67±2.96
47.50±6.28
44.75±7.45
, 百拇医药
S
31.67±1.68
39.90±1.78
41.60±3.52
40.90±7.07
42.10±1.04*
32.67±5.92
41.93±6.48
45.70±6.93
G2、M
13.83±2.20
, 百拇医药
11.43±3.04
11.23±1.74
13.10±9.76
14.33±2.74
14.70±3.00
11.58±1.98
9.25±0.07
Note:*P<0.05,as compared with the same time control
讨 论
良好的生长状态是内皮细胞实现各种功能的保证[1,2]。缺氧条件下,内皮细胞生长状态的改变也必将对其功能产生影响,从而产生各种病理后果。以往内皮细胞生长状态的研究多数只注意观察了内皮细胞生长数量上的变化,而很少注意细胞质量的上的改变[3,4]。为此本实验从细胞的质和量以及细胞的生长周期等方面入手,对PAEC在缺氧时的生长状态作了比较全面的观察。实验结果表明,缺氧条件下培养的PAEC在生长数量上与常氧状态下无明显差别。有人观察到[4],PAEC在无氧条件下只提供糖代谢底物,细胞可耐受48 h以上,但不增殖。由此推测,缺氧时PAEC能够保持一定的缺氧耐受性的原因可能与糖酵解有关。
, 百拇医药
PAEC在数量上无明显的变化,这一结果是否由PAEC的生长周期决定的呢? 研究结果表明,PAEC的细胞周期在缺氧2 h出现了明显的变化,G0/G1明显减少,细胞的S期明显增加,G2、M无明显变化,说明静息的PAEC明显减少,而进入DNA扩增,染色体复制的细胞群明显增加。这可能是缺氧开始刺激了PAEC,使PAEC增殖活跃。但随缺氧时间的延长,PAEC在缺氧12 h时,细胞的S期减少了7%,但细胞的G2、M期却增加了4%,这样增殖的细胞群和静息的细胞群与对照组比基本无明显变化。说明缺氧过程,细胞的增殖在缺氧12 h开始趋于稳定,与常氧无明显差别。这与细胞生长数量上的变化基本吻合。
缺氧对PAEC生长数目以及生长周期均无明显影响,但这不能说明缺氧对细胞生长的质量没有影响。有研究表明[6],飞行员在吸入低氧混合气体之后,循环内皮细胞数目和形态发生明显改变,其中年轻的内皮细胞明显增多,说明内皮细胞脱落生长状态受到影响,但缺乏直接的证据。实验中以ⅧR:Ag作为衡量指标观察了PAEC生长质量的变化。ⅧR:Ag是内皮细胞合成并释放的一种高分子糖蛋白(>1200 kD),是内皮细胞特异性标志之一[7],正常的血管内皮细胞含有一定量的ⅧR:Ag,而在血管内皮细胞受到外来刺激或某些血管损伤性疾病中[8],内皮细胞上的ⅧR:Ag明显降低,血中ⅧR:Ag含量增加。所以在缺氧过程中观察PAEC上ⅧR:Ag的变化可以间接反映PAEC的质量和功能状态。Cunha-Ribeiro[8]将人脐静脉内皮细胞暴露在14 mmHg的氧分压12~72 h后,用Elisa检测内皮细胞释放到培养液中的vWF因子,发现vWF含量明显增加。本实验通过流式细胞计对PAEC上vWF因子检测结果表明,缺氧2 h,PAEC的ⅧR:Ag阳性率下降10%左右,说明PAEC对缺氧感受十分敏感,2 h即可引起变化。缺氧12 h后,ⅧR:Ag的阳性率进一步下降,但基本稳定与24 h下降幅度大致相同,均下降20%左右,这可能是PAEC对缺氧已有代偿而不继续下降。ⅧR:Ag是一种高分子糖蛋白,它释放入血的机制上不十分清楚,缺氧过程中,PAEC上的ⅧR:Ag的大量丢失,可能是缺氧使细胞膜的通透性增加,细胞内ⅧR:Ag释放到细胞外。同时也有可能是缺氧所导致的功能不全细胞数增加,含有ⅧR:Ag的正常细胞数量下降。这极有可能影响肺血管内皮的完整性,容易发生细胞内和细胞外水肿。其机理尚需进一步探讨。
, 百拇医药
[参考文献]
[1] Haler H. Endothelial function general considerations[J]. Drugs,1997, 53(Suppl 1):1~10
[2] Lum H, Malik A. Mechanisms of increased endothelial permeability[J]. Can J Physiol Pharmacol,1996,74(7):787~800
[3] WANG Peiyong,SUN Bingyong. The effect of hypoxia on CAMP and cacium concentrations in pulmonary artery endothelial cells[J]. Chin J Pathophysiol 1996, 12(4):337~340
, 百拇医药
王培勇,孙秉庸. 缺氧对肺动脉内皮细胞生长特性、细胞内游离钙及CAMP浓度的影响[J]. 中国病理生理杂志,1996,12(4):337~340
[4] Lee SL, Fanburg BL. Glycolytic activity and enchance of serotonin uptake by endotheolial cell exposed to hypoxia and anoxia[J]. Circ Res, 1987,60(5):653~660
[5] 鄂 征.组织培养和细胞分子生物学技术[M].北京:北京出版社出版,1995:78~92
[6] CHEN Jianhe,YU Raorong,DONG Qi et al.Change of endothelial cell count and morphology after inhalation of low oxygen gas mixture[J]. Space Medical & Medicine Engineering,1996,9(5):313~316
, 百拇医药
陈建和,俞尧荣,董 颀等.吸低氧混合气后循环内皮细胞数目及形态学的变化[J].航天医学与医学工程,1996,9(5):313~316
[7] Jaffe EA, Nachman RL,Becher CG et al.Culture of human endothelial cells derived from umbilical vein. Identification by morphologic and immunologic critia[J]. J Clin Invest,1973,52(10):2745~2756
[8] Cunha-Ribeiro LM,Sakariassen KS. Modulation of vascular properties of cultured human endothelium by hypoxia and reoxygenation[M]. New York:Plenum Press,1996,281:260
收稿日期:1999-09-27, 百拇医药