髁突软骨细胞分离及体外快速扩增
作者:焦岩涛 马绪臣 于世凤 张震康 邵曼君
单位:焦岩涛(100081北京医科大学口腔医学院放射科);马绪臣(100081北京医科大学口腔医学院放射科);于世凤(100081北京医科大学口腔医学院病理科);张震康(100081北京医科大学口腔医学院口腔颌面外科);邵曼君(中国科学院化学冶金所多相反应开放实验室)
关键词:下颌骨髁状突;软骨;颞下颌关节
中华口腔医学杂志000404 【摘要】 目的 探索在短期内获得大量成活率高、分化良好的下颌髁突软骨(mandibular condylar cartilage,MCC)细胞。方法 采用细胞工程技术进行兔MCC细胞的Cytodex-3微载体培养,应用先进的环境扫描电镜技术对培养MCC细胞在微载体表面的生长方式进行了动态观察。结果 MCC细胞可快速贴附于Cytodex-3微载体表面,但其舍 甫展相对较慢。细胞舍 甫展后生长加速,到培养后期,细胞密度可达最初接种时的16.2倍。结论 微载体细胞培养技术是一种简便的快速体外细胞扩增方法,可为建立软骨细胞库及进行软骨缺损的组织工程修复提供大量供体细胞。
, 百拇医药
A quick way in isolation and amplification of mandibular condylar cartilage cell in vitro
JIAO Yantao,MA Xuchen,YU Shifeng
(Department of Radiology, School of Stomatology, Beijing Medical University, Beijing 100081, China)
【Abstract】 Objective To establish a quick way in acquiring well differentiated mandibular condylar cartilage (MCC) cells with high viability in large scale. Methods Japan white rabbit MCC cells were harvested by enzymatic method. They were grown in a modified bioreactor culture system, which contained the cytodex-3 micro-carriers in the culture medium. Kinetic growth of MCC cells on DEAE-dextran micro-carrier was observed under phase contrast microscope and environmental scanning microscope respectively. Results MCC cells attached rapidly to the surface of micro-carriers, but their spreading was slow. A quick growth of these cells was observed when they fully spread onto the micro-carrier. The number of MCC cells increased 16.2 times compared with that of plating. Conclusions Micro-carrier culture of MCC cells can yield a large quantity of cells within a short period of time that will be of benefit in banking MCC cells for reconstruction of impaired cartilage.
, 百拇医药
【Key words】 Mandibular condylar; Cartilage; Temporomandilar joint
修复关节软骨的损伤是一临床难题,结合材料学及细胞工程学的组织工程技术为软骨的生物性修复带来了希望。但因受细胞来源、数量及分化状态的限制,故短期内获得充足的、分化良好的软骨细胞是进行组织工程研究的前提[1]。我们利用微载体培养技术对髁突软骨细胞的体外大规模扩增进行了尝试。
材料和方法
1.材料:DMEM培养基(Gibco, U.S.A.),Ⅱ型胶原酶(Sigma, U.S.A.),Cytodex 3 (Pharmica, Sweden),新生小牛血清(北京经科生物试剂公司)。
2.兔髁突软骨细胞的分离:参照文献[2],髁突软骨取自4只新生日本大耳白兔,无菌条件下切取双侧髁突,含双抗磷酸盐缓冲液(PBS)冲洗并剥离软骨,反复剪切至1 mm3大小,首先进行2.5 g/L 胰蛋白酶消化30 min,离心弃消化液,加入2 g/LⅠ型胶原酶,37 ℃ 震荡消化1~2 h。显微镜下控制消化时间,及时收集细胞,接种于DMEM培养基,内含10%小牛血清。
, http://www.100md.com
3.MCC细胞的Cytodex-3微载体培养:将Cytodex-3用无Ca2+和Mg2+的PBS洗涤后,再浸泡3 h使其水化,然后尽量弃净PBS,用 70%(V/V)乙醇洗涤2次,并于其中浸泡12 h,消毒后的微载体用无菌PBS充分洗涤后保存于DMEM 培养基中备用。将0.25 g微载体加入盛有20 ml培养基的自制的磁力搅拌培养瓶中,细胞接种密度为1×108/L。初始搅拌速度为30 r/ min,0.5 h搅拌2 min,4 h后加入20 ml培养基,并以50 r/min持续搅拌,整个装置放于CO2孵箱,于37 ℃常规条件下培养,期间酌情更换培养液。
4.细胞形态学观察:培养过程中定期进行相差显微镜观察,并取细胞微载体样本100 μl,经PBS洗涤后直接于环境扫描电镜(environmental scanning electronic microscope,ESEM,KYKY 1 500A)下观察并摄影记录。
, 百拇医药
5.MCC细胞微载体培养的增殖动力学观察:自培养第3天起,隔日取细胞样本1 ml加入离心管中,静置片刻,待微载体充分沉淀后,小心吸出培养液,加入等体积的0.1%结晶紫(0.1 mol/L柠檬酸)染液,37 ℃孵育1 h,用吸管反复吹打后,血细胞计数板计数洗脱的MCC细胞核,据此描记微载体细胞培养生长曲线。
结果
1.MCC细胞在Cytodex-3微载体表面贴附生长情况:接种后6 h,细胞大部分贴附于微载体表面,呈半球形(图1)。此后细胞开始舍 甫展,细胞形态变为不规则扁平状,周边舍 甫展,伸出伪足,紧附于微载体表面,细胞间基质沉积(图2,3)。至第9天时,细胞已长满微载体表面,细胞紧密接触(图4)。
2.DMCC细胞Cytodex-3微载体培养生长曲线:细胞接种后前两天生长较慢,自第3天起生长加速,至第9天细胞密度达到最高值(16.2×108/L)。此期间为对数生长期。此后细胞数变化不显著(图5)。
, 百拇医药
图5 下颌髁突软骨细胞微载体培养生长曲线
讨论
以往体外获得大量软骨细胞的方法是进行传代。但常规方法工作量大,试剂消耗多,并且易污染。研究发现单层贴壁培养软骨细胞经反复传代后(通常自第3代起),其分化特征将逐渐丧失,即出现软骨细胞“反分化”(dedifferentiation)现象[3],因而限制了体外培养软骨细胞的数量。微载体培养技术始于1967年,目前已广泛应用于贴壁细胞及微生物的大规模培养。该培养系统兼有悬浮培养及贴壁培养的优点,微载体可明显增加贴壁依赖细胞生长的表面积(通常1 g微载体可提供约3 000 cm2的表面积),微载体在磁力搅拌下呈悬浮状态,有利于细胞的物质交换。在相同传代次数中可获得较常规培养高出数倍的细胞量[4,5]。因而可避免因反复传代造成的软骨细胞生物学性状的改变。本研究表明,MCC细胞在微载体表面长满时,其细胞密度增加到接种时的16.2倍。而通常使用培养瓶、皿,细胞只能增加3~5倍。
, http://www.100md.com
ESEM是一种新的观察微观世界的手段,其突出的优点是样本不需经复杂的常规电镜制样过程即可直接观察,因而避免了因制样过程中操做不当造成的假象,可真实反映生物体的自然形貌。本研究利用ESEM对MCC细胞在微载体表面生长过程进行了实时动态观察,结果显示MCC细胞可快速贴附于带正电荷的DEAE-葡聚糖微载体表面,但其舍 甫展速度较于其他材料表面稍慢,最近研究表明细胞在由细胞外基质包埋的微载体表面可快速贴附及舍 甫展[5],有关载体性能的改进有待进一步研究。
总之,微载体培养技术可为建立髁突软骨细胞库及进行颞下颌关节软骨缺损的组织工程修复获取大量软骨细胞提供有效的手段。
图1 接种24 h,细胞形态扁平,已完全舍 甫展(ESEM×1 000)
, 百拇医药
图2 接种后第3天,细胞开始增殖并合成基质(ESEM×1 000)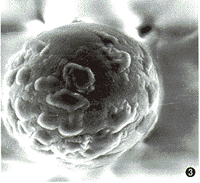
图3 接种后第5天,细胞间有大量细胞外基质分泌(ESEM×1 000)
图4 接种后第9天,细胞长满微载体表面(ESEM×1 000)
基金项目:国家自然科学基金资助项目 (39770800)
参考文献
1,Wakitani S, Kimura T, Hirooka A, et al. Repair of rabbit articular surfaces with allograft chondrocytes embeded in collagen gel. J Bone Joint Surg, 1989,71:74-80.
, 百拇医药
2,姚向前,马绪臣,张震康.兔下颌髁状突软骨细胞的分离、培养和鉴定.北京医科大学学报, 1996,28:436-438.
3,焦岩涛,王大章, 韩文利, 等.下颌骨髁状突软骨细胞传代过程中生物学特性变化.华西口腔医学杂志,1999,17: 355-357.
4,Keese CR, Giaever I. Cell growth on liquid microcarriers. Science, 1983, 219: 1 448-1 449.
5,徐小平,高毅,杨继震. Cytodex-3微载体高密度培养人肝细胞系CL-5.中华实验外科杂志,1999,16:80-81.
(收稿日期:1999-05-25), http://www.100md.com
单位:焦岩涛(100081北京医科大学口腔医学院放射科);马绪臣(100081北京医科大学口腔医学院放射科);于世凤(100081北京医科大学口腔医学院病理科);张震康(100081北京医科大学口腔医学院口腔颌面外科);邵曼君(中国科学院化学冶金所多相反应开放实验室)
关键词:下颌骨髁状突;软骨;颞下颌关节
中华口腔医学杂志000404 【摘要】 目的 探索在短期内获得大量成活率高、分化良好的下颌髁突软骨(mandibular condylar cartilage,MCC)细胞。方法 采用细胞工程技术进行兔MCC细胞的Cytodex-3微载体培养,应用先进的环境扫描电镜技术对培养MCC细胞在微载体表面的生长方式进行了动态观察。结果 MCC细胞可快速贴附于Cytodex-3微载体表面,但其舍 甫展相对较慢。细胞舍 甫展后生长加速,到培养后期,细胞密度可达最初接种时的16.2倍。结论 微载体细胞培养技术是一种简便的快速体外细胞扩增方法,可为建立软骨细胞库及进行软骨缺损的组织工程修复提供大量供体细胞。
, 百拇医药
A quick way in isolation and amplification of mandibular condylar cartilage cell in vitro
JIAO Yantao,MA Xuchen,YU Shifeng
(Department of Radiology, School of Stomatology, Beijing Medical University, Beijing 100081, China)
【Abstract】 Objective To establish a quick way in acquiring well differentiated mandibular condylar cartilage (MCC) cells with high viability in large scale. Methods Japan white rabbit MCC cells were harvested by enzymatic method. They were grown in a modified bioreactor culture system, which contained the cytodex-3 micro-carriers in the culture medium. Kinetic growth of MCC cells on DEAE-dextran micro-carrier was observed under phase contrast microscope and environmental scanning microscope respectively. Results MCC cells attached rapidly to the surface of micro-carriers, but their spreading was slow. A quick growth of these cells was observed when they fully spread onto the micro-carrier. The number of MCC cells increased 16.2 times compared with that of plating. Conclusions Micro-carrier culture of MCC cells can yield a large quantity of cells within a short period of time that will be of benefit in banking MCC cells for reconstruction of impaired cartilage.
, 百拇医药
【Key words】 Mandibular condylar; Cartilage; Temporomandilar joint
修复关节软骨的损伤是一临床难题,结合材料学及细胞工程学的组织工程技术为软骨的生物性修复带来了希望。但因受细胞来源、数量及分化状态的限制,故短期内获得充足的、分化良好的软骨细胞是进行组织工程研究的前提[1]。我们利用微载体培养技术对髁突软骨细胞的体外大规模扩增进行了尝试。
材料和方法
1.材料:DMEM培养基(Gibco, U.S.A.),Ⅱ型胶原酶(Sigma, U.S.A.),Cytodex 3 (Pharmica, Sweden),新生小牛血清(北京经科生物试剂公司)。
2.兔髁突软骨细胞的分离:参照文献[2],髁突软骨取自4只新生日本大耳白兔,无菌条件下切取双侧髁突,含双抗磷酸盐缓冲液(PBS)冲洗并剥离软骨,反复剪切至1 mm3大小,首先进行2.5 g/L 胰蛋白酶消化30 min,离心弃消化液,加入2 g/LⅠ型胶原酶,37 ℃ 震荡消化1~2 h。显微镜下控制消化时间,及时收集细胞,接种于DMEM培养基,内含10%小牛血清。
, http://www.100md.com
3.MCC细胞的Cytodex-3微载体培养:将Cytodex-3用无Ca2+和Mg2+的PBS洗涤后,再浸泡3 h使其水化,然后尽量弃净PBS,用 70%(V/V)乙醇洗涤2次,并于其中浸泡12 h,消毒后的微载体用无菌PBS充分洗涤后保存于DMEM 培养基中备用。将0.25 g微载体加入盛有20 ml培养基的自制的磁力搅拌培养瓶中,细胞接种密度为1×108/L。初始搅拌速度为30 r/ min,0.5 h搅拌2 min,4 h后加入20 ml培养基,并以50 r/min持续搅拌,整个装置放于CO2孵箱,于37 ℃常规条件下培养,期间酌情更换培养液。
4.细胞形态学观察:培养过程中定期进行相差显微镜观察,并取细胞微载体样本100 μl,经PBS洗涤后直接于环境扫描电镜(environmental scanning electronic microscope,ESEM,KYKY 1 500A)下观察并摄影记录。
, 百拇医药
5.MCC细胞微载体培养的增殖动力学观察:自培养第3天起,隔日取细胞样本1 ml加入离心管中,静置片刻,待微载体充分沉淀后,小心吸出培养液,加入等体积的0.1%结晶紫(0.1 mol/L柠檬酸)染液,37 ℃孵育1 h,用吸管反复吹打后,血细胞计数板计数洗脱的MCC细胞核,据此描记微载体细胞培养生长曲线。
结果
1.MCC细胞在Cytodex-3微载体表面贴附生长情况:接种后6 h,细胞大部分贴附于微载体表面,呈半球形(图1)。此后细胞开始舍 甫展,细胞形态变为不规则扁平状,周边舍 甫展,伸出伪足,紧附于微载体表面,细胞间基质沉积(图2,3)。至第9天时,细胞已长满微载体表面,细胞紧密接触(图4)。
2.DMCC细胞Cytodex-3微载体培养生长曲线:细胞接种后前两天生长较慢,自第3天起生长加速,至第9天细胞密度达到最高值(16.2×108/L)。此期间为对数生长期。此后细胞数变化不显著(图5)。

, 百拇医药
图5 下颌髁突软骨细胞微载体培养生长曲线
讨论
以往体外获得大量软骨细胞的方法是进行传代。但常规方法工作量大,试剂消耗多,并且易污染。研究发现单层贴壁培养软骨细胞经反复传代后(通常自第3代起),其分化特征将逐渐丧失,即出现软骨细胞“反分化”(dedifferentiation)现象[3],因而限制了体外培养软骨细胞的数量。微载体培养技术始于1967年,目前已广泛应用于贴壁细胞及微生物的大规模培养。该培养系统兼有悬浮培养及贴壁培养的优点,微载体可明显增加贴壁依赖细胞生长的表面积(通常1 g微载体可提供约3 000 cm2的表面积),微载体在磁力搅拌下呈悬浮状态,有利于细胞的物质交换。在相同传代次数中可获得较常规培养高出数倍的细胞量[4,5]。因而可避免因反复传代造成的软骨细胞生物学性状的改变。本研究表明,MCC细胞在微载体表面长满时,其细胞密度增加到接种时的16.2倍。而通常使用培养瓶、皿,细胞只能增加3~5倍。
, http://www.100md.com
ESEM是一种新的观察微观世界的手段,其突出的优点是样本不需经复杂的常规电镜制样过程即可直接观察,因而避免了因制样过程中操做不当造成的假象,可真实反映生物体的自然形貌。本研究利用ESEM对MCC细胞在微载体表面生长过程进行了实时动态观察,结果显示MCC细胞可快速贴附于带正电荷的DEAE-葡聚糖微载体表面,但其舍 甫展速度较于其他材料表面稍慢,最近研究表明细胞在由细胞外基质包埋的微载体表面可快速贴附及舍 甫展[5],有关载体性能的改进有待进一步研究。
总之,微载体培养技术可为建立髁突软骨细胞库及进行颞下颌关节软骨缺损的组织工程修复获取大量软骨细胞提供有效的手段。

图1 接种24 h,细胞形态扁平,已完全舍 甫展(ESEM×1 000)

, 百拇医药
图2 接种后第3天,细胞开始增殖并合成基质(ESEM×1 000)

图3 接种后第5天,细胞间有大量细胞外基质分泌(ESEM×1 000)

图4 接种后第9天,细胞长满微载体表面(ESEM×1 000)
基金项目:国家自然科学基金资助项目 (39770800)
参考文献
1,Wakitani S, Kimura T, Hirooka A, et al. Repair of rabbit articular surfaces with allograft chondrocytes embeded in collagen gel. J Bone Joint Surg, 1989,71:74-80.
, 百拇医药
2,姚向前,马绪臣,张震康.兔下颌髁状突软骨细胞的分离、培养和鉴定.北京医科大学学报, 1996,28:436-438.
3,焦岩涛,王大章, 韩文利, 等.下颌骨髁状突软骨细胞传代过程中生物学特性变化.华西口腔医学杂志,1999,17: 355-357.
4,Keese CR, Giaever I. Cell growth on liquid microcarriers. Science, 1983, 219: 1 448-1 449.
5,徐小平,高毅,杨继震. Cytodex-3微载体高密度培养人肝细胞系CL-5.中华实验外科杂志,1999,16:80-81.
(收稿日期:1999-05-25), http://www.100md.com