双膦酸盐类药物的化学研究进展
作者:付焱 张嫡群 杨继清
单位:(河北医科大学药学院药物化学教研室 石家庄 050017)
关键词:二膦酸盐类;骨疾病,代谢性;化学,药物;构效关系
河北医科大学学报000541
中图号 R977.5
1969年Fleisch 报道了双膦酸盐类化合物可作用于羟基磷灰石结晶的过程,体内、体外均具有抑制骨重吸收作用[1]。至今已合成双膦酸盐类化合物约300多个(不计盐及多晶型物),并有6个上市,临床广泛用于骨代谢性疾病的治疗。目前,双膦酸盐类药物是国际上药物研究的热点之一。本文旨在综述此类药物的研究应用概况、合成及构效关系。
1 双膦酸盐类药物的研究应用概况
, 百拇医药
1.1 依替膦酸二钠(etidronate):美国孟山都(Monsanto)化学公司研制的,美国P&G公司开发,商品名Didronel,70年代上市用于临床。 是最早用于治疗骨质疏松症的双膦酸盐类药物,1997年在我国获准上市。
1.2 氯屈膦酸二钠(clodronate):1986年首次上市,芬兰利拉斯(Leiras)药厂生产,商品名Bonefos。 抑制骨重吸收作用强度较依膦强10倍[2],口服能防治绝经后早期骨丢失。1992年进口clodronate在我国开始使用。
1.3 帕米膦酸二钠(pamidronate):瑞士Giba-Geigy 公司开发,1987 年在阿根廷首次上市,商品名为Aredia。 抑制骨重吸收作用强度比骨膦强10倍[2]。1991年美国FDA批准用于治疗恶性肿瘤高血钙、Paget病、多发性骨髓病和恶性肿瘤骨转移,是目前唯一能修复骨转移病灶的药物。1996年在我国获准生产。
, 百拇医药
1.4 阿仑膦酸钠(alendrononate):美国Merck公司开发,商品名Fosamax,抑制骨重吸收作用是帕屈膦酸钠的10倍[2]。1995年10月获美国FDA批准用于治疗骨质疏松症。国内已上市,商品名固邦。
1.5 埃本膦酸钠(ibandronate,BM21.0955):德国Boehringer Mannheim 公司开发,1996年在德国首次上市,商品名Bondronat。是目前开发研究中最有效的双膦酸盐类药物,抗骨重吸收作用强度是阿仑膦酸钠的10倍[2],用于治疗恶性高钙血症。
1.6 替鲁膦酸钠(tiludronate):法国Sanofi Winthrop公司开发,商品名Skelid,1996年在瑞士首先上市,治疗Paget病。抑制骨重吸收作用与骨膦大致相同[2]。美国FDA批准用于治疗骨质疏松症。
, 百拇医药 1.7 利塞膦酸钠(risedronate):Procter和Camble公司研制,抗骨重吸收作用强度是替鲁膦酸钠的500倍[2],可用于高钙血症及变形性骨炎的治疗。
1.8 斯孟膦酸(cimadronic acid,YW175):日本山之内制药公司开发。目前正以骨质疏松症和预防癌症骨转移为适应症进行Ⅱ期临床试验。其作用强度为依膦的100倍。
除以上药物外,正在研究的双膦酸盐类化合物还有neridronate、olpadronate、zoledronate(CGP42'446)、 EB-1053及YH529等。
2 双膦酸盐类药物的合成研究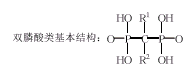
从近年研制的新衍生物看,R1以-H和-OH取代为主;结构变化主要在R2,双膦酸盐类药物的合成可根据R1是否为羟基大致分为2种类型。
, 百拇医药
2.1 无羟基双膦酸盐类:合成方法有2种,一是先制备亚甲基双膦酸酯,再在碳原子上引入其它基团成盐制得;二是由适当原料与亚膦酸酯直接反应后成盐制得。例如,clodronate的合成一般是由亚磷酸三异丙基酯与二溴甲烷反应,水解制备亚甲基双膦酸酯,若改用188~195 ℃加热除去丙烯并重结晶[3]制备,后者不经水解制备,不仅提高产品纯度和收率,且方法快速简便;亚甲基双膦酸酯再氯化成盐。 tiludronate是在二甲基甲酰胺溶剂中,经亚甲基双膦酸四甲基酯与氢化钠15 ℃搅拌后,加入双(4-氯苯基)二硫化物,搅拌缩合,水解成盐制备[4]。cimadronate 可由原甲酸乙酯与亚磷酸二酯和环庚胺直接反应后水解成盐[5]。
2.2 有羟基双膦酸盐类:合成可分为羧酸衍生物制备和双膦酸盐制备。 多是由羧酸衍生物与膦酰化试剂(亚磷酸酯、三氯化磷)缩合后成盐制得。
膦酰化反应为非均相,目前采用一是加入固相稀释剂或反应溶剂改善反应条件,提高反应收率。二是设计并选择适当反应条件的无溶剂制备,简化后处理及操作。例如,etidronate 的合成可由滴加三氯化磷于乙酸反应,水解制备。若加入固相稀释剂反应制备[6],可提高反应收率;改用乙酸与乙酰氯、三氯化磷反应制备[7],不仅反应时间短,无污染,且减少副产物亚磷酸(<3 %),提高产品纯度;冰乙酸与三氯化磷直接反应成盐制备,收率达72 %以上[8]。pamidronate 最初是由β-丙氨酸与无水亚磷酸和三氯化磷在无水氯苯中加热反应,水解,成盐制得,无水要求高,反应条件不易掌握,质量难以保证。用β-氨基丙酸水溶液在氯苯中直接与三氯化磷反应,冷冻析晶,成盐制备,反应条件易控制,降低物料消耗,并能提高收率[9]。alendronate的合成研究较多,一般以γ-氨基丁酸与亚磷酸和三氯化磷为原料,在无水氯苯中反应,水解后成盐制得; 此反应为固液两相,反应均匀度影响收率,卤代烃溶剂残留会影响药物的药理作用,改用甲磺酸为反应溶剂[10]能够克服非均相及部分固化等缺点,收率为90 %以上,但甲磺酸有致癌性;在无溶剂条件下,按1∶1.5∶2 mol投料比,95 ℃反应[11],反应温度较低,产品纯度好,收率为64.6 %,无环境污染。
, 百拇医药
双膦酸盐类药物已经或即将成为变形性骨炎、 肿瘤性恶性高钙血症及骨质疏松症的首选药物,认真研究这类药物的合成工艺,找出简捷而经济,适合国情的工业生产方法,以加速我国这类药物的发展是很有实际意义的。
3 双膦酸盐类构效关系研究
双膦酸结构中的碳原子含有2个取代基团R1和R2,现认为R1主要参与双膦酸盐与骨矿化基质结合过程;R2可能与双膦酸盐生物活性有关[12]。本文着重讨论此类药物基本结构,R1和R2取代基对药物生物活性的影响。
3.1 基本结构的确定:药物分子中连有膦酸基团,有助于药物向细胞内转运。R1-C-R2应为直链结构,若C原子邻位直接连有含碳环状结构,由于R1、R2均与环系结合,导致与羟磷灰石亲和力减弱,没有明显的抗骨重吸收作用。
, 百拇医药
3.2 R1为羟基可增强抑制骨重吸收活性:羟基可增加药物与钙结晶表面结合的亲合力;R2不变,R1若为氯或氢原子则骨矿物结合力减弱;若用烃基取代,则几乎无作用。
3.3 R2对药物生物活性的影响
3.3.1 杂原子取代使抗骨重吸收作用增强:杂原子可增加脂溶性,使药物生物活性发生变化。clodronate、tiludronate、cimadronate分别含Cl、S、N杂原子,其抗骨重吸收作用强度是 etidronate的10、10、100倍。
3.3.2 脂肪烃链长短对药物的抗骨重吸收作用也很重要:药物转运扩散需要一定的水溶性和脂溶性。一个适宜的碳链长度可增强化合物的脂溶性,提高稳定性和生物利用度。pamidronate、alendronate结构相近,R2碳链长度不同,alendronate碳链较长,作用强;neridronate虽有6碳长链,作用却低于alendronate[13]。
, 百拇医药
3.3.3 末端游离氨基可显著提高生物活性:N原子还可参与氢键形成,显示多种生物活性。含末端氨基的双膦酸盐类化合物 pamidronate、alendronate等的抗骨重吸收作用均高于烃基或杂原子取代的药物[14]。
3.3.4 末端氨基烷基化可大大提高药物活性:生理环境下胺易于形成铵离子,增加了静电作用。pamidronate、olpadronate、ibandronate碳链等长,末端分别为氨基、N,N-二甲胺基、N,N-甲基正戊胺基,作用强度依次增高。
3.3.5 引入含氮的环状侧链仍具有抗骨重吸收活性:含氮杂环可能对抑制骨吸收有效,如吡啶环、咪唑环等,并与碳链长度和区域选择性有关。即使R1为H,此类化合物也有抗骨重吸收活性,活性大小与杂环取代基位置及性质有关,如risedronate、zoledronate等。
4 前 景 展 望
, 百拇医药
在双膦酸盐类化合物的独特家族中,双膦酸盐类结构的多样性为此类药物化学合成方法的研究及改进提供了广阔空间。 尤其是此类药物还有抗动脉粥样硬化、 治疗高脂血症和抗炎、抗关节炎作用[15],有望发现新的先导化合物,设计合成新的药物。相信双膦酸盐类药物在不远的将来有可能成为用途广泛的常用治疗药物之一。
参考文献
1,Fleisch H,Russell RGG,Francis MD.Diphosphonates inhibit hydroxya-patite dissolution in vitro and bone resorption in tissue culture and in vivo.Sience,1969,165(899):1262
2,Fleisch H.Bisphosphonates-pharmacology and use in the treatment of tumour-induced hyperealcaemic and metasfatic bone disease.Drugs,1991,42(6):919
, 百拇医药
3,Budsky F,Prokop J,Zobacova A.Process of proparing methylenediphos- phonic acid.CS patent,276850.1992-08-12
4,Breliere JC,Emonds-Alt X.Antiflammatory products derived from methylenediphosphonic acid.EP patent,100718.1984-02-15
5,俞雄,张秀平.双膦酸盐类进展.中国医药工业杂志,1997,28(3):110
6,Mikhalin NV,Alfer'ev ZS,Kotlyarevskii IL,et al.Method of preparation of higher 1-hydroxyalkylidene-1,1-diphosphonic acids or their mixture or salts.SU patent,1719405.1992-03-15
, http://www.100md.com
7,Li yufang.Preparation of (1-hydroxyethylidene)-1,1-bisphosphonic acid.CN patent,1091137.1994-08-24
8,陈卫民,徐继红.依替膦酸二钠的合成.中国医药工业杂志,1996,27(7):296
9,朱崇泉,苏国强,边军,等.骨吸收抑制剂帕米膦酸二钠的合成.中国药科大学学报,1996,27(11):647
10,Kieczykowski GR.Process for preparing 4-amino-1-hydroxybutylidene-1,1-bisphosphonic acid(ABP) or salt thereof.US patent,5019651.1991-05-28
11,Istituto Gentili S.P.A.Diphosphonic acids.BE patent,903519.1986-02-17
, 百拇医药
12,Van Beek E,Hoekstra M,Van de Ruit M,et al.Structural requirements for bisphosphonate actions in vitro.J Bone Miner Res,1994,9(12):1875
13,Clifford J.Rosen and Cathy R.Kessenich.Comparative clinical pharmacology and therapeutic use of bisphosphonates in metabolic bone diseases.Drugs,1996,51(4):537
14,Shinoda H.Inhibitory effects of bisphosphonates on bone resorption.Nippon Yakurigaku Zasshi,1995,105(5):285
15,Richard AN,Stephen TS,Megan M,et al.Carbonyl-containing bisphosphonate esters as novel antiinflammatory and antiarthritic agents.J Med Chem,1994,36(26):4449
收稿日期:1999-01-07, http://www.100md.com
单位:(河北医科大学药学院药物化学教研室 石家庄 050017)
关键词:二膦酸盐类;骨疾病,代谢性;化学,药物;构效关系
河北医科大学学报000541
中图号 R977.5
1969年Fleisch 报道了双膦酸盐类化合物可作用于羟基磷灰石结晶的过程,体内、体外均具有抑制骨重吸收作用[1]。至今已合成双膦酸盐类化合物约300多个(不计盐及多晶型物),并有6个上市,临床广泛用于骨代谢性疾病的治疗。目前,双膦酸盐类药物是国际上药物研究的热点之一。本文旨在综述此类药物的研究应用概况、合成及构效关系。
1 双膦酸盐类药物的研究应用概况
, 百拇医药
1.1 依替膦酸二钠(etidronate):美国孟山都(Monsanto)化学公司研制的,美国P&G公司开发,商品名Didronel,70年代上市用于临床。 是最早用于治疗骨质疏松症的双膦酸盐类药物,1997年在我国获准上市。
1.2 氯屈膦酸二钠(clodronate):1986年首次上市,芬兰利拉斯(Leiras)药厂生产,商品名Bonefos。 抑制骨重吸收作用强度较依膦强10倍[2],口服能防治绝经后早期骨丢失。1992年进口clodronate在我国开始使用。
1.3 帕米膦酸二钠(pamidronate):瑞士Giba-Geigy 公司开发,1987 年在阿根廷首次上市,商品名为Aredia。 抑制骨重吸收作用强度比骨膦强10倍[2]。1991年美国FDA批准用于治疗恶性肿瘤高血钙、Paget病、多发性骨髓病和恶性肿瘤骨转移,是目前唯一能修复骨转移病灶的药物。1996年在我国获准生产。
, 百拇医药
1.4 阿仑膦酸钠(alendrononate):美国Merck公司开发,商品名Fosamax,抑制骨重吸收作用是帕屈膦酸钠的10倍[2]。1995年10月获美国FDA批准用于治疗骨质疏松症。国内已上市,商品名固邦。
1.5 埃本膦酸钠(ibandronate,BM21.0955):德国Boehringer Mannheim 公司开发,1996年在德国首次上市,商品名Bondronat。是目前开发研究中最有效的双膦酸盐类药物,抗骨重吸收作用强度是阿仑膦酸钠的10倍[2],用于治疗恶性高钙血症。
1.6 替鲁膦酸钠(tiludronate):法国Sanofi Winthrop公司开发,商品名Skelid,1996年在瑞士首先上市,治疗Paget病。抑制骨重吸收作用与骨膦大致相同[2]。美国FDA批准用于治疗骨质疏松症。
, 百拇医药 1.7 利塞膦酸钠(risedronate):Procter和Camble公司研制,抗骨重吸收作用强度是替鲁膦酸钠的500倍[2],可用于高钙血症及变形性骨炎的治疗。
1.8 斯孟膦酸(cimadronic acid,YW175):日本山之内制药公司开发。目前正以骨质疏松症和预防癌症骨转移为适应症进行Ⅱ期临床试验。其作用强度为依膦的100倍。
除以上药物外,正在研究的双膦酸盐类化合物还有neridronate、olpadronate、zoledronate(CGP42'446)、 EB-1053及YH529等。
2 双膦酸盐类药物的合成研究
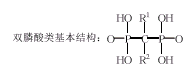
从近年研制的新衍生物看,R1以-H和-OH取代为主;结构变化主要在R2,双膦酸盐类药物的合成可根据R1是否为羟基大致分为2种类型。
, 百拇医药
2.1 无羟基双膦酸盐类:合成方法有2种,一是先制备亚甲基双膦酸酯,再在碳原子上引入其它基团成盐制得;二是由适当原料与亚膦酸酯直接反应后成盐制得。例如,clodronate的合成一般是由亚磷酸三异丙基酯与二溴甲烷反应,水解制备亚甲基双膦酸酯,若改用188~195 ℃加热除去丙烯并重结晶[3]制备,后者不经水解制备,不仅提高产品纯度和收率,且方法快速简便;亚甲基双膦酸酯再氯化成盐。 tiludronate是在二甲基甲酰胺溶剂中,经亚甲基双膦酸四甲基酯与氢化钠15 ℃搅拌后,加入双(4-氯苯基)二硫化物,搅拌缩合,水解成盐制备[4]。cimadronate 可由原甲酸乙酯与亚磷酸二酯和环庚胺直接反应后水解成盐[5]。
2.2 有羟基双膦酸盐类:合成可分为羧酸衍生物制备和双膦酸盐制备。 多是由羧酸衍生物与膦酰化试剂(亚磷酸酯、三氯化磷)缩合后成盐制得。
膦酰化反应为非均相,目前采用一是加入固相稀释剂或反应溶剂改善反应条件,提高反应收率。二是设计并选择适当反应条件的无溶剂制备,简化后处理及操作。例如,etidronate 的合成可由滴加三氯化磷于乙酸反应,水解制备。若加入固相稀释剂反应制备[6],可提高反应收率;改用乙酸与乙酰氯、三氯化磷反应制备[7],不仅反应时间短,无污染,且减少副产物亚磷酸(<3 %),提高产品纯度;冰乙酸与三氯化磷直接反应成盐制备,收率达72 %以上[8]。pamidronate 最初是由β-丙氨酸与无水亚磷酸和三氯化磷在无水氯苯中加热反应,水解,成盐制得,无水要求高,反应条件不易掌握,质量难以保证。用β-氨基丙酸水溶液在氯苯中直接与三氯化磷反应,冷冻析晶,成盐制备,反应条件易控制,降低物料消耗,并能提高收率[9]。alendronate的合成研究较多,一般以γ-氨基丁酸与亚磷酸和三氯化磷为原料,在无水氯苯中反应,水解后成盐制得; 此反应为固液两相,反应均匀度影响收率,卤代烃溶剂残留会影响药物的药理作用,改用甲磺酸为反应溶剂[10]能够克服非均相及部分固化等缺点,收率为90 %以上,但甲磺酸有致癌性;在无溶剂条件下,按1∶1.5∶2 mol投料比,95 ℃反应[11],反应温度较低,产品纯度好,收率为64.6 %,无环境污染。
, 百拇医药
双膦酸盐类药物已经或即将成为变形性骨炎、 肿瘤性恶性高钙血症及骨质疏松症的首选药物,认真研究这类药物的合成工艺,找出简捷而经济,适合国情的工业生产方法,以加速我国这类药物的发展是很有实际意义的。
3 双膦酸盐类构效关系研究
双膦酸结构中的碳原子含有2个取代基团R1和R2,现认为R1主要参与双膦酸盐与骨矿化基质结合过程;R2可能与双膦酸盐生物活性有关[12]。本文着重讨论此类药物基本结构,R1和R2取代基对药物生物活性的影响。
3.1 基本结构的确定:药物分子中连有膦酸基团,有助于药物向细胞内转运。R1-C-R2应为直链结构,若C原子邻位直接连有含碳环状结构,由于R1、R2均与环系结合,导致与羟磷灰石亲和力减弱,没有明显的抗骨重吸收作用。
, 百拇医药
3.2 R1为羟基可增强抑制骨重吸收活性:羟基可增加药物与钙结晶表面结合的亲合力;R2不变,R1若为氯或氢原子则骨矿物结合力减弱;若用烃基取代,则几乎无作用。
3.3 R2对药物生物活性的影响
3.3.1 杂原子取代使抗骨重吸收作用增强:杂原子可增加脂溶性,使药物生物活性发生变化。clodronate、tiludronate、cimadronate分别含Cl、S、N杂原子,其抗骨重吸收作用强度是 etidronate的10、10、100倍。
3.3.2 脂肪烃链长短对药物的抗骨重吸收作用也很重要:药物转运扩散需要一定的水溶性和脂溶性。一个适宜的碳链长度可增强化合物的脂溶性,提高稳定性和生物利用度。pamidronate、alendronate结构相近,R2碳链长度不同,alendronate碳链较长,作用强;neridronate虽有6碳长链,作用却低于alendronate[13]。
, 百拇医药
3.3.3 末端游离氨基可显著提高生物活性:N原子还可参与氢键形成,显示多种生物活性。含末端氨基的双膦酸盐类化合物 pamidronate、alendronate等的抗骨重吸收作用均高于烃基或杂原子取代的药物[14]。
3.3.4 末端氨基烷基化可大大提高药物活性:生理环境下胺易于形成铵离子,增加了静电作用。pamidronate、olpadronate、ibandronate碳链等长,末端分别为氨基、N,N-二甲胺基、N,N-甲基正戊胺基,作用强度依次增高。
3.3.5 引入含氮的环状侧链仍具有抗骨重吸收活性:含氮杂环可能对抑制骨吸收有效,如吡啶环、咪唑环等,并与碳链长度和区域选择性有关。即使R1为H,此类化合物也有抗骨重吸收活性,活性大小与杂环取代基位置及性质有关,如risedronate、zoledronate等。
4 前 景 展 望
, 百拇医药
在双膦酸盐类化合物的独特家族中,双膦酸盐类结构的多样性为此类药物化学合成方法的研究及改进提供了广阔空间。 尤其是此类药物还有抗动脉粥样硬化、 治疗高脂血症和抗炎、抗关节炎作用[15],有望发现新的先导化合物,设计合成新的药物。相信双膦酸盐类药物在不远的将来有可能成为用途广泛的常用治疗药物之一。
参考文献
1,Fleisch H,Russell RGG,Francis MD.Diphosphonates inhibit hydroxya-patite dissolution in vitro and bone resorption in tissue culture and in vivo.Sience,1969,165(899):1262
2,Fleisch H.Bisphosphonates-pharmacology and use in the treatment of tumour-induced hyperealcaemic and metasfatic bone disease.Drugs,1991,42(6):919
, 百拇医药
3,Budsky F,Prokop J,Zobacova A.Process of proparing methylenediphos- phonic acid.CS patent,276850.1992-08-12
4,Breliere JC,Emonds-Alt X.Antiflammatory products derived from methylenediphosphonic acid.EP patent,100718.1984-02-15
5,俞雄,张秀平.双膦酸盐类进展.中国医药工业杂志,1997,28(3):110
6,Mikhalin NV,Alfer'ev ZS,Kotlyarevskii IL,et al.Method of preparation of higher 1-hydroxyalkylidene-1,1-diphosphonic acids or their mixture or salts.SU patent,1719405.1992-03-15
, http://www.100md.com
7,Li yufang.Preparation of (1-hydroxyethylidene)-1,1-bisphosphonic acid.CN patent,1091137.1994-08-24
8,陈卫民,徐继红.依替膦酸二钠的合成.中国医药工业杂志,1996,27(7):296
9,朱崇泉,苏国强,边军,等.骨吸收抑制剂帕米膦酸二钠的合成.中国药科大学学报,1996,27(11):647
10,Kieczykowski GR.Process for preparing 4-amino-1-hydroxybutylidene-1,1-bisphosphonic acid(ABP) or salt thereof.US patent,5019651.1991-05-28
11,Istituto Gentili S.P.A.Diphosphonic acids.BE patent,903519.1986-02-17
, 百拇医药
12,Van Beek E,Hoekstra M,Van de Ruit M,et al.Structural requirements for bisphosphonate actions in vitro.J Bone Miner Res,1994,9(12):1875
13,Clifford J.Rosen and Cathy R.Kessenich.Comparative clinical pharmacology and therapeutic use of bisphosphonates in metabolic bone diseases.Drugs,1996,51(4):537
14,Shinoda H.Inhibitory effects of bisphosphonates on bone resorption.Nippon Yakurigaku Zasshi,1995,105(5):285
15,Richard AN,Stephen TS,Megan M,et al.Carbonyl-containing bisphosphonate esters as novel antiinflammatory and antiarthritic agents.J Med Chem,1994,36(26):4449
收稿日期:1999-01-07, http://www.100md.com