竞争性PCR内参照菌的构建及应用
作者:杜迪军 缪竞智 张秀珍
单位:100730 卫生部北京医院呼吸内科
关键词:整合载体;DNA指纹图谱;铜绿假单胞菌;聚合酶链反应
中华微生物学和免疫学杂志000522 【 摘要 】 目的 建立一种构建竞争性PCR内参照菌的方法,并初步应用于铜绿假单胞菌(Pseudomonas aeruginosa,简称PA)的竞争性PCR定量检测。 方法 通过整合载体pSX1-2和pUC19-attP-tetr将竞争模板插入大肠杆菌JM83染色体中,构建内参照菌JM83/16SN。以JM83/16SN作为内参照,建立PA竞争性PCR定量和半定量检测方法。 结果 细菌质粒限制性酶切分析、药敏试验及染色体DNA指纹图谱分析证实竞争模板已插入到JM83/16SN染色体中。在竞争性PCR定量法中,得出定量回归方程y=-1.99x+14.05(r=-0.97)。将10倍系列稀释的PA标本作竞争性PCR半定量检测及定量培养,其结果存在良好的一致性。 结论 通过整合载体可以将竞争模板插入大肠杆菌染色体中来构建内参照菌株。竞争性PCR半定量法可以简便、准确地测定标本中PA浓度范围。
, 百拇医药
Construction and application of E. coli strains used as internal control for competitive PCR
DU Dijun, MIAO Jingzhi, ZHANG Xiuzhen.
(Department of Respiratory Medicine, Beijing Hospital, Ministry of Public Health, Beijing 100730, P. R. China)
【 Abstract 】 Objective To develop a method to construct E. coli strains used as internal control for competitive PCR(cPCR), with which to establish the cPCR assay of Pseudomonas aeruginosa (PA). Methods The attachment site of phage λ(attP) and tetracycline-resistant gene from pBR322 were subcloned into pUC19 to obtain recombinant plasmid pUC19-attP-tetr. A 85bps DNA fragment was inserted into the 345bps target template amplified from PA to obtain competitive template. The competitive template was inserted into chromosome of E. coli by integration vectors pSX1-2 and pUC19-attP-tetr to construct an E. coli strain designated JM83/16SN. Quantitative assay and semi-quantitative assay of PA with cPCR were established by using JM83/16SN as internal control. Results Restriction analysis of plasmid, drug susceptibility testing and DNA fingerprinting of chromosome DNA of JM83/16SN indicated that the competitive template had been inserted in chromosome of JM83/16SN. The equation y=-1.99x+14.05 (r=-0.97) was got in the quantitative assay of cPCR. PA samples of 10-fold dilutions were detected semi-quantitatively by cPCR and detected by quantitative culture. A good correlation was demonstrated between the results of semi-quantitatively assay with cPCR and the results of quantitative culture. Conclusions Competitive template can be inserted into chromosome of E. coli by integration vectors to construct E. coli strain used as internal control for cPCR. Semi-quantitative assay with cPCR provides a simple and accurate way to detect the concentration ranges of PA.
, 百拇医药
【 Subject words 】 Quantitative PCR; Genetic vectors; DNA fingerprinting; Pseudomonas aeruginosa
痰标本易受口腔定植菌污染,造成下呼吸道感染病原学诊断困难。竞争性PCR能定量检测痰标本中细菌浓度,可以用于鉴别致病菌与定植菌。影响竞争性PCR准确性的因素较多,大多可以通过优化实验条件予以消除。目前竞争性PCR未被控制的变异性主要来自标本的质量、标本处理过程中的损失等因素。以含竞争模板的菌株作为内参照,加入标本中,参与标本的处理过程,理论上可以减少标本处理过程对竞争性PCR定量检测的影响。因此,我们建立了一种构建内参照菌的方法,并初步应用于PA的竞争性PCR定量检测。
材料与方法
菌株、质粒和噬菌体:大肠杆菌JM109、JM83、XL1-Blue由茆灿泉博士惠赠,PA标准株(菌株号:ATCC27853)由北京医院检验科细菌室提供,质粒pUC19、pBR322、和λ噬菌体DNA(非甲基化)购自华美生物工程公司,质粒pSX1-2由Gardner JF教授惠赠。
, 百拇医药
酶和化学试剂:限制性内切酶、T4 DNA连接酶、RNA酶A、Taq DNA聚合酶、蛋白酶K、IPTG、X-Gal及PCR裂解缓冲液购自华美生物工程公司,dNTP为宝灵曼公司产品,85bp PCR Marker购自天象人公司,低熔点琼脂糖(DNA级)和脉冲场级琼脂糖为Bio-Rad实验室产品,普通琼脂糖(电泳级)为北京中山生物技术公司产品,PA PCR引物参照文献设计〔1〕,引物序列分别为P1:5′-GTGCCTGCAGCCGCGGTAAT-3′,P2:5′-TGCGCCACTAAGATGTCAAG-3′,由中国科学院微生物研究所基因工程中心合成,其余试剂均为分析纯。
DNA重组操作:质粒DNA的制备(碱裂解法)、质粒转化(氯化钙转化程序)、含重组质粒的细菌菌落的鉴定、DNA限制性内切酶反应、DNA片段的分离及纯化、外源DNA和质粒载体的连接反应等操作参照《分子克隆实验指南》略作修改进行〔2〕。
DNA质量及分子量测定:采用Gel Doc 2000凝胶数字成像系统及凝胶影像分析软件Multi-AnalystR/PC(1.1版)进行测定。该数字成像系统和影像分析软件为Bio-Rad实验室产品。质量和分子量标准采用Promega公司生产的PCR Markers。DNA条带间摩尔比的计算采用其质量比乘以分子长度(bp)比的倒数〔3〕。
, 百拇医药
细菌染色体DNA指纹图谱:采用文献中介绍的“标准PFGE程序”略作修改进行〔4〕。脉冲场电泳设备为Bio-Rad实验室生产的GenePathTM系统。
细菌浓度测定及药敏试验方法:细菌浓度测定采用细菌定量培养及比浊法进行,细菌药敏试验采用纸片琼脂扩散法。
痰标本的处理:痰标本与等体积的液化剂(4% NaOH,100mmol/L柠檬酸钠,10mg/ml N-乙酰-L-半胱氨酸)混匀,室温哺育15~20min。取液化痰400μl,12000×g离心3min。去上清液,用500μl灭菌去离子水重悬沉淀,12000×g离心3min。去上清液,用20μl裂解缓冲液重悬沉淀,加2滴石蜡油,300×g离心10s,然后99 ℃裂解15min,标本贮存在4℃备用。
PCR扩增条件:反应混合物组成:10mmol/L Tris*Cl (25℃时pH9.0),50mmol/L KCl,1.5mmol/L MgCl2,0.1% TritonX-100,dATP、dTTP、dCTP、dGTP均为200μmol/L,Taq酶2.5U,引物P1、P2均为0.1μmol/L,标本10μl,反应体积100μl。温度循环参数:变性94℃ 1min,退火55℃ 1min,延伸72℃ 2min。扩增35个循环后于72℃延伸10min,标本贮存于4℃备用。480型DNA热循环仪为PE公司产品。
, http://www.100md.com
结果
1.整合载体的构建:整合载体由pUC19-attP-tetr和pSX1-2两个质粒组成。质粒pUC19-attP-tetr按图1所示进行构建。用限制性酶切方法获得λ噬菌体染色体第27480至27973位之间的493bp HindⅢ-BamHⅠ片段(该片段含attP),将该片段克隆到质粒pUC19上,获得重组质粒pUC19-attP。将质粒pBR322第0~2067位间的EcoRⅠ-PvuⅡ片段(该片段含四环素抗性基因)克隆到质粒pUC19-attP的EcoRⅠ-ScaⅠ位点之间,构建成质粒pUC19-attP-tetr(图2)。pSX1-2是含λ噬菌体整合酶基因(int)的表达质粒,在IPTG诱导下可表达整合酶〔5〕。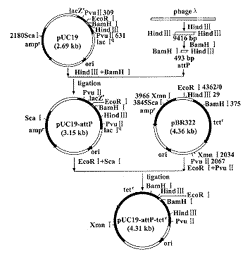
图1 整合载体pUC19-attP-tetr的构建
, http://www.100md.com
Fig 1. Construction of integration vector pUC19-attP-tetr
图2 质粒pUC19-attP-tetr和pUC19-16SN的限制性酶切分析
Fig 2. Restriction analysis of plasmids pUC19-attP-tetr and pUC19-16SN
1. pUC19-attP-tetr/PvuⅡ+XmnⅠ; 2. pUC19-16SN/EcoRⅠ+PstⅠ; 3. λDNA/EcoRⅠ+HindⅢ markers
2.竞争模板的构建:用引物P1、P2可从PA 16S rDNA中扩增出1个345bp目标模板。用SmaⅠ酶切分析目标模板,显示其中含有单一SmaⅠ酶切位点。将目标模板插入到pUC19的SmaⅠ位点,获得重组质粒pUC19-16S,然后将1个85bp片段插入到pUC19-16S的SmaⅠ位点,获得重组质粒pUC19-16SN(图2)。用引物P1、P2可从pUC19-16SN中扩增出1个430bp片段,该片段作为竞争模板。
, 百拇医药
3.内参照菌株的构建及鉴定:将质粒pSX1-2转化到大肠杆菌JM83中,得到菌株JM83/pSX1-2,该菌株在IPTG诱导下可以表达整合酶。质粒pUC19-attP
-tetr用PvuⅡ、XmnⅠ双酶切得到的一个2765bp PvuⅡ-XmnⅠ片段中含attP和四环素抗性基因,不含质粒的复制起始位点。将该片段与竞争模板连接,转化到JM83/pSX1-2中,转化菌在含IPTG(1mmol/L)的LB中复苏1.5h后,用含四环素5μg/ml的LB琼脂平板筛选,筛选出的菌株进一步作PCR筛选,筛选出可扩增出430bp竞争模板的菌株作为内参照菌,命名为JM83/16SN。
药敏试验显示,菌株JM83/pSX1-2对四环素敏感(抑菌圈27mm),JM83/16SN对四环素中度敏感(抑菌圈18mm),二者均对氨苄青霉素耐药。从二菌株中均只能提取到一种质粒,分别用EcoRⅤ、PstⅠ酶切后电泳,结果显示其分子量和限制性内切酶图谱相同。两菌株染色体DNA以XbaⅠ酶切,用脉冲场凝胶电泳技术作DNA指纹图谱,结果显示其DNA指纹图谱相同,提示二者的同源性(图3)。这些证据说明竞争模板已插入到JM83/16SN的染色体中。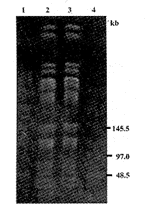
, http://www.100md.com
图3 菌株JM83/pSX1-2和JM83/16SN染色体DNA指纹图谱
Fig 3. PFGE analysis of DNA fingerprinting of JM83/pSX1-2 and JM83/16SN (digested by XbaⅠ)
1,4. Lambda ladders; 2. PFGE pattern of JM83/pSX1-2; 3. PFGE pattern of JM83/16SN
4.PA竞争性PCR定量检测方法〔6,7〕
(1) 定量法:将PA标准株作2倍系列稀释,取各稀释度的PA与JM83/16SN一起作竞争性PCR扩增,同时作定量培养,图4为竞争性PCR扩增结果,图5示各稀释度PA定量培养值的对数值与目标模板和竞争模板扩增产物摩尔比值对数值的回归直线。图5即为PA的定量回归直线,测定标本目标模板和竞争模板扩增产物摩尔比值,通过定量回归直线即可计算出目标模板的起始数量。此外,目标模板和竞争模板在平台期扩增产物摩尔比值的对数值与其起始数量的对数值存在良好的线性关系(r=-0.97),提示二者扩增效率的差别不大。
, 百拇医药
图4 2倍系列稀释的PA cPCR检测结果
Fig 4. cPCR assay of PA with 2-fold dilutions
Lane 1~8: PA samples with 2-fold dilutions; Lane 9: PCR markers
图5 PA cPCR定量回归直线
Fig 5. Quantitative curve of cPCR of PA
(2) 半定量法:在标本中加入已知浓度的内参照菌协同扩增,若目标模板与竞争模板扩增产物的摩尔比>1,则PA浓度大于内参照菌浓度,反之PA浓度小于内参照菌浓度。图6为1份PA标本10倍系列稀释后与JM83/16SN竞争性PCR扩增结果,稀释标本1~8 PA定量培养值分别为9.0×100~7,JM83/16SN定量培养值为1.1×105。稀释标本1~5竞争性PCR半定量法测定PA值<1.1×105,标本6~8 PA值>1.1×105。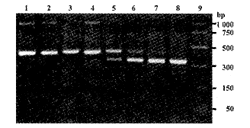
, http://www.100md.com
图6 10倍系列稀释的PA cPCR检测结果
Fig 6. cPCR assay of PA with 10-fold dilutions
Lane 1~8: PA samples with 10-fold dilutions; Lane 9: PCR markers (Promega)
选择PA PCR定性检测阴性的痰标本液化,用液化痰10倍系列稀释PA标准株,每个稀释度的PA标本分别与两种不同浓度的JM83/16SN作竞争性PCR检测,PA和JM83/16SN分别作定量培养。图7为1份PA标本10倍系列稀释后与JM83/16SN竞争性PCR扩增结果,稀释标本1~8,PA定量培养值分别为1.03×102~9,组1和组2,JM83/16SN定量培养值分别为7.0×106和7.0×103。稀释标本1~2,竞争性PCR半定量法测定PA值<7.0×103,标本3~5 PA值介于7.0×103与7.0×106之间,标本6~8 PA值>7.0×106。用同样方法对另2份PA标本作竞争性PCR半定量检测及定量培养,取得了类似结果。竞争性PCR半定量法测定标本中PA的浓度范围与定量培养结果一致。
, http://www.100md.com
图7 10倍系列稀释的PA cPCR检测结果
Fig 7. cPCR assay of PA with 10-fold dilutions
Lane 1~8: PA samples with 10-fold dilutions; Lnae 9: 100bp DNA ladder
讨论
野生型λ噬菌体感染宿主菌后可以裂解性或溶源性生长途径进行复制。在溶源性生长途径中,λ噬菌体通过自身表达的整合酶(Int)作用于其插入序列位点(attP),在宿主菌表达的整合寄主因子(IHF)协同作用下,将其单拷贝整合到宿主菌染色体的插入序列位点(attB)〔8〕。根据λ噬菌体的溶源机理,我们构建了整合载体,并用该载体构建了PA竞争性PCR内参照菌。
, 百拇医药
从图6我们可以看出,目标模板与竞争模板起始数量差别在一个数量级以上时,其中量少的模板扩增产物通过琼脂糖凝胶不能被检测出来,临床标本中PA浓度差别可能在10个数量级以上,因此用标准回归直线法,每份标本需要作多次竞争性PCR检测才能得到定量结果。采用半定量法可以较准确地测定标本中细菌的浓度范围,从图4我们可以看出,目标模板与竞争模板浓度相差两倍以上,扩增产物经琼脂糖凝胶电泳分离后在紫外灯下目测即可以区别开其量的差别,临床标本细菌浓度大多不会与内参照菌浓度正好相差2倍以内,因此不需要专门的设备即可以进行半定量检测。
痰标本由于存在PCR抑制物(如血红蛋白)等因素,可导致PCR出现假阴性结果〔9〕,在标本中加入内参照菌,如果目标模板和竞争模板都不能被扩增出来,提示可能存在某种因素使PCR出现假阴性。因此,竞争性PCR能有效地排除假阴性结果。
痰定量培养通过对标本中活细菌菌落形成单位(CFU)计数来鉴别致病菌与定植菌。竞争性PCR对痰标本中的活细菌和死细菌均可以定量测定,其优点是定量检测不受抗生素等因素的影响,但定量培养鉴别致病菌与定植菌的标准不一定适用于竞争性PCR。竞争性PCR鉴别致病菌与定植菌的标准尚需要通过大量检测临床标本并结合临床资料来确定。
, http://www.100md.com
肺部感染病原菌种类较多,若一次竞争性PCR只能对某种病原菌进行定量检测,其临床应用价值有限。Blok HJ,Wang RF等〔10,11〕根据多种细菌16S rDNA中共有的保守序列结构设计引物进行PCR扩增,用各自特异性寡核苷酸探针检测PCR产物,可以通过一次竞争性PCR同时对多种病原菌进行定量检测,为竞争性PCR的临床应用开拓了前景。
我们建立了一种构建内参照菌的通用方法,肺部感染常见病原菌均可以应用本方法来构建内参照菌,建立竞争性PCR检测方法。本研究为下呼吸道感染病原学诊断初步探讨了一种新途径。
参考文献
1,Karpati F, Jonasson J. Polymerase chain reaction for the detection of Pseudomonas aeruginosa, Stenotrophomonas maltophilia and Burlcholderia cepacia in sputum of patients with cystic fibrosis. Mol Cell Probes, 1996, 10(6):397-403.
, 百拇医药
2,〔美〕J萨姆布鲁克, EF弗里奇, T曼尼阿蒂斯,等著, 金冬雁, 黎孟枫,等译. 分子克隆实验指南. 第二版. 北京: 科学出版社, 1996.
3,Piatak M, Luk KC, Williams B, et al. Quantitative competitive polymerase chain reaction for accurate quantitation of HIV DNA and RNA species. Bio Techniques, 1993, 14(1):70-81.
4,Gautom RK. Rapid pulsed-field gel electrophoresis protocol for typing of Escherichia coli O157: H7 and other Gram-negative organisms in 1 day. J Clin Microbiol, 1997, 35(11):2977-2980.
, 百拇医药
5,Lee EC, Gumport RI, Gardner JF. Genetic analysis of bacteriophage λ integrase interactions with arm-type attachment site sequences. J Bacteriol, 1990, 172(3):1529-1538.
6,Sweet-Cordero EA, Chambers HF, Cicero-Sabido R, et al. Burden of Mycobacterium tuberculosis in sputum samples can be reliably determined using a quantitative, non-radioactive polymerase chain reaction assay. Tuber Lung Dis, 1996, 77(6):496-501.
7,Zachar V, Thomas RA, Goustin AS. Absolute quantification of target DNA: a simple competitive PCR for efficient analysis of multiple samples. Nucleic Acids Res, 1993, 21(8):2017.
, 百拇医药
8,Daniels DL. LambdaⅡ. Cold Spring Harbor Laboratory Press, U.S.A. 1983.
9,Victor T, du Toit R, van Helden PD. Purification of sputum samples through sucrose improves detection of Mycobacterium tuberculosis by polymerase chain reaction. J Clin Microbiol, 1992, 30(6):1514-1517.
10,Blok HJ, Gohlke AM, Akkermans AD. Quantitative analysis of 16S rDNA using competitive PCR and the QPCR system 5000. Biotechniques, 1997, 22(4):700-704.
11,Wang RF, Cao WW, Cerniglia CE. PCR detection and quantitation of predominant anaerobic bacteria in human and animal fecal samples. Appl Environ Microbiol, 1996, 62(4):1242-1247.
(收稿日期:1999-10-26), http://www.100md.com
单位:100730 卫生部北京医院呼吸内科
关键词:整合载体;DNA指纹图谱;铜绿假单胞菌;聚合酶链反应
中华微生物学和免疫学杂志000522 【 摘要 】 目的 建立一种构建竞争性PCR内参照菌的方法,并初步应用于铜绿假单胞菌(Pseudomonas aeruginosa,简称PA)的竞争性PCR定量检测。 方法 通过整合载体pSX1-2和pUC19-attP-tetr将竞争模板插入大肠杆菌JM83染色体中,构建内参照菌JM83/16SN。以JM83/16SN作为内参照,建立PA竞争性PCR定量和半定量检测方法。 结果 细菌质粒限制性酶切分析、药敏试验及染色体DNA指纹图谱分析证实竞争模板已插入到JM83/16SN染色体中。在竞争性PCR定量法中,得出定量回归方程y=-1.99x+14.05(r=-0.97)。将10倍系列稀释的PA标本作竞争性PCR半定量检测及定量培养,其结果存在良好的一致性。 结论 通过整合载体可以将竞争模板插入大肠杆菌染色体中来构建内参照菌株。竞争性PCR半定量法可以简便、准确地测定标本中PA浓度范围。
, 百拇医药
Construction and application of E. coli strains used as internal control for competitive PCR
DU Dijun, MIAO Jingzhi, ZHANG Xiuzhen.
(Department of Respiratory Medicine, Beijing Hospital, Ministry of Public Health, Beijing 100730, P. R. China)
【 Abstract 】 Objective To develop a method to construct E. coli strains used as internal control for competitive PCR(cPCR), with which to establish the cPCR assay of Pseudomonas aeruginosa (PA). Methods The attachment site of phage λ(attP) and tetracycline-resistant gene from pBR322 were subcloned into pUC19 to obtain recombinant plasmid pUC19-attP-tetr. A 85bps DNA fragment was inserted into the 345bps target template amplified from PA to obtain competitive template. The competitive template was inserted into chromosome of E. coli by integration vectors pSX1-2 and pUC19-attP-tetr to construct an E. coli strain designated JM83/16SN. Quantitative assay and semi-quantitative assay of PA with cPCR were established by using JM83/16SN as internal control. Results Restriction analysis of plasmid, drug susceptibility testing and DNA fingerprinting of chromosome DNA of JM83/16SN indicated that the competitive template had been inserted in chromosome of JM83/16SN. The equation y=-1.99x+14.05 (r=-0.97) was got in the quantitative assay of cPCR. PA samples of 10-fold dilutions were detected semi-quantitatively by cPCR and detected by quantitative culture. A good correlation was demonstrated between the results of semi-quantitatively assay with cPCR and the results of quantitative culture. Conclusions Competitive template can be inserted into chromosome of E. coli by integration vectors to construct E. coli strain used as internal control for cPCR. Semi-quantitative assay with cPCR provides a simple and accurate way to detect the concentration ranges of PA.
, 百拇医药
【 Subject words 】 Quantitative PCR; Genetic vectors; DNA fingerprinting; Pseudomonas aeruginosa
痰标本易受口腔定植菌污染,造成下呼吸道感染病原学诊断困难。竞争性PCR能定量检测痰标本中细菌浓度,可以用于鉴别致病菌与定植菌。影响竞争性PCR准确性的因素较多,大多可以通过优化实验条件予以消除。目前竞争性PCR未被控制的变异性主要来自标本的质量、标本处理过程中的损失等因素。以含竞争模板的菌株作为内参照,加入标本中,参与标本的处理过程,理论上可以减少标本处理过程对竞争性PCR定量检测的影响。因此,我们建立了一种构建内参照菌的方法,并初步应用于PA的竞争性PCR定量检测。
材料与方法
菌株、质粒和噬菌体:大肠杆菌JM109、JM83、XL1-Blue由茆灿泉博士惠赠,PA标准株(菌株号:ATCC27853)由北京医院检验科细菌室提供,质粒pUC19、pBR322、和λ噬菌体DNA(非甲基化)购自华美生物工程公司,质粒pSX1-2由Gardner JF教授惠赠。
, 百拇医药
酶和化学试剂:限制性内切酶、T4 DNA连接酶、RNA酶A、Taq DNA聚合酶、蛋白酶K、IPTG、X-Gal及PCR裂解缓冲液购自华美生物工程公司,dNTP为宝灵曼公司产品,85bp PCR Marker购自天象人公司,低熔点琼脂糖(DNA级)和脉冲场级琼脂糖为Bio-Rad实验室产品,普通琼脂糖(电泳级)为北京中山生物技术公司产品,PA PCR引物参照文献设计〔1〕,引物序列分别为P1:5′-GTGCCTGCAGCCGCGGTAAT-3′,P2:5′-TGCGCCACTAAGATGTCAAG-3′,由中国科学院微生物研究所基因工程中心合成,其余试剂均为分析纯。
DNA重组操作:质粒DNA的制备(碱裂解法)、质粒转化(氯化钙转化程序)、含重组质粒的细菌菌落的鉴定、DNA限制性内切酶反应、DNA片段的分离及纯化、外源DNA和质粒载体的连接反应等操作参照《分子克隆实验指南》略作修改进行〔2〕。
DNA质量及分子量测定:采用Gel Doc 2000凝胶数字成像系统及凝胶影像分析软件Multi-AnalystR/PC(1.1版)进行测定。该数字成像系统和影像分析软件为Bio-Rad实验室产品。质量和分子量标准采用Promega公司生产的PCR Markers。DNA条带间摩尔比的计算采用其质量比乘以分子长度(bp)比的倒数〔3〕。
, 百拇医药
细菌染色体DNA指纹图谱:采用文献中介绍的“标准PFGE程序”略作修改进行〔4〕。脉冲场电泳设备为Bio-Rad实验室生产的GenePathTM系统。
细菌浓度测定及药敏试验方法:细菌浓度测定采用细菌定量培养及比浊法进行,细菌药敏试验采用纸片琼脂扩散法。
痰标本的处理:痰标本与等体积的液化剂(4% NaOH,100mmol/L柠檬酸钠,10mg/ml N-乙酰-L-半胱氨酸)混匀,室温哺育15~20min。取液化痰400μl,12000×g离心3min。去上清液,用500μl灭菌去离子水重悬沉淀,12000×g离心3min。去上清液,用20μl裂解缓冲液重悬沉淀,加2滴石蜡油,300×g离心10s,然后99 ℃裂解15min,标本贮存在4℃备用。
PCR扩增条件:反应混合物组成:10mmol/L Tris*Cl (25℃时pH9.0),50mmol/L KCl,1.5mmol/L MgCl2,0.1% TritonX-100,dATP、dTTP、dCTP、dGTP均为200μmol/L,Taq酶2.5U,引物P1、P2均为0.1μmol/L,标本10μl,反应体积100μl。温度循环参数:变性94℃ 1min,退火55℃ 1min,延伸72℃ 2min。扩增35个循环后于72℃延伸10min,标本贮存于4℃备用。480型DNA热循环仪为PE公司产品。
, http://www.100md.com
结果
1.整合载体的构建:整合载体由pUC19-attP-tetr和pSX1-2两个质粒组成。质粒pUC19-attP-tetr按图1所示进行构建。用限制性酶切方法获得λ噬菌体染色体第27480至27973位之间的493bp HindⅢ-BamHⅠ片段(该片段含attP),将该片段克隆到质粒pUC19上,获得重组质粒pUC19-attP。将质粒pBR322第0~2067位间的EcoRⅠ-PvuⅡ片段(该片段含四环素抗性基因)克隆到质粒pUC19-attP的EcoRⅠ-ScaⅠ位点之间,构建成质粒pUC19-attP-tetr(图2)。pSX1-2是含λ噬菌体整合酶基因(int)的表达质粒,在IPTG诱导下可表达整合酶〔5〕。

图1 整合载体pUC19-attP-tetr的构建
, http://www.100md.com
Fig 1. Construction of integration vector pUC19-attP-tetr

图2 质粒pUC19-attP-tetr和pUC19-16SN的限制性酶切分析
Fig 2. Restriction analysis of plasmids pUC19-attP-tetr and pUC19-16SN
1. pUC19-attP-tetr/PvuⅡ+XmnⅠ; 2. pUC19-16SN/EcoRⅠ+PstⅠ; 3. λDNA/EcoRⅠ+HindⅢ markers
2.竞争模板的构建:用引物P1、P2可从PA 16S rDNA中扩增出1个345bp目标模板。用SmaⅠ酶切分析目标模板,显示其中含有单一SmaⅠ酶切位点。将目标模板插入到pUC19的SmaⅠ位点,获得重组质粒pUC19-16S,然后将1个85bp片段插入到pUC19-16S的SmaⅠ位点,获得重组质粒pUC19-16SN(图2)。用引物P1、P2可从pUC19-16SN中扩增出1个430bp片段,该片段作为竞争模板。
, 百拇医药
3.内参照菌株的构建及鉴定:将质粒pSX1-2转化到大肠杆菌JM83中,得到菌株JM83/pSX1-2,该菌株在IPTG诱导下可以表达整合酶。质粒pUC19-attP
-tetr用PvuⅡ、XmnⅠ双酶切得到的一个2765bp PvuⅡ-XmnⅠ片段中含attP和四环素抗性基因,不含质粒的复制起始位点。将该片段与竞争模板连接,转化到JM83/pSX1-2中,转化菌在含IPTG(1mmol/L)的LB中复苏1.5h后,用含四环素5μg/ml的LB琼脂平板筛选,筛选出的菌株进一步作PCR筛选,筛选出可扩增出430bp竞争模板的菌株作为内参照菌,命名为JM83/16SN。
药敏试验显示,菌株JM83/pSX1-2对四环素敏感(抑菌圈27mm),JM83/16SN对四环素中度敏感(抑菌圈18mm),二者均对氨苄青霉素耐药。从二菌株中均只能提取到一种质粒,分别用EcoRⅤ、PstⅠ酶切后电泳,结果显示其分子量和限制性内切酶图谱相同。两菌株染色体DNA以XbaⅠ酶切,用脉冲场凝胶电泳技术作DNA指纹图谱,结果显示其DNA指纹图谱相同,提示二者的同源性(图3)。这些证据说明竞争模板已插入到JM83/16SN的染色体中。

, http://www.100md.com
图3 菌株JM83/pSX1-2和JM83/16SN染色体DNA指纹图谱
Fig 3. PFGE analysis of DNA fingerprinting of JM83/pSX1-2 and JM83/16SN (digested by XbaⅠ)
1,4. Lambda ladders; 2. PFGE pattern of JM83/pSX1-2; 3. PFGE pattern of JM83/16SN
4.PA竞争性PCR定量检测方法〔6,7〕
(1) 定量法:将PA标准株作2倍系列稀释,取各稀释度的PA与JM83/16SN一起作竞争性PCR扩增,同时作定量培养,图4为竞争性PCR扩增结果,图5示各稀释度PA定量培养值的对数值与目标模板和竞争模板扩增产物摩尔比值对数值的回归直线。图5即为PA的定量回归直线,测定标本目标模板和竞争模板扩增产物摩尔比值,通过定量回归直线即可计算出目标模板的起始数量。此外,目标模板和竞争模板在平台期扩增产物摩尔比值的对数值与其起始数量的对数值存在良好的线性关系(r=-0.97),提示二者扩增效率的差别不大。

, 百拇医药
图4 2倍系列稀释的PA cPCR检测结果
Fig 4. cPCR assay of PA with 2-fold dilutions
Lane 1~8: PA samples with 2-fold dilutions; Lane 9: PCR markers

图5 PA cPCR定量回归直线
Fig 5. Quantitative curve of cPCR of PA
(2) 半定量法:在标本中加入已知浓度的内参照菌协同扩增,若目标模板与竞争模板扩增产物的摩尔比>1,则PA浓度大于内参照菌浓度,反之PA浓度小于内参照菌浓度。图6为1份PA标本10倍系列稀释后与JM83/16SN竞争性PCR扩增结果,稀释标本1~8 PA定量培养值分别为9.0×100~7,JM83/16SN定量培养值为1.1×105。稀释标本1~5竞争性PCR半定量法测定PA值<1.1×105,标本6~8 PA值>1.1×105。

, http://www.100md.com
图6 10倍系列稀释的PA cPCR检测结果
Fig 6. cPCR assay of PA with 10-fold dilutions
Lane 1~8: PA samples with 10-fold dilutions; Lane 9: PCR markers (Promega)
选择PA PCR定性检测阴性的痰标本液化,用液化痰10倍系列稀释PA标准株,每个稀释度的PA标本分别与两种不同浓度的JM83/16SN作竞争性PCR检测,PA和JM83/16SN分别作定量培养。图7为1份PA标本10倍系列稀释后与JM83/16SN竞争性PCR扩增结果,稀释标本1~8,PA定量培养值分别为1.03×102~9,组1和组2,JM83/16SN定量培养值分别为7.0×106和7.0×103。稀释标本1~2,竞争性PCR半定量法测定PA值<7.0×103,标本3~5 PA值介于7.0×103与7.0×106之间,标本6~8 PA值>7.0×106。用同样方法对另2份PA标本作竞争性PCR半定量检测及定量培养,取得了类似结果。竞争性PCR半定量法测定标本中PA的浓度范围与定量培养结果一致。

, http://www.100md.com
图7 10倍系列稀释的PA cPCR检测结果
Fig 7. cPCR assay of PA with 10-fold dilutions
Lane 1~8: PA samples with 10-fold dilutions; Lnae 9: 100bp DNA ladder
讨论
野生型λ噬菌体感染宿主菌后可以裂解性或溶源性生长途径进行复制。在溶源性生长途径中,λ噬菌体通过自身表达的整合酶(Int)作用于其插入序列位点(attP),在宿主菌表达的整合寄主因子(IHF)协同作用下,将其单拷贝整合到宿主菌染色体的插入序列位点(attB)〔8〕。根据λ噬菌体的溶源机理,我们构建了整合载体,并用该载体构建了PA竞争性PCR内参照菌。
, 百拇医药
从图6我们可以看出,目标模板与竞争模板起始数量差别在一个数量级以上时,其中量少的模板扩增产物通过琼脂糖凝胶不能被检测出来,临床标本中PA浓度差别可能在10个数量级以上,因此用标准回归直线法,每份标本需要作多次竞争性PCR检测才能得到定量结果。采用半定量法可以较准确地测定标本中细菌的浓度范围,从图4我们可以看出,目标模板与竞争模板浓度相差两倍以上,扩增产物经琼脂糖凝胶电泳分离后在紫外灯下目测即可以区别开其量的差别,临床标本细菌浓度大多不会与内参照菌浓度正好相差2倍以内,因此不需要专门的设备即可以进行半定量检测。
痰标本由于存在PCR抑制物(如血红蛋白)等因素,可导致PCR出现假阴性结果〔9〕,在标本中加入内参照菌,如果目标模板和竞争模板都不能被扩增出来,提示可能存在某种因素使PCR出现假阴性。因此,竞争性PCR能有效地排除假阴性结果。
痰定量培养通过对标本中活细菌菌落形成单位(CFU)计数来鉴别致病菌与定植菌。竞争性PCR对痰标本中的活细菌和死细菌均可以定量测定,其优点是定量检测不受抗生素等因素的影响,但定量培养鉴别致病菌与定植菌的标准不一定适用于竞争性PCR。竞争性PCR鉴别致病菌与定植菌的标准尚需要通过大量检测临床标本并结合临床资料来确定。
, http://www.100md.com
肺部感染病原菌种类较多,若一次竞争性PCR只能对某种病原菌进行定量检测,其临床应用价值有限。Blok HJ,Wang RF等〔10,11〕根据多种细菌16S rDNA中共有的保守序列结构设计引物进行PCR扩增,用各自特异性寡核苷酸探针检测PCR产物,可以通过一次竞争性PCR同时对多种病原菌进行定量检测,为竞争性PCR的临床应用开拓了前景。
我们建立了一种构建内参照菌的通用方法,肺部感染常见病原菌均可以应用本方法来构建内参照菌,建立竞争性PCR检测方法。本研究为下呼吸道感染病原学诊断初步探讨了一种新途径。
参考文献
1,Karpati F, Jonasson J. Polymerase chain reaction for the detection of Pseudomonas aeruginosa, Stenotrophomonas maltophilia and Burlcholderia cepacia in sputum of patients with cystic fibrosis. Mol Cell Probes, 1996, 10(6):397-403.
, 百拇医药
2,〔美〕J萨姆布鲁克, EF弗里奇, T曼尼阿蒂斯,等著, 金冬雁, 黎孟枫,等译. 分子克隆实验指南. 第二版. 北京: 科学出版社, 1996.
3,Piatak M, Luk KC, Williams B, et al. Quantitative competitive polymerase chain reaction for accurate quantitation of HIV DNA and RNA species. Bio Techniques, 1993, 14(1):70-81.
4,Gautom RK. Rapid pulsed-field gel electrophoresis protocol for typing of Escherichia coli O157: H7 and other Gram-negative organisms in 1 day. J Clin Microbiol, 1997, 35(11):2977-2980.
, 百拇医药
5,Lee EC, Gumport RI, Gardner JF. Genetic analysis of bacteriophage λ integrase interactions with arm-type attachment site sequences. J Bacteriol, 1990, 172(3):1529-1538.
6,Sweet-Cordero EA, Chambers HF, Cicero-Sabido R, et al. Burden of Mycobacterium tuberculosis in sputum samples can be reliably determined using a quantitative, non-radioactive polymerase chain reaction assay. Tuber Lung Dis, 1996, 77(6):496-501.
7,Zachar V, Thomas RA, Goustin AS. Absolute quantification of target DNA: a simple competitive PCR for efficient analysis of multiple samples. Nucleic Acids Res, 1993, 21(8):2017.
, 百拇医药
8,Daniels DL. LambdaⅡ. Cold Spring Harbor Laboratory Press, U.S.A. 1983.
9,Victor T, du Toit R, van Helden PD. Purification of sputum samples through sucrose improves detection of Mycobacterium tuberculosis by polymerase chain reaction. J Clin Microbiol, 1992, 30(6):1514-1517.
10,Blok HJ, Gohlke AM, Akkermans AD. Quantitative analysis of 16S rDNA using competitive PCR and the QPCR system 5000. Biotechniques, 1997, 22(4):700-704.
11,Wang RF, Cao WW, Cerniglia CE. PCR detection and quantitation of predominant anaerobic bacteria in human and animal fecal samples. Appl Environ Microbiol, 1996, 62(4):1242-1247.
(收稿日期:1999-10-26), http://www.100md.com