小鼠IL-3 cDNA转染的骨髓基质细胞促进造血的实验研究
作者:袁良平 粟永萍 程天民 郑华金 刘林 王延江 瞿红云
单位:袁良平 粟永萍 程天民 刘林 王延江(400038 重庆,第三军医大学复合伤研究所);郑华金 瞿红云(成都军区总医院血液科)
关键词:
中华血液学杂志000511 骨髓基质细胞是造血微环境中的重要组成部分。我们借助逆转录病毒载体将小鼠白细胞介素3(IL-3)cDNA导入小鼠骨髓基质细胞,利用聚合酶链反应(PCR)检测基质细胞是否导入外源性IL-3基因,并观察其对造血细胞增殖活性的影响。
材料和方法
1 材料 逆转录病毒载体pLXSN及pUC-IL-3质粒由刘昕博士馈赠,工具酶购自宝灵曼及新英格兰公司,BALB/c小鼠购自本校动物中心。
, 百拇医药
2 重组IL-3 cDNA 的构建[1] 用XhoⅠ将载体pLXSN线性化并将IL-3 cDNA由pUC-IL-3质粒上切下(片段约1.2kb),经V型槽回收,T4 Ligase连接,得到重组子pLXSN-IL-3;用HindⅢ酶切鉴定IL-3片段插入方向。
3 重组逆转录病毒的产生及病毒滴液检测 利用脂质体dosper将pLXSN-IL-3和空载体pLXSN,分别转染入包装细胞PA317,用G418筛选PA317的细胞克隆。用含病毒的培养上清液转染NIH/3T3细胞,计算每皿G418抗性细胞克隆,即为产病毒滴度,以每毫升集落形成单位(CFU/ml)表示,计算公式:抗病毒效价=每皿克隆数×上清稀释倍数。
4 转染小鼠骨髓基质细胞(BMS)[2] 取BALB/c小鼠股骨骨髓,制成单细胞悬液,取1×106个细胞在基质细胞培养体系中培养(DMEM培养液,体积分数为20%的胎牛血清,体积分数为10%的马血清,10-6mol/L氢化可的松,青、链霉素各100U/ml),3周后加含高效价病毒上清液(以不含病毒的培养液及含空载体的上清液作对照),继续培养48h,G418筛选,约10d后克隆形成。挑选各组阳性克隆(BMS/pLXSNIL-3和BMS/pLXSN),培养扩增后收集细胞和上清备用。
, 百拇医药
5 培养基质细胞基因组DNA的提取及基因检测
5.1 按Sambrook等的方法[1]进行培养细胞基因组DNA的提取,真空抽滤至接近干燥,TE溶解后备用。
5.2 PCR检测载体中NeoR基因及IL-3基因:
5.2.1 检测NeoR的基因引物:
引物1:5′-CCAGGCTCAAGGCGCGCATGA-3′;
引物2:3′-TCACGGGTAGCCAACGCTATG-5′。
产物长度170bp。
5.2.2 检测IL-3的基因引物:
, 百拇医药
引物1:5′-CTGAATTCATGGTTCTTGCCAGC-3′;
引物2:5′-TCGTCGACTTAACATTCCACGGTTCC-3′。
产物长度500bp。
PCR反应条件:总反应体积为50μl,其中DNA模板10μl (1μg),10×缓冲液5μl,引物各1μl(1μg), MgCl2(15mmol/L) 5μl,dNTP 3μl, dH2O 25μl。95℃ 5min,94℃ 90s,55℃ 60s,72℃ 60s,循环35次,72℃延伸10min。PCR产物经25g/L琼脂糖凝胶电泳,标准DNA分子量为PCR大分子量标记。
6 小鼠骨髓CFU-GM的培养 参照文献[3]的方法,稍作改良。
, 百拇医药 7 噻唑蓝(MTT)法检测细胞增殖活性 NFS-60细胞分别与基质细胞各组混合培养24h、48h、72h,加入MTT后检测增殖活性。
结 果
1 IL-3 cDNA与逆转录载体pLXSN克隆后,得到重组子pLXSN-IL-3质粒,用XhoⅠ酶切鉴定,证实IL-3 cDNA已重组到pLXSN上。HindⅢ酶切,得到1240bp和633bp 2个片段,前者为正向连接,后者为反向连接。
2 病毒滴度的检测 pLXSN-IL-3和空载体pLXSN经脂质体dosper转染PA317细胞,经G418筛选得到产病毒细胞株,转化NIH/3T3细胞,测得其产毒滴度在105CFU/ml以上。
3 转染基质细胞上清生物活性检测 结果见表1。此结果表明,转染pLXSN/IL-3的基质细胞有明显促进小鼠骨髓CFU-GM增殖的作用, 空载体组及未转染基质细胞组也有促进5.1 按Sambrook等的方法[1]进行培养细胞基因组DNA的提取,真空抽滤至接近干燥,TE溶解后备用。CFU-GM增殖的作用,但不及转染组。
, 百拇医药
表1 骨髓基质细胞培养上清液的生物活性检测(CFU-GM)(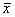 ±s) 组 别
±s) 组 别
上清液的稀释度
5-1
5-2
5-3
5-4
BMS/pLXSNIL-3
765.0±123.4**
603.0±110.4**
, 百拇医药
512.0±68.6**
310.0±58.3**
BMS/pLXSN
260.1±21.4*△
245.6±26.3*△
176.0±21.3*△
121.0±25.4*△
BMS
256.5±22.1*△
248.2±24.2*△
, http://www.100md.com
167.0±24.2*△
118.4±25.6*△
EMEM
40.1±6.6
38.8±7.1
38.2±6.8
34.1±5.7
注:上清液按1∶5稀释;与各组比较,**P<0.01,pLXSN组与BMS组比较,*P<0.05,与DMEM组比较,△P<0.014 PCR检测骨髓基质细胞中外源性基因 将含5%高效价病毒的培养上清液(pLXSN-IL-3和空载体pLXSN)感染BMS,G418筛选,10d后均表现出大量G418抗性克隆,基因转移效率分别为40.3%和52.2%,未转染的BMS组加入G418后3~5d全部死亡(表2)。
, 百拇医药
表2 PCR检测基质细胞中的外源基因 组别
加入上清成分
基因转移
效率(%)
PCR检测
BMS
含pLXSNIL-3
40.3
扩增出NeoR及IL-3基因
BMS
含pLXSN
52.2
, http://www.100md.com
扩增出NeoR,无IL-3基因
BMS
不含pLXSN
0
未扩增出NeoR及IL-3基因
及pLXSN-IL-3
5 NFS-60细胞增殖活性检测 结果见表3。无基质细胞混合培养的NFS-60(亦未加入其它造血因子)培养24h后大部分死亡(未加入MTT检测),提示基质细胞具有促进NSF-60细胞增殖的作用,但不及转染pLXSN/IL-3的基质细胞。表3 NFS-60细胞增殖活性检测(MTT法,A值) 组别
培养时间
24h
, http://www.100md.com
48h
72h
BMS/pLXSNIL-3
0.68±0.04**
0.76±0.05**
0.70±0.05**
BMS/pLXSN
0.32±0.05*
0.40±0.04*
0.34±0.03*
, http://www.100md.com
BMS
0.30±0.03
0.39±0.03
0.32±0.05
注:与各组比较,**P<0.01;与BMS组比较,*P>0.05讨 论
骨髓造血干/祖细胞的增殖、分化受多方面的调控,除造血因子外,最重要的就是造血微环境。BMS是造血微环境的主要成分,BMS一方面与造血干细胞紧密接触,以保证干细胞的自我更新,另一方面分泌造血生长因子促进造血干/祖细胞的增殖与分化。正常情况下,BMS能少量地分泌IL-3、IL-6、GM-CSF等细胞因子,但浓度不稳定且非常微量。在放、化疗条件下,较高浓度IL-3对恢复骨髓造血有一定促进作用[4]。整合了外源性IL-3 cDNA的基质细胞能显著促进小鼠骨髓CFU-GM的形成,其表达的IL-3具有一定的生物活性。用重组IL-3 cDNA逆转录病毒载体转染的小鼠BMS输入受体小鼠后,在其血清中出现一定水平的IL-3活性(约250U/ml),且在小鼠被照射后能促进外周血白细胞恢复。基因治疗的关键是正确选择基因导入的靶细胞。有学者将GM-CSF cDNA导入造血细胞PDCP,结果发现GM-CSF转移后PDCP丧失了自我更新能力,同步分化为正常成熟粒-单核细胞[5]。较高浓度的IL-3能刺激IL-3依赖细胞TF-1表达IL-3受体β链,增加细胞对IL-3的亲和力。我们的实验结果证实,转染pLXSN/IL-3的基质细胞有明显促进小鼠骨髓CFU-GM增殖的作用。
, 百拇医药
参考文献
1,Sambrook J, Fritch EF, Manitafis T. Molecular cloning, a laboratory manual. 2nd. New York: Cold Spring Harbor Laboratory Press, 1989. 9-11.
2,Kittler EL, McGrath H, Temeles D, et al. Biological significance of constitutive and subliminal growth factor production by bone marrow stroma. Blood, 1992,79:3168-3178.
3,李青,曹雪涛,蔡荣,等.白细胞介素-3基因疗法对同基因骨髓移植造血重建的影响.中华血液学杂志, 1996,17:237-239.
, 百拇医药
4,刘秀珍. 造血祖细胞培养技术实验手册. 北京: 北京出版社, 1993. 45-49.
5,Chang JM,Johnson GR. Effects of spleen colony forming unit self-renewal after retroviral-mediated gene transfer of multi-colony-stimulating factor granulocyte-macrophage colony-stimulating factor or granulocyte colony-stimulating factor. Exp Hematol, 1992, 30:602-607.
(收稿日期:1998-11-16), 百拇医药
单位:袁良平 粟永萍 程天民 刘林 王延江(400038 重庆,第三军医大学复合伤研究所);郑华金 瞿红云(成都军区总医院血液科)
关键词:
中华血液学杂志000511 骨髓基质细胞是造血微环境中的重要组成部分。我们借助逆转录病毒载体将小鼠白细胞介素3(IL-3)cDNA导入小鼠骨髓基质细胞,利用聚合酶链反应(PCR)检测基质细胞是否导入外源性IL-3基因,并观察其对造血细胞增殖活性的影响。
材料和方法
1 材料 逆转录病毒载体pLXSN及pUC-IL-3质粒由刘昕博士馈赠,工具酶购自宝灵曼及新英格兰公司,BALB/c小鼠购自本校动物中心。
, 百拇医药
2 重组IL-3 cDNA 的构建[1] 用XhoⅠ将载体pLXSN线性化并将IL-3 cDNA由pUC-IL-3质粒上切下(片段约1.2kb),经V型槽回收,T4 Ligase连接,得到重组子pLXSN-IL-3;用HindⅢ酶切鉴定IL-3片段插入方向。
3 重组逆转录病毒的产生及病毒滴液检测 利用脂质体dosper将pLXSN-IL-3和空载体pLXSN,分别转染入包装细胞PA317,用G418筛选PA317的细胞克隆。用含病毒的培养上清液转染NIH/3T3细胞,计算每皿G418抗性细胞克隆,即为产病毒滴度,以每毫升集落形成单位(CFU/ml)表示,计算公式:抗病毒效价=每皿克隆数×上清稀释倍数。
4 转染小鼠骨髓基质细胞(BMS)[2] 取BALB/c小鼠股骨骨髓,制成单细胞悬液,取1×106个细胞在基质细胞培养体系中培养(DMEM培养液,体积分数为20%的胎牛血清,体积分数为10%的马血清,10-6mol/L氢化可的松,青、链霉素各100U/ml),3周后加含高效价病毒上清液(以不含病毒的培养液及含空载体的上清液作对照),继续培养48h,G418筛选,约10d后克隆形成。挑选各组阳性克隆(BMS/pLXSNIL-3和BMS/pLXSN),培养扩增后收集细胞和上清备用。
, 百拇医药
5 培养基质细胞基因组DNA的提取及基因检测
5.1 按Sambrook等的方法[1]进行培养细胞基因组DNA的提取,真空抽滤至接近干燥,TE溶解后备用。
5.2 PCR检测载体中NeoR基因及IL-3基因:
5.2.1 检测NeoR的基因引物:
引物1:5′-CCAGGCTCAAGGCGCGCATGA-3′;
引物2:3′-TCACGGGTAGCCAACGCTATG-5′。
产物长度170bp。
5.2.2 检测IL-3的基因引物:
, 百拇医药
引物1:5′-CTGAATTCATGGTTCTTGCCAGC-3′;
引物2:5′-TCGTCGACTTAACATTCCACGGTTCC-3′。
产物长度500bp。
PCR反应条件:总反应体积为50μl,其中DNA模板10μl (1μg),10×缓冲液5μl,引物各1μl(1μg), MgCl2(15mmol/L) 5μl,dNTP 3μl, dH2O 25μl。95℃ 5min,94℃ 90s,55℃ 60s,72℃ 60s,循环35次,72℃延伸10min。PCR产物经25g/L琼脂糖凝胶电泳,标准DNA分子量为PCR大分子量标记。
6 小鼠骨髓CFU-GM的培养 参照文献[3]的方法,稍作改良。
, 百拇医药 7 噻唑蓝(MTT)法检测细胞增殖活性 NFS-60细胞分别与基质细胞各组混合培养24h、48h、72h,加入MTT后检测增殖活性。
结 果
1 IL-3 cDNA与逆转录载体pLXSN克隆后,得到重组子pLXSN-IL-3质粒,用XhoⅠ酶切鉴定,证实IL-3 cDNA已重组到pLXSN上。HindⅢ酶切,得到1240bp和633bp 2个片段,前者为正向连接,后者为反向连接。
2 病毒滴度的检测 pLXSN-IL-3和空载体pLXSN经脂质体dosper转染PA317细胞,经G418筛选得到产病毒细胞株,转化NIH/3T3细胞,测得其产毒滴度在105CFU/ml以上。
3 转染基质细胞上清生物活性检测 结果见表1。此结果表明,转染pLXSN/IL-3的基质细胞有明显促进小鼠骨髓CFU-GM增殖的作用, 空载体组及未转染基质细胞组也有促进5.1 按Sambrook等的方法[1]进行培养细胞基因组DNA的提取,真空抽滤至接近干燥,TE溶解后备用。CFU-GM增殖的作用,但不及转染组。
, 百拇医药
表1 骨髓基质细胞培养上清液的生物活性检测(CFU-GM)(
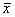 ±s) 组 别
±s) 组 别上清液的稀释度
5-1
5-2
5-3
5-4
BMS/pLXSNIL-3
765.0±123.4**
603.0±110.4**
, 百拇医药
512.0±68.6**
310.0±58.3**
BMS/pLXSN
260.1±21.4*△
245.6±26.3*△
176.0±21.3*△
121.0±25.4*△
BMS
256.5±22.1*△
248.2±24.2*△
, http://www.100md.com
167.0±24.2*△
118.4±25.6*△
EMEM
40.1±6.6
38.8±7.1
38.2±6.8
34.1±5.7
注:上清液按1∶5稀释;与各组比较,**P<0.01,pLXSN组与BMS组比较,*P<0.05,与DMEM组比较,△P<0.014 PCR检测骨髓基质细胞中外源性基因 将含5%高效价病毒的培养上清液(pLXSN-IL-3和空载体pLXSN)感染BMS,G418筛选,10d后均表现出大量G418抗性克隆,基因转移效率分别为40.3%和52.2%,未转染的BMS组加入G418后3~5d全部死亡(表2)。
, 百拇医药
表2 PCR检测基质细胞中的外源基因 组别
加入上清成分
基因转移
效率(%)
PCR检测
BMS
含pLXSNIL-3
40.3
扩增出NeoR及IL-3基因
BMS
含pLXSN
52.2
, http://www.100md.com
扩增出NeoR,无IL-3基因
BMS
不含pLXSN
0
未扩增出NeoR及IL-3基因
及pLXSN-IL-3
5 NFS-60细胞增殖活性检测 结果见表3。无基质细胞混合培养的NFS-60(亦未加入其它造血因子)培养24h后大部分死亡(未加入MTT检测),提示基质细胞具有促进NSF-60细胞增殖的作用,但不及转染pLXSN/IL-3的基质细胞。表3 NFS-60细胞增殖活性检测(MTT法,A值) 组别
培养时间
24h
, http://www.100md.com
48h
72h
BMS/pLXSNIL-3
0.68±0.04**
0.76±0.05**
0.70±0.05**
BMS/pLXSN
0.32±0.05*
0.40±0.04*
0.34±0.03*
, http://www.100md.com
BMS
0.30±0.03
0.39±0.03
0.32±0.05
注:与各组比较,**P<0.01;与BMS组比较,*P>0.05讨 论
骨髓造血干/祖细胞的增殖、分化受多方面的调控,除造血因子外,最重要的就是造血微环境。BMS是造血微环境的主要成分,BMS一方面与造血干细胞紧密接触,以保证干细胞的自我更新,另一方面分泌造血生长因子促进造血干/祖细胞的增殖与分化。正常情况下,BMS能少量地分泌IL-3、IL-6、GM-CSF等细胞因子,但浓度不稳定且非常微量。在放、化疗条件下,较高浓度IL-3对恢复骨髓造血有一定促进作用[4]。整合了外源性IL-3 cDNA的基质细胞能显著促进小鼠骨髓CFU-GM的形成,其表达的IL-3具有一定的生物活性。用重组IL-3 cDNA逆转录病毒载体转染的小鼠BMS输入受体小鼠后,在其血清中出现一定水平的IL-3活性(约250U/ml),且在小鼠被照射后能促进外周血白细胞恢复。基因治疗的关键是正确选择基因导入的靶细胞。有学者将GM-CSF cDNA导入造血细胞PDCP,结果发现GM-CSF转移后PDCP丧失了自我更新能力,同步分化为正常成熟粒-单核细胞[5]。较高浓度的IL-3能刺激IL-3依赖细胞TF-1表达IL-3受体β链,增加细胞对IL-3的亲和力。我们的实验结果证实,转染pLXSN/IL-3的基质细胞有明显促进小鼠骨髓CFU-GM增殖的作用。
, 百拇医药
参考文献
1,Sambrook J, Fritch EF, Manitafis T. Molecular cloning, a laboratory manual. 2nd. New York: Cold Spring Harbor Laboratory Press, 1989. 9-11.
2,Kittler EL, McGrath H, Temeles D, et al. Biological significance of constitutive and subliminal growth factor production by bone marrow stroma. Blood, 1992,79:3168-3178.
3,李青,曹雪涛,蔡荣,等.白细胞介素-3基因疗法对同基因骨髓移植造血重建的影响.中华血液学杂志, 1996,17:237-239.
, 百拇医药
4,刘秀珍. 造血祖细胞培养技术实验手册. 北京: 北京出版社, 1993. 45-49.
5,Chang JM,Johnson GR. Effects of spleen colony forming unit self-renewal after retroviral-mediated gene transfer of multi-colony-stimulating factor granulocyte-macrophage colony-stimulating factor or granulocyte colony-stimulating factor. Exp Hematol, 1992, 30:602-607.
(收稿日期:1998-11-16), 百拇医药