继发性红细胞增多症动物模型的建立
作者:马麟麟 杨宇飞 周霭祥 张玉海 刘利 应红光
单位:马麟麟(100050 北京,首都医科大学附属友谊医院泌尿科);张玉海(100050 北京,首都医科大学附属友谊医院泌尿科);刘利(100050 北京,首都医科大学附属友谊医院泌尿科);杨宇飞(中国中医研究院西苑医院肿瘤科);周霭祥(中国中医研究院西苑医院肿瘤科);应红光(中国医学科学院、中国协和医科大学血液学研究所)
关键词:
中华血液学杂志000518 有临床研究证实,各种继发性红细胞增多症的发生大多与血清红细胞生成素(Epo)水平异常升高有关[1]。据此,我们利用注射外源性Epo的方法,建立大鼠继发性红细胞增多症模型。为研究此病提供一种简便、准确的动物模型。
材料和方法
, http://www.100md.com 1 实验材料
1.1 实验动物:中国药品生物制品检定所提供近交系Ⅱ级Wistar大鼠,雌、雄性各半,3月龄,体重(250±50)g。北京友谊医院Ⅱ级动物室饲养。
1.2 试剂:Epo(美国Angen公司出品)。
2 实验方法
2.1 实验动物分组:大鼠48只,38只为模型组,10只为正常对照组。
2.2 用药方法:①剂量:全量每次75IU/250g体重,维持量每次40IU/250g体重(根据成人剂量每次3000IU/70kg体重的4倍,换算成大鼠每次注射剂量)。②注射时间:第1,2,3,4,6,8,10,13天注射全量;第16,19天注射维持量,此后停止注射。对照组同上时间注射等量注射用水。③注射部位:腹腔内。
, 百拇医药
2.3 血液学检测:注射当日及注射后第2~第16天隔日取血,第17~第35天每5d取血。测血红蛋白,血细胞比容,红细胞、白细胞、血小板计数。取血方式:断尾取血。对照组仅取实验前和处死时两次。
2.4 放免方法测定血清Epo水平。大鼠Epo正常参考值13.1IU/L(11~16IU/L)[2]。均于处死时留血标本。
2.5 病理学检查:对照组10只与模型组28只在成模时一次性处死,对比成模前后变化。取肝、肾、脾、骨髓标本,称重后用体积分数为10%的甲醛固定。石蜡切片、苏木素伊红染色,光镜下病理检查。模型组另10只采取阶梯式处死方式,每一观察点每次处死2只大鼠,用于动态观察各脏器及骨髓动态病理改变。
3 结果判断标准 根据大鼠正常血细胞生理参数[3],参照人红细胞增多症诊断标准[4]以及PTE诊断标准[5]设定大鼠红细胞增多症诊断标准。
, http://www.100md.com
3.1 主要指标:血红蛋白高于正常均值(150g/L),血细胞比容高于0.50,骨髓红系统增生活跃,Epo水平超过正常。
3.2 参考指标:红细胞计数≥正常水平10%,无导致缺氧的情况,非脱水状态。
4 统计学处理 t检验,直线相关分析。
结果
1 模型完成时间 实验周期分为造模、成模和回复3个阶段。本组实验共用5周完成。第1~第8天为造模阶段。平均9.2d成模,继续用药稳定模型可维持10.5d。停止注射Epo后第10~第14天外周血象逐步回复正常。此前预实验显示,成模后如继续注射Epo,模型可继续保持稳定。
表1 实验动物在实验不同时间外周血象的变化(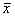 ±s) 组别
±s) 组别
, 百拇医药
鼠数
Hb(g/L)
0d
10d
17d
35d
实验组
38
153±13
188±18
186±15
145±4
对照组
, 百拇医药
10
154±17
157±14
155±21
149±11
P值
>0.05
<0.001
<0.001
>0.05
组别
鼠
数
, http://www.100md.com
HCT
0d
10d
17d
35d
实验组
38
0.40±0.06
0.50±0.09
0.57±0.04
0.41±0.04
对照组
10
, http://www.100md.com
0.40±0.05
0.40±0.05
0.39±0.07
0.39±0.04
P值
>0.05
<0.001
<0.0001
>0.05
组别
鼠
数
RBC(×1012/L)
, http://www.100md.com
0d
10d
17d
35d
实验组
38
6.7±1.4
8.5±1.9
8.5±1.3
7.8±0.9
对照组
10
6.8±1.9
, http://www.100md.com
6.9±1.2
6.6±2.3
6.9±1.8
P值
>0.05
<0.001
<0.001
>0.10
2 外周血象改变
2.1 血红蛋白:如表1所示。实验前Hb均值153g/L。实验第8天Hb平均值174g/L。第10天达到最高点,为188g/L,达到红细胞增多症标准(P<0.0001)。实验第9~第18天Hb维持在18.0g/L以上。与对照组相比,第0天和第35天时差异无统计学意义(P>0.05),第10和第17天差异有统计学意义(P<0.001)。
, http://www.100md.com
2.2 血细胞比容:实验前HCT 0.40。第12天HCT 0.52,达到红细胞增多症标准(P<0.001),上升速度比血红蛋白略慢。第16天达到最高点,均值0.57。第9~第19天HCT维持在0.51以上。与对照组相比,第0天和第35天时差异无统计学意义(P>0.05),第10天和第17天HCT升高,差异有统计学意义(P<0.001)。
2.3 红细胞计数:实验前红细胞均值6.7×1012/L。第10天8.54×1012/L,达到诊断标准。第9~第14基本持续这一水平。与对照组相比,第0天和第35天时差异无统计学意义(P<0.005),第10天和第17天红细胞计数值升高,差异有统计学意义(P<0.001)。
2.4 白细胞与血小板计数:成模时分别达19.27×109/L和598×109/L,成模前后差异无显著性(P=0.25,P=0.72)。符合继发性红细胞增多症时白细胞和血小板计数不超过正常的临床特征。
, 百拇医药
2.5 模型组红系三项指标变化与对照组差异均有显著性(血红蛋白:P=0.0001;血细胞比容:P=0.002;红细胞计数:P=0.0001),结果符合红细胞增多症诊断标准。
3 血清Epo水平 在每一观察点阶梯式处死实验组大鼠时取血测定血清Epo水平。测定结果显示,随注射次数增加,体内Epo水平逐步升高,外周血红系三项指标随之升高;当Epo注射减少,外周血红系三项指标也随之下降。
4 脾及骨髓病理变化 造血程度分3个阶段改变。实验第2~第6天为第1阶段,可见脾及骨髓造血呈现活跃状态,粒、红、巨三系细胞均较正常增多;脾脏有少量含铁血黄素沉着[(±)~(+)]。第9~第13天为第2阶段,造血更现活跃,进入高峰期;脾脏表现为血窦充血,淋巴小结不明显,粒、巨、红三系造血细胞均明显增多,含铁血黄素沉着增多[(+)~(++)];骨髓表现为增生活跃,乃至极度活跃,几乎见不到脂肪细胞。第16~第33天为第3阶段,脾脏造血虽仍明显活跃,但较前两阶段有所减缓,含铁血黄素沉着明显[(++)~(+++)];骨髓增生仍非常活跃并可见少量含铁血黄素沉着。整个造模过程中可见到在Epo刺激下骨髓和脾脏造血增生活跃的动态改变。上述变化证明正常大鼠的造血器官骨髓和脾脏对Epo作用反应敏感,尤以骨髓造血更显敏感,造血程度的改变与注射Epo的剂量成正比。实验不同时间动物脾脏和肝脏重量在成模时略有增加,体重与正常对照组的差异无显著性(P>0.05)。这一结果表明,各组动物在同样饲养、实验条件下,两组的全身血浆容量基本一致。讨论
, 百拇医药
利用外源性Epo建立红细胞增多症动物模型,可以达到红细胞增多症的病理状态。
1 本模型的优点:①模型成模后,血液学检验和病理改变与临床患者病变过程相似。②模型稳定,制作过程简单易行,重复性强。③由于制模采用药物注射,动物各脏器没有缺氧损伤,并可根据实验要求维持长时间稳定状态。与采用低压缺氧制作动物红细胞增多症模型的方式比较,可避免因缺氧而导致其他器官和组织的病理过程而影响实验结果。
2 本模型的意义:①建立无缺氧红细胞增多症动物模型,为进一步研究探讨红细胞增多症提供与临床更接近、更理想的动物模型。②可在非缺氧状态下观察红细胞增多症时骨髓、外周血及有关脏器的病理改变过程,没有缺氧造成的影响。目前国内外较少关于治疗前后患者骨髓改变情况的报道,本模型可提供动态骨髓病理变化。病理实验结果与作者临床上遇到的患者骨髓变化十分相近。③观察各种不同治疗方法的疗效及优缺点,为临床提供治疗依据。④为进一步研究新药药理提供动物模型。可作为药效学、药理学、治疗学和病理学实验研究的基础工具。
, http://www.100md.com
基金项目:北京市中医药管理局资助项目(JX9517)
参考文献
1,Oymak O,Demiroglu H,Akpolat T, et al. Increased erythropoietic response to venesection in erythrocytosis renal transplant patients.Int Uro Nephrol,1995,27:223-227.
2,Hamilton DL, Cotes PM. The effect of bilateral removal of the submandibular salivary glands on the erythropoietic response of mice. Exp Hematol, 1993, 21:656-659.
, 百拇医药 3,苗三明,主编. 实验动物和动物实验技术. 第1版. 北京:中国中医药出版社,1997.
4,张之南,沈悌,主编. 血液病诊断及疗效标准. 第2版. 北京:科学出版社,1997.
5,Besatab A,Jarrell BE, Burde JF, et al. “Erythrocytosis" in renal transplantation patients treated with cyclosporine. Transplantation Proceedings, 1988, 20:945-947.
(收稿日期:1999-06-11), 百拇医药
单位:马麟麟(100050 北京,首都医科大学附属友谊医院泌尿科);张玉海(100050 北京,首都医科大学附属友谊医院泌尿科);刘利(100050 北京,首都医科大学附属友谊医院泌尿科);杨宇飞(中国中医研究院西苑医院肿瘤科);周霭祥(中国中医研究院西苑医院肿瘤科);应红光(中国医学科学院、中国协和医科大学血液学研究所)
关键词:
中华血液学杂志000518 有临床研究证实,各种继发性红细胞增多症的发生大多与血清红细胞生成素(Epo)水平异常升高有关[1]。据此,我们利用注射外源性Epo的方法,建立大鼠继发性红细胞增多症模型。为研究此病提供一种简便、准确的动物模型。
材料和方法
, http://www.100md.com 1 实验材料
1.1 实验动物:中国药品生物制品检定所提供近交系Ⅱ级Wistar大鼠,雌、雄性各半,3月龄,体重(250±50)g。北京友谊医院Ⅱ级动物室饲养。
1.2 试剂:Epo(美国Angen公司出品)。
2 实验方法
2.1 实验动物分组:大鼠48只,38只为模型组,10只为正常对照组。
2.2 用药方法:①剂量:全量每次75IU/250g体重,维持量每次40IU/250g体重(根据成人剂量每次3000IU/70kg体重的4倍,换算成大鼠每次注射剂量)。②注射时间:第1,2,3,4,6,8,10,13天注射全量;第16,19天注射维持量,此后停止注射。对照组同上时间注射等量注射用水。③注射部位:腹腔内。
, 百拇医药
2.3 血液学检测:注射当日及注射后第2~第16天隔日取血,第17~第35天每5d取血。测血红蛋白,血细胞比容,红细胞、白细胞、血小板计数。取血方式:断尾取血。对照组仅取实验前和处死时两次。
2.4 放免方法测定血清Epo水平。大鼠Epo正常参考值13.1IU/L(11~16IU/L)[2]。均于处死时留血标本。
2.5 病理学检查:对照组10只与模型组28只在成模时一次性处死,对比成模前后变化。取肝、肾、脾、骨髓标本,称重后用体积分数为10%的甲醛固定。石蜡切片、苏木素伊红染色,光镜下病理检查。模型组另10只采取阶梯式处死方式,每一观察点每次处死2只大鼠,用于动态观察各脏器及骨髓动态病理改变。
3 结果判断标准 根据大鼠正常血细胞生理参数[3],参照人红细胞增多症诊断标准[4]以及PTE诊断标准[5]设定大鼠红细胞增多症诊断标准。
, http://www.100md.com
3.1 主要指标:血红蛋白高于正常均值(150g/L),血细胞比容高于0.50,骨髓红系统增生活跃,Epo水平超过正常。
3.2 参考指标:红细胞计数≥正常水平10%,无导致缺氧的情况,非脱水状态。
4 统计学处理 t检验,直线相关分析。
结果
1 模型完成时间 实验周期分为造模、成模和回复3个阶段。本组实验共用5周完成。第1~第8天为造模阶段。平均9.2d成模,继续用药稳定模型可维持10.5d。停止注射Epo后第10~第14天外周血象逐步回复正常。此前预实验显示,成模后如继续注射Epo,模型可继续保持稳定。
表1 实验动物在实验不同时间外周血象的变化(
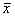 ±s) 组别
±s) 组别, 百拇医药
鼠数
Hb(g/L)
0d
10d
17d
35d
实验组
38
153±13
188±18
186±15
145±4
对照组
, 百拇医药
10
154±17
157±14
155±21
149±11
P值
>0.05
<0.001
<0.001
>0.05
组别
鼠
数
, http://www.100md.com
HCT
0d
10d
17d
35d
实验组
38
0.40±0.06
0.50±0.09
0.57±0.04
0.41±0.04
对照组
10
, http://www.100md.com
0.40±0.05
0.40±0.05
0.39±0.07
0.39±0.04
P值
>0.05
<0.001
<0.0001
>0.05
组别
鼠
数
RBC(×1012/L)
, http://www.100md.com
0d
10d
17d
35d
实验组
38
6.7±1.4
8.5±1.9
8.5±1.3
7.8±0.9
对照组
10
6.8±1.9
, http://www.100md.com
6.9±1.2
6.6±2.3
6.9±1.8
P值
>0.05
<0.001
<0.001
>0.10
2 外周血象改变
2.1 血红蛋白:如表1所示。实验前Hb均值153g/L。实验第8天Hb平均值174g/L。第10天达到最高点,为188g/L,达到红细胞增多症标准(P<0.0001)。实验第9~第18天Hb维持在18.0g/L以上。与对照组相比,第0天和第35天时差异无统计学意义(P>0.05),第10和第17天差异有统计学意义(P<0.001)。
, http://www.100md.com
2.2 血细胞比容:实验前HCT 0.40。第12天HCT 0.52,达到红细胞增多症标准(P<0.001),上升速度比血红蛋白略慢。第16天达到最高点,均值0.57。第9~第19天HCT维持在0.51以上。与对照组相比,第0天和第35天时差异无统计学意义(P>0.05),第10天和第17天HCT升高,差异有统计学意义(P<0.001)。
2.3 红细胞计数:实验前红细胞均值6.7×1012/L。第10天8.54×1012/L,达到诊断标准。第9~第14基本持续这一水平。与对照组相比,第0天和第35天时差异无统计学意义(P<0.005),第10天和第17天红细胞计数值升高,差异有统计学意义(P<0.001)。
2.4 白细胞与血小板计数:成模时分别达19.27×109/L和598×109/L,成模前后差异无显著性(P=0.25,P=0.72)。符合继发性红细胞增多症时白细胞和血小板计数不超过正常的临床特征。
, 百拇医药
2.5 模型组红系三项指标变化与对照组差异均有显著性(血红蛋白:P=0.0001;血细胞比容:P=0.002;红细胞计数:P=0.0001),结果符合红细胞增多症诊断标准。
3 血清Epo水平 在每一观察点阶梯式处死实验组大鼠时取血测定血清Epo水平。测定结果显示,随注射次数增加,体内Epo水平逐步升高,外周血红系三项指标随之升高;当Epo注射减少,外周血红系三项指标也随之下降。
4 脾及骨髓病理变化 造血程度分3个阶段改变。实验第2~第6天为第1阶段,可见脾及骨髓造血呈现活跃状态,粒、红、巨三系细胞均较正常增多;脾脏有少量含铁血黄素沉着[(±)~(+)]。第9~第13天为第2阶段,造血更现活跃,进入高峰期;脾脏表现为血窦充血,淋巴小结不明显,粒、巨、红三系造血细胞均明显增多,含铁血黄素沉着增多[(+)~(++)];骨髓表现为增生活跃,乃至极度活跃,几乎见不到脂肪细胞。第16~第33天为第3阶段,脾脏造血虽仍明显活跃,但较前两阶段有所减缓,含铁血黄素沉着明显[(++)~(+++)];骨髓增生仍非常活跃并可见少量含铁血黄素沉着。整个造模过程中可见到在Epo刺激下骨髓和脾脏造血增生活跃的动态改变。上述变化证明正常大鼠的造血器官骨髓和脾脏对Epo作用反应敏感,尤以骨髓造血更显敏感,造血程度的改变与注射Epo的剂量成正比。实验不同时间动物脾脏和肝脏重量在成模时略有增加,体重与正常对照组的差异无显著性(P>0.05)。这一结果表明,各组动物在同样饲养、实验条件下,两组的全身血浆容量基本一致。讨论
, 百拇医药
利用外源性Epo建立红细胞增多症动物模型,可以达到红细胞增多症的病理状态。
1 本模型的优点:①模型成模后,血液学检验和病理改变与临床患者病变过程相似。②模型稳定,制作过程简单易行,重复性强。③由于制模采用药物注射,动物各脏器没有缺氧损伤,并可根据实验要求维持长时间稳定状态。与采用低压缺氧制作动物红细胞增多症模型的方式比较,可避免因缺氧而导致其他器官和组织的病理过程而影响实验结果。
2 本模型的意义:①建立无缺氧红细胞增多症动物模型,为进一步研究探讨红细胞增多症提供与临床更接近、更理想的动物模型。②可在非缺氧状态下观察红细胞增多症时骨髓、外周血及有关脏器的病理改变过程,没有缺氧造成的影响。目前国内外较少关于治疗前后患者骨髓改变情况的报道,本模型可提供动态骨髓病理变化。病理实验结果与作者临床上遇到的患者骨髓变化十分相近。③观察各种不同治疗方法的疗效及优缺点,为临床提供治疗依据。④为进一步研究新药药理提供动物模型。可作为药效学、药理学、治疗学和病理学实验研究的基础工具。
, http://www.100md.com
基金项目:北京市中医药管理局资助项目(JX9517)
参考文献
1,Oymak O,Demiroglu H,Akpolat T, et al. Increased erythropoietic response to venesection in erythrocytosis renal transplant patients.Int Uro Nephrol,1995,27:223-227.
2,Hamilton DL, Cotes PM. The effect of bilateral removal of the submandibular salivary glands on the erythropoietic response of mice. Exp Hematol, 1993, 21:656-659.
, 百拇医药 3,苗三明,主编. 实验动物和动物实验技术. 第1版. 北京:中国中医药出版社,1997.
4,张之南,沈悌,主编. 血液病诊断及疗效标准. 第2版. 北京:科学出版社,1997.
5,Besatab A,Jarrell BE, Burde JF, et al. “Erythrocytosis" in renal transplantation patients treated with cyclosporine. Transplantation Proceedings, 1988, 20:945-947.
(收稿日期:1999-06-11), 百拇医药