从动物和土壤中直接检测鼠疫耶尔森氏菌
张敏丽 郭兆彪 宋亚军 汪晓辉 王津 杨瑞馥 丛显斌
摘 要:目的 探讨用防污染的PCR-ELISA(UDPE)技术检测人为污染的土壤和感染的动物标本的可行性。方法 根据鼠疫耶尔森氏菌Cafl和Pla基因分别设计了3条引物,组合成3对引物,建立UDPE检测技术。结果 利用该实验体系可以检出每克土壤中1 000个鼠疫耶尔森氏菌的污染。比检测纯细菌的敏感性低200倍,说明土壤中有抑制PCR反应的因子。对20只实验组动物40份标本(肝脏和脾脏)的培养、UDPE和PCR-电泳检测表明,3种方法的检出吻合率为100%,均能从40份标本中检出靶细菌,而用3种方法检测对照组动物的20份肝脏和脾脏均为阴性。结论 利用UDPE技术可以被用于动物脏器中鼠疫耶尔森氏菌的检测。
关键词:鼠疫耶尔森氏菌 土壤 动物 PCR
目前用于鼠疫耶尔森氏菌的常规检测方法包括标准的微生物学技术、噬菌体敏感性试验、抗原组分I的免疫学检测和经典的动物试验[1]。这些方法在鼠疫常规监测中起着重要的作用,但是,当监测标本量较多时,会因为工作量大大增加而使工作人员产生麻痹思想,而造成漏检。另外,这些常规监测技术在典型鼠疫耶尔森氏菌特征基础上,往往漏检自然变异株。最近发展起来的分子生物学检测和鉴定技术在对大量标本筛选时具有操作简便和不受环境选择压力使菌株发生表型变异的影响。其中以PCR(Polymerase Chain Reaction)技术为代表,使细菌的检测和鉴定技术更加完善[2~9]。本文采用了UDPE(UDG-Duplex PCR-EIA)技术直接检测人工感染的动物和人为污染的土壤标本中的鼠疫耶尔森氏菌,以探讨分子生物学技术作为鼠疫监测技术之一的可能性。
, 百拇医药
1 材料与方法
1.1 菌株 所用鼠疫耶尔森氏菌EV76株由全国鼠疫布病防治基地保存,用营养琼脂平板于28℃培养。
1.2 引物设计 通过Internet从DDBJ核酸库网址(http:∥www.ddbj.nig.ac.jp)中检索并调取相应基因用SEQNCE、PRIMERS和PCRDESN等软件设计引物(表1,图1)。引物由国家生物医学中心DNA测序与合成实验室合成,其中5′端生物素标记的引物(I和F)由美国赛百盛公司合成。
表1 引物及其序列
引物名称
靶序列
引物序列(5′→3′)
引物组合及扩增片段大小(bp)
, 百拇医药
G
G1
I
I1
H
D
D1
E1
F
Pla基因
Pla基因
Pla基因
Pla基因
, 百拇医药 Pla基因
Cafl基因
Cafl基因
Cafl基因
Cafl基因
CATTATGTGGATCTGCCTGGC
CTGCCTGGCCGGAGTAAT
Bio-ACAGTGTTGTCCGCTA*
CCGCTAGGACGATGCGAT
ATCCTGTTTGCTTCGCTGACC
AGCGGTGTCTATTTGACTGGAC
, http://www.100md.com
ACCATTGAAGGGCAATCATCCA
AAATCTGCCGCATTAGCAGTTG
Bio-GTTGCAGTGGTGCTTG
G+H:605
G1+I1:297
G+I:320
D+F:329;
D+E1:310
注:*引物5′端标有“Bio-”表示该引物在合成时5′标记生物素。
, 百拇医药
图1 引物在相应基因中位置示意图
1.3 动物试验和标本处理 试验用雄性小白鼠(25g)购自军事医学科学院动物中心,培养的EV76株细菌制备成生理盐水悬液后,10倍系列稀释,用平板涂布法活菌计数。分成2个剂量组(0.5和0.25亿个比浊浓度的细菌每组10只动物)腹腔注射小白鼠,对照组(10只动物)注射0.5ml生理盐水。注射动物的菌液和生理盐水中均加入0.1%的硫酸亚铁。从注射24h后随时解剖死亡的动物,观察至第6天,杀死未死亡的实验组和对照组动物。
动物解剖后,取肝脏和脾脏,用压印法分离细菌,剩余脏器立即用玻璃研磨器匀浆,取50μl匀浆按如下方法提取DNA,其余冻存于-20℃备用。
向50μl匀浆中加入生理盐水50μl和50μl蛋白酶K消化液(30mmol/L Tirs-HCl,pH8.2,30mmol/L EDTA Na2,0.1mol/L NaCl,1.5% SDS,3mmol/L DTT,100μg/ml蛋白酶K),混匀后,56℃水浴作用3h,100℃煮沸15min,2000rpm离心1min后,取上清200μl用Nal裂解-玻璃粉吸附法提取DNA[10,11]。
, 百拇医药
1.4 污染土壤及标本处理 称取1g土壤为1份,分别向每份土壤中加入100μl 10倍系列稀释的鼠疫耶尔森氏菌EV76株生理盐水悬液作为污染土样,同时用培养法做EV76株生理盐水悬液的活菌计数。
向每份污染土样中加入生理盐水500μl,充分振荡混匀,100℃煮沸10min后,2000rpm离心1min去除大颗粒,取上清500μl用Nal裂解-玻璃粉吸附法提取DNA。
1.5 UDPE技术[12]
1.5.1 防污染PCR反应 在30μl反应体系中,上述处理的模板DNA加26μl,Taq DNA聚合酶(1U/μl)1μl,PCR-mix 3μl[100mmol/L Tris-HCl,pH8.3,50mmol/L KCl,0.1% BSA,20mmol/L MgCl2,配对引物(G+H、G+I和D+F)各0.2μmom/L,400μmol/L dNTPs,其中dUTP由dTTP代替],0.5U UDG,于DNA热循环仪(EP 2400)上37℃作用30min,94℃预变性3min 94℃变性10sec、58℃退火10sec,72℃延伸10sec。共35个循环,最后72℃延伸5min以确保扩增产物的充分延伸。
, 百拇医药
1.5.2 微孔板杂交-酶联显色检测PCR产物
1.5.2.1 DNA包被与封闭:将G1+I1和D+E1引物组合的扩增产物分别用包被缓冲液(PBS-0.1mol/L MgCl2,pH7.0)于45℃包被NUNC板条3h。用PBS缓冲液洗涤后,每孔加入200μl预杂交液(5×Denharts-5×SSC-50μl/ml鲑鱼精DNA-3%BSA)在55℃下封闭1h后直接用于杂交或45℃烘干保存于4℃。
1.5.2.2 DNA杂交:倾去预杂交液后,加入杂交液(5×Denharts-5×SSC-50μl/ml鲑鱼精DNA-2%硫酸葡聚糖-50%甲酰胺,5~100ng生物素标记的G+I或D+F PCR产物),于42℃杂交15~60min。杂交后弃去杂交液,用漂洗液(PBS-0.1%Tween 20)洗5次。
1.5.2.3 酶联显色:杂交漂洗后,加入100μl 1∶1000倍稀释的链霉亲和素化的辣根过氧化酶(用2mmol/L MgCl2-1%BSA-PBS缓冲液稀释酶)液。37℃作用5min,用PBS-0.1%Tween20漂洗5次,然后加入100μl相应的OPD底物液,37℃显色10min,用2N H2SO4终止后,于波长为490nm测OD值。
, 百拇医药
杂交检测同时以电泳法作对照。取15μl反应于1.5%琼脂糖凝胶在TBE缓冲液中电泳(60~80V电压,15~30min),在紫外灯下观察结果并拍照。
2 结果
2.1 动物脏器标本中鼠疫耶尔森氏菌的检测 注射0.25和0.5亿个细菌的小白鼠在注射24h后即开始死亡,直到第5天全部死亡,立即解剖死亡动物,取肝脏和脾脏按上述方法处理,用培养方法培养细菌或提取DNA用于PCR;而对照组动物无死亡,注射第5天后,将对照组动物全部处死,并取肝脏和脾脏同上处理。对20只实验组动物40份标本(肝脏和脾脏)的培养、UDPE和PCR-电泳检测表明,3种方法的检出吻合率为100%,均能从40份标本中检出靶细菌(图2)。而用3种方法检测对照组动物的20份肝脏和脾脏均为阴性。说明利用本文叙述的PCR技术可以用于动物脏器中鼠疫耶尔森氏菌的检测,为该方法的现场应用研究奠定了基础。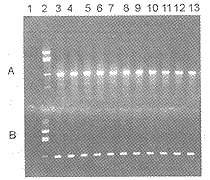
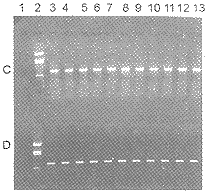
, 百拇医药
图2 从动物标本中直接检测鼠疫耶尔森氏菌。图A和B分别为引物D+E1检测肝脏和脾脏的结果;图C和D分别为引物G+H检测肝脏和脾脏的结果。第1泳道为阴性对照,第2泳道为BstNI-pBR322酶切分子量对照(从上至下的5条DNA带大小分别为:1875,1060,929,383,121bp),第3~7泳道为0.5亿个菌剂量组的动物脏器,第8~13泳道为0.25亿个菌剂量组的动物脏器
2.2 土壤标本中鼠疫耶尔森氏菌的检测 对人工污染土壤标本的检测表明,利用该实验体系可以检出每克土壤中1000个鼠疫耶尔森氏菌的污染。而系列稀释的细菌悬液对照PCR扩增表明,该实验体系可以检测出PCR反应中1CFU的细菌的存在,电泳法可以检测出PCR反应中5CFU的细菌的存在(图3)。说明土壤中有抑制PCR反应的因子。
, 百拇医药
图3 从土壤中直接检测鼠疫耶尔森氏菌(A)和系列稀释鼠疫耶尔森氏菌悬液(B)的PCR直接检测结果。第1~10泳道对应的细菌数分别为:1000万,100万,10万,10000,1000,100,10,5和2.5个,第11泳道为阴性对照。图A1和B1为引物G+H扩增结果,图A2和B2为引物D+E1扩增结果。
3 讨论
耶尔森氏菌属中3个致病种——鼠疫耶尔森氏菌、假结核耶尔森氏菌和小肠结肠炎耶尔森氏菌——都含有70kb的低钙反应质粒(pCad),只有鼠疫耶尔森氏菌还含有另外两种毒力相关质粒,即编码鼠疫杆菌素的10k pPst和编码鼠外毒素(抗原组分I)的100kb pFra质粒。目前报道的鼠疫耶尔森氏菌PCR检测方法大多以这两种质粒DNA为靶序列。多数鼠疫耶尔森氏菌菌株至少有pPst和pFra这两种质粒之一,有些菌株缺乏pPst或pFra质粒,所以,检测标本中鼠疫耶尔森氏菌时,必需同时用两对分别以这两个质粒为靶序列的引物检测才能保证不漏检。
, http://www.100md.com
目前报道的PCR检测系统大多依赖于电泳方法检测结果,且扩增体系中未加入防PCR产物污染的预防措施,使得检测缺乏客观性和易出现假阳性的问题。针对这些问题,我们采用了以两种不同靶序列为模板同时检测一种病原菌防止了基因变异或质粒缺失对检测系统造成假阴性的偏差,反应体系中以dUTP代替dTTP,并加入尿嘧啶糖基化酶(Uracil Deoxynucleotide Glycosidase UDG)防PCR产物污染所致的假阳性,用微孔板杂交-酶联显色检测扩增结果保证检测结果的客观性。
通过对人工感染动物标本和人为污染土壤标本的检测证明该方法可以直接检测动物肝脏和脾脏标本及土壤标本中的鼠疫耶尔森氏菌。该方法可以作为鼠疫监测的方法之一,每天可以获得100~200份监测标本的结果,比常规监测的“四步”法简便快速。
俄罗斯的Kaya大学微生物所应用遗传学实验室的Norkina等以pla和cafI基因为模板分别设计一对引物,扩增443bp和501bp的片段来检测鼠疫耶尔森氏菌[7]。检测模拟感染动物标本表明,可以检测出1000~5000CFU/ml血中的靶细菌。美国陆军传染病研究所的Campbell等选自pla基因的引物检测了淋巴结、大鼠肝组织和两种跳蚤(Diamanus montanus和Hoplopsyllus anomalus)中的鼠疫耶尔森氏菌[9]。美国的过敏与传染病国立研究所的Hinnebusch等用来自pla基因的引物检测了试验感染跳蚤(Xenopsylla cheopis)中鼠疫耶尔森氏菌[8],检测敏感性可以达到10个细菌,检测阳性率为55%。这些试验均证明PCR技术对动物和跳蚤标本直接检测的实用性。■
, http://www.100md.com
作者简介:张敏丽,女,1965年生,实验师
作者单位:张敏丽(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
郭兆彪(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
宋亚军(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
汪晓辉(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
王津(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
杨瑞馥(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
, 百拇医药
丛显斌(全国鼠疫布氏菌病防治基地,吉林,137000)
参考文献:
[1]Lindler LE,Plano GV,Burland V,et al.Complete DNA sequence and detailed analysis of the Yersinia pestis KIM5 plasmid encoding murine toxin and capsular antigen[J].Infect Immun,1998,66(12):5731-42.
[2]Drancourt M,Aboudharam G,Signoli M,et al.Detection of 400-year-old Yersinia pestis DNA in human dental pulp:an approach to the diagnosis of ancient septicemia[J].Proc Natl Acad Sci USA,1998,95(21):12637-40.
, 百拇医药
[3]Belgrader P,Benett W,Hadley,et al.Rapid pathogen detection using a microchip PCR array instrument[J].Clin Chem,1998,44(10):2191-4.
[4]Hu P,Elliott J,Mc Cready P,et al.Structural organization of virulence-associated plasmids of Yersinia pestis[J].J Bacteriol,1998,180(19):5192-202.
[5]Leal NC,Abath FG,Alves LC,et al.A simple PCR-based procedure for plague diagnosis[J].Rev Inst Med Trop Sao Paulo,1996,38(5):371-3.
, 百拇医药
[6]Tsukano H,Itoh K,Suzuki S,et al.Detection and identification of Yersinia pestis by polymerase chain reaction(PCR) using multiplex primers[J].Microbiol Immunol,1996,40(10):773-5.
[7]Norkina OV,Kulichenko AN,Gintsburg AL,et al.Development of a diagnostic test for Yersinia pestis by the polymerase chain reaction[J].J Appl Bacteriol,1994,76(3):240-5.
[8]Hinnebusch J,Schwan TG.New method for plague surveillance using polymerse chain reaction to detect Yersinia pestis in fleas[J].J Clin Microbiol,1993,31(6):1511-4.
, 百拇医药
[9]Campbell J,Lowe J,Walz S,et al.Rapid and spectific identification of Yersinia pestis by using a nested polymerase chain reaction procedure[J].Clin Microbiol,1993,31(3):758-9.
[10]Room RC,et al.Rapid and simple method for purification of nucleic acids[J].Clin Microbiol,1990,28:495.
[11]郭兆彪,杨瑞馥.PCR快速检测淋球菌方法的建立及初步应用[J].中华流行病学杂志,1993,14(特刊11号):171.
[12]杨瑞馥,郭兆彪,张敏丽,等.核酸诊断技术规范化的研究[J].生物技术通讯,1999,10(2):81-88., 百拇医药
摘 要:目的 探讨用防污染的PCR-ELISA(UDPE)技术检测人为污染的土壤和感染的动物标本的可行性。方法 根据鼠疫耶尔森氏菌Cafl和Pla基因分别设计了3条引物,组合成3对引物,建立UDPE检测技术。结果 利用该实验体系可以检出每克土壤中1 000个鼠疫耶尔森氏菌的污染。比检测纯细菌的敏感性低200倍,说明土壤中有抑制PCR反应的因子。对20只实验组动物40份标本(肝脏和脾脏)的培养、UDPE和PCR-电泳检测表明,3种方法的检出吻合率为100%,均能从40份标本中检出靶细菌,而用3种方法检测对照组动物的20份肝脏和脾脏均为阴性。结论 利用UDPE技术可以被用于动物脏器中鼠疫耶尔森氏菌的检测。
关键词:鼠疫耶尔森氏菌 土壤 动物 PCR
目前用于鼠疫耶尔森氏菌的常规检测方法包括标准的微生物学技术、噬菌体敏感性试验、抗原组分I的免疫学检测和经典的动物试验[1]。这些方法在鼠疫常规监测中起着重要的作用,但是,当监测标本量较多时,会因为工作量大大增加而使工作人员产生麻痹思想,而造成漏检。另外,这些常规监测技术在典型鼠疫耶尔森氏菌特征基础上,往往漏检自然变异株。最近发展起来的分子生物学检测和鉴定技术在对大量标本筛选时具有操作简便和不受环境选择压力使菌株发生表型变异的影响。其中以PCR(Polymerase Chain Reaction)技术为代表,使细菌的检测和鉴定技术更加完善[2~9]。本文采用了UDPE(UDG-Duplex PCR-EIA)技术直接检测人工感染的动物和人为污染的土壤标本中的鼠疫耶尔森氏菌,以探讨分子生物学技术作为鼠疫监测技术之一的可能性。
, 百拇医药
1 材料与方法
1.1 菌株 所用鼠疫耶尔森氏菌EV76株由全国鼠疫布病防治基地保存,用营养琼脂平板于28℃培养。
1.2 引物设计 通过Internet从DDBJ核酸库网址(http:∥www.ddbj.nig.ac.jp)中检索并调取相应基因用SEQNCE、PRIMERS和PCRDESN等软件设计引物(表1,图1)。引物由国家生物医学中心DNA测序与合成实验室合成,其中5′端生物素标记的引物(I和F)由美国赛百盛公司合成。
表1 引物及其序列
引物名称
靶序列
引物序列(5′→3′)
引物组合及扩增片段大小(bp)
, 百拇医药
G
G1
I
I1
H
D
D1
E1
F
Pla基因
Pla基因
Pla基因
Pla基因
, 百拇医药 Pla基因
Cafl基因
Cafl基因
Cafl基因
Cafl基因
CATTATGTGGATCTGCCTGGC
CTGCCTGGCCGGAGTAAT
Bio-ACAGTGTTGTCCGCTA*
CCGCTAGGACGATGCGAT
ATCCTGTTTGCTTCGCTGACC
AGCGGTGTCTATTTGACTGGAC
, http://www.100md.com
ACCATTGAAGGGCAATCATCCA
AAATCTGCCGCATTAGCAGTTG
Bio-GTTGCAGTGGTGCTTG
G+H:605
G1+I1:297
G+I:320
D+F:329;
D+E1:310
注:*引物5′端标有“Bio-”表示该引物在合成时5′标记生物素。

, 百拇医药
图1 引物在相应基因中位置示意图
1.3 动物试验和标本处理 试验用雄性小白鼠(25g)购自军事医学科学院动物中心,培养的EV76株细菌制备成生理盐水悬液后,10倍系列稀释,用平板涂布法活菌计数。分成2个剂量组(0.5和0.25亿个比浊浓度的细菌每组10只动物)腹腔注射小白鼠,对照组(10只动物)注射0.5ml生理盐水。注射动物的菌液和生理盐水中均加入0.1%的硫酸亚铁。从注射24h后随时解剖死亡的动物,观察至第6天,杀死未死亡的实验组和对照组动物。
动物解剖后,取肝脏和脾脏,用压印法分离细菌,剩余脏器立即用玻璃研磨器匀浆,取50μl匀浆按如下方法提取DNA,其余冻存于-20℃备用。
向50μl匀浆中加入生理盐水50μl和50μl蛋白酶K消化液(30mmol/L Tirs-HCl,pH8.2,30mmol/L EDTA Na2,0.1mol/L NaCl,1.5% SDS,3mmol/L DTT,100μg/ml蛋白酶K),混匀后,56℃水浴作用3h,100℃煮沸15min,2000rpm离心1min后,取上清200μl用Nal裂解-玻璃粉吸附法提取DNA[10,11]。
, 百拇医药
1.4 污染土壤及标本处理 称取1g土壤为1份,分别向每份土壤中加入100μl 10倍系列稀释的鼠疫耶尔森氏菌EV76株生理盐水悬液作为污染土样,同时用培养法做EV76株生理盐水悬液的活菌计数。
向每份污染土样中加入生理盐水500μl,充分振荡混匀,100℃煮沸10min后,2000rpm离心1min去除大颗粒,取上清500μl用Nal裂解-玻璃粉吸附法提取DNA。
1.5 UDPE技术[12]
1.5.1 防污染PCR反应 在30μl反应体系中,上述处理的模板DNA加26μl,Taq DNA聚合酶(1U/μl)1μl,PCR-mix 3μl[100mmol/L Tris-HCl,pH8.3,50mmol/L KCl,0.1% BSA,20mmol/L MgCl2,配对引物(G+H、G+I和D+F)各0.2μmom/L,400μmol/L dNTPs,其中dUTP由dTTP代替],0.5U UDG,于DNA热循环仪(EP 2400)上37℃作用30min,94℃预变性3min 94℃变性10sec、58℃退火10sec,72℃延伸10sec。共35个循环,最后72℃延伸5min以确保扩增产物的充分延伸。
, 百拇医药
1.5.2 微孔板杂交-酶联显色检测PCR产物
1.5.2.1 DNA包被与封闭:将G1+I1和D+E1引物组合的扩增产物分别用包被缓冲液(PBS-0.1mol/L MgCl2,pH7.0)于45℃包被NUNC板条3h。用PBS缓冲液洗涤后,每孔加入200μl预杂交液(5×Denharts-5×SSC-50μl/ml鲑鱼精DNA-3%BSA)在55℃下封闭1h后直接用于杂交或45℃烘干保存于4℃。
1.5.2.2 DNA杂交:倾去预杂交液后,加入杂交液(5×Denharts-5×SSC-50μl/ml鲑鱼精DNA-2%硫酸葡聚糖-50%甲酰胺,5~100ng生物素标记的G+I或D+F PCR产物),于42℃杂交15~60min。杂交后弃去杂交液,用漂洗液(PBS-0.1%Tween 20)洗5次。
1.5.2.3 酶联显色:杂交漂洗后,加入100μl 1∶1000倍稀释的链霉亲和素化的辣根过氧化酶(用2mmol/L MgCl2-1%BSA-PBS缓冲液稀释酶)液。37℃作用5min,用PBS-0.1%Tween20漂洗5次,然后加入100μl相应的OPD底物液,37℃显色10min,用2N H2SO4终止后,于波长为490nm测OD值。
, 百拇医药
杂交检测同时以电泳法作对照。取15μl反应于1.5%琼脂糖凝胶在TBE缓冲液中电泳(60~80V电压,15~30min),在紫外灯下观察结果并拍照。
2 结果
2.1 动物脏器标本中鼠疫耶尔森氏菌的检测 注射0.25和0.5亿个细菌的小白鼠在注射24h后即开始死亡,直到第5天全部死亡,立即解剖死亡动物,取肝脏和脾脏按上述方法处理,用培养方法培养细菌或提取DNA用于PCR;而对照组动物无死亡,注射第5天后,将对照组动物全部处死,并取肝脏和脾脏同上处理。对20只实验组动物40份标本(肝脏和脾脏)的培养、UDPE和PCR-电泳检测表明,3种方法的检出吻合率为100%,均能从40份标本中检出靶细菌(图2)。而用3种方法检测对照组动物的20份肝脏和脾脏均为阴性。说明利用本文叙述的PCR技术可以用于动物脏器中鼠疫耶尔森氏菌的检测,为该方法的现场应用研究奠定了基础。


, 百拇医药
图2 从动物标本中直接检测鼠疫耶尔森氏菌。图A和B分别为引物D+E1检测肝脏和脾脏的结果;图C和D分别为引物G+H检测肝脏和脾脏的结果。第1泳道为阴性对照,第2泳道为BstNI-pBR322酶切分子量对照(从上至下的5条DNA带大小分别为:1875,1060,929,383,121bp),第3~7泳道为0.5亿个菌剂量组的动物脏器,第8~13泳道为0.25亿个菌剂量组的动物脏器
2.2 土壤标本中鼠疫耶尔森氏菌的检测 对人工污染土壤标本的检测表明,利用该实验体系可以检出每克土壤中1000个鼠疫耶尔森氏菌的污染。而系列稀释的细菌悬液对照PCR扩增表明,该实验体系可以检测出PCR反应中1CFU的细菌的存在,电泳法可以检测出PCR反应中5CFU的细菌的存在(图3)。说明土壤中有抑制PCR反应的因子。


, 百拇医药
图3 从土壤中直接检测鼠疫耶尔森氏菌(A)和系列稀释鼠疫耶尔森氏菌悬液(B)的PCR直接检测结果。第1~10泳道对应的细菌数分别为:1000万,100万,10万,10000,1000,100,10,5和2.5个,第11泳道为阴性对照。图A1和B1为引物G+H扩增结果,图A2和B2为引物D+E1扩增结果。
3 讨论
耶尔森氏菌属中3个致病种——鼠疫耶尔森氏菌、假结核耶尔森氏菌和小肠结肠炎耶尔森氏菌——都含有70kb的低钙反应质粒(pCad),只有鼠疫耶尔森氏菌还含有另外两种毒力相关质粒,即编码鼠疫杆菌素的10k pPst和编码鼠外毒素(抗原组分I)的100kb pFra质粒。目前报道的鼠疫耶尔森氏菌PCR检测方法大多以这两种质粒DNA为靶序列。多数鼠疫耶尔森氏菌菌株至少有pPst和pFra这两种质粒之一,有些菌株缺乏pPst或pFra质粒,所以,检测标本中鼠疫耶尔森氏菌时,必需同时用两对分别以这两个质粒为靶序列的引物检测才能保证不漏检。
, http://www.100md.com
目前报道的PCR检测系统大多依赖于电泳方法检测结果,且扩增体系中未加入防PCR产物污染的预防措施,使得检测缺乏客观性和易出现假阳性的问题。针对这些问题,我们采用了以两种不同靶序列为模板同时检测一种病原菌防止了基因变异或质粒缺失对检测系统造成假阴性的偏差,反应体系中以dUTP代替dTTP,并加入尿嘧啶糖基化酶(Uracil Deoxynucleotide Glycosidase UDG)防PCR产物污染所致的假阳性,用微孔板杂交-酶联显色检测扩增结果保证检测结果的客观性。
通过对人工感染动物标本和人为污染土壤标本的检测证明该方法可以直接检测动物肝脏和脾脏标本及土壤标本中的鼠疫耶尔森氏菌。该方法可以作为鼠疫监测的方法之一,每天可以获得100~200份监测标本的结果,比常规监测的“四步”法简便快速。
俄罗斯的Kaya大学微生物所应用遗传学实验室的Norkina等以pla和cafI基因为模板分别设计一对引物,扩增443bp和501bp的片段来检测鼠疫耶尔森氏菌[7]。检测模拟感染动物标本表明,可以检测出1000~5000CFU/ml血中的靶细菌。美国陆军传染病研究所的Campbell等选自pla基因的引物检测了淋巴结、大鼠肝组织和两种跳蚤(Diamanus montanus和Hoplopsyllus anomalus)中的鼠疫耶尔森氏菌[9]。美国的过敏与传染病国立研究所的Hinnebusch等用来自pla基因的引物检测了试验感染跳蚤(Xenopsylla cheopis)中鼠疫耶尔森氏菌[8],检测敏感性可以达到10个细菌,检测阳性率为55%。这些试验均证明PCR技术对动物和跳蚤标本直接检测的实用性。■
, http://www.100md.com
作者简介:张敏丽,女,1965年生,实验师
作者单位:张敏丽(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
郭兆彪(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
宋亚军(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
汪晓辉(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
王津(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
杨瑞馥(军事医学科学院微生物流行病研究所国家生物医学分析中心分析微生物实验 室,北京,100071)
, 百拇医药
丛显斌(全国鼠疫布氏菌病防治基地,吉林,137000)
参考文献:
[1]Lindler LE,Plano GV,Burland V,et al.Complete DNA sequence and detailed analysis of the Yersinia pestis KIM5 plasmid encoding murine toxin and capsular antigen[J].Infect Immun,1998,66(12):5731-42.
[2]Drancourt M,Aboudharam G,Signoli M,et al.Detection of 400-year-old Yersinia pestis DNA in human dental pulp:an approach to the diagnosis of ancient septicemia[J].Proc Natl Acad Sci USA,1998,95(21):12637-40.
, 百拇医药
[3]Belgrader P,Benett W,Hadley,et al.Rapid pathogen detection using a microchip PCR array instrument[J].Clin Chem,1998,44(10):2191-4.
[4]Hu P,Elliott J,Mc Cready P,et al.Structural organization of virulence-associated plasmids of Yersinia pestis[J].J Bacteriol,1998,180(19):5192-202.
[5]Leal NC,Abath FG,Alves LC,et al.A simple PCR-based procedure for plague diagnosis[J].Rev Inst Med Trop Sao Paulo,1996,38(5):371-3.
, 百拇医药
[6]Tsukano H,Itoh K,Suzuki S,et al.Detection and identification of Yersinia pestis by polymerase chain reaction(PCR) using multiplex primers[J].Microbiol Immunol,1996,40(10):773-5.
[7]Norkina OV,Kulichenko AN,Gintsburg AL,et al.Development of a diagnostic test for Yersinia pestis by the polymerase chain reaction[J].J Appl Bacteriol,1994,76(3):240-5.
[8]Hinnebusch J,Schwan TG.New method for plague surveillance using polymerse chain reaction to detect Yersinia pestis in fleas[J].J Clin Microbiol,1993,31(6):1511-4.
, 百拇医药
[9]Campbell J,Lowe J,Walz S,et al.Rapid and spectific identification of Yersinia pestis by using a nested polymerase chain reaction procedure[J].Clin Microbiol,1993,31(3):758-9.
[10]Room RC,et al.Rapid and simple method for purification of nucleic acids[J].Clin Microbiol,1990,28:495.
[11]郭兆彪,杨瑞馥.PCR快速检测淋球菌方法的建立及初步应用[J].中华流行病学杂志,1993,14(特刊11号):171.
[12]杨瑞馥,郭兆彪,张敏丽,等.核酸诊断技术规范化的研究[J].生物技术通讯,1999,10(2):81-88., 百拇医药