固相合成疏水肽纯度的HPSEC评价
作者:周伟 吴玉章 王祥智 边疆 贾正才
单位:周伟(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);吴玉章(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);王祥智(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);边疆(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);贾正才(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038)
关键词:固相合成疏水肽;高效体积排阻色谱(HPSEC);纯度鉴定
第三军医大学学报000617 提 要: 目的 快速评价固相合成疏水肽P44的纯度。方法 本文为避开反相梯度色谱可能潜在的影响因素,运用高效体积排阻色谱(HPSEC)原理,选用耐一定浓度有机相的Ultrahydrogel 250高效凝胶分析柱对固相合成疏水肽P44进行分析,并通过996二极管阵列检测器对其纯度进行了客观的评价。结果 Ultrahydrogel 250高效凝胶分析柱分离P44疏水肽目的肽峰纯度通过996纯度鉴定,目的肽纯度为70.91%;与分子筛柱与反相柱两步纯度评价的结果一致(70.90%)。结论 提示HPSEC可用作为高效快速的固相合成疏水肽纯度评价。
, http://www.100md.com
中图法分类号: R341.43;R392 文献标识码: A
文章编号:1000-5404(2000)06-0568-03
Purity evaluation of hydrophobic peptide with high-performance size exclusion chromatography
ZHOU Wei, WU Yu-zhang, WANG Xiang-zhi, BIAN Jiang, JIA Zheng-cai
(Research Institute of Immunology, Third Military Medical University, Chongqing 400038, China)
Abstract: Objective To evaluate the purity of hydrophobic peptide with high-performance size exclusion chromatograph (HPSEC). Methods Peptide P44 was synthesized with Merryfiled solid-phase peptide synthesis method. High-performance liquid chromatography and ultrahydrogel 250 analytic column were employed with HPSEC theory to analyze the purity of this peptide. Results High resolving power of peptide P44 was showed with an ideal linear limit of molecular weight in ultrahydrogel column. The purity of peptide P44 gotten with this method was 70.91% as same to the one obtained from conventional method. Conclusion Our findings suggest that HPSEC can be used as a rapid, high-effect method to evaluate the purity of hydrophobic peptide.
, 百拇医药
Key words: hydrophobic peptide; high-performance size exclusion chromatography; purity analysis
化学固相合成疏水肽的纯度以其理论偶联率来估算通常与实际纯度值存在较大的差异。采用反相梯度色谱的分析方法,检测214nm肽键的吸收值来估算其实际纯度的确是一种常用的方法[1]。但因其梯度的运用,其流动相紫外吸收光谱的不断变化使996二极管距阵检测器对色谱峰的纯度无法进行准确鉴定;再者有时在肽的固相合成切割过程中引入的一些疏水性小分子残留物质,如苯甲硫醚(Thioansole)、苯酚(Phenol)、EDT等在214nm波长也有吸收,因而其可能干扰或作为伪肽峰而被积分,从而影响其纯度评价。传统的凝胶柱本身不受这些因素影响, 但因其几乎不耐有机相和低分辨率而不被考虑。正基于此,本文选用价格不扉的能耐一定浓度有机相和酸度的高效排阻色谱分析柱Ultrahydrogel 250,运用高效体积排阻色谱(HPSEC)的原理,采用Waters 996二极管距阵检测器纯度分析功能[2],使固相合成疏水肽P44的纯度评价更为客观。
, http://www.100md.com
1 材料与方法
1.1 仪器 Waters Delta 600高效液相色谱仪;Waters 996二极管距阵检测器;Waters Millennium32色谱软件;Waters Ultrahydrogel 250 高分辨凝胶分析柱(粒度6 μm,孔径250?,柱直径7.8 mm 柱长300 mm);Waters Symmetry C18分析柱(粒度5 μm,孔径100,柱直径3.9 mm 柱长150 mm); CH3CN(HPLC级,浙江临海);TFA(Trifluoroacetic Acid:三氟乙酸,HPLC级,美国Sigma公司)。
1.2 方法
Fmoc法固相合成疏水肽P44粗品[3], 10 mg/ml(DMSO溶解,1号样品)。对照品:Fmoc法固相合成疏水肽P44经Suphadex-LH-20 凝胶柱脱盐后肽粗品(DMSO溶解,2号样品)。Ultrahydrogel 250柱流动相浓度、酸度及分析条件的确定:为克服凝胶柱基质对疏水肽的吸附,参照Ultrahydrogel 250柱分析肽时的流动相选择,选择40%CN3CN 0.1%TFA为流动相,流速0.5 ml/min。Symmetry C18柱分析条件的选择:Symmetry系列柱因其填料采用了高纯度的硅胶,对酸、碱及中性化合物都具有很高对称性色谱峰,因此本文选用Waters Symmetry C18对称柱作为分析评价标准;采用本室建立的P44分析方法,40%CH3CN 0.1%TFA至60%CH3CN 0.1%TFA 20 min 1 ml/min线性梯度。996波长检测范围: 200~400 nm 。步骤:Ultrahydrogel 250柱:40%CH3CN 0.1%TFA流动相以0.5 ml/min 3个柱床体积平衡好,然后上1号样品2 μl执行仪器分析方法。重复3次。Symmetry C18柱: 40% CH3CN 0.1%TFA为初始相平衡后分别上1号样品和2号样品,执行梯度方法。重复3次。
, 百拇医药
2 结果
P44肽粗品在Ultrahydrogel 250柱上的分离3次都呈现很好的重现性,图1为996检测器采集得到的样品200~400 nm光谱信息三维图谱。图2为从三维图谱中提取的214 nm色谱图。分子量最大的16.821 min峰为目的肽峰,其峰形态尖锐,峰尾出现分子量十分接近的杂质肽干扰;18.162 min杂质肽峰呈圆顶正态峰形;最后为溶剂(DMSO)及小分子杂质峰。
图1 200~400 nm波长范围样品的三维光谱图谱
Fig 1 200~400 nm UV 3D plot of sample
图2 P44肽粗品在Ultrahydrogel 250分析
, http://www.100md.com
柱上的214 nm色谱图
Fig 2 HPSEC chromatogram of crude P44 in 214 nm
接下来应用Millennium32软件996纯度鉴定模块对目的肽峰进行纯度分析,分析结果见图3,目的肽纯度角为0.223,其光谱分析认为峰为同一肽组分,随后对目的肽峰和杂质肽峰214 nm峰面积积分,见表1。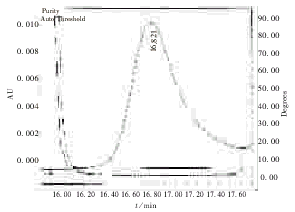
图3 目的肽峰996二极管阵列检测器纯度鉴定图
Fig 3 Purity plot of aim peptide
表1 目的肽和杂质214 nm峰面积积分及百分比
, http://www.100md.com
Tab 1 Peak area integrate of aim peptide andimpurifies in 214 nm
Retention time(min)
Area
Area (%)
Aim peptide
16.821
12488819
70.91
Crud peptide
18.162
, http://www.100md.com 5123143
29.10
经Suphadex-LH-20凝胶柱脱盐后P44肽粗品2号样品和未脱盐的1号样品在Symmetry C18柱分析色谱图,见图4;2号样品目的肽的214 nm波长峰面积积分为70.90%(均为第二次进样结果)。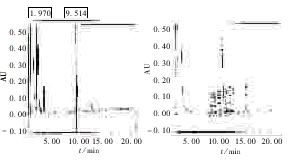
图4 Symmetry C18 分析未脱盐与脱盐后P44肽粗品色谱对照图
Fig 4 Chromatogram compare in P44 and desalt P44
3 讨论
从图4分析结果看到,主要在1.970 min和9.514 min有214 nm强吸收小分子物质干扰,经分析肽切割过程中引用过的试剂,确认其为苯酚和苯甲硫醚残留,其由此可见常规的Symmetry C18反相法分析评价固相合成疏水肽应首先经凝胶柱脱盐处理为好。从Ultrahydrogel 250柱一步法分析结果峰面积积分得到的P44目的肽色谱峰纯度为70.91%,与应用Suphadex-LH-20凝胶柱和Symmetry C18反相柱两步法分析结果一致(70.90%),证实了单用C18反相分析方法存在的缺点;同时为从另一个角度证实这种快速的分析方法对P44肽合成纯度评价的可靠性及其对P44肽制备的指导意义,运用Waters径向加压柱反相少量制备了P44肽纯品,其收率(%)与Ultrahydrogel 250柱一步法纯度评价值(%)十分接近,即以理论平均偶联率99.5%计算,44肽的理论纯度为80.2%;而实际上Ultrahydrogel 250柱一步法分析得到的肽纯度较之理论值,对肽制备条件的优化无疑更有指导意义(另文报道)。本方法因选用了耐较高的有机相(40%CH3CN/0.1%TFA) Ultrahydrogel 250凝胶柱,克服了凝胶基质对疏水肽的吸附作用;充分利用高效体积排阻色谱(HPSEC)Ultrahydrogel 250柱良好的分子量线性范围(102-8×105D)及高分辨率;且本方法采用恒比例洗脱的方法,使996二极管距阵检测器的峰纯度鉴定更准确,且具很好的重现性;同时使固相合成过程中引入的一些疏水性小分子在Ultrahydrogel 250柱上能够得到十分有效的分离,消除了其对肽峰的干扰。因此,提示本方法可作为一种快速的固相合成疏水肽纯度评估的方法。
, 百拇医药
作者简介:周伟(1968-),男,重庆市人,实验师,主要从事多肽及蛋白质分析、纯化及鉴定方面的研究。电话:(023)68752236
参考文献:
[1] Heath T G, Giordani A B. Reversed-phase capillary high-performance liquid chromatography with on-line UV,fluorescence and electrospray ionization mass spectrometric detection in the analysis of peptides and proteins[J]. J Chromatogr,1993,638(1):9-19.
[2] Young P M, Burgoyne R F, Wheat T E. Photodiode array spectral identification of modified amino acids in synthetic peptides following high resolution HPLC separation[J]. Pept Res,1990,3(2): 81-84.
[3] Zeng W, Regamey P O, Rose K, et al. Use of Fmoc-N-(2-hydroxy-4-methoxybenzyl)amino acids in peptide synthesis[J]. J Pept Res,1997,49(3): 273-279.
收稿日期:1999-10-30;修回日期:2000-05-05, http://www.100md.com
单位:周伟(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);吴玉章(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);王祥智(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);边疆(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038);贾正才(第三军医大学基础医学部免疫学教研室、全军免疫学研究所,重庆 400038)
关键词:固相合成疏水肽;高效体积排阻色谱(HPSEC);纯度鉴定
第三军医大学学报000617 提 要: 目的 快速评价固相合成疏水肽P44的纯度。方法 本文为避开反相梯度色谱可能潜在的影响因素,运用高效体积排阻色谱(HPSEC)原理,选用耐一定浓度有机相的Ultrahydrogel 250高效凝胶分析柱对固相合成疏水肽P44进行分析,并通过996二极管阵列检测器对其纯度进行了客观的评价。结果 Ultrahydrogel 250高效凝胶分析柱分离P44疏水肽目的肽峰纯度通过996纯度鉴定,目的肽纯度为70.91%;与分子筛柱与反相柱两步纯度评价的结果一致(70.90%)。结论 提示HPSEC可用作为高效快速的固相合成疏水肽纯度评价。
, http://www.100md.com
中图法分类号: R341.43;R392 文献标识码: A
文章编号:1000-5404(2000)06-0568-03
Purity evaluation of hydrophobic peptide with high-performance size exclusion chromatography
ZHOU Wei, WU Yu-zhang, WANG Xiang-zhi, BIAN Jiang, JIA Zheng-cai
(Research Institute of Immunology, Third Military Medical University, Chongqing 400038, China)
Abstract: Objective To evaluate the purity of hydrophobic peptide with high-performance size exclusion chromatograph (HPSEC). Methods Peptide P44 was synthesized with Merryfiled solid-phase peptide synthesis method. High-performance liquid chromatography and ultrahydrogel 250 analytic column were employed with HPSEC theory to analyze the purity of this peptide. Results High resolving power of peptide P44 was showed with an ideal linear limit of molecular weight in ultrahydrogel column. The purity of peptide P44 gotten with this method was 70.91% as same to the one obtained from conventional method. Conclusion Our findings suggest that HPSEC can be used as a rapid, high-effect method to evaluate the purity of hydrophobic peptide.
, 百拇医药
Key words: hydrophobic peptide; high-performance size exclusion chromatography; purity analysis
化学固相合成疏水肽的纯度以其理论偶联率来估算通常与实际纯度值存在较大的差异。采用反相梯度色谱的分析方法,检测214nm肽键的吸收值来估算其实际纯度的确是一种常用的方法[1]。但因其梯度的运用,其流动相紫外吸收光谱的不断变化使996二极管距阵检测器对色谱峰的纯度无法进行准确鉴定;再者有时在肽的固相合成切割过程中引入的一些疏水性小分子残留物质,如苯甲硫醚(Thioansole)、苯酚(Phenol)、EDT等在214nm波长也有吸收,因而其可能干扰或作为伪肽峰而被积分,从而影响其纯度评价。传统的凝胶柱本身不受这些因素影响, 但因其几乎不耐有机相和低分辨率而不被考虑。正基于此,本文选用价格不扉的能耐一定浓度有机相和酸度的高效排阻色谱分析柱Ultrahydrogel 250,运用高效体积排阻色谱(HPSEC)的原理,采用Waters 996二极管距阵检测器纯度分析功能[2],使固相合成疏水肽P44的纯度评价更为客观。
, http://www.100md.com
1 材料与方法
1.1 仪器 Waters Delta 600高效液相色谱仪;Waters 996二极管距阵检测器;Waters Millennium32色谱软件;Waters Ultrahydrogel 250 高分辨凝胶分析柱(粒度6 μm,孔径250?,柱直径7.8 mm 柱长300 mm);Waters Symmetry C18分析柱(粒度5 μm,孔径100,柱直径3.9 mm 柱长150 mm); CH3CN(HPLC级,浙江临海);TFA(Trifluoroacetic Acid:三氟乙酸,HPLC级,美国Sigma公司)。
1.2 方法
Fmoc法固相合成疏水肽P44粗品[3], 10 mg/ml(DMSO溶解,1号样品)。对照品:Fmoc法固相合成疏水肽P44经Suphadex-LH-20 凝胶柱脱盐后肽粗品(DMSO溶解,2号样品)。Ultrahydrogel 250柱流动相浓度、酸度及分析条件的确定:为克服凝胶柱基质对疏水肽的吸附,参照Ultrahydrogel 250柱分析肽时的流动相选择,选择40%CN3CN 0.1%TFA为流动相,流速0.5 ml/min。Symmetry C18柱分析条件的选择:Symmetry系列柱因其填料采用了高纯度的硅胶,对酸、碱及中性化合物都具有很高对称性色谱峰,因此本文选用Waters Symmetry C18对称柱作为分析评价标准;采用本室建立的P44分析方法,40%CH3CN 0.1%TFA至60%CH3CN 0.1%TFA 20 min 1 ml/min线性梯度。996波长检测范围: 200~400 nm 。步骤:Ultrahydrogel 250柱:40%CH3CN 0.1%TFA流动相以0.5 ml/min 3个柱床体积平衡好,然后上1号样品2 μl执行仪器分析方法。重复3次。Symmetry C18柱: 40% CH3CN 0.1%TFA为初始相平衡后分别上1号样品和2号样品,执行梯度方法。重复3次。
, 百拇医药
2 结果
P44肽粗品在Ultrahydrogel 250柱上的分离3次都呈现很好的重现性,图1为996检测器采集得到的样品200~400 nm光谱信息三维图谱。图2为从三维图谱中提取的214 nm色谱图。分子量最大的16.821 min峰为目的肽峰,其峰形态尖锐,峰尾出现分子量十分接近的杂质肽干扰;18.162 min杂质肽峰呈圆顶正态峰形;最后为溶剂(DMSO)及小分子杂质峰。

图1 200~400 nm波长范围样品的三维光谱图谱
Fig 1 200~400 nm UV 3D plot of sample

图2 P44肽粗品在Ultrahydrogel 250分析
, http://www.100md.com
柱上的214 nm色谱图
Fig 2 HPSEC chromatogram of crude P44 in 214 nm
接下来应用Millennium32软件996纯度鉴定模块对目的肽峰进行纯度分析,分析结果见图3,目的肽纯度角为0.223,其光谱分析认为峰为同一肽组分,随后对目的肽峰和杂质肽峰214 nm峰面积积分,见表1。

图3 目的肽峰996二极管阵列检测器纯度鉴定图
Fig 3 Purity plot of aim peptide
表1 目的肽和杂质214 nm峰面积积分及百分比
, http://www.100md.com
Tab 1 Peak area integrate of aim peptide andimpurifies in 214 nm
Retention time(min)
Area
Area (%)
Aim peptide
16.821
12488819
70.91
Crud peptide
18.162
, http://www.100md.com 5123143
29.10
经Suphadex-LH-20凝胶柱脱盐后P44肽粗品2号样品和未脱盐的1号样品在Symmetry C18柱分析色谱图,见图4;2号样品目的肽的214 nm波长峰面积积分为70.90%(均为第二次进样结果)。

图4 Symmetry C18 分析未脱盐与脱盐后P44肽粗品色谱对照图
Fig 4 Chromatogram compare in P44 and desalt P44
3 讨论
从图4分析结果看到,主要在1.970 min和9.514 min有214 nm强吸收小分子物质干扰,经分析肽切割过程中引用过的试剂,确认其为苯酚和苯甲硫醚残留,其由此可见常规的Symmetry C18反相法分析评价固相合成疏水肽应首先经凝胶柱脱盐处理为好。从Ultrahydrogel 250柱一步法分析结果峰面积积分得到的P44目的肽色谱峰纯度为70.91%,与应用Suphadex-LH-20凝胶柱和Symmetry C18反相柱两步法分析结果一致(70.90%),证实了单用C18反相分析方法存在的缺点;同时为从另一个角度证实这种快速的分析方法对P44肽合成纯度评价的可靠性及其对P44肽制备的指导意义,运用Waters径向加压柱反相少量制备了P44肽纯品,其收率(%)与Ultrahydrogel 250柱一步法纯度评价值(%)十分接近,即以理论平均偶联率99.5%计算,44肽的理论纯度为80.2%;而实际上Ultrahydrogel 250柱一步法分析得到的肽纯度较之理论值,对肽制备条件的优化无疑更有指导意义(另文报道)。本方法因选用了耐较高的有机相(40%CH3CN/0.1%TFA) Ultrahydrogel 250凝胶柱,克服了凝胶基质对疏水肽的吸附作用;充分利用高效体积排阻色谱(HPSEC)Ultrahydrogel 250柱良好的分子量线性范围(102-8×105D)及高分辨率;且本方法采用恒比例洗脱的方法,使996二极管距阵检测器的峰纯度鉴定更准确,且具很好的重现性;同时使固相合成过程中引入的一些疏水性小分子在Ultrahydrogel 250柱上能够得到十分有效的分离,消除了其对肽峰的干扰。因此,提示本方法可作为一种快速的固相合成疏水肽纯度评估的方法。
, 百拇医药
作者简介:周伟(1968-),男,重庆市人,实验师,主要从事多肽及蛋白质分析、纯化及鉴定方面的研究。电话:(023)68752236
参考文献:
[1] Heath T G, Giordani A B. Reversed-phase capillary high-performance liquid chromatography with on-line UV,fluorescence and electrospray ionization mass spectrometric detection in the analysis of peptides and proteins[J]. J Chromatogr,1993,638(1):9-19.
[2] Young P M, Burgoyne R F, Wheat T E. Photodiode array spectral identification of modified amino acids in synthetic peptides following high resolution HPLC separation[J]. Pept Res,1990,3(2): 81-84.
[3] Zeng W, Regamey P O, Rose K, et al. Use of Fmoc-N-(2-hydroxy-4-methoxybenzyl)amino acids in peptide synthesis[J]. J Pept Res,1997,49(3): 273-279.
收稿日期:1999-10-30;修回日期:2000-05-05, http://www.100md.com