乙型肝炎病毒X抗原转导细胞差示表达全长基因C2的克隆及初步功能研究
作者:刘杰 连兆瑞 潘静波 胡家露 朱明华 窦科峰 丁杰 吴开春 樊代明 Mark Feitelson
单位:刘杰 胡家露 丁杰 吴开春 樊代明(西安第四军医大学西京医院消化疾病研究所 710032);窦科峰(肝胆外科);朱明华(上海第二军医大学病理教研室);连兆瑞 潘静波(美国Thomas Jefferson大学病理及细胞生物学实验室);Mark Feitelson(美国Thomas Jefferson大学病理及细胞生物学实验室)
关键词:肝肿瘤;杂交;DNA;互补;乙型肝炎病毒X抗原
中华医学杂志000524 【摘要】 目的 克隆乙型肝炎病毒X抗原 (HBxAg)相关肝癌差示表达基因并做功能研究。方法 (1)用逆转录病毒方法建立表达HBxAg细胞模型。(2)用抑制差减杂交做基因差示表达分析。(3)做RNA印迹分析(Northern Blot)及原位分子杂交筛选基因探针。(4)用5′和3′迅速末端扩增法(RACE PCR)进行全长基因序列扩增,并进行体外蛋白翻译及制备抗体,做蛋白质印迹(Western Blot)分析。(5)进行该基因细胞内转导,进行功能研究。结果 共得到10个cDNA探针,其中8个因HBX表达上调,2个表达下降。 经筛选及全长基因扩增,得到1个全长为1.35 kb、编码113个氨基酸的全长基因 C2,和蛋白翻译起始因子(Suil)同源,其表达被HBX抑制。初步功能研究显示,此基因对细胞生长具有抑制作用 ,并且正常肝组织中其mRNA信号明显高于肝癌组织。结论 我们不仅克隆出HBX相关基因C2并进行了功能研究,还首次提出DNA病毒(HBV)能通过对细胞蛋白翻译水平的调节而导致癌变的机理。
, 百拇医药
Function of one novel gene identified by SSH PCR differentially expressed in HBX transfected HepG2 cells
LIU Jie LIAN Zhaorui PAN Jingbo et al
( Institute of Digestive Diseases, Xijing Hospital, Xi′an 710032, China)
【Abstract】 Objective To clone full length differentially expressed genes which are related with HBxAg. Methods HepG2-cells were infected with prepared recombinant retroviruses encoding the X antigen. The differences in gene expression between HepG2×and HepG2Cat cells were evaluated by suppression subtractive hybridization and PCR. In situ hybridization (ISH) and Northern blot analysis were carried out to screen the differentially expressed genes. The full length cDNA clone of the gene was obtained by 5′and 3′rapid amplification of cDNA ends(race) PCR. HepG2 cells transiently transfected with the new full length gene were subjected to fluorescence activated cell sorting(FACS) analysis for DNA content. HepG2 cells stably transfected with the new full length gene were tested for anchorage independent growth in soft agar and for tumorigenicity in nude mice. Results The expression of multiple genes were turned on(8) or off(2) in HepG2X compared to HepG2CAT cells. One differentially expressed gene C2, the human homology of Sui1, encoded a translation initiation factor whose expression was suppressed by X antigen in HepG2 cells. The full length of this gene was 1.35 kb, which encoded a small protein of 113 amino acids. Introduction of C2 into HepG2 cells could inhibit cell growth in culture, in soft agar, and partially inhibit tumor formation in nude mice. Cells transfected with pcDNA3-HBx showed little or no detectable C2, which was consistent with the suppression of this protein in the presence of HBxAg. C2 was also expressed in nontumor liver, but not in tumor cells from patients with hepatocellular carcinoma. Conclusions HBX can regulate the expression of genes whose products may be positive or negative regulators of cell growth. Our work for the first time demonstrates that the mechanism of DNA virus associated carcinogenesis involves altered patterns of gene expression regulated at the level of translation initiation.
, 百拇医药
【Key words】 Liver neoplasms; Hybridization; DNA, complementary; Hepatitis antigens
乙型肝炎病毒(HBV)尤其是乙型肝炎病毒X抗原(HBxAg)和肝癌发病密切相关。实验研究显示HBX不仅能体外转化鼠的肝细胞株,并能和p53抑癌基因结合而抑制其功能[1]。更有实验证实,HBX因能改变和调节一些转录因子的活性及通过改变信号传导途径,在转录调节水平上介导肿瘤形成[2]。因此,本实验目的就是通过用乙型肝炎病毒X(HBVX)基因转染肝纤维母细胞株(HepG2细胞)而建立表达HBxAg的细胞模型来研究宿主细胞因HBxAg的转入而在基因水平上的变异,对有差异的其中1个基因片断,进一步克隆出了全长基因序列并做了初步功能分析。
材料与方法
一、HBX逆转录病毒质粒载体(pSLXCMVHBV-X)及氯霉素乙酰转移酶逆转录病毒质粒载体(pSLXCMVCAT)的构建
, 百拇医药
HBVX基因pSLXCMVHBV-X表达载体及氯霉素乙酰转移酶基因pSLXCMVCAT表达载体均由美国Thomas Jefferson大学病理及细胞生物学实验室构建。 此两种重组细胞内表达载体均在真核细胞启动子(CMV)启动子调控之下。在转化细菌(HB101)后,进行序列鉴定。
二、重组逆转录病毒HepG2细胞的感染
用磷酸钙共沉淀法将15 μg的pSLXCMVHBX及pSLXCMV CAT感染大约1×106 PA317包装细胞。用5 ml富含重组逆转录病毒的上清感染HepG2细胞,经G418 2周筛选后,挑选阳性克隆。
三、抑制性cDNA差减杂交,cDNA探针克隆及测序
用抑制性差减杂交试剂盒(美国,Clontech公司产品)做上述经乙型肝炎病毒X基因(HepG2X)及氯霉素乙酰转移酶基因(HepG2CAT)的cDNA文库的差示筛选,详见操作手册。将上述抑制性PCR产物用胶提试剂盒纯化(美国,Qiagen公司产品),连结到T载体(美国,Novagen公司产品),通过转染大肠杆菌后纯化质粒DNA做序列测定,并在基因库中做比较。
, 百拇医药
四、RNA印迹法(Northern Blot)分析杂交产物
抽提细胞总RNA(美国,Qiagen公司试剂盒)并转移至硝酸纤维素滤膜,以32P随机引物标记法标记每一个探针(美国,Promega公司),在严格条件下进行杂交。洗膜后做放射自显影。用G3PDH做内源性对照。
五、原位分子杂交
将抑制差减杂交所得cDNA探针,用地高辛缺口翻译标记法标记后(德国,BOEHRINGER MANNHEIM公司试剂盒),在细胞株及冰冻切片标本上做原位分子杂交。具体方法用Oncor原位分子杂交试剂盒(美国,Oncor公司产品)。
六、临床病例标本
23例临床肝癌和癌旁正常组织均取自西京医院,所有标本均为新鲜手术标本,手术切除后立即放于液氮和-80℃冰箱中备用。
, 百拇医药
七、全长基因C2的克隆
全长cDNA克隆的获得用马拉松cDNA全长基因扩增试剂盒的5′和3′末端迅速扩增(RACE)PCR(美国,Clontech公司试剂盒),首先合成3′和5′特异性引物,用子宫cDNA文库作为模板,用3′和5′基因特异性引物分别和连接子引物配对,用递减(touchdown) PCR分别得到3′末端和5′末端产物。将此产物分别克隆到T载体(美国,Novagen公司产品)测序。在重叠部分找出适当酶切位点进行全长基因连结并测序鉴定。
八、体外蛋白翻译
体外蛋白翻译用美国Novagen公司试剂盒。在兔网织红细胞裂解液中完成其翻译过程,并用35S标记蛋氨酸参入。将其翻译产物做聚丙烯酰胺凝胶电泳,负压干胶后,作放射自显影。
九、多克隆抗体的制备
, 百拇医药
根据计算机分析结果,C2的52-69及75-94氨基酸寡肽在美国Thomas Jefferson大学的kimmel Cancer中心合成,合成后的寡肽由Keyhole Limpet hemocyanin (KLH)包被。在分3次在新西兰家兔免疫后的第35 d抽取血清,用ELISA检测抗体滴度。
十、细胞转染
将C2装入细胞内表达载体PcDNA3(美国,Invitrogen公司产品)。离心收集HepG2细胞,磷酸盐缓冲液(PBS)洗后,重新种于4 ml培养液中,加入10 μg质粒DNA(PcDNA3-C2),混匀后加入20 μl的SuperFect Reagent(美国,Qiagen公司产品),混匀,室温下温育10 min。37℃ 3 h后换常规培养液,继续培养48 h,做瞬时基因表达检测,或加入G418(800 μg/ml)后做稳定选择培养。
十一、流式细胞分析(FACS)
, 百拇医药
离心收集进入对数生长期的经C2 转染的HepG2细胞,溶于PBS,加质量分数为0.95的乙醇固定细胞,于4℃存放数天后作FACS分析。
十二、软琼脂集落形成实验及成瘤性观察
用质量分数为0.004的软琼脂做为底胶,将1×103用C2稳定转染的HepG2细胞和质量分数为0.002的琼脂混合后种于底胶上,继续培养3 W,观察集落数目。将1×107的用C2稳定转染的HepG2细胞种于裸鼠皮下,6 W后观察肿瘤的大小和数目,以判定转染细胞的成瘤性。
结果
一、HepG2X及HepG2CAT细胞cDNA文库的抑制差减杂交及基因库比较结果
共有8个cDNA片断从HepG2X细胞中克隆,其中5个与基因库已知基因有大于89%的同源性,3个无同源性。在5个有同源性的基因中,3个与胚胎来的组织有部分同源,提示这3个基因可能有促进细胞生长的功能。此外,有2个片断从HepG2CAT细胞中克隆出来,其中一个C2与酵母(yeast)蛋白翻译启始因子(Sui1)同源,另一个无同源性。因此,在HepG2X和HepG2CAT细胞之间,共有10个差示表达基因片断被克隆。
, http://www.100md.com
二、Northern Blot分析C2在HepG2X和HepG2CAT细胞中的表达
提取两组细胞等量RNA,做多聚甲醛凝胶电泳及硝酸纤维素膜转印,用32P标记C2探针,做Northern Blot杂交。C2(来自HepG2CAT的探针)主要表达在HepG2CAT细胞(图1)。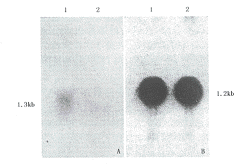
图1 A.Northern Blot分析C2 RNA表达显示条带在1.3 kb,且HepG2CAT(1)表达强于HepG2X(2) B.G3PDH内源性
对照示HepG2CAT(1)及HepG2X(2)两泳道均加入等量RNA
三、原位分子杂交检测C2在HepG2X,HepG2CAT及临床组织中的表达
, 百拇医药
用C2探针在HepG2X和HepG2CAT细胞上做原位分子杂交,其结果和Northern Blot一致,来自HepG2CAT的探针(C2)主要表达在HepG2CAT细胞上(图2A、B)。同时我们用原位分子杂交在HBV感染的临床标本上检测了C2的表达情况,结果显示,96%(22/23)正常癌旁肝组织可检测到C2mRNA信号,而肝癌组织仅22%(5/23)弱阳性(P<0.01)( 图2C、D)。
四、C2全长基因序列克隆及基因库比较结果
用马拉松全长cDNA扩增技术及末端RACE PCR 得到C2全长基因序列为1.35 kb,编码113个氨基酸(图3),基因库比较和酵母的蛋白翻译起始因子同源。
五、C2全长基因体外蛋白翻译
将C2全长基因装入体外表达载体,在兔网织红细胞裂解液中,将35S-蛋氨酸参入完成其蛋白翻译。放射自显影后,可以看到C2的翻译蛋白在13 000(图4)。
, http://www.100md.com
六、C2蛋白质印迹分析(Western Blot)结果
建立PcDNA3-C2,PcDNA3-HBX和PcDNA3 3种细胞内表达载体,分别做HepG2细胞的稳定转染,提取等量蛋白质做Western Blot分析。结果显示C2相对分子质量大约为13 000,转染pcDNA3-C2的细胞表达明显强于转染PcDNA3-HBX和PcDNA3的细胞,其中单纯载体转染的PcDNA3-HepG2细胞的表达介于两者中间(图5)。
七、C2初步功能研究
1.流式细胞分析:将全长基因C2装入细胞内表达载体PcDNA3,进行细胞转染。 在转染后48 h,有32.2%的PcDNA3-C2转染的HepG2CAT细胞处在S期,而对照细胞(PcDNA3单独转染HepG2CAT)有44.8%处在S期(P<0.01)。提示C2可抑制细胞的DNA合成。
, 百拇医药
图2 原位分子杂交检测C2 mRNA表达:HepG2CAT(A)表达明显强于HepG2X(B),正常肝组织(C)表达明显强于肝癌组织(D)
图3 C2全长cDNA序列。全长为1.35 kb,编码113个氨基酸蛋白,其翻译启始和终止密码子分别为ATG和TAA
图4 C2全长基因体外蛋白翻译。1为阳性对照,2为C2全长基因体外蛋白翻译,翻译蛋白在13 000 图5 Western Blot分析C2在转染pcDNA3-C2的HepG2细胞(1)表达明显强于转染pcDNA3-HBX(2)和PcDNA3(3)的HepG2细胞
2.软琼脂集落形成实验:将1×103用PcDNA3及PcDNA3-C2 稳定转染的HepG2细胞,种于软琼脂上,3周后,观察集落形成数目。结果HepG2-PcDNA3-C2平均产生(90±28)个克隆,而HepG2-PcDNA3平均产生(219±36)个克隆。提示在琼脂集落形成实验中C2的表达明显抑制HepG2细胞的生长。 组间比较差异显著(P<0.01)。
, http://www.100md.com
3.C2成瘤实验:成瘤性观测显示,10只用C2转染细胞接种的裸鼠,有2只形成肿瘤,成瘤性为20%,肿瘤平均直径为0.50 cm。而21只用对照细胞接种的裸鼠有16只形成肿瘤,成瘤性为76%,肿瘤平均直径0.94 cm,两组比较差异有显著意义(P<0.01),提示C2可减低HepG2细胞的成瘤性。
讨论
HBxAg和肝癌发病密切相关 。并且已有实验证实HBxAg因能改变宿主细胞基因表达而导致肿瘤形成[3]。本研究通过应用HepG2X和HepG2CAT两种细胞模型的cDNA文库的差减杂交及抑制性PCR技术,探讨了宿主细胞中HBxAg的自然作用分子,即HBxAg相关基因。结果显示,8个cDNA片断因HBX的转入而表达上调,另有2个cDNA片断因HBX基因的转入而受到抑制,表达下降。通过原位分子杂交及Northern Blot 筛选,这些探针在两种细胞中的表达均有差异,因此,可被认为HBX相关基因的部分序列。在被HBX下调的基因中, 有一个(命名为C2)在正常临床肝组织中的表达明显强于肿瘤组织,提示HBX对C2表达的抑制可能和肝癌的发生有关。
, 百拇医药
进一步对C2的全长基因序列进行了克隆,并做了初步功能研究。显示此基因对细胞生长具有抑制作用。且基因库比较结果显示此基因和酵母蛋白翻译起始因子同源。 已有实验证实,细胞内mRNA编码的人类同源的翻译起始因子Sui1,其功能是与 eIF-2共同使tRNA建立核糖体识别位点AUG密码子[4]。Sui1同时也可通过抑制核糖体框架移动而维持蛋白翻译的完整性,是蛋白翻译过程中的总监控分子[5,6],提示HBxAg通过抑制C2的表达,可在HBV基因组及某些宿主基因内促进其框架转移,从而在蛋白翻译水平上促进细胞的恶性转化。
本研究结果显示,C2在HepG2X中的转录水平明显低于HepG2CAT,HBxAg能够刺激细胞的生长(资料另文发表),提示C2的下调能够促进生长刺激因子的表达和/或阻碍生长抑制蛋白的翻译。我们的研究结果同时还发现 C2 mRNA在正常组织中表达明显高于肿瘤组织,提示其表达在肿瘤恶性化过程中逐渐受到抑制,并且这种差示表达可能和肿瘤形成有关。进一步研究结果显示,C2在单纯培养及软琼脂集落形成实验中均抑制细胞的生长,并能够减低其在裸鼠的成瘤性,亦支持此种观点。虽然所有这些结果均支持细胞在蛋白翻译起始水平的调节,可能作为一个新发现的肝癌癌变的潜在步骤,但事实上这种翻译水平的调节已在别的肿瘤发展过程中得到证实。如eIF-2和/或eIF-4E已经被证实参与几种细胞的恶性转化[7,8],因此,在这点上,本研究发现的C2过表达能够抑制细胞生长及别人发现的eIF-2和/或eIF-4E能够刺激细胞生长,提示这些因子的比率对调节及维持蛋白翻译水平的正负平衡起着重要作用,HBx对C2的抑制可能为肝细胞癌变的分子机制之一。如果进一步工作继续支持这种癌变模式,那么本研究将是第一次提出HBV的DNA病毒能够通过对宿主细胞蛋白翻译水平的调节而导致癌变的机理。
, 百拇医药
基金项目:国家自然科学基金高技术探索资助项目(39980041)
参考文献
1,Truant R, Antunovic J, Greenblatt J, et al. Direct interaction of the hepatitis B virus HBx protein with p53 response element-directed transactivation. J Virol, 1995,69:1851-1859.
2,Kekule AS, Lauer U, Weiss L, et al. Hepatitis B virus transactivator HBx uses a tumor promoter signalling pathway. Nature, 1993,361:742-745.
, 百拇医药 3,Henkler F, Koshy R. Hepatitis B virus transcriptional activators: mechanisms and possible role in oncogenesis. J Viral Hepat, 1996,3:109-112.
4,Yoon HJ, Donahue TF. The suil suppressor locus in Saccharomyces cerevisiae encodes a translation factor that functions during tRNA (iMet) recognition of the start codon. Mol Cell Biol, 1992,12:248-260.
5,Cui Y, Dinman JD, Kinzy TG, et al. The Mof2/Suil protein is a general monitor of translational accuracy. Mol Cell Biol, 1998,18:1506-1516.
, 百拇医药
6,Cui Y, Gonzalez CI, Kinzy TG, et al. Mutation in the MOF2/Sui1 gene affected both translation and nonsense-mediated mRNA decay. RNA, 1999,5:794-804.
7,Rosenwald IB, Rhoads DB, Callanan LD, et al. Increased expression of eukaryotic translation initiation factors eIF-4E and eIF-2 alpha in response to growth induction by c-myc. Proc Natl Acad Sci USA, 1993,90:6175-6178.
8,Kerekatte V, Smiley K, Hu B, et al. The proto-oncogene/translation factor eIF4E: a survey of its expression in breast carcinomas. Int J Cancer, 1995,64:27-31.
s(收稿日期:1999-08-31)
, http://www.100md.com
单位:刘杰 胡家露 丁杰 吴开春 樊代明(西安第四军医大学西京医院消化疾病研究所 710032);窦科峰(肝胆外科);朱明华(上海第二军医大学病理教研室);连兆瑞 潘静波(美国Thomas Jefferson大学病理及细胞生物学实验室);Mark Feitelson(美国Thomas Jefferson大学病理及细胞生物学实验室)
关键词:肝肿瘤;杂交;DNA;互补;乙型肝炎病毒X抗原
中华医学杂志000524 【摘要】 目的 克隆乙型肝炎病毒X抗原 (HBxAg)相关肝癌差示表达基因并做功能研究。方法 (1)用逆转录病毒方法建立表达HBxAg细胞模型。(2)用抑制差减杂交做基因差示表达分析。(3)做RNA印迹分析(Northern Blot)及原位分子杂交筛选基因探针。(4)用5′和3′迅速末端扩增法(RACE PCR)进行全长基因序列扩增,并进行体外蛋白翻译及制备抗体,做蛋白质印迹(Western Blot)分析。(5)进行该基因细胞内转导,进行功能研究。结果 共得到10个cDNA探针,其中8个因HBX表达上调,2个表达下降。 经筛选及全长基因扩增,得到1个全长为1.35 kb、编码113个氨基酸的全长基因 C2,和蛋白翻译起始因子(Suil)同源,其表达被HBX抑制。初步功能研究显示,此基因对细胞生长具有抑制作用 ,并且正常肝组织中其mRNA信号明显高于肝癌组织。结论 我们不仅克隆出HBX相关基因C2并进行了功能研究,还首次提出DNA病毒(HBV)能通过对细胞蛋白翻译水平的调节而导致癌变的机理。
, 百拇医药
Function of one novel gene identified by SSH PCR differentially expressed in HBX transfected HepG2 cells
LIU Jie LIAN Zhaorui PAN Jingbo et al
( Institute of Digestive Diseases, Xijing Hospital, Xi′an 710032, China)
【Abstract】 Objective To clone full length differentially expressed genes which are related with HBxAg. Methods HepG2-cells were infected with prepared recombinant retroviruses encoding the X antigen. The differences in gene expression between HepG2×and HepG2Cat cells were evaluated by suppression subtractive hybridization and PCR. In situ hybridization (ISH) and Northern blot analysis were carried out to screen the differentially expressed genes. The full length cDNA clone of the gene was obtained by 5′and 3′rapid amplification of cDNA ends(race) PCR. HepG2 cells transiently transfected with the new full length gene were subjected to fluorescence activated cell sorting(FACS) analysis for DNA content. HepG2 cells stably transfected with the new full length gene were tested for anchorage independent growth in soft agar and for tumorigenicity in nude mice. Results The expression of multiple genes were turned on(8) or off(2) in HepG2X compared to HepG2CAT cells. One differentially expressed gene C2, the human homology of Sui1, encoded a translation initiation factor whose expression was suppressed by X antigen in HepG2 cells. The full length of this gene was 1.35 kb, which encoded a small protein of 113 amino acids. Introduction of C2 into HepG2 cells could inhibit cell growth in culture, in soft agar, and partially inhibit tumor formation in nude mice. Cells transfected with pcDNA3-HBx showed little or no detectable C2, which was consistent with the suppression of this protein in the presence of HBxAg. C2 was also expressed in nontumor liver, but not in tumor cells from patients with hepatocellular carcinoma. Conclusions HBX can regulate the expression of genes whose products may be positive or negative regulators of cell growth. Our work for the first time demonstrates that the mechanism of DNA virus associated carcinogenesis involves altered patterns of gene expression regulated at the level of translation initiation.
, 百拇医药
【Key words】 Liver neoplasms; Hybridization; DNA, complementary; Hepatitis antigens
乙型肝炎病毒(HBV)尤其是乙型肝炎病毒X抗原(HBxAg)和肝癌发病密切相关。实验研究显示HBX不仅能体外转化鼠的肝细胞株,并能和p53抑癌基因结合而抑制其功能[1]。更有实验证实,HBX因能改变和调节一些转录因子的活性及通过改变信号传导途径,在转录调节水平上介导肿瘤形成[2]。因此,本实验目的就是通过用乙型肝炎病毒X(HBVX)基因转染肝纤维母细胞株(HepG2细胞)而建立表达HBxAg的细胞模型来研究宿主细胞因HBxAg的转入而在基因水平上的变异,对有差异的其中1个基因片断,进一步克隆出了全长基因序列并做了初步功能分析。
材料与方法
一、HBX逆转录病毒质粒载体(pSLXCMVHBV-X)及氯霉素乙酰转移酶逆转录病毒质粒载体(pSLXCMVCAT)的构建
, 百拇医药
HBVX基因pSLXCMVHBV-X表达载体及氯霉素乙酰转移酶基因pSLXCMVCAT表达载体均由美国Thomas Jefferson大学病理及细胞生物学实验室构建。 此两种重组细胞内表达载体均在真核细胞启动子(CMV)启动子调控之下。在转化细菌(HB101)后,进行序列鉴定。
二、重组逆转录病毒HepG2细胞的感染
用磷酸钙共沉淀法将15 μg的pSLXCMVHBX及pSLXCMV CAT感染大约1×106 PA317包装细胞。用5 ml富含重组逆转录病毒的上清感染HepG2细胞,经G418 2周筛选后,挑选阳性克隆。
三、抑制性cDNA差减杂交,cDNA探针克隆及测序
用抑制性差减杂交试剂盒(美国,Clontech公司产品)做上述经乙型肝炎病毒X基因(HepG2X)及氯霉素乙酰转移酶基因(HepG2CAT)的cDNA文库的差示筛选,详见操作手册。将上述抑制性PCR产物用胶提试剂盒纯化(美国,Qiagen公司产品),连结到T载体(美国,Novagen公司产品),通过转染大肠杆菌后纯化质粒DNA做序列测定,并在基因库中做比较。
, 百拇医药
四、RNA印迹法(Northern Blot)分析杂交产物
抽提细胞总RNA(美国,Qiagen公司试剂盒)并转移至硝酸纤维素滤膜,以32P随机引物标记法标记每一个探针(美国,Promega公司),在严格条件下进行杂交。洗膜后做放射自显影。用G3PDH做内源性对照。
五、原位分子杂交
将抑制差减杂交所得cDNA探针,用地高辛缺口翻译标记法标记后(德国,BOEHRINGER MANNHEIM公司试剂盒),在细胞株及冰冻切片标本上做原位分子杂交。具体方法用Oncor原位分子杂交试剂盒(美国,Oncor公司产品)。
六、临床病例标本
23例临床肝癌和癌旁正常组织均取自西京医院,所有标本均为新鲜手术标本,手术切除后立即放于液氮和-80℃冰箱中备用。
, 百拇医药
七、全长基因C2的克隆
全长cDNA克隆的获得用马拉松cDNA全长基因扩增试剂盒的5′和3′末端迅速扩增(RACE)PCR(美国,Clontech公司试剂盒),首先合成3′和5′特异性引物,用子宫cDNA文库作为模板,用3′和5′基因特异性引物分别和连接子引物配对,用递减(touchdown) PCR分别得到3′末端和5′末端产物。将此产物分别克隆到T载体(美国,Novagen公司产品)测序。在重叠部分找出适当酶切位点进行全长基因连结并测序鉴定。
八、体外蛋白翻译
体外蛋白翻译用美国Novagen公司试剂盒。在兔网织红细胞裂解液中完成其翻译过程,并用35S标记蛋氨酸参入。将其翻译产物做聚丙烯酰胺凝胶电泳,负压干胶后,作放射自显影。
九、多克隆抗体的制备
, 百拇医药
根据计算机分析结果,C2的52-69及75-94氨基酸寡肽在美国Thomas Jefferson大学的kimmel Cancer中心合成,合成后的寡肽由Keyhole Limpet hemocyanin (KLH)包被。在分3次在新西兰家兔免疫后的第35 d抽取血清,用ELISA检测抗体滴度。
十、细胞转染
将C2装入细胞内表达载体PcDNA3(美国,Invitrogen公司产品)。离心收集HepG2细胞,磷酸盐缓冲液(PBS)洗后,重新种于4 ml培养液中,加入10 μg质粒DNA(PcDNA3-C2),混匀后加入20 μl的SuperFect Reagent(美国,Qiagen公司产品),混匀,室温下温育10 min。37℃ 3 h后换常规培养液,继续培养48 h,做瞬时基因表达检测,或加入G418(800 μg/ml)后做稳定选择培养。
十一、流式细胞分析(FACS)
, 百拇医药
离心收集进入对数生长期的经C2 转染的HepG2细胞,溶于PBS,加质量分数为0.95的乙醇固定细胞,于4℃存放数天后作FACS分析。
十二、软琼脂集落形成实验及成瘤性观察
用质量分数为0.004的软琼脂做为底胶,将1×103用C2稳定转染的HepG2细胞和质量分数为0.002的琼脂混合后种于底胶上,继续培养3 W,观察集落数目。将1×107的用C2稳定转染的HepG2细胞种于裸鼠皮下,6 W后观察肿瘤的大小和数目,以判定转染细胞的成瘤性。
结果
一、HepG2X及HepG2CAT细胞cDNA文库的抑制差减杂交及基因库比较结果
共有8个cDNA片断从HepG2X细胞中克隆,其中5个与基因库已知基因有大于89%的同源性,3个无同源性。在5个有同源性的基因中,3个与胚胎来的组织有部分同源,提示这3个基因可能有促进细胞生长的功能。此外,有2个片断从HepG2CAT细胞中克隆出来,其中一个C2与酵母(yeast)蛋白翻译启始因子(Sui1)同源,另一个无同源性。因此,在HepG2X和HepG2CAT细胞之间,共有10个差示表达基因片断被克隆。
, http://www.100md.com
二、Northern Blot分析C2在HepG2X和HepG2CAT细胞中的表达
提取两组细胞等量RNA,做多聚甲醛凝胶电泳及硝酸纤维素膜转印,用32P标记C2探针,做Northern Blot杂交。C2(来自HepG2CAT的探针)主要表达在HepG2CAT细胞(图1)。

图1 A.Northern Blot分析C2 RNA表达显示条带在1.3 kb,且HepG2CAT(1)表达强于HepG2X(2) B.G3PDH内源性
对照示HepG2CAT(1)及HepG2X(2)两泳道均加入等量RNA
三、原位分子杂交检测C2在HepG2X,HepG2CAT及临床组织中的表达
, 百拇医药
用C2探针在HepG2X和HepG2CAT细胞上做原位分子杂交,其结果和Northern Blot一致,来自HepG2CAT的探针(C2)主要表达在HepG2CAT细胞上(图2A、B)。同时我们用原位分子杂交在HBV感染的临床标本上检测了C2的表达情况,结果显示,96%(22/23)正常癌旁肝组织可检测到C2mRNA信号,而肝癌组织仅22%(5/23)弱阳性(P<0.01)( 图2C、D)。
四、C2全长基因序列克隆及基因库比较结果
用马拉松全长cDNA扩增技术及末端RACE PCR 得到C2全长基因序列为1.35 kb,编码113个氨基酸(图3),基因库比较和酵母的蛋白翻译起始因子同源。
五、C2全长基因体外蛋白翻译
将C2全长基因装入体外表达载体,在兔网织红细胞裂解液中,将35S-蛋氨酸参入完成其蛋白翻译。放射自显影后,可以看到C2的翻译蛋白在13 000(图4)。
, http://www.100md.com
六、C2蛋白质印迹分析(Western Blot)结果
建立PcDNA3-C2,PcDNA3-HBX和PcDNA3 3种细胞内表达载体,分别做HepG2细胞的稳定转染,提取等量蛋白质做Western Blot分析。结果显示C2相对分子质量大约为13 000,转染pcDNA3-C2的细胞表达明显强于转染PcDNA3-HBX和PcDNA3的细胞,其中单纯载体转染的PcDNA3-HepG2细胞的表达介于两者中间(图5)。
七、C2初步功能研究
1.流式细胞分析:将全长基因C2装入细胞内表达载体PcDNA3,进行细胞转染。 在转染后48 h,有32.2%的PcDNA3-C2转染的HepG2CAT细胞处在S期,而对照细胞(PcDNA3单独转染HepG2CAT)有44.8%处在S期(P<0.01)。提示C2可抑制细胞的DNA合成。

, 百拇医药
图2 原位分子杂交检测C2 mRNA表达:HepG2CAT(A)表达明显强于HepG2X(B),正常肝组织(C)表达明显强于肝癌组织(D)

图3 C2全长cDNA序列。全长为1.35 kb,编码113个氨基酸蛋白,其翻译启始和终止密码子分别为ATG和TAA

图4 C2全长基因体外蛋白翻译。1为阳性对照,2为C2全长基因体外蛋白翻译,翻译蛋白在13 000 图5 Western Blot分析C2在转染pcDNA3-C2的HepG2细胞(1)表达明显强于转染pcDNA3-HBX(2)和PcDNA3(3)的HepG2细胞
2.软琼脂集落形成实验:将1×103用PcDNA3及PcDNA3-C2 稳定转染的HepG2细胞,种于软琼脂上,3周后,观察集落形成数目。结果HepG2-PcDNA3-C2平均产生(90±28)个克隆,而HepG2-PcDNA3平均产生(219±36)个克隆。提示在琼脂集落形成实验中C2的表达明显抑制HepG2细胞的生长。 组间比较差异显著(P<0.01)。
, http://www.100md.com
3.C2成瘤实验:成瘤性观测显示,10只用C2转染细胞接种的裸鼠,有2只形成肿瘤,成瘤性为20%,肿瘤平均直径为0.50 cm。而21只用对照细胞接种的裸鼠有16只形成肿瘤,成瘤性为76%,肿瘤平均直径0.94 cm,两组比较差异有显著意义(P<0.01),提示C2可减低HepG2细胞的成瘤性。
讨论
HBxAg和肝癌发病密切相关 。并且已有实验证实HBxAg因能改变宿主细胞基因表达而导致肿瘤形成[3]。本研究通过应用HepG2X和HepG2CAT两种细胞模型的cDNA文库的差减杂交及抑制性PCR技术,探讨了宿主细胞中HBxAg的自然作用分子,即HBxAg相关基因。结果显示,8个cDNA片断因HBX的转入而表达上调,另有2个cDNA片断因HBX基因的转入而受到抑制,表达下降。通过原位分子杂交及Northern Blot 筛选,这些探针在两种细胞中的表达均有差异,因此,可被认为HBX相关基因的部分序列。在被HBX下调的基因中, 有一个(命名为C2)在正常临床肝组织中的表达明显强于肿瘤组织,提示HBX对C2表达的抑制可能和肝癌的发生有关。
, 百拇医药
进一步对C2的全长基因序列进行了克隆,并做了初步功能研究。显示此基因对细胞生长具有抑制作用。且基因库比较结果显示此基因和酵母蛋白翻译起始因子同源。 已有实验证实,细胞内mRNA编码的人类同源的翻译起始因子Sui1,其功能是与 eIF-2共同使tRNA建立核糖体识别位点AUG密码子[4]。Sui1同时也可通过抑制核糖体框架移动而维持蛋白翻译的完整性,是蛋白翻译过程中的总监控分子[5,6],提示HBxAg通过抑制C2的表达,可在HBV基因组及某些宿主基因内促进其框架转移,从而在蛋白翻译水平上促进细胞的恶性转化。
本研究结果显示,C2在HepG2X中的转录水平明显低于HepG2CAT,HBxAg能够刺激细胞的生长(资料另文发表),提示C2的下调能够促进生长刺激因子的表达和/或阻碍生长抑制蛋白的翻译。我们的研究结果同时还发现 C2 mRNA在正常组织中表达明显高于肿瘤组织,提示其表达在肿瘤恶性化过程中逐渐受到抑制,并且这种差示表达可能和肿瘤形成有关。进一步研究结果显示,C2在单纯培养及软琼脂集落形成实验中均抑制细胞的生长,并能够减低其在裸鼠的成瘤性,亦支持此种观点。虽然所有这些结果均支持细胞在蛋白翻译起始水平的调节,可能作为一个新发现的肝癌癌变的潜在步骤,但事实上这种翻译水平的调节已在别的肿瘤发展过程中得到证实。如eIF-2和/或eIF-4E已经被证实参与几种细胞的恶性转化[7,8],因此,在这点上,本研究发现的C2过表达能够抑制细胞生长及别人发现的eIF-2和/或eIF-4E能够刺激细胞生长,提示这些因子的比率对调节及维持蛋白翻译水平的正负平衡起着重要作用,HBx对C2的抑制可能为肝细胞癌变的分子机制之一。如果进一步工作继续支持这种癌变模式,那么本研究将是第一次提出HBV的DNA病毒能够通过对宿主细胞蛋白翻译水平的调节而导致癌变的机理。
, 百拇医药
基金项目:国家自然科学基金高技术探索资助项目(39980041)
参考文献
1,Truant R, Antunovic J, Greenblatt J, et al. Direct interaction of the hepatitis B virus HBx protein with p53 response element-directed transactivation. J Virol, 1995,69:1851-1859.
2,Kekule AS, Lauer U, Weiss L, et al. Hepatitis B virus transactivator HBx uses a tumor promoter signalling pathway. Nature, 1993,361:742-745.
, 百拇医药 3,Henkler F, Koshy R. Hepatitis B virus transcriptional activators: mechanisms and possible role in oncogenesis. J Viral Hepat, 1996,3:109-112.
4,Yoon HJ, Donahue TF. The suil suppressor locus in Saccharomyces cerevisiae encodes a translation factor that functions during tRNA (iMet) recognition of the start codon. Mol Cell Biol, 1992,12:248-260.
5,Cui Y, Dinman JD, Kinzy TG, et al. The Mof2/Suil protein is a general monitor of translational accuracy. Mol Cell Biol, 1998,18:1506-1516.
, 百拇医药
6,Cui Y, Gonzalez CI, Kinzy TG, et al. Mutation in the MOF2/Sui1 gene affected both translation and nonsense-mediated mRNA decay. RNA, 1999,5:794-804.
7,Rosenwald IB, Rhoads DB, Callanan LD, et al. Increased expression of eukaryotic translation initiation factors eIF-4E and eIF-2 alpha in response to growth induction by c-myc. Proc Natl Acad Sci USA, 1993,90:6175-6178.
8,Kerekatte V, Smiley K, Hu B, et al. The proto-oncogene/translation factor eIF4E: a survey of its expression in breast carcinomas. Int J Cancer, 1995,64:27-31.
s(收稿日期:1999-08-31)
, http://www.100md.com