花生四烯酸在紫杉醇生物合成途径上作用位点的研究
作者:苗志奇 未作君 元英进
单位:天津大学生物化学工程系 300072
关键词:紫杉醇;花生四烯酸;作用位点;植物细胞培养
中草药000610摘 要 利用短期诱导实验,分析了花生四烯酸对红豆杉细胞培养中紫 杉烷合成的影响。在适宜浓度的花生四烯酸诱导下,紫杉醇(taxol)的产量提高了近3 倍, 同时10-去乙酰基巴卡亭Ⅲ(10-DAB)与巴卡亭Ⅲ(baccatinⅢ)相应上升。通过对紫杉醇合 成 代谢途径的等拓扑结构简化与动力学分析,获得了诱导子加入后可能的3 种中间代谢产物浓 度转移模式。结合花生四烯酸短期诱导实验结果,提出了花生四烯酸的加入提高了10-DAB 合成通量的观点,诱导子作用位点的确定为多诱导子配伍方案奠定了基础。
Studies on the Acting Point of Arachidonic Acid in Taxol Bios ynthetic Pathway
, 百拇医药
Miao Zhiqi, Wei Zuojun and Yuan Yingjin
(Department of Biochemical Engineering, Tianjin University Tianjin 300072)
Abstract The influence of arachidonic acid on the production of taxanes in the process of plant cell culture was studied by short term elicit ation experiments. Experiments showed that arachidonic acid at a concentration o f 0.1 mg/L can improve the production of taxol nearly three-fold. It was disc o vered that the concentration of 10-deacetyl baccatin Ⅲ (10-DAB Ⅲ) and baccat in Ⅲ were also increased while taxol concentration increases under arachidonic acid elicitation. By dynamic kinetic analysis on the simplified taxol biosynthe ti c pathway, the mode of taxoid concentration transformation may proceed in three different ways. On the basis of experimental results of arachidonic acid elicit ation, it could be postulated that at certain concentration of arachidonic acid the reaction rate for the production of 10-DAB Ⅲ could be increased. To define s u ch a point precisely may provide a basis to achieve a synergistic action of mult iple-elicitors.
, 百拇医药
Key words taxol arachidonic acid the acting point of enzyme plant cell culture
脂肪酸,特别是多羟基不饱和脂肪酸,被认为可以激活防御诱导和防御相关基因,是植物 病 理反应和信号传导系统的一组重要物质。抗癌药物紫杉醇是红豆杉属植物在病理条件下合成 的一种二萜类物质,可以杀伤寄生真菌,抵御真菌入侵,属于植物病理反应产物,文献报道 经过诱导[1~9]的红豆杉细胞中紫杉醇含量出现上升。
本文尝试将一种重要的脂肪酸--花生四烯酸应用于南方红豆杉细胞培养体系,研究花生四 烯酸的加入与紫杉烷产量间的对应关系,寻找最优的花生四烯酸诱导浓度,并结合紫杉醇生 物合成途径的研究成果,利用动力学定性分析,在酶水平以及次生代谢水平上,研究花生四 烯酸加入后紫杉醇合成途径中酶活力与代谢通量改变,确定花生四烯酸在紫杉醇生物合成途 径上的作用位点与配伍特性,为实现多种诱导子协同配伍方案奠定基础。
, 百拇医药
1 材料与方法
1.1 细胞株系:实验中所采用的细胞为南方红豆杉细胞的一个变种YH。
1.2 培养基:培养基采用含蔗糖20 g/L的B5培养基。培养基pH值在灭菌前调整到5.8。
1.3 诱导子实验设计:采用250 mL的锥形瓶摇床培养,转速定为100 r/min。每瓶盛40 mL 实验用培养基,接入3 g(以湿重计)混合均匀的种子细胞。为保证实验结果的有效性,每个 实验都采用3 个平行组, 培养第6,10 天后分别取样,检测细胞的生长量与紫杉烷含量。实验用培养基为含不同浓度 花生四烯酸的B5培养基,其中花生四烯酸浓度如表1所示。
1.4 细胞干湿重测量:培养物在3 000 r/min离心 30 min,收集细胞,测量湿重。将细胞 在60 ℃下烘干至恒重,测量细胞干重。
, 百拇医药
表1 花生四烯酸短期诱导实验设计 实验编号
花生四烯酸浓度mg/L
A
0
B
0.1
C
1
D
10
1.5 紫杉烷的提取与测量方法:按文献[6]方法,结果如下。
2 结果分析
, 百拇医药
图1,2分别是第6,10天时紫杉醇合成途径中关键性中间代谢产物的浓度,其中实验编号对 应花生四烯酸浓度如表1所示。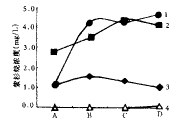
1-taxl 2-baccatin Ⅲ
3-10-DAB 4-cephalomannine
图1 不同浓度花生四烯酸诱导下第6 天
后紫杉烷含量的变化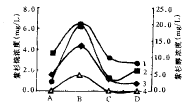
(1~4同图1)
图2 不同浓度花生四烯酸诱导下第10 天
, 百拇医药
后紫杉烷含量的变化
从图1可以看出加入花生四烯酸6 d后,紫杉醇的含量与花生四烯酸的加入浓度呈现为一 条饱和曲线。当花生四烯酸加入浓度小于0.1 mg/L时,紫杉醇的含量随花生四烯酸的增加 而增加;当花生四烯酸浓度大于等于0.1 mg/L时,紫杉醇的含量保持恒定,与花生四烯酸 的浓度无关。同时10-DAB和baccatin Ⅲ的含量出现上升。
从图2可以看出花生四烯酸加入第10 天后,其对紫杉醇含量的影响体现得更明显。当花生烯 酸浓度小于0.1 mg/L时,紫杉烷的含量随花生四烯酸的增加而增加;当花生四烯酸浓度等 于0.1 mg/L时,紫杉醇的含量最高,比对照组高出近3 倍;当花生四烯酸的浓度大于0.1 mg/L,随着花生四烯酸浓度的提高,紫杉醇含量出现下降。
对照细胞的生长曲线(图3),可以看出1和10 mg/L的花生四烯酸明显抑制细胞生长,细胞在 第6 天取样时就已经出现大量死亡。因为紫杉醇的产量等于单位质量的细胞中紫杉醇的产量 与细胞量的乘积,所以高浓度的花生四烯酸并不能提高紫杉醇的产量。而0.1 mg/L的花生 四烯酸既能通过诱导作用提高紫杉醇的合成速率,又保持了一定的细胞活力,达到了紫杉醇 合成速度与细胞活力的最佳平衡,因此在第10 天时获得了最大的紫杉醇产量。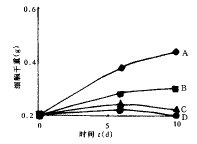
, 百拇医药
(A、B、C、D见表1)
图3 花生四烯酸诱导下细胞生长曲线
综合以上分析,适宜浓度花生四烯酸作为一种诱导子,在加入细胞培养体系10 d后,可以 提高紫杉醇的产量到对照组的4 倍。另外在花生四烯酸诱导下10-DAB,baccatin Ⅲ的含量 与紫杉醇的含量呈现出明显的正相关性。0.1 mg/L的花生四烯酸造成10-DAB,baccatin Ⅲ与紫杉醇含量的同时上升。这种正相关性包含了花生四烯酸对紫杉醇生物合成途径中酶活 力和代谢通量的信息。
3 花生四烯酸对紫杉醇合成动力学的影响
3.1 紫杉醇生物合成途径的拓扑简化:紫杉醇生物合成途径非常复杂,涉及酶、代谢产物 众多,因此必须在保持拓扑结构不变的前提下,对该途径进行简化,才能适合动力学分析的 需要。具体方法是:三尖杉磷碱(cephalomannine)的含量无论在实验组还是在对照组都非常 低,因此该支路在简化中被忽略;利用三个关键中间代谢产物:10-DAB,baccatin Ⅲ和ta xol,将紫杉醇生物合成与降解途径划分为顺序串联的四段,在每段中都用一个虚拟酶来等 效代替生物合成途径中实现相同催化功能的一系列酶,从而简化代谢途径(见图4)。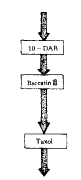
, 百拇医药
图4 紫杉醇生物合成途径简图
诱导子在紫杉醇生物合成与降解途径上的作用位点是指诱导子加入反应速度得到最大程度提 高的那步生化反应。在模型分析中诱导子的作用位点的详尽程度必然受途径拓扑简化程度的 影响,由于在本模型中紫杉醇生物合成途径被分为三段,因此利用模型确定的作用位点有三 种可能,分别在10-DAB之前、10-DAB和baccatin Ⅲ之间、和baccatin Ⅲ与taxol之间。
3.2 紫杉醇生物合成动力学分析:根据紫杉醇的生物合成途径(图4),以酶促反应动力学 中最常用的Monod方程为基础,可以得出模型中的所有方程。以rM表示物质M合成反应的反应速率,RM表示物质M合成反应的最大反应速率,KM,S表示物质M的底物饱和系数,KM,I表示物质M的产物抑制系数,D、B、T分别表示培养体系中10-DAB,baccatin Ⅲ,taxol的含量
, 百拇医药
10-DAB的生成反应速率为: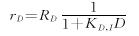
baccatin Ⅲ生成速率为: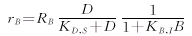
紫杉醇生成速率为: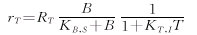
假设紫杉醇的降解产物为X,紫杉醇的降解速率为: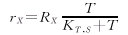
10-DAB、baccatin Ⅲ和taxol的浓度可以用下式表示: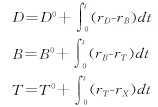
, 百拇医药
对照以上三种可能的作用位点,若花生烯酸作用在10-DAB之前,则10-DAB的合成速度比对 照组得以提高,因此其浓度就会上升;10-DAB是baccatin Ⅲ合成的底物,因此10-DAB浓 度的上升通过底物效应增加了baccatin Ⅲ合成合成速度,baccatin Ⅲ含量相应上升;同理 ,baccatin Ⅲ浓度的上升通过底物效应导致了紫杉醇含量的上升。
若花生四烯酸作用在10-DAB与baccatin Ⅲ之间,则从10-DAB到baccatin Ⅲ间的反应速度 比对照组得以提高,因此底物10-DAB浓度出现下降,产物baccatin Ⅲ浓度就会上升;bacc atin Ⅲ是紫杉醇合成的底物,因此10-DAB浓度的上升通过底物效应增加了紫杉醇 的合成速度,紫杉醇含量相应上升。
若花生四烯酸作用在baccatin Ⅲ与紫杉醇之间,则从baccatin Ⅲ与紫杉醇间的反应速度比 对照组得以提高,因此底物baccatin Ⅲ浓度出现下降,产物紫杉醇浓度就会上升;baccati n Ⅲ是10-DAB消耗反应的产物,因此baccatin Ⅲ浓度的下降必然部分消除产物抑制,10- DAB消耗反应的反应速率上升,10-DAB浓度相应下降。
, http://www.100md.com
综合以上分析,可以看出不同作用位点的诱导子在短期诱导实验中会导致的10-DAB、bacca tin Ⅲ、紫杉醇浓度的不同变化模式,如表2所示。
适宜浓度的花生四烯酸在实验中提高了紫杉醇的产量,即提高了紫杉醇合成途径的代谢通量 ,同时10-DAB,baccatin Ⅲ的浓度比对照组出现上升。对照上表,花生四烯酸 的作用位点在10-DAB,即花生四烯酸通过提高催化10-DAB合成酶的酶活力,从而提高紫杉 醇的产量。而任何假定花生四烯酸作用在10-DAB之后都会与实践中baccatin Ⅲ含量上升的 实验现象矛盾。
表2 诱导子的作用位点与其诱导下紫杉烷含量转换 模式间的关系 模型参数
紫杉烷含量转移模式1
紫杉烷含量转移模式2
紫杉烷含量转移模式3
, http://www.100md.com
RD
↑
RB
↑
RT
↑
D
↑
↓
↓
B
↑
↑
, 百拇医药
↑
T
↑
↑
↑
途径代谢通量
↑
↑
↑
诱导子作用位点
10-DAB之前
10-DAB与baccatin Ⅲ之间
baccatin Ⅲ与 taxol之间
, http://www.100md.com
4 结论
花生四烯酸的加入可以提高红豆杉培养体系中紫杉醇生物合成途径的代谢通量,0.1 mg/L 的花生四烯酸诱导下紫杉醇含量提高到对照组的四倍。同时10-DAB,baccatin Ⅲ的含量也 相应上升。通过动力学分析,确定花生四烯酸在紫杉醇生物合成途径上的作用位点在10-DA B之前。
如果在细胞培养的对数期后期加入三种作用位点不同的诱导子,分别提高紫杉醇合成途径上 三个阶段的反应速度,从而解除紫杉醇合成途径的多重限速步骤,提高紫杉醇合成代谢途径 的代谢通量,结合释放与反应分离偶合技术,就可以大幅度提高紫杉醇产量。
教育部“跨世纪优秀人才培养计划”基金和天津市科委项目(96 3107211)资助
参 考 文 献
1,Choi H K, et al. WO 96/3410
, 百拇医药
2,Ciddi V, et al. Biotechnology Letters,1995,17(12):134 3
3,Fett-Neto G, et al. Biotechnology and Bioengineering ,1994,44:205
4,Hirasuna J, et al. Plant Cell Tissue and Organ Cultur e,1996,44:95
5,元英进,等.中国稀土学报,1998,16:56
6,Moon W J, et al. Biotechnology Techniques,1998,12(1): 79
7,Choi D, et al. Proc Natl Acad Sci USA,1994,91:2329
8,Mirjalili N, et al. Biotechnol Prog,1996,12:110
9,Ketchum R E B, et al. Biotechnology and Bioengineerin g,1999,62(1):97
(1999-09-08收稿), 百拇医药
单位:天津大学生物化学工程系 300072
关键词:紫杉醇;花生四烯酸;作用位点;植物细胞培养
中草药000610摘 要 利用短期诱导实验,分析了花生四烯酸对红豆杉细胞培养中紫 杉烷合成的影响。在适宜浓度的花生四烯酸诱导下,紫杉醇(taxol)的产量提高了近3 倍, 同时10-去乙酰基巴卡亭Ⅲ(10-DAB)与巴卡亭Ⅲ(baccatinⅢ)相应上升。通过对紫杉醇合 成 代谢途径的等拓扑结构简化与动力学分析,获得了诱导子加入后可能的3 种中间代谢产物浓 度转移模式。结合花生四烯酸短期诱导实验结果,提出了花生四烯酸的加入提高了10-DAB 合成通量的观点,诱导子作用位点的确定为多诱导子配伍方案奠定了基础。
Studies on the Acting Point of Arachidonic Acid in Taxol Bios ynthetic Pathway
, 百拇医药
Miao Zhiqi, Wei Zuojun and Yuan Yingjin
(Department of Biochemical Engineering, Tianjin University Tianjin 300072)
Abstract The influence of arachidonic acid on the production of taxanes in the process of plant cell culture was studied by short term elicit ation experiments. Experiments showed that arachidonic acid at a concentration o f 0.1 mg/L can improve the production of taxol nearly three-fold. It was disc o vered that the concentration of 10-deacetyl baccatin Ⅲ (10-DAB Ⅲ) and baccat in Ⅲ were also increased while taxol concentration increases under arachidonic acid elicitation. By dynamic kinetic analysis on the simplified taxol biosynthe ti c pathway, the mode of taxoid concentration transformation may proceed in three different ways. On the basis of experimental results of arachidonic acid elicit ation, it could be postulated that at certain concentration of arachidonic acid the reaction rate for the production of 10-DAB Ⅲ could be increased. To define s u ch a point precisely may provide a basis to achieve a synergistic action of mult iple-elicitors.
, 百拇医药
Key words taxol arachidonic acid the acting point of enzyme plant cell culture
脂肪酸,特别是多羟基不饱和脂肪酸,被认为可以激活防御诱导和防御相关基因,是植物 病 理反应和信号传导系统的一组重要物质。抗癌药物紫杉醇是红豆杉属植物在病理条件下合成 的一种二萜类物质,可以杀伤寄生真菌,抵御真菌入侵,属于植物病理反应产物,文献报道 经过诱导[1~9]的红豆杉细胞中紫杉醇含量出现上升。
本文尝试将一种重要的脂肪酸--花生四烯酸应用于南方红豆杉细胞培养体系,研究花生四 烯酸的加入与紫杉烷产量间的对应关系,寻找最优的花生四烯酸诱导浓度,并结合紫杉醇生 物合成途径的研究成果,利用动力学定性分析,在酶水平以及次生代谢水平上,研究花生四 烯酸加入后紫杉醇合成途径中酶活力与代谢通量改变,确定花生四烯酸在紫杉醇生物合成途 径上的作用位点与配伍特性,为实现多种诱导子协同配伍方案奠定基础。
, 百拇医药
1 材料与方法
1.1 细胞株系:实验中所采用的细胞为南方红豆杉细胞的一个变种YH。
1.2 培养基:培养基采用含蔗糖20 g/L的B5培养基。培养基pH值在灭菌前调整到5.8。
1.3 诱导子实验设计:采用250 mL的锥形瓶摇床培养,转速定为100 r/min。每瓶盛40 mL 实验用培养基,接入3 g(以湿重计)混合均匀的种子细胞。为保证实验结果的有效性,每个 实验都采用3 个平行组, 培养第6,10 天后分别取样,检测细胞的生长量与紫杉烷含量。实验用培养基为含不同浓度 花生四烯酸的B5培养基,其中花生四烯酸浓度如表1所示。
1.4 细胞干湿重测量:培养物在3 000 r/min离心 30 min,收集细胞,测量湿重。将细胞 在60 ℃下烘干至恒重,测量细胞干重。
, 百拇医药
表1 花生四烯酸短期诱导实验设计 实验编号
花生四烯酸浓度mg/L
A
0
B
0.1
C
1
D
10
1.5 紫杉烷的提取与测量方法:按文献[6]方法,结果如下。
2 结果分析
, 百拇医药
图1,2分别是第6,10天时紫杉醇合成途径中关键性中间代谢产物的浓度,其中实验编号对 应花生四烯酸浓度如表1所示。

1-taxl 2-baccatin Ⅲ
3-10-DAB 4-cephalomannine
图1 不同浓度花生四烯酸诱导下第6 天
后紫杉烷含量的变化

(1~4同图1)
图2 不同浓度花生四烯酸诱导下第10 天
, 百拇医药
后紫杉烷含量的变化
从图1可以看出加入花生四烯酸6 d后,紫杉醇的含量与花生四烯酸的加入浓度呈现为一 条饱和曲线。当花生四烯酸加入浓度小于0.1 mg/L时,紫杉醇的含量随花生四烯酸的增加 而增加;当花生四烯酸浓度大于等于0.1 mg/L时,紫杉醇的含量保持恒定,与花生四烯酸 的浓度无关。同时10-DAB和baccatin Ⅲ的含量出现上升。
从图2可以看出花生四烯酸加入第10 天后,其对紫杉醇含量的影响体现得更明显。当花生烯 酸浓度小于0.1 mg/L时,紫杉烷的含量随花生四烯酸的增加而增加;当花生四烯酸浓度等 于0.1 mg/L时,紫杉醇的含量最高,比对照组高出近3 倍;当花生四烯酸的浓度大于0.1 mg/L,随着花生四烯酸浓度的提高,紫杉醇含量出现下降。
对照细胞的生长曲线(图3),可以看出1和10 mg/L的花生四烯酸明显抑制细胞生长,细胞在 第6 天取样时就已经出现大量死亡。因为紫杉醇的产量等于单位质量的细胞中紫杉醇的产量 与细胞量的乘积,所以高浓度的花生四烯酸并不能提高紫杉醇的产量。而0.1 mg/L的花生 四烯酸既能通过诱导作用提高紫杉醇的合成速率,又保持了一定的细胞活力,达到了紫杉醇 合成速度与细胞活力的最佳平衡,因此在第10 天时获得了最大的紫杉醇产量。

, 百拇医药
(A、B、C、D见表1)
图3 花生四烯酸诱导下细胞生长曲线
综合以上分析,适宜浓度花生四烯酸作为一种诱导子,在加入细胞培养体系10 d后,可以 提高紫杉醇的产量到对照组的4 倍。另外在花生四烯酸诱导下10-DAB,baccatin Ⅲ的含量 与紫杉醇的含量呈现出明显的正相关性。0.1 mg/L的花生四烯酸造成10-DAB,baccatin Ⅲ与紫杉醇含量的同时上升。这种正相关性包含了花生四烯酸对紫杉醇生物合成途径中酶活 力和代谢通量的信息。
3 花生四烯酸对紫杉醇合成动力学的影响
3.1 紫杉醇生物合成途径的拓扑简化:紫杉醇生物合成途径非常复杂,涉及酶、代谢产物 众多,因此必须在保持拓扑结构不变的前提下,对该途径进行简化,才能适合动力学分析的 需要。具体方法是:三尖杉磷碱(cephalomannine)的含量无论在实验组还是在对照组都非常 低,因此该支路在简化中被忽略;利用三个关键中间代谢产物:10-DAB,baccatin Ⅲ和ta xol,将紫杉醇生物合成与降解途径划分为顺序串联的四段,在每段中都用一个虚拟酶来等 效代替生物合成途径中实现相同催化功能的一系列酶,从而简化代谢途径(见图4)。

, 百拇医药
图4 紫杉醇生物合成途径简图
诱导子在紫杉醇生物合成与降解途径上的作用位点是指诱导子加入反应速度得到最大程度提 高的那步生化反应。在模型分析中诱导子的作用位点的详尽程度必然受途径拓扑简化程度的 影响,由于在本模型中紫杉醇生物合成途径被分为三段,因此利用模型确定的作用位点有三 种可能,分别在10-DAB之前、10-DAB和baccatin Ⅲ之间、和baccatin Ⅲ与taxol之间。
3.2 紫杉醇生物合成动力学分析:根据紫杉醇的生物合成途径(图4),以酶促反应动力学 中最常用的Monod方程为基础,可以得出模型中的所有方程。以rM表示物质M合成反应的反应速率,RM表示物质M合成反应的最大反应速率,KM,S表示物质M的底物饱和系数,KM,I表示物质M的产物抑制系数,D、B、T分别表示培养体系中10-DAB,baccatin Ⅲ,taxol的含量
, 百拇医药
10-DAB的生成反应速率为:
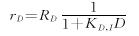
baccatin Ⅲ生成速率为:
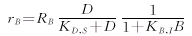
紫杉醇生成速率为:
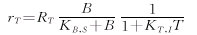
假设紫杉醇的降解产物为X,紫杉醇的降解速率为:
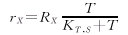
10-DAB、baccatin Ⅲ和taxol的浓度可以用下式表示:
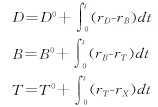
, 百拇医药
对照以上三种可能的作用位点,若花生烯酸作用在10-DAB之前,则10-DAB的合成速度比对 照组得以提高,因此其浓度就会上升;10-DAB是baccatin Ⅲ合成的底物,因此10-DAB浓 度的上升通过底物效应增加了baccatin Ⅲ合成合成速度,baccatin Ⅲ含量相应上升;同理 ,baccatin Ⅲ浓度的上升通过底物效应导致了紫杉醇含量的上升。
若花生四烯酸作用在10-DAB与baccatin Ⅲ之间,则从10-DAB到baccatin Ⅲ间的反应速度 比对照组得以提高,因此底物10-DAB浓度出现下降,产物baccatin Ⅲ浓度就会上升;bacc atin Ⅲ是紫杉醇合成的底物,因此10-DAB浓度的上升通过底物效应增加了紫杉醇 的合成速度,紫杉醇含量相应上升。
若花生四烯酸作用在baccatin Ⅲ与紫杉醇之间,则从baccatin Ⅲ与紫杉醇间的反应速度比 对照组得以提高,因此底物baccatin Ⅲ浓度出现下降,产物紫杉醇浓度就会上升;baccati n Ⅲ是10-DAB消耗反应的产物,因此baccatin Ⅲ浓度的下降必然部分消除产物抑制,10- DAB消耗反应的反应速率上升,10-DAB浓度相应下降。
, http://www.100md.com
综合以上分析,可以看出不同作用位点的诱导子在短期诱导实验中会导致的10-DAB、bacca tin Ⅲ、紫杉醇浓度的不同变化模式,如表2所示。
适宜浓度的花生四烯酸在实验中提高了紫杉醇的产量,即提高了紫杉醇合成途径的代谢通量 ,同时10-DAB,baccatin Ⅲ的浓度比对照组出现上升。对照上表,花生四烯酸 的作用位点在10-DAB,即花生四烯酸通过提高催化10-DAB合成酶的酶活力,从而提高紫杉 醇的产量。而任何假定花生四烯酸作用在10-DAB之后都会与实践中baccatin Ⅲ含量上升的 实验现象矛盾。
表2 诱导子的作用位点与其诱导下紫杉烷含量转换 模式间的关系 模型参数
紫杉烷含量转移模式1
紫杉烷含量转移模式2
紫杉烷含量转移模式3
, http://www.100md.com
RD
↑
RB
↑
RT
↑
D
↑
↓
↓
B
↑
↑
, 百拇医药
↑
T
↑
↑
↑
途径代谢通量
↑
↑
↑
诱导子作用位点
10-DAB之前
10-DAB与baccatin Ⅲ之间
baccatin Ⅲ与 taxol之间
, http://www.100md.com
4 结论
花生四烯酸的加入可以提高红豆杉培养体系中紫杉醇生物合成途径的代谢通量,0.1 mg/L 的花生四烯酸诱导下紫杉醇含量提高到对照组的四倍。同时10-DAB,baccatin Ⅲ的含量也 相应上升。通过动力学分析,确定花生四烯酸在紫杉醇生物合成途径上的作用位点在10-DA B之前。
如果在细胞培养的对数期后期加入三种作用位点不同的诱导子,分别提高紫杉醇合成途径上 三个阶段的反应速度,从而解除紫杉醇合成途径的多重限速步骤,提高紫杉醇合成代谢途径 的代谢通量,结合释放与反应分离偶合技术,就可以大幅度提高紫杉醇产量。
教育部“跨世纪优秀人才培养计划”基金和天津市科委项目(96 3107211)资助
参 考 文 献
1,Choi H K, et al. WO 96/3410
, 百拇医药
2,Ciddi V, et al. Biotechnology Letters,1995,17(12):134 3
3,Fett-Neto G, et al. Biotechnology and Bioengineering ,1994,44:205
4,Hirasuna J, et al. Plant Cell Tissue and Organ Cultur e,1996,44:95
5,元英进,等.中国稀土学报,1998,16:56
6,Moon W J, et al. Biotechnology Techniques,1998,12(1): 79
7,Choi D, et al. Proc Natl Acad Sci USA,1994,91:2329
8,Mirjalili N, et al. Biotechnol Prog,1996,12:110
9,Ketchum R E B, et al. Biotechnology and Bioengineerin g,1999,62(1):97
(1999-09-08收稿), 百拇医药