caspase3在细胞因子调节急性白血病细胞凋亡中的变化
作者:樊娟 徐功立 徐健 王春霞 马兰英
单位:樊娟 徐功立 徐健 马兰英(250021 济南,山东省立医院血液科);王春霞(山东省立医院中心实验室)
关键词:粒细胞集落刺激因子;粒-巨噬细胞集落刺激因子;细胞凋亡;caspase;3
中华血液学杂志000607 【摘要】 目的 研究caspase 3在粒细胞集落刺激因子(G-CSF)和粒-巨噬细胞集落刺激因子(GM-CSF)调节白血病细胞系NB4细胞凋亡过程中的变化及其意义。方法 利用细胞形态学、流式细胞仪分析及DNA片段化比率测定,检测G-CSF及GM-CSF对NB4细胞凋亡的影响,应用荧光分光光度法检测caspase3活性变化,并利用AC-DEVD-CHO进行caspase 3 抑制试验。结果 G-CSF能诱导NB4细胞凋亡,而GM-CSF则无此作用;G-CSF诱导的细胞凋亡过程中caspase 3活性明显升高,而AC-DEVD-CHO能有效地阻断G-CSF诱导的细胞凋亡。结论 G-CSF及GM-CSF对NB4细胞的凋亡有着不同的调节作用,G-CSF通过激活caspase 3而诱导白血病细胞的凋亡,caspase 3在细胞凋亡中起重要作用。
, 百拇医药
caspase 3 in the cytokines induced acute leukemia cell apoptosis
FAN Juan, XU Gongli, XU Jian, et al.
(Department of Hematology, Shandong Provincial Hospital, Jinan 250021, China)
【Abstract】 Objective To explore the variation and significance of caspase 3 activity in the process of G-CSF and GM-CSF regulated NB4 cell apoptosis. Methods Cell morphology, flow cytometry and DNA fragmentation assay were used to demonstrate the apoptosis induced by G-CSF and GM-CSF. caspase 3 activity was detected by spectrofluorometry,and its inhibition test by AC-DEVD-CHO. Results G-CSF could induce NB4 cell apoptosis,while GM-CSF could not. caspase 3 activity was significantly higher in the apoptotic cells than in control cells. The G-CSF induced NB4 cell apoptosis was efficiently inhibited by AC-DEVD-CHO. Conclusions G-CSF and GM-CSF exert different effects on the apoptosis of leukemic cells. G-CSF induced apoptosis of leukemic cells through activation of caspase 3.
, 百拇医药
【Key words】 Apoptosis; G-CSF; GM-CSF; Caspase 3
caspase 3(Cysteinyl aspartic acid-protease-3)是人类白细胞介素1β 转化酶(interleukin 1 β converting enzyme,ICE)家族的重要成员之一,因编码相对分子质量为32×103的半胱氨酸蛋白酶也称为CPP32。研究发现caspase 3是细胞凋亡过程中的重要激酶,我们观察了粒细胞集落刺激因子(G-CSF)和粒-巨噬细胞集落刺激因子(GM-CSF)对NB4细胞凋亡的影响,及在此过程中caspase 3活性的变化,以探讨细胞因子调控凋亡的作用机制。
材料和方法
1 试剂 重组人(rh)G-CSF及rhGM-CSF由日本麒麟公司惠赠,用PBS(pH 7.4)将rhG-CSF配制成100ng/ml ,rhGM-CSF配制成100,500,1000ng/ml,4℃保存。caspase 3活性检测所用试剂盒及caspase 3阻断剂AC-DEVD-CHO均购自PharMingen公司。
, 百拇医药
2 细胞株及细胞培养 NB4细胞由上海第二医科大学附属瑞金医院上海血液学研究所惠赠,在含体积分数为10%的小牛血清、青霉素(100U/ml)、链霉素(100μg/ml)及L-谷氨酰胺(200μg/ml)的RPMI 1640培养液中常规培养。细胞的起始浓度为2×105/ml,将细胞分为对照组、rhG-CSF组(rhG-CSF终浓度为10ng/ml)、rhGM-CSF1组(终浓度为10ng/ml)、rhGM-CSF2组(终浓度为50ng/ml)、rhGM-CSF3组(终浓度为100ng/ml);对照组以等量RPMI 1640培养液替代,培养1,2,3,4,5d收集细胞。
3 细胞凋亡的检测 用以下三种方法 ① 细胞形态学:细胞用PBS洗涤2次,滴片后自然干燥,Wright-Giemsa染色后,光镜下观察细胞形态的变化。②流式细胞仪分析:收集2 ×106细胞,体积分数为70%的乙醇4℃固定24h,PBS洗涤2次,与含0.01g/ml RNA酶的Tris-HCl缓冲液(pH 7.4)孵育30min,1mg/ml 碘化丙锭进行DNA染色,用流式细胞仪进行细胞周期分析,计算凋亡细胞的百分率。③DNA片段化比率测定:参照文献[1]方法,收集1×106细胞,PBS洗涤2次,沉淀加入400μl低渗细胞裂解液,室温作用30min,分离上清液和沉淀,断裂的DNA溶于上清液中,完整的基因组DNA则存于沉淀中。上清液加250g/L三氯乙酸(TCA)400μl;沉淀加125g/L TCA 800μl,4℃过夜,离心后,沉淀加50g/L TCA 80μl,置90℃热处理30min。加入20μl高氯酸和新配制的二苯胺反应液250μl;50℃孵育2h,取250μl加至96孔酶标板,用酶标仪(Wescan MK2)测定波长为570nm处吸光度(A)值,计算DNA片段化比率: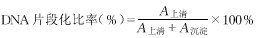
, 百拇医药
4 caspase 3活性测定
4.1 caspase 3活性测定方法:在不同时间点收集6×105细胞,PBS洗涤2次,加入细胞裂解液0.5ml,充分振荡后,室温作用30min,15000×g离心15min;取上清液100μl,转入另一EP管中,加Hepes缓冲液1ml,再加入AC-DEVD-AMC 10μg(1μg/μl),37℃水浴1h后上机测定激发波长为380nm、发散波长为460nm处的荧光强度。
4.2 caspase 3测定阻断试验:细胞加细胞裂解液、离心后的上清液,另取100μl转入EP管中,先加入AC-DEVD-CHO 10μl(1μg/μl),室温作用30min后,再加入AC-DEVD-AMC 10μl,37℃水浴1h后测定其荧光强度。同一份标本比较其加与不加caspase 3阻断剂的荧光强度,以判断结果的特异性。
4.3 caspase 3抑制试验:NB4细胞调整为2×105/ml,先加入AC-DEVD-CHO(40μg/ml),在37℃、体积分数为5%的CO2孵箱中孵育2h后,加入rhG-CSF(终浓度为10ng/ml),再孵育72,96h后,收集细胞用流式细胞术检测细胞凋亡率及caspase 3活性。测定结果与未加阻断剂的相应的试验进行比较。
, 百拇医药
5 统计学方法 采用t检验及χ2检验。
结果
1 rhG-CSF及rhGM-CSF对NB4细胞凋亡的影响 rhG-CSF作用NB4细胞2d后,细胞形态学上出现染色质浓缩、核固缩、核碎裂及凋亡小体的形成;随着时间的延长,凋亡细胞数量逐渐增多。流式细胞仪DNA直方图上呈现特征性的亚二倍体峰,凋亡细胞百分率在0,1,2,3,4,5d分别为0.95%,1.06%,2.38%,9.18%,13.17%,11.16%(图1)。DNA片段化百分率测定结果见表1。不同浓度的rhGM-CSF(10~100ng/ml)与NB4细胞共同孵育相同时间后,形态学上未出现细胞凋亡的征象,流式细胞仪测定未出现亚二倍体峰,凋亡细胞百分率在0及4d分别为1.53%及2.01%(rhGM-CSF 10ng/ml)、1.05%及1.64%(rhGM-CSF 50ng/ml)、0.94%及1.86%(rhGM-CSF 100ng/ml)。DNA片段化百分率测定结果如表1所示,与对照组比较差异无显著性(P>0.05)。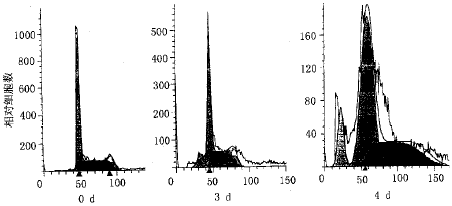
, 百拇医药
图1 流式细胞仪测得不同时间G-CSF诱导的NB4细胞的凋亡
表1 DNA片段化比率测定结果 组别
DNA片段化比率(%)
1d
]2d
3d
4d
5d
对照组
11.8±4.3
13.5±3.6
15.6±3.0
, 百拇医药
15.4±4.3
14.8±4.5
GM-CSF组
13.2±3.4
24.5±4.5*
32.1±4.8*
41.6±6.3*
38.5±9.6*
GM-CSF1组
10.7±2.4
10.9±3.2
, http://www.100md.com
12.6±5.3
15.7±3.7
15.4±4.1
GM-CSF2组
12.6±3.3
12.8±3.9
16.3±4.4
16.1±3.2
15. 7±5.6
GM-CSF3组
11.2±3.5
10.7±2.9
, 百拇医药
17.1±3.8
14.6±4.2
13.8±4.5
注:*与对照组比较,P<0.012 caspase 3活性在NB4细胞凋亡中的变化 caspase 3活性阻断试验:选择3份标本,未加阻断剂时caspase 3 活性(荧光强度)分别为0.341,0.862,2.032,加入AC-DEVD-CHO后作用30min,其caspase 3活性测定结果分别为0.230,0.303,0.267,显示阻断剂能有效地抑制测定物的活性,该项检测具有较高的特异性。
rhG-CSF及rhGM-CSF作用NB4细胞后,caspase 3活性变化见图2。rhG-CSF作用NB4细胞后,该酶活性逐渐升高,与NB4对照组相比,差异有显著性(P<0.001);而不同浓度的rhGM-CSF作用同样时间后,caspase 3 活性水平与对照组比较,差异无显著性(P>0.05)。
, 百拇医药
图2 caspase 3活性测定结果
3 caspase 3抑制试验结果 加入AC-DEVD-CHO后,流式细胞仪测定结果显示NB4细胞的凋亡率在3,4d分别为1.81%,2.18%,较未加AC-DEVD-CHO组明显下降(P<0.01);caspase 3活性测定结果显示caspase 3活性明显受抑(P<0.01,见表2)。
表2 caspase 3活性抑制试验结果 组别
caspase 3活性(荧光强度)
3d
4d
AC-DEVD-CHO(-)
0.946
, 百拇医药
0.232*
AC-DEVD-CHO(+)
1.862
0.301*
注: *与AC-DEVD-CHO(-)比较,P<0.01讨论
G-CSF及GM-CSF在体内外能有效地促进粒细胞的增殖,并增强粒细胞的功能,但对白血病细胞的作用目前尚有争议。已有报道临床应用rhG-CSF可使部分急性髓系白血病(AML)患者自发缓解。Muroi等[2]总结了6例AML患者应用rhG-CSF 3~4周后获完全缓解;Takahashi等[3]也有类似的报道。体外实验发现G-CSF能诱导小鼠髓系白血病细胞发生凋亡[4],但未见有GM-CSF诱导白血病细胞凋亡的报道。本研究结果显示,rhG-CSF与急性早幼粒细胞白血病细胞系NB4细胞孵育一定时间后,细胞形态学、流式细胞仪分析及DNA片段化测定结果表明,G-CSF有诱导NB4细胞凋亡的作用;而GM-CSF作用同样时间后,各项检测指标均无变化,说明GM-CSF对NB4细胞的凋亡无影响。
, 百拇医药
caspase(Cysteinyl aspartate-apecific proteinase)是指具有ICE/ced-3结构特征,并在细胞凋亡中起作用的一组同源性蛋白,迄今发现至少14个成员(caspase 1~14)。caspase 3(CPP32)是目前发现的caspase成员中与ced-3同源性最高者,是凋亡过程中激活的关键激酶,也是凋亡的主要效应因子[5]。激活的caspase 3作用于底物PARP,使之发生水解,其水解产物促进细胞骨架降解和DNA片段化[6]。我们利用荧光分光光度法测定细胞因子诱导的NB4细胞凋亡过程中caspase3的变化,发现G-CSF诱导细胞发生凋亡时,其活性明显升高,而GM-CSF不能诱导细胞发生凋亡,则caspase 3活性无变化,表明caspase 3在这一凋亡过程中被激活。caspase 3抑制试验显示加入caspase 3 特异性抑制剂后,G-CSF诱导细胞凋亡的作用消失,进一步表明在细胞因子调控NB4细胞凋亡过程中caspase 3起关键作用,caspase 3的激活为细胞因子诱导细胞凋亡所必需。
, 百拇医药
本研究结果表明,G-CSF可通过激活caspase 3诱导NB4细胞发生凋亡,提示caspase 3在细胞因子调控白血病细胞凋亡过程中起重要作用。凋亡过程中细胞因子与caspase 3间的信息传递途径尚待进一步研究。
参考文献
1,Gisslinger H, Kurzrock R, Wetzler M, et al. Apoptosis in chronic myelogenous leukemia: studies of stage-specific differences. Leuk Lymphoma,1997,25:121-133.
2,Muroi K, Hatake K, Yoshida M, et al. Remission induction in acute myeloid leukemia by granulocyte colony-stimulating factor: differentiation or apoptosis Leukemia Lymphoma, 1996,20:355-356.
, http://www.100md.com
3,Takahashi M, Kioke T, Aizawa Y, et al. Complete remission in three patients with acute myeloblastic leukemia by administration of G-CSF without antileukemic agents. Am J Hematol, 1997,56:42-44.
4,Kohno T, Yoshida S, Bessho M. Accelerated entry into S phase associated with up-regulation of cyclin D1 as a mechanism for granulocyte colony-stimulating factor (G-CSF)-induced apoptosis of murine myeloid leukemia cells. Leuk Res,1998,22:257-263.
5,Raff M. Cell suicide for beginners. Nature,1998,396:119-122.
6,Enari M, Sakahira H, Yokoyama H, et al. A caspase-activated DNase that degrades DNA during apoptosis, and its inhibitor. Nature, 1998,391:43-50.
(收稿日期:1999-09-13), http://www.100md.com
单位:樊娟 徐功立 徐健 马兰英(250021 济南,山东省立医院血液科);王春霞(山东省立医院中心实验室)
关键词:粒细胞集落刺激因子;粒-巨噬细胞集落刺激因子;细胞凋亡;caspase;3
中华血液学杂志000607 【摘要】 目的 研究caspase 3在粒细胞集落刺激因子(G-CSF)和粒-巨噬细胞集落刺激因子(GM-CSF)调节白血病细胞系NB4细胞凋亡过程中的变化及其意义。方法 利用细胞形态学、流式细胞仪分析及DNA片段化比率测定,检测G-CSF及GM-CSF对NB4细胞凋亡的影响,应用荧光分光光度法检测caspase3活性变化,并利用AC-DEVD-CHO进行caspase 3 抑制试验。结果 G-CSF能诱导NB4细胞凋亡,而GM-CSF则无此作用;G-CSF诱导的细胞凋亡过程中caspase 3活性明显升高,而AC-DEVD-CHO能有效地阻断G-CSF诱导的细胞凋亡。结论 G-CSF及GM-CSF对NB4细胞的凋亡有着不同的调节作用,G-CSF通过激活caspase 3而诱导白血病细胞的凋亡,caspase 3在细胞凋亡中起重要作用。
, 百拇医药
caspase 3 in the cytokines induced acute leukemia cell apoptosis
FAN Juan, XU Gongli, XU Jian, et al.
(Department of Hematology, Shandong Provincial Hospital, Jinan 250021, China)
【Abstract】 Objective To explore the variation and significance of caspase 3 activity in the process of G-CSF and GM-CSF regulated NB4 cell apoptosis. Methods Cell morphology, flow cytometry and DNA fragmentation assay were used to demonstrate the apoptosis induced by G-CSF and GM-CSF. caspase 3 activity was detected by spectrofluorometry,and its inhibition test by AC-DEVD-CHO. Results G-CSF could induce NB4 cell apoptosis,while GM-CSF could not. caspase 3 activity was significantly higher in the apoptotic cells than in control cells. The G-CSF induced NB4 cell apoptosis was efficiently inhibited by AC-DEVD-CHO. Conclusions G-CSF and GM-CSF exert different effects on the apoptosis of leukemic cells. G-CSF induced apoptosis of leukemic cells through activation of caspase 3.
, 百拇医药
【Key words】 Apoptosis; G-CSF; GM-CSF; Caspase 3
caspase 3(Cysteinyl aspartic acid-protease-3)是人类白细胞介素1β 转化酶(interleukin 1 β converting enzyme,ICE)家族的重要成员之一,因编码相对分子质量为32×103的半胱氨酸蛋白酶也称为CPP32。研究发现caspase 3是细胞凋亡过程中的重要激酶,我们观察了粒细胞集落刺激因子(G-CSF)和粒-巨噬细胞集落刺激因子(GM-CSF)对NB4细胞凋亡的影响,及在此过程中caspase 3活性的变化,以探讨细胞因子调控凋亡的作用机制。
材料和方法
1 试剂 重组人(rh)G-CSF及rhGM-CSF由日本麒麟公司惠赠,用PBS(pH 7.4)将rhG-CSF配制成100ng/ml ,rhGM-CSF配制成100,500,1000ng/ml,4℃保存。caspase 3活性检测所用试剂盒及caspase 3阻断剂AC-DEVD-CHO均购自PharMingen公司。
, 百拇医药
2 细胞株及细胞培养 NB4细胞由上海第二医科大学附属瑞金医院上海血液学研究所惠赠,在含体积分数为10%的小牛血清、青霉素(100U/ml)、链霉素(100μg/ml)及L-谷氨酰胺(200μg/ml)的RPMI 1640培养液中常规培养。细胞的起始浓度为2×105/ml,将细胞分为对照组、rhG-CSF组(rhG-CSF终浓度为10ng/ml)、rhGM-CSF1组(终浓度为10ng/ml)、rhGM-CSF2组(终浓度为50ng/ml)、rhGM-CSF3组(终浓度为100ng/ml);对照组以等量RPMI 1640培养液替代,培养1,2,3,4,5d收集细胞。
3 细胞凋亡的检测 用以下三种方法 ① 细胞形态学:细胞用PBS洗涤2次,滴片后自然干燥,Wright-Giemsa染色后,光镜下观察细胞形态的变化。②流式细胞仪分析:收集2 ×106细胞,体积分数为70%的乙醇4℃固定24h,PBS洗涤2次,与含0.01g/ml RNA酶的Tris-HCl缓冲液(pH 7.4)孵育30min,1mg/ml 碘化丙锭进行DNA染色,用流式细胞仪进行细胞周期分析,计算凋亡细胞的百分率。③DNA片段化比率测定:参照文献[1]方法,收集1×106细胞,PBS洗涤2次,沉淀加入400μl低渗细胞裂解液,室温作用30min,分离上清液和沉淀,断裂的DNA溶于上清液中,完整的基因组DNA则存于沉淀中。上清液加250g/L三氯乙酸(TCA)400μl;沉淀加125g/L TCA 800μl,4℃过夜,离心后,沉淀加50g/L TCA 80μl,置90℃热处理30min。加入20μl高氯酸和新配制的二苯胺反应液250μl;50℃孵育2h,取250μl加至96孔酶标板,用酶标仪(Wescan MK2)测定波长为570nm处吸光度(A)值,计算DNA片段化比率:
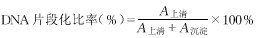
, 百拇医药
4 caspase 3活性测定
4.1 caspase 3活性测定方法:在不同时间点收集6×105细胞,PBS洗涤2次,加入细胞裂解液0.5ml,充分振荡后,室温作用30min,15000×g离心15min;取上清液100μl,转入另一EP管中,加Hepes缓冲液1ml,再加入AC-DEVD-AMC 10μg(1μg/μl),37℃水浴1h后上机测定激发波长为380nm、发散波长为460nm处的荧光强度。
4.2 caspase 3测定阻断试验:细胞加细胞裂解液、离心后的上清液,另取100μl转入EP管中,先加入AC-DEVD-CHO 10μl(1μg/μl),室温作用30min后,再加入AC-DEVD-AMC 10μl,37℃水浴1h后测定其荧光强度。同一份标本比较其加与不加caspase 3阻断剂的荧光强度,以判断结果的特异性。
4.3 caspase 3抑制试验:NB4细胞调整为2×105/ml,先加入AC-DEVD-CHO(40μg/ml),在37℃、体积分数为5%的CO2孵箱中孵育2h后,加入rhG-CSF(终浓度为10ng/ml),再孵育72,96h后,收集细胞用流式细胞术检测细胞凋亡率及caspase 3活性。测定结果与未加阻断剂的相应的试验进行比较。
, 百拇医药
5 统计学方法 采用t检验及χ2检验。
结果
1 rhG-CSF及rhGM-CSF对NB4细胞凋亡的影响 rhG-CSF作用NB4细胞2d后,细胞形态学上出现染色质浓缩、核固缩、核碎裂及凋亡小体的形成;随着时间的延长,凋亡细胞数量逐渐增多。流式细胞仪DNA直方图上呈现特征性的亚二倍体峰,凋亡细胞百分率在0,1,2,3,4,5d分别为0.95%,1.06%,2.38%,9.18%,13.17%,11.16%(图1)。DNA片段化百分率测定结果见表1。不同浓度的rhGM-CSF(10~100ng/ml)与NB4细胞共同孵育相同时间后,形态学上未出现细胞凋亡的征象,流式细胞仪测定未出现亚二倍体峰,凋亡细胞百分率在0及4d分别为1.53%及2.01%(rhGM-CSF 10ng/ml)、1.05%及1.64%(rhGM-CSF 50ng/ml)、0.94%及1.86%(rhGM-CSF 100ng/ml)。DNA片段化百分率测定结果如表1所示,与对照组比较差异无显著性(P>0.05)。

, 百拇医药
图1 流式细胞仪测得不同时间G-CSF诱导的NB4细胞的凋亡
表1 DNA片段化比率测定结果 组别
DNA片段化比率(%)
1d
]2d
3d
4d
5d
对照组
11.8±4.3
13.5±3.6
15.6±3.0
, 百拇医药
15.4±4.3
14.8±4.5
GM-CSF组
13.2±3.4
24.5±4.5*
32.1±4.8*
41.6±6.3*
38.5±9.6*
GM-CSF1组
10.7±2.4
10.9±3.2
, http://www.100md.com
12.6±5.3
15.7±3.7
15.4±4.1
GM-CSF2组
12.6±3.3
12.8±3.9
16.3±4.4
16.1±3.2
15. 7±5.6
GM-CSF3组
11.2±3.5
10.7±2.9
, 百拇医药
17.1±3.8
14.6±4.2
13.8±4.5
注:*与对照组比较,P<0.012 caspase 3活性在NB4细胞凋亡中的变化 caspase 3活性阻断试验:选择3份标本,未加阻断剂时caspase 3 活性(荧光强度)分别为0.341,0.862,2.032,加入AC-DEVD-CHO后作用30min,其caspase 3活性测定结果分别为0.230,0.303,0.267,显示阻断剂能有效地抑制测定物的活性,该项检测具有较高的特异性。
rhG-CSF及rhGM-CSF作用NB4细胞后,caspase 3活性变化见图2。rhG-CSF作用NB4细胞后,该酶活性逐渐升高,与NB4对照组相比,差异有显著性(P<0.001);而不同浓度的rhGM-CSF作用同样时间后,caspase 3 活性水平与对照组比较,差异无显著性(P>0.05)。

, 百拇医药
图2 caspase 3活性测定结果
3 caspase 3抑制试验结果 加入AC-DEVD-CHO后,流式细胞仪测定结果显示NB4细胞的凋亡率在3,4d分别为1.81%,2.18%,较未加AC-DEVD-CHO组明显下降(P<0.01);caspase 3活性测定结果显示caspase 3活性明显受抑(P<0.01,见表2)。
表2 caspase 3活性抑制试验结果 组别
caspase 3活性(荧光强度)
3d
4d
AC-DEVD-CHO(-)
0.946
, 百拇医药
0.232*
AC-DEVD-CHO(+)
1.862
0.301*
注: *与AC-DEVD-CHO(-)比较,P<0.01讨论
G-CSF及GM-CSF在体内外能有效地促进粒细胞的增殖,并增强粒细胞的功能,但对白血病细胞的作用目前尚有争议。已有报道临床应用rhG-CSF可使部分急性髓系白血病(AML)患者自发缓解。Muroi等[2]总结了6例AML患者应用rhG-CSF 3~4周后获完全缓解;Takahashi等[3]也有类似的报道。体外实验发现G-CSF能诱导小鼠髓系白血病细胞发生凋亡[4],但未见有GM-CSF诱导白血病细胞凋亡的报道。本研究结果显示,rhG-CSF与急性早幼粒细胞白血病细胞系NB4细胞孵育一定时间后,细胞形态学、流式细胞仪分析及DNA片段化测定结果表明,G-CSF有诱导NB4细胞凋亡的作用;而GM-CSF作用同样时间后,各项检测指标均无变化,说明GM-CSF对NB4细胞的凋亡无影响。
, 百拇医药
caspase(Cysteinyl aspartate-apecific proteinase)是指具有ICE/ced-3结构特征,并在细胞凋亡中起作用的一组同源性蛋白,迄今发现至少14个成员(caspase 1~14)。caspase 3(CPP32)是目前发现的caspase成员中与ced-3同源性最高者,是凋亡过程中激活的关键激酶,也是凋亡的主要效应因子[5]。激活的caspase 3作用于底物PARP,使之发生水解,其水解产物促进细胞骨架降解和DNA片段化[6]。我们利用荧光分光光度法测定细胞因子诱导的NB4细胞凋亡过程中caspase3的变化,发现G-CSF诱导细胞发生凋亡时,其活性明显升高,而GM-CSF不能诱导细胞发生凋亡,则caspase 3活性无变化,表明caspase 3在这一凋亡过程中被激活。caspase 3抑制试验显示加入caspase 3 特异性抑制剂后,G-CSF诱导细胞凋亡的作用消失,进一步表明在细胞因子调控NB4细胞凋亡过程中caspase 3起关键作用,caspase 3的激活为细胞因子诱导细胞凋亡所必需。
, 百拇医药
本研究结果表明,G-CSF可通过激活caspase 3诱导NB4细胞发生凋亡,提示caspase 3在细胞因子调控白血病细胞凋亡过程中起重要作用。凋亡过程中细胞因子与caspase 3间的信息传递途径尚待进一步研究。
参考文献
1,Gisslinger H, Kurzrock R, Wetzler M, et al. Apoptosis in chronic myelogenous leukemia: studies of stage-specific differences. Leuk Lymphoma,1997,25:121-133.
2,Muroi K, Hatake K, Yoshida M, et al. Remission induction in acute myeloid leukemia by granulocyte colony-stimulating factor: differentiation or apoptosis Leukemia Lymphoma, 1996,20:355-356.
, http://www.100md.com
3,Takahashi M, Kioke T, Aizawa Y, et al. Complete remission in three patients with acute myeloblastic leukemia by administration of G-CSF without antileukemic agents. Am J Hematol, 1997,56:42-44.
4,Kohno T, Yoshida S, Bessho M. Accelerated entry into S phase associated with up-regulation of cyclin D1 as a mechanism for granulocyte colony-stimulating factor (G-CSF)-induced apoptosis of murine myeloid leukemia cells. Leuk Res,1998,22:257-263.
5,Raff M. Cell suicide for beginners. Nature,1998,396:119-122.
6,Enari M, Sakahira H, Yokoyama H, et al. A caspase-activated DNase that degrades DNA during apoptosis, and its inhibitor. Nature, 1998,391:43-50.
(收稿日期:1999-09-13), http://www.100md.com