儿童急性白血病T细胞受体δ、γ基因重排连接区序列的动态分析
作者:卢洁 谷仁凯 雷珂 王学淳 孙立荣 庞秀英 李学荣 董增义
单位:卢洁 谷仁凯 雷珂 孙立荣 庞秀英 李学荣 董增义(266003 青岛大学医学院附属医院儿科研究所);王学淳(青岛市立医院)
关键词:白血病,急性;T细胞受体;分子克隆;序列动态分析
中华血液学杂志000606 【摘要】 目的 探讨儿童急性淋巴细胞白血病(ALL)患者在初诊、完全缓解(CR)及复发不同时期的T细胞受体(TCR)δV-D、γV-J基因重排连接区序列的差异及其意义。方法 采用T-载体分子克隆测序、限制性酶切及聚合酶链反应等技术,对34份ALL患者标本进行TCR δ、γ连接区序列动态分析。结果 34份ALL患者标本的TCRδ、γ基因重排序列在初诊、CR及复发不同转归时期显示有差异性和规律性。TCRδV-D重排序列分析显示:24份ALL患者标本中,10份初诊患者Vδ2、Dδ3序列较完整,其中7份伴有Dδ3的九碱基序列区T→C突变。11份CR期患者有明显Vδ2的3′端、Dδ3的5′端及七碱基序列重排序列缺失,Dδ3九碱基序列区T→C突变消失。初诊与CR期ALL患者Vδ2或Dδ3重排序列缺失率及Dδ3九碱基序列区T→C突变率比较,差异均有极显著性意义(精确概率计算,P=0.001, P=0.001)。3份复发患者标本均保留Dδ3的5′端重排序列完整。10份TCRγV-J序列分析结果规律性与δ相似。结论 ALL的TCRδV-D 、TCRγV-J基因重排序列的改变与ALL的发生、疗效及转归有着密切的内在联系。
, http://www.100md.com
Dynamic analysis of junctional sequences of T cell receptor(TCR) δ and γ gene rearrangement in childhood with acute lymphoblastic leukemia
LU Jie, GU Renkai, LEI Ke, et al.
(Institute of Pediatrics, Affiliated Hospital, Medical School of Qingdao University, Qingdao 266003,China)
【Abstract】 Objective To explore the junctional sequence difference of T cell receptor δ and γ gene rearrangement in childhood acute lymphoblastic leukemia (ALL) at diagnosis, complete remission (CR) and relapse. Methods By using the T-vector molecular cloning and sequencing and polymerase chain reaction, the junctional sequences of TCRδV-D and TCRγV-J were dynamically analyzed in 34 bone marrow samples of ALL. Results The junctional sequence of TCR δ、γ gene showed significant difference and regularity before and after remission and during relapsed peroids. The sequence of TCR δV-D were analyzed in 24 samples from ALL. Among them, the intact Vδ2 and 5′Dδ3 sequences were observed in 10 samples at diagnosis, of which 7 samples had T→C mutation in Dδ3 nonamer sequence. The deletions of rearranged Vδ2, 5′Dδ3 and Dδ3 haptamer sequences were found in 11 complete remission (CR) samples with ALL, but none had T→C mutation in Dδ3 nonamer sequence. The deletion rate of Vδ2 or Dδ3 sequences and the T→C mutation in Dδ3 nonamer sequence were extremely differed between samples at diagnosis and in remission (calculate exact probabilities P=0.001). The junctional rearrangement sequence of 5′D δ 3 sequences tended to remain intact in 3 relapsed samples. The findings of TCRγV-J sequences were similar to that of TCRδV-D in 10 ALL patients. Conclusion The difference of TCRδV-D and TCRγV-J junctional sequences were related to the development, therapeutic effectiveness and outcome in ALL.
, 百拇医药
【Key words】 Leukemia, acute; T cell receptor; Molecular cloning; Dynamic sequence analysis
T细胞受体(TCR)的基因重排不仅存在于急性T淋巴细胞白血病(T-ALL)中,多数B-ALL中也有此重排[1-5]。我们曾以TCRδ、γ重排为克隆特异性标志,对ALL完全缓解(CR)期患者进行微量残留病(MRD)的定量研究,发现MRD量的变化与ALL化疗的疗效、缓解及复发密切相关。关于ALL不同转归时期TCR重排序列变化的动态研究报道甚少。为探讨儿童ALL在初诊、CR及复发不同时期TCRδ、γ连接区重排序列的差异及其意义,我们对34份ALL患者骨髓标本进行了TCRδV-D和TCRγV-J重排序列动态分析。现将结果报告如下。
病例和方法
1 病例 经我院儿科诊治的ALL患者27例(34份标本),男17例,女10例,初诊年龄2~11岁,中位年龄6岁。所用34份标本为ALL患者新鲜骨髓液及保存的骨髓涂片,参考Sambrook和Fey等提供的方法[ 6,7],采用DNA提取试剂盒(Promega公司产品) 提取骨髓DNA,用紫外分光光度计测定DNA纯度及质量浓度。
, 百拇医药
2 聚合酶链反应(PCR)
2.1 寡核苷酸引物选择与合成:用于扩增ALL的TCRδ、γ基因重排的特异性寡核苷酸引物[1]由北京华美生物工程公司合成。
Vδ2:5′-TGGCCCTGGTTTCAAAGACAATTTCCA-3′;
Dδ3:5′-GAGGATATCCCAGGGAAATGGCACTT-3′;
Vγ1:5′-CTACACCAGGAGGGGAAGG-3′;
Jγ12:5′-ATTCTTCCGATACTTACCTGTGA-3′。
2.2 PCR条件:经PCR条件优化,在50μl的体系中,加入5μl的10×PCR缓冲液,dNTP 200μmol/L,患儿骨髓DNA 0.1μg,Mg2+终浓度2.5mmol/L,引物终浓度1.0μmol/L 。循环前100℃加热5min,立即将试管置于冰渣中冷却后,加入 Taq酶1.0U。循环条件:TCR δ为95℃变性45s,60℃复性45s, 72℃延伸30s, 30个循环,72℃延伸5min。TCRγ为94℃变性1min,56℃复性1min, 延伸条件及循环次数同TCRδ扩增。
, 百拇医药
2.3 PCR扩增产物经20g/L的琼脂糖凝胶(含溴化乙锭)电泳分离20min,用分子量标记物鉴定扩增产物,同时设阳性及阴性对照。用GDS-UVP8000凝胶成像仪及其分析软件进行吸光度(A)分析并摄影。
3 T-载体分子克隆及测序
3.1 PCR产物的纯化:用PCR扩增产物纯化试剂盒(Promega公司产品)及其提供的方法,对34份ALL患者标本TCR Vδ2Dδ3和TCR Vγ1-Jγ12的PCR扩增产物进行凝胶电泳分离和纯化回收。
3.2 用pGEM-T载体试剂盒(Promega公司产品)及其提供的方法将已纯化的PCR产物与T-载体连接。于转化前将连接物置12~16℃ 2h。
3.3 感受态细胞制备及转化:按常规法制备感受态细胞、转化细菌及提取重组质粒DNA[6],并加入X-gal和异丙基硫代-B-D-半乳糖苷(IPTG)进行蓝白斑菌落鉴定。
, 百拇医药
3.4 阳性克隆鉴定:①以质粒DNA为模板进行PCR扩增。②质粒的酶切鉴定:每份标本分别用限制性内切酶ScaⅠ(酶切pGEM-T 载体的1890bp位点)和Eco 52Ⅰ(酶切pGEM-T 载体的31,43,77 bp位点)酶切质粒DNA,酶切产物于7g/L琼脂糖凝胶中电泳,同时以蓝斑及分子量标记物作对照。
4 测序 由军事医学科学院及瑞士Micro-Synth JMBH 公司提供测序结果。
结果
1 形态学和免疫学分型 27例ALL患者中,L1型6例,L2型21例。19例B-ALL按Drexler等六型分类法[8]进行免疫分型: BⅠ型1例,BⅡ 型1例,BⅢ型7例,BⅣ型9例,BⅤ型1例。
2 PCR扩增结果 34份ALL患者的TCR δ、γ基因重排PCR产物呈单克隆特异性扩增,片段大小分别为250,270bp。而阴性对照者呈无条带片状或多克隆性扩增。
, 百拇医药
3 T-载体阳性克隆的鉴定
3.1 PCR扩增鉴定:以质粒DNA为模板进行PCR扩增,产物经20g/L的琼脂糖凝胶(含溴化乙锭)电泳分离20min,以分子量标记物鉴定产物, 34份标本电泳结果均显示单克隆特异性扩增。
3.2 质粒的酶切鉴定:分别用限制性内切酶ScaⅠ、Eco52Ⅰ酶切质粒DNA,酶切产物于7g/L琼脂糖凝胶中电泳,与蓝斑(载体质粒DNA约3000bp)及分子量标记作比较。酶切鉴定结果表明:PCR产物与T-载体的连接是成功的(图1,2)。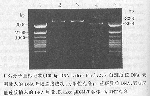
图1 用ScaⅠ内切酶酶切pEGM-T载体重组质粒DNA
(1890bp位点)的电泳结果
4 TCRδV-D 、TCRγV-J连接区重排序列动态分析 34份ALL 患者标本的PCR产物T-载体克隆测序结果显示:pGEM-T 载体60~61bp均有特异性重排片段插入,表明T-载体克隆成功及ALL患儿高度的基因重排频率(达100%)和恶性细胞克隆同源性,印证了PCR方法的特异性。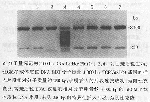
, 百拇医药
图2 用Eco52Ⅰ内切酶酶切pEGM-T载体重组质粒DNA
(31,43,77bp位点)的电泳结果
4.1 动态分析24份ALL初诊、CR及复发患者标本的TCRδV-D重排序列,发现呈一定规律性改变: ① 初诊组10份患者标本的Dδ3重排序列均较完整,其中7份伴Dδ3九碱基序列区T→C突变;Vδ2重排序列7份完整,3份有Vδ2的3′末端序列部分缺失;Dδ2序列部分缺失7份,完全缺失3份;均有Dδ1序列完全缺失。该组Dδ3重排序列完整率达100%;Vδ2序列缺失率为30%;Dδ3九碱基序列区T→C突变率为70%。② 11份CR期标本中8份有Dδ3的5′端序列缺失,3份保留Dδ3的5′端重排序列,伴Dδ3七碱基序列区部分序列缺失或碱基插入,11份标本Dδ3九碱基序列区T→C突变均消失;有3份标本Dδ2序列趋于完整,8份存在部分缺失;均有Dδ1序列完全缺失。CR期患者的Vδ2和Dδ3序列缺失率为100%,Dδ3九碱基序列区均无T→C突变。初诊与CR期ALL患者Vδ2或Dδ3序列缺失率及Dδ3七碱基序列区T→C突变率比较,差异均有极显著性意义(精确概率计算,P值均=0.001)。③ 3份复发ALL患者标本中,有2份标本Dδ3重排序列保持完整,1份保留Dδ3的5′端重排序列,伴Dδ3七碱基序列区22个碱基缺失,3份均无Dδ3九碱基序列区T→C突变;2份标本Vδ2序列保持完整,1份有部分缺失;Dδ1、Dδ2序列均完全缺失。
, 百拇医药
4.2 典型病例: 连续追踪检测同一病例的初诊、CR及复发时TCRδV-D基因重排序列。结果显示:初诊时存在Dδ3重排序列,伴Dδ3九碱基序列区T→C突变,Vδ2的3′末端有部分缺失,Dδ1、Dδ2序列完全缺失。CR时与初诊不同,有明显的Vδ2的3′端、Dδ3的5′端及七碱基序列区重排序列缺失,伴Dδ3九碱基序列区T→C突变消失, Dδ2序列部分缺失,Dδ1序列仍完全缺失。复发时产生再重排,显示Vδ2及Dδ3的5′端序列完整(与初诊时相似),伴有Dδ3七碱基序列区重排序列22个碱基缺失和Dδ3九碱基序列区T→C突变消失(与CR时相似);Dδ1、Dδ2序列仍完全缺失,复发时重排类型介于初诊与CR之间。该患者于复发后不久死亡。
4.3 TCRγV-J连接区序列动态分析:10例ALL患儿CR前后连接区序列亦有规律性改变:初发3份患者标本均有完整的Jγ重排序列,Vγ序列完整2份, 1份有Vγ3′末端6个碱基缺失。2份复发和5份CR期标本均有Jγ的5′末端序列缺失,2份有Vγ的3′末端序列缺失。10例N区序列变化复杂。
, http://www.100md.com
讨论
TCR基因由4个亚单位组成:TCRα、TCRβ、TCRδ、TCRγ。每个亚单位由非编码序列分隔形成不连续的序列片段,包括V、D、J、C 4个重排区,其中D区只存在于β、δ链,形成V-D-J连接,而γ链形成V-J连接。由于不同的细胞克隆形成的基因重排序列不同,正常的或反应增生性淋巴细胞的基因重排为多克隆性的,而ALL细胞的基因重排是以单克隆(少数为寡克隆性)形式存在[9],TCRδ和γ的重排序列片段构成与TCRα、β比较相对简单,这些正是我们及其他研究者用此作为细胞克隆特异性标志进行ALL细胞检测及序列分析的原因。
为探讨ALL初诊、CR及复发不同时期TCR基因重排序列的变化及其意义,我们动态分析了34份儿童ALL患者标本,结果显示:① ALL患者初发组与CR组的TCRVδ2或Dδ3重排序列缺失率与Dδ3九碱基序列区T→C突变率比较,差异有极显著性意义。认为Dδ3的5′端基因重排序列的完整,可能是ALL恶性细胞克隆的特征。② CR期Dδ3的5′端与七碱基序列区重排序列的明显缺失,对判断ALL的疗效可能有重要意义。③复发患者均有完整的Dδ3的5′端重排序列,提示恶性细胞克隆的特征再现。另外本研究CR组中有3份标本仍保留Dδ3的5′端重排序列,伴Dδ3中间序列部分碱基缺失或插入,随访发现其中1例曾多次复发,提示CR者若仍完整保留Dδ3的5′端重排序列,将有复发的可能性,预后较差。
, 百拇医药
在ALL病程中细胞克隆特征可发生变化,新的基因重排完成或部分不同于初始阶段或新旧克隆并存,即克隆演化。有文献报道[10]:寡克隆和克隆演化为白血病克隆继发重排出现在疾病的两个不同阶段,初诊时为寡克隆者,病程中易发生克隆演化。TCRδ基因的演化往往表现为重排缺失。我们对同一患者的初诊、CR及复发时TCRδ重排进行连续追踪观察,发现初诊时Vδ2、Dδ3重排序列完整,而CR时有明显Dδ3的5′端及七碱基序列区重排序列缺失,这种克隆演化可能是ALL治疗后产生与基因损伤修复有关的分子生物学现象;追踪观察该患者复发时重排序列变化,发现Dδ3的5′端重排序列完整再现,但仍保留CR时Dδ3七碱基重排序列缺失,重排类型介于初诊与CR之间。提示复发产生的克隆演化和白血病细胞过度生长可能与耐药克隆形成有关。由于研究水平的不同,克隆演化发生率不尽一致。有报道,经PCR扩增约85.2%儿童B-ALL患者TCRVδ2Dδ3基因重排可有亚克隆演化[11]。因我们连续追踪的病例数较少,对ALL的克隆演化,需进一步积累资料深入研究。
, 百拇医药
10例ALL患儿缓解前后TCRγV-J连接区序列亦有差异和规律性,其N区序列变化复杂。有文献报道,TCRγN区序列克隆特异性探针可用于微量残留病(MRD)的监测[5]。
上述研究表明:ALL患者TCRδ、γ连接区重排序列的差异与ALL发生、发展及转归有着密切的内在联系。分析ALL的基因重排序列变化,对从分子水平上揭示其病因及发病机制有重要理论意义。TCRDδ3的5′端重排序列保持完整,可能为ALL恶性细胞克隆的特征。该序列的动态分析及其寡核苷酸特异性探针杂交技术,对ALL的基因诊断、MRD的监测、判断克隆演化及预后等可能有重要价值。
基金项目:山东省自然科学基金资助项目(Y97C17053);山东省“九五”医药科技攻关资助项目(鲁卫科教字[1997]第九号)
参考文献
1,Cave H, Guidal C, Rohrlich P, et al. Prospective monitoring and quantitation of residual blasts in childhood acute lymphoblastic leukemia by polymerase chain reaction study of δ and γ T-cell receptor genes. Blood, 1994, 83:1892-1902.
, http://www.100md.com
2,刘乐宇,孙金英,殷慧君. 急性淋巴细胞白血病化疗缓解后TCRγ基因检测的意义. 中华血液学杂志,1998,19:353-356.
3,卢洁,谷仁凯,佟琳如,等. 儿童急性淋巴细胞白血病微量残留病细胞的DNA定量研究. 中华儿科杂志,1999,37:356-358.
4,Shouhei Y, Thomas E, Hanaen H, et al. T-cell receptor δ gene recombination in common acute lymphoblastic leukemia:preferential usage of Vδ2 and requent involvement of the Jα cluster. Blood, 1991,77:141-148.
5,Dong S,Huang W,Tong J,et al. V-J junctional sequences of T cell receptor γ gene in acute lymphocytic leukemia. 中国科学B辑, 1995 ,38:202-210.
, http://www.100md.com
6,Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. 2 nd. New York: Cold Spring Harbor Laboratory Press,1989.463-468.
7,Fey MF, Pilkingtin SP, Summers C, et al. Moleculor diagnosis of haematological disorders using DNA from stored bone marrow slides. Br J Haematol,1987,67: 489-491.
8,Drexler HG, Gignac SM, Minowada J. Routine immunophenotyping of acute leukemia. Blut,1988,57:327-339.
, 百拇医药
9,林万明,主编.PCR技术操作和应用指南.北京:人民军医出版社,1995.417-425.
10,朱平,主编.现代血液肿瘤诊断治疗学. 北京:北京医科大学、中国协和医科大学联合出版社,1999.37-42.
11,Steenbergen EJ,Verhagen OJ, van Leeuwen EF, et al.Frequent ongoing T-cell receptor rearrangement in childhood B-precursor acute lymphoblastic leukemia: implications for mionitoring minimal residual disease.Blood ,1995,86:692-702.
(收稿日期:1999-09-15), 百拇医药
单位:卢洁 谷仁凯 雷珂 孙立荣 庞秀英 李学荣 董增义(266003 青岛大学医学院附属医院儿科研究所);王学淳(青岛市立医院)
关键词:白血病,急性;T细胞受体;分子克隆;序列动态分析
中华血液学杂志000606 【摘要】 目的 探讨儿童急性淋巴细胞白血病(ALL)患者在初诊、完全缓解(CR)及复发不同时期的T细胞受体(TCR)δV-D、γV-J基因重排连接区序列的差异及其意义。方法 采用T-载体分子克隆测序、限制性酶切及聚合酶链反应等技术,对34份ALL患者标本进行TCR δ、γ连接区序列动态分析。结果 34份ALL患者标本的TCRδ、γ基因重排序列在初诊、CR及复发不同转归时期显示有差异性和规律性。TCRδV-D重排序列分析显示:24份ALL患者标本中,10份初诊患者Vδ2、Dδ3序列较完整,其中7份伴有Dδ3的九碱基序列区T→C突变。11份CR期患者有明显Vδ2的3′端、Dδ3的5′端及七碱基序列重排序列缺失,Dδ3九碱基序列区T→C突变消失。初诊与CR期ALL患者Vδ2或Dδ3重排序列缺失率及Dδ3九碱基序列区T→C突变率比较,差异均有极显著性意义(精确概率计算,P=0.001, P=0.001)。3份复发患者标本均保留Dδ3的5′端重排序列完整。10份TCRγV-J序列分析结果规律性与δ相似。结论 ALL的TCRδV-D 、TCRγV-J基因重排序列的改变与ALL的发生、疗效及转归有着密切的内在联系。
, http://www.100md.com
Dynamic analysis of junctional sequences of T cell receptor(TCR) δ and γ gene rearrangement in childhood with acute lymphoblastic leukemia
LU Jie, GU Renkai, LEI Ke, et al.
(Institute of Pediatrics, Affiliated Hospital, Medical School of Qingdao University, Qingdao 266003,China)
【Abstract】 Objective To explore the junctional sequence difference of T cell receptor δ and γ gene rearrangement in childhood acute lymphoblastic leukemia (ALL) at diagnosis, complete remission (CR) and relapse. Methods By using the T-vector molecular cloning and sequencing and polymerase chain reaction, the junctional sequences of TCRδV-D and TCRγV-J were dynamically analyzed in 34 bone marrow samples of ALL. Results The junctional sequence of TCR δ、γ gene showed significant difference and regularity before and after remission and during relapsed peroids. The sequence of TCR δV-D were analyzed in 24 samples from ALL. Among them, the intact Vδ2 and 5′Dδ3 sequences were observed in 10 samples at diagnosis, of which 7 samples had T→C mutation in Dδ3 nonamer sequence. The deletions of rearranged Vδ2, 5′Dδ3 and Dδ3 haptamer sequences were found in 11 complete remission (CR) samples with ALL, but none had T→C mutation in Dδ3 nonamer sequence. The deletion rate of Vδ2 or Dδ3 sequences and the T→C mutation in Dδ3 nonamer sequence were extremely differed between samples at diagnosis and in remission (calculate exact probabilities P=0.001). The junctional rearrangement sequence of 5′D δ 3 sequences tended to remain intact in 3 relapsed samples. The findings of TCRγV-J sequences were similar to that of TCRδV-D in 10 ALL patients. Conclusion The difference of TCRδV-D and TCRγV-J junctional sequences were related to the development, therapeutic effectiveness and outcome in ALL.
, 百拇医药
【Key words】 Leukemia, acute; T cell receptor; Molecular cloning; Dynamic sequence analysis
T细胞受体(TCR)的基因重排不仅存在于急性T淋巴细胞白血病(T-ALL)中,多数B-ALL中也有此重排[1-5]。我们曾以TCRδ、γ重排为克隆特异性标志,对ALL完全缓解(CR)期患者进行微量残留病(MRD)的定量研究,发现MRD量的变化与ALL化疗的疗效、缓解及复发密切相关。关于ALL不同转归时期TCR重排序列变化的动态研究报道甚少。为探讨儿童ALL在初诊、CR及复发不同时期TCRδ、γ连接区重排序列的差异及其意义,我们对34份ALL患者骨髓标本进行了TCRδV-D和TCRγV-J重排序列动态分析。现将结果报告如下。
病例和方法
1 病例 经我院儿科诊治的ALL患者27例(34份标本),男17例,女10例,初诊年龄2~11岁,中位年龄6岁。所用34份标本为ALL患者新鲜骨髓液及保存的骨髓涂片,参考Sambrook和Fey等提供的方法[ 6,7],采用DNA提取试剂盒(Promega公司产品) 提取骨髓DNA,用紫外分光光度计测定DNA纯度及质量浓度。
, 百拇医药
2 聚合酶链反应(PCR)
2.1 寡核苷酸引物选择与合成:用于扩增ALL的TCRδ、γ基因重排的特异性寡核苷酸引物[1]由北京华美生物工程公司合成。
Vδ2:5′-TGGCCCTGGTTTCAAAGACAATTTCCA-3′;
Dδ3:5′-GAGGATATCCCAGGGAAATGGCACTT-3′;
Vγ1:5′-CTACACCAGGAGGGGAAGG-3′;
Jγ12:5′-ATTCTTCCGATACTTACCTGTGA-3′。
2.2 PCR条件:经PCR条件优化,在50μl的体系中,加入5μl的10×PCR缓冲液,dNTP 200μmol/L,患儿骨髓DNA 0.1μg,Mg2+终浓度2.5mmol/L,引物终浓度1.0μmol/L 。循环前100℃加热5min,立即将试管置于冰渣中冷却后,加入 Taq酶1.0U。循环条件:TCR δ为95℃变性45s,60℃复性45s, 72℃延伸30s, 30个循环,72℃延伸5min。TCRγ为94℃变性1min,56℃复性1min, 延伸条件及循环次数同TCRδ扩增。
, 百拇医药
2.3 PCR扩增产物经20g/L的琼脂糖凝胶(含溴化乙锭)电泳分离20min,用分子量标记物鉴定扩增产物,同时设阳性及阴性对照。用GDS-UVP8000凝胶成像仪及其分析软件进行吸光度(A)分析并摄影。
3 T-载体分子克隆及测序
3.1 PCR产物的纯化:用PCR扩增产物纯化试剂盒(Promega公司产品)及其提供的方法,对34份ALL患者标本TCR Vδ2Dδ3和TCR Vγ1-Jγ12的PCR扩增产物进行凝胶电泳分离和纯化回收。
3.2 用pGEM-T载体试剂盒(Promega公司产品)及其提供的方法将已纯化的PCR产物与T-载体连接。于转化前将连接物置12~16℃ 2h。
3.3 感受态细胞制备及转化:按常规法制备感受态细胞、转化细菌及提取重组质粒DNA[6],并加入X-gal和异丙基硫代-B-D-半乳糖苷(IPTG)进行蓝白斑菌落鉴定。
, 百拇医药
3.4 阳性克隆鉴定:①以质粒DNA为模板进行PCR扩增。②质粒的酶切鉴定:每份标本分别用限制性内切酶ScaⅠ(酶切pGEM-T 载体的1890bp位点)和Eco 52Ⅰ(酶切pGEM-T 载体的31,43,77 bp位点)酶切质粒DNA,酶切产物于7g/L琼脂糖凝胶中电泳,同时以蓝斑及分子量标记物作对照。
4 测序 由军事医学科学院及瑞士Micro-Synth JMBH 公司提供测序结果。
结果
1 形态学和免疫学分型 27例ALL患者中,L1型6例,L2型21例。19例B-ALL按Drexler等六型分类法[8]进行免疫分型: BⅠ型1例,BⅡ 型1例,BⅢ型7例,BⅣ型9例,BⅤ型1例。
2 PCR扩增结果 34份ALL患者的TCR δ、γ基因重排PCR产物呈单克隆特异性扩增,片段大小分别为250,270bp。而阴性对照者呈无条带片状或多克隆性扩增。
, 百拇医药
3 T-载体阳性克隆的鉴定
3.1 PCR扩增鉴定:以质粒DNA为模板进行PCR扩增,产物经20g/L的琼脂糖凝胶(含溴化乙锭)电泳分离20min,以分子量标记物鉴定产物, 34份标本电泳结果均显示单克隆特异性扩增。
3.2 质粒的酶切鉴定:分别用限制性内切酶ScaⅠ、Eco52Ⅰ酶切质粒DNA,酶切产物于7g/L琼脂糖凝胶中电泳,与蓝斑(载体质粒DNA约3000bp)及分子量标记作比较。酶切鉴定结果表明:PCR产物与T-载体的连接是成功的(图1,2)。

图1 用ScaⅠ内切酶酶切pEGM-T载体重组质粒DNA
(1890bp位点)的电泳结果
4 TCRδV-D 、TCRγV-J连接区重排序列动态分析 34份ALL 患者标本的PCR产物T-载体克隆测序结果显示:pGEM-T 载体60~61bp均有特异性重排片段插入,表明T-载体克隆成功及ALL患儿高度的基因重排频率(达100%)和恶性细胞克隆同源性,印证了PCR方法的特异性。

, 百拇医药
图2 用Eco52Ⅰ内切酶酶切pEGM-T载体重组质粒DNA
(31,43,77bp位点)的电泳结果
4.1 动态分析24份ALL初诊、CR及复发患者标本的TCRδV-D重排序列,发现呈一定规律性改变: ① 初诊组10份患者标本的Dδ3重排序列均较完整,其中7份伴Dδ3九碱基序列区T→C突变;Vδ2重排序列7份完整,3份有Vδ2的3′末端序列部分缺失;Dδ2序列部分缺失7份,完全缺失3份;均有Dδ1序列完全缺失。该组Dδ3重排序列完整率达100%;Vδ2序列缺失率为30%;Dδ3九碱基序列区T→C突变率为70%。② 11份CR期标本中8份有Dδ3的5′端序列缺失,3份保留Dδ3的5′端重排序列,伴Dδ3七碱基序列区部分序列缺失或碱基插入,11份标本Dδ3九碱基序列区T→C突变均消失;有3份标本Dδ2序列趋于完整,8份存在部分缺失;均有Dδ1序列完全缺失。CR期患者的Vδ2和Dδ3序列缺失率为100%,Dδ3九碱基序列区均无T→C突变。初诊与CR期ALL患者Vδ2或Dδ3序列缺失率及Dδ3七碱基序列区T→C突变率比较,差异均有极显著性意义(精确概率计算,P值均=0.001)。③ 3份复发ALL患者标本中,有2份标本Dδ3重排序列保持完整,1份保留Dδ3的5′端重排序列,伴Dδ3七碱基序列区22个碱基缺失,3份均无Dδ3九碱基序列区T→C突变;2份标本Vδ2序列保持完整,1份有部分缺失;Dδ1、Dδ2序列均完全缺失。
, 百拇医药
4.2 典型病例: 连续追踪检测同一病例的初诊、CR及复发时TCRδV-D基因重排序列。结果显示:初诊时存在Dδ3重排序列,伴Dδ3九碱基序列区T→C突变,Vδ2的3′末端有部分缺失,Dδ1、Dδ2序列完全缺失。CR时与初诊不同,有明显的Vδ2的3′端、Dδ3的5′端及七碱基序列区重排序列缺失,伴Dδ3九碱基序列区T→C突变消失, Dδ2序列部分缺失,Dδ1序列仍完全缺失。复发时产生再重排,显示Vδ2及Dδ3的5′端序列完整(与初诊时相似),伴有Dδ3七碱基序列区重排序列22个碱基缺失和Dδ3九碱基序列区T→C突变消失(与CR时相似);Dδ1、Dδ2序列仍完全缺失,复发时重排类型介于初诊与CR之间。该患者于复发后不久死亡。
4.3 TCRγV-J连接区序列动态分析:10例ALL患儿CR前后连接区序列亦有规律性改变:初发3份患者标本均有完整的Jγ重排序列,Vγ序列完整2份, 1份有Vγ3′末端6个碱基缺失。2份复发和5份CR期标本均有Jγ的5′末端序列缺失,2份有Vγ的3′末端序列缺失。10例N区序列变化复杂。
, http://www.100md.com
讨论
TCR基因由4个亚单位组成:TCRα、TCRβ、TCRδ、TCRγ。每个亚单位由非编码序列分隔形成不连续的序列片段,包括V、D、J、C 4个重排区,其中D区只存在于β、δ链,形成V-D-J连接,而γ链形成V-J连接。由于不同的细胞克隆形成的基因重排序列不同,正常的或反应增生性淋巴细胞的基因重排为多克隆性的,而ALL细胞的基因重排是以单克隆(少数为寡克隆性)形式存在[9],TCRδ和γ的重排序列片段构成与TCRα、β比较相对简单,这些正是我们及其他研究者用此作为细胞克隆特异性标志进行ALL细胞检测及序列分析的原因。
为探讨ALL初诊、CR及复发不同时期TCR基因重排序列的变化及其意义,我们动态分析了34份儿童ALL患者标本,结果显示:① ALL患者初发组与CR组的TCRVδ2或Dδ3重排序列缺失率与Dδ3九碱基序列区T→C突变率比较,差异有极显著性意义。认为Dδ3的5′端基因重排序列的完整,可能是ALL恶性细胞克隆的特征。② CR期Dδ3的5′端与七碱基序列区重排序列的明显缺失,对判断ALL的疗效可能有重要意义。③复发患者均有完整的Dδ3的5′端重排序列,提示恶性细胞克隆的特征再现。另外本研究CR组中有3份标本仍保留Dδ3的5′端重排序列,伴Dδ3中间序列部分碱基缺失或插入,随访发现其中1例曾多次复发,提示CR者若仍完整保留Dδ3的5′端重排序列,将有复发的可能性,预后较差。
, 百拇医药
在ALL病程中细胞克隆特征可发生变化,新的基因重排完成或部分不同于初始阶段或新旧克隆并存,即克隆演化。有文献报道[10]:寡克隆和克隆演化为白血病克隆继发重排出现在疾病的两个不同阶段,初诊时为寡克隆者,病程中易发生克隆演化。TCRδ基因的演化往往表现为重排缺失。我们对同一患者的初诊、CR及复发时TCRδ重排进行连续追踪观察,发现初诊时Vδ2、Dδ3重排序列完整,而CR时有明显Dδ3的5′端及七碱基序列区重排序列缺失,这种克隆演化可能是ALL治疗后产生与基因损伤修复有关的分子生物学现象;追踪观察该患者复发时重排序列变化,发现Dδ3的5′端重排序列完整再现,但仍保留CR时Dδ3七碱基重排序列缺失,重排类型介于初诊与CR之间。提示复发产生的克隆演化和白血病细胞过度生长可能与耐药克隆形成有关。由于研究水平的不同,克隆演化发生率不尽一致。有报道,经PCR扩增约85.2%儿童B-ALL患者TCRVδ2Dδ3基因重排可有亚克隆演化[11]。因我们连续追踪的病例数较少,对ALL的克隆演化,需进一步积累资料深入研究。
, 百拇医药
10例ALL患儿缓解前后TCRγV-J连接区序列亦有差异和规律性,其N区序列变化复杂。有文献报道,TCRγN区序列克隆特异性探针可用于微量残留病(MRD)的监测[5]。
上述研究表明:ALL患者TCRδ、γ连接区重排序列的差异与ALL发生、发展及转归有着密切的内在联系。分析ALL的基因重排序列变化,对从分子水平上揭示其病因及发病机制有重要理论意义。TCRDδ3的5′端重排序列保持完整,可能为ALL恶性细胞克隆的特征。该序列的动态分析及其寡核苷酸特异性探针杂交技术,对ALL的基因诊断、MRD的监测、判断克隆演化及预后等可能有重要价值。
基金项目:山东省自然科学基金资助项目(Y97C17053);山东省“九五”医药科技攻关资助项目(鲁卫科教字[1997]第九号)
参考文献
1,Cave H, Guidal C, Rohrlich P, et al. Prospective monitoring and quantitation of residual blasts in childhood acute lymphoblastic leukemia by polymerase chain reaction study of δ and γ T-cell receptor genes. Blood, 1994, 83:1892-1902.
, http://www.100md.com
2,刘乐宇,孙金英,殷慧君. 急性淋巴细胞白血病化疗缓解后TCRγ基因检测的意义. 中华血液学杂志,1998,19:353-356.
3,卢洁,谷仁凯,佟琳如,等. 儿童急性淋巴细胞白血病微量残留病细胞的DNA定量研究. 中华儿科杂志,1999,37:356-358.
4,Shouhei Y, Thomas E, Hanaen H, et al. T-cell receptor δ gene recombination in common acute lymphoblastic leukemia:preferential usage of Vδ2 and requent involvement of the Jα cluster. Blood, 1991,77:141-148.
5,Dong S,Huang W,Tong J,et al. V-J junctional sequences of T cell receptor γ gene in acute lymphocytic leukemia. 中国科学B辑, 1995 ,38:202-210.
, http://www.100md.com
6,Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. 2 nd. New York: Cold Spring Harbor Laboratory Press,1989.463-468.
7,Fey MF, Pilkingtin SP, Summers C, et al. Moleculor diagnosis of haematological disorders using DNA from stored bone marrow slides. Br J Haematol,1987,67: 489-491.
8,Drexler HG, Gignac SM, Minowada J. Routine immunophenotyping of acute leukemia. Blut,1988,57:327-339.
, 百拇医药
9,林万明,主编.PCR技术操作和应用指南.北京:人民军医出版社,1995.417-425.
10,朱平,主编.现代血液肿瘤诊断治疗学. 北京:北京医科大学、中国协和医科大学联合出版社,1999.37-42.
11,Steenbergen EJ,Verhagen OJ, van Leeuwen EF, et al.Frequent ongoing T-cell receptor rearrangement in childhood B-precursor acute lymphoblastic leukemia: implications for mionitoring minimal residual disease.Blood ,1995,86:692-702.
(收稿日期:1999-09-15), 百拇医药