红细胞生成素受体介导的白血病细胞系增殖信号传导的研究
作者:樊华 杉田完尔 翟明 中泽真平
单位:樊华(110001 沈阳,中国医科大学第一临床学院血液科);翟明(110001 沈阳,中国医科大学第一临床学院血液科);杉田完尔(日本山梨医科大学小儿科);中泽真平(日本山梨医科大学小儿科)
关键词:细胞系;受体,红细胞生成素;信号传递;酪氨酸磷酸化
中华血液学杂志000604 【摘要】 目的 检测白血病细胞系红细胞生成素受体(EpoR)的表达并阐明EpoR介导的白血病细胞系KOCL-33增殖信号传导途径。方法 用生物素酰基化Epo及流式细胞仪检测白血病细胞系EpoR的表达;3H-TdR掺入法检测各细胞系对Epo刺激的增殖反应;免疫沉淀法和Western印迹法检测KOCL-33细胞中几种信号传导蛋白的酪氨酸磷酸化。结果 ①除T淋巴细胞系外,其余细胞系EpoR表达均为阳性,阳性率为18%~99%,均值52%。不同类型的细胞系EpoR阳性率的差异没有统计学意义。②9株细胞中7株细胞因受刺激而显著地增殖,P值<0.05。EpoR阳性率与增殖反应不相一致。③Epo可引起KOCL-33细胞的增殖,刺激后1min, EpoR形成同源二聚体、出现酪氨酸磷酸化,JAK2酪氨酸磷酸化;5min时STAT5被酪氨酸磷酸化。结论 ①白血病细胞系可有EpoR的表达;②Epo可引起部分白血病细胞系的增殖;③在EpoR 介导的KOCL-33细胞增殖信号的传导中,EpoR形成同源二聚体、出现酪氨酸磷酸化,JAK2、STAT5参与了增殖信号的传导。
, http://www.100md.com
Proliferative signal transmission mediated by EpoR in leukemic cell lines
FAN Hua,Sukida Kanji,ZHAI Ming,et al.
(Department of Hematology,The First Clinical College, China Medical University, Shenyang 110001,China)
【Abstract】 Objective To investigate the expression of erythropoietin receptor (EpoR) in leukemic cell lines and to clearify the mechanism of proliferative signal transmission in the leukemic cell line KOCL-33 mediated by EpoR. Methods Biotinylated Epo and flow cytometry were used for EpoR expression,3H-TdR incorporation for cell proliferation, immunoprecipitation and Western blot analysis for the tyrosine phosphorylation of signal transmission proteins. Results ①All the cell lines tested expressed EpoR except for T-lymphoid cell lines. The positivity rates ranged from 18% to 99% with an average of 52%, and was no difference among T, B and non-lymphoid cells. ②The cell proliferation was significantly enhanced in response to Epo in 7 of 9 cell lines tested. The stimulating effects of Epo did not correlate with the densities of EpoR expressed on the cells. ③The proliferation of KOCL-33 cells was significantly enhanced in response to Epo. Dimerization and tyrosine phosphorylation of EpoR and tyrosine phosphorylation of JAK2 occurred in 1min and tyrosine phosphorylation of STAT5 in 5 minutes after Epo stimulation. Conclusion ①There was EpoR expression in leukemic cell lines. ②The cell proliferation could be stimulated by Epo in some leukemic cell lines. The stimulating effect of Epo did not correlate with the densities of EpoR expressed on the cells.③Dimerization and tyosine phosphorylation of EpoR occurred,and JAK2, STAT5 involved in the proliferative signal transmission in KOCL-33 cells mediated by EpoR.
, http://www.100md.com
【Key words】 Cell line; Receptor, erythropoietin(EpoR); Proliferative signal transduction; Tyrosine phosphorylation
红细胞生成素(Epo)与幼红细胞表面Epo受体(EpoR)结合后,EpoR形成二聚体,再通过JAK/STAT[1,2]和Ras/MAP激酶[3]等信号传导途径调节红系的增殖和分化。EpoR不仅存在于幼红细胞,在其它细胞中也发现了EpoR。这就提示Epo的作用不仅仅限于红系。因此,我们检测了来源于白血病的细胞系,明确了一些细胞系表达EpoR,且对Epo 刺激有显著扩增反应。进而选择对Epo 刺激有显著增殖反应的细胞系KOCL-33进行了有关信号传导蛋白的酪氨酸磷酸化的检测,探讨Epo/EpoR在KOCL-33中的增殖信号传递途径。
材料和方法
, http://www.100md.com
1 白血病细胞系 T淋巴细胞系:KOPT-5、KOPT-K1; B淋巴细胞系:KOPN-30bi、KOPN-55bi、KOPN-57bi、KOPN-1、KOCL-33、KOCL-69、KOPN-34、KOPN-35、KOPN-56、KOPN-60、KOPN-62、KOPN-70、KOPN-87;非淋巴细胞系:KOPM-28、U937、HL-60、K562,共19株。除U937、HL-60、K562细胞系外,其余均为山梨医科大学小儿科用小儿急性白血病来源细胞建立的。其中KOCL-33是从小儿急性B淋巴细胞白血病细胞建立的细胞系,核型为t(11;19)。
2 主要试剂 抗EpoR(Anti-EpoR)、STAT5(Anti-STAT5)为相对分子质量55×103,92×103 的抗体(TL产品)。抗Ptyr(Anti-Ptyr)抗体为UBI公司产品。抗JAK2(Anti-JAK2)为相对分子质量130×103的抗体(UBI公司产品)。
, http://www.100md.com
3 荧光染色法 按照文献[4]方法制备生物素酰基化Epo,将其与细胞共孵育,再加PE-Avidin。用流式细胞仪检测EpoR的阳性率。不加生物素酰基化Epo作为阴性对照。阳性细胞比<10%判为阴性。并且,对KOCL-33细胞用不同浓度未生物素酰基化Epo对生物素酰基化Epo进行竞争抑制试验。
4 3H-TdR掺入法 选择9株细胞接种到96孔培养板的微孔池中。对照组只加含体积分数为10%胎牛血清(FCS)的RPMI 1640培养液。实验组分别加Epo 2.5,5.0,10.0U/ml,培养72h。用液体闪烁计数仪计数放射性核素每分钟闪烁计数(CPM)值,测定3H-TdR掺入量。
5 Western印迹法 KOCL-33细胞用D-MEM/F12洗3次, 再将其悬浮于D-MEM/F12中,放入CO2孵箱中, 使细胞饥饿2h。再取出分装于6支试管中,每支试管中细胞数为2×106,于37℃水浴槽中,对照不加Epo,另5管加Epo 5U,分别1,5,15,30,60min时中止反应。然后裂解细胞,提取蛋白质,进行SDS-聚丙烯酰胺凝胶电泳(PAGE)及转移电泳。再分别用一、二抗标记。用增强的化学发光法(ECL)显像于X线胶片上。
, 百拇医药
6 免疫沉淀法(immunoprecipitation,IP) 于裂解的细胞上清液中,按需要分别加入抗信号传导蛋白的抗体。4℃轻摇动过夜。然后加蛋白A琼脂糖珠匀浆40μl,于4℃轻摇动过夜。其余同Western印迹法。按需要更换一抗。
7 抗体的去除和再标记 将已标记一、二抗的硝酸纤维素膜上的抗体去除,再重新标记相应的抗体。硝酸纤维素膜放入55℃的抗体去除液中,振荡30min,取出膜。余同Western印迹法,按需要更换一抗。
8 统计学分析 T淋巴细胞系、B淋巴细胞系、非淋巴细胞系之间EpoR阳性率的差异用成组秩和检验法作分析。样本3H-TdR掺入量的差异用配对t检验。
结 果
1 白血病细胞系EpoR的阳性率 除KOPT5、KOPT-K1外,其余细胞系均为阳性,EpoR阳性率为18%~99%(均值52%)。B淋巴细胞系为18%~99%(均值69%);非淋巴细胞系为53%~96%(均值71%)。三系间的EpoR阳性率差异没有统计学意义。KOCL-33 EpoR的阳性率为82%;随着未生物素酰基化Epo浓度的增加KOCL-33的EpoR表达减少,当Epo为2U时,EpoR阳性率为89%,Epo增至80U时,EpoR阳性率降低到8%。其中生物素酰基化Epo为2U。
, http://www.100md.com
2 Epo刺激的增殖反应 9株细胞中7株细胞显著地因被刺激而增殖(P<0.05)。KOCL-33、KOPN-60、K562细胞的刺激指数(SI)>1.5(表1)。Epo 5U/ml时KOCL-33刺激反应最大,3H-TdR最大掺入量与对照组相比差异有显著意义,P值为0.0044(见表2)。
表1 白血病细胞系EpoR的表达和对Epo刺激的增殖反应 细胞系
EpoR阳性率
(%)
对照组3H-TdR
掺入量(CPM)
最大3H-TdR
掺入量(CPM)
, http://www.100md.com
Epo最佳浓度
(U/ml)
P值
KOPT-5
5
80449±4356
80528±901
10.0
0.0635
KOPN-57bi
66
39111±919
, 百拇医药 53317±440
5.0
0.0004
KOCL-33
82
52873±4338
85306±1957
5.0
0.0044
KOPN-34
99
16575±399
, 百拇医药 18502±256
10.0
0.0018
KOPN-35
20
35551±2877
48105±1399
5.0
0.0200
KOPN-60
74
41258±1862
, 百拇医药 62250±301
5.0
0.0034
KOPN-62
99
12099±342
12512±505
10.0
0.4440
KOPM-28
75
7357±312
8686±106
, http://www.100md.com
10.0
0.0259
K562
61
104973±7901
259813±6032
2.5
0.0002
注:表中数值为3个孔的均值±标准差表2 不同浓度Epo 刺激72h KOCL-33细胞3H-TdR
掺入量(CMP) Epo浓度(U/ml)
样本数
, http://www.100md.com
3 H-TdR掺入量
P值
0
3
52873±4338
2.5
3
57426±4556
0.1617
5.0
3
85306±1957
, 百拇医药
0.0044
10.0
3
79191±979
0.0106
注:*与Epo浓度为0组比较的P值
3 Western印迹结果 一抗为抗PTyr。图1可见在相对分子质量(46~210)×103间出现若干蛋白带。Epo刺激后1min出现酪氨酸磷酸化或酪氨酸磷酸化增强。
1:对照;2~6:5U/ml Epo刺激0,1,5,15,30,60min
, 百拇医药
图1 Western印迹法检测Epo刺激不同时间KOCL-33
中蛋白质酪氨酸磷酸化水平的变化
4 免疫沉淀法鉴定蛋白性质 ①用抗PTyr免疫沉淀后,再行Western印迹,一抗为抗EpoR。图2可见Epo刺激后1min,于相对分子质量110×103处见一明显的蛋白带发生酪氨酸磷酸化,5min脱磷酸。②用抗JAK2进行免疫沉淀后,再行Western印迹,一抗为抗PTyr抗体。从图3a中可见在相对分子质量为(111~210)×103的蛋白带,于1min出现酪氨酸磷酸化,60min仍未完全脱磷酸;将图3a膜除掉抗体后用抗JAK2重新标记,结果证实该蛋白是相对分子质量130×103的JAK2(图3b)。③用抗PTyr免疫沉淀后,再行Western印迹,一抗为抗STAT5。从图4可见相对分子质量为92×103的蛋白带(STAT5)于5min出现酪氨酸磷酸化,15min脱磷酸。
, http://www.100md.com
讨 论
EpoR是细胞因子受体超家族的一员,由507个氨基酸组成。包括细胞外部分、跨膜区域、胞浆部分。胞浆部分缺少酪氨酸激酶的特征排列顺序,所以不具有酪氨酸激酶活性。EpoR是否也存在于非红系中大量的研究表明,在血管内皮细胞[5]、神经细胞[6]、B淋巴细胞[7]有EpoR的表达。我们检测了白血病细胞系EpoR的表达,结果于所检测的全部B淋巴细胞白血病细胞系和非淋巴细胞白血病细胞系中均发现了EpoR的表达。为了排除非特异荧光所致假阳性的可能,我们对KOCL-33又进行了非生物素酰基化Epo的竞争抑制试验。结果可见生物素和非生物素酰基化Epo二者间存在着竞争抑制作用,可以排除非特异荧光所致的假阳性。
1:对照;2~6:Epo刺激1,5,15,30,60min
, 百拇医药
图2 免疫沉淀后Western印迹法检测Epo刺激不同时间
KOCL-33中EpoR的酪氨酸磷酸化水平的变化
1:对照;2~6:Epo刺激1,5,15,30,60min
图3 免疫沉淀后Western印迹法检测Epo刺激不同时间
KOCL-33中JAK2的酪氨酸磷酸化水平的变化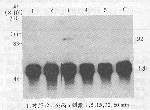
1:对照;2~6:Epo刺激1,5,15,30,60min
图4 免疫沉淀后Western印迹法检测Epo刺激不同时间
, 百拇医药
KOCL-33中STAT5的酪氨酸磷酸化水平的变化
为了阐明EpoR的作用,我们检测了Epo对白血病细胞系的刺激作用。结果表明,部分白血病细胞系能被Epo刺激而增殖。这提示白血病细胞系表达的是功能性的EpoR。有趣的是白血病细胞系EpoR阳性率并不与Epo刺激的增殖反应相一致。从表1中可见KOPN-62不为Epo所刺激,但却高水平地表达EpoR。而KOPN-35可因Epo刺激而显著地增殖,但只是低水平地表达EpoR。这提示细胞对Epo的敏感性是依赖于能将信号从EpoR传导到细胞核的细胞内传导系统的存在与否,而不单纯依赖于细胞表面EpoR的数目,并且Neumann等[8]报道了红细胞表面EpoR至多为每个细胞1000个,大部分存在于细胞内,因而不能仅凭细胞表面EpoR阳性率来推断增殖反应的强弱。
关于Epo是如何通过EpoR调节红系的增殖,1990年Yoshimura等[9]的研究结果证实,当Epo与EpoR结合时,受体形成同源二聚体,再通过JAK/STAT途径调节红系的增殖和分化。
, 百拇医药
在红系及依赖Epo增殖的细胞系中,JAK2/STAT5途径发挥着主要作用。我们选择了对Epo刺激有显著扩增反应的细胞系KOCL-33进行了Epo刺激前后EpoR 、JAK2、STAT5的酪氨酸磷酸化的检测。图2可见KOCL-33在Epo刺激后1min,于相对分子质量110×103处有一明显的蛋白带发生酪氨酸磷酸化,鉴于EpoR可以互相聚合,而凝胶加样缓冲液短时间煮沸的处理有时并不能使聚合体解聚,并且我们所用抗EpoR抗体的相对分子质量为55×103,推测此蛋白带可能为EpoR的同源二聚体。
本实验也证实了Epo刺激1min时JAK2的酪氨酸磷酸化和5min时STAT5的酪氨酸磷酸化。这说明与EpoR形成二聚体、酪氨酸磷酸化的同时出现了JAK2的酪氨酸磷酸化增强,其后STAT5被磷酸化,这提示有增殖信号的传导,表明了白血病细胞系增殖信号传导过程中JAK/STAT途径的参与。
总之,我们的实验提示,Epo/EpoR除了特异地作用于红系外,对非红系的白血病细胞系也具有刺激其增殖的作用。
, http://www.100md.com
参考文献
1,Sawyer ST, Kalyani P. Association of JAK2 and STAT5 with erythropoietin receptors. J Biol Chem, 1996, 271:3243-3248.
2,Oda A, Sawada K, Druker BJ, et al. Erythropoietin induces tyrosine phosphorylation of JAK2, STAT5A, and STAT5B in primary cultured human erythroid precursors. Blood, 1998, 92: 443-451.
3,Miura Y, Miura O, Ihle JN, et al. Activation of the Mitogen activated protein kinase pathway by the erythropoietin receptor. J Biol Chem, 1994, 269:29962-29969.
, http://www.100md.com
4,Shimoda K, Okamura S, Harada N, et al. Granulocyte colony stimulating factor receptors on human acute leukemia: biphenotypic leukemic cells prossess granulocyte colony stimulating factor receptors. Cancer Res, 1992, 52:3052-3055.
5,Anagnostou A, Lee ES, Kessimian N, et al. Erythropoietin has a mitogenic and positive chemotactic effect on endothelial cells. Proc Natl Acad Sci U S A, 1990, 87:5978-5982.
6,Juul SE, Anderson DK,Li Y, et al. Erythropoietin and erythropoietin receptor in the developing human central nervous system. Pedia Res, 1998, 43:40-43.
, 百拇医药
7,Kimata H, Yoshida A,Ishioka C, et al. Human recombinant erythropoietin directly stimulates B cell immunoglobin production and proliferation in serum-free medium. Clin Exp Immunol,1991,85:151-156.
8,Neumann D,Wikstrom L, Watowich SS, et al. Intermediates in degradation of the erythropoietin receptor accumulate and are degraded in lysosomes. J Biol Chem, 1993, 268:13639-13642.
9,Yoshimura A, Longmore G, Lodish HF, et al. Point mutation in the exoplasmic domain of the erythropoietin receptor resulting in hormone-independent activation and tumourigenicity. Nature,1990,348:647-649.
(收稿日期:1999-08-12)
, 百拇医药
单位:樊华(110001 沈阳,中国医科大学第一临床学院血液科);翟明(110001 沈阳,中国医科大学第一临床学院血液科);杉田完尔(日本山梨医科大学小儿科);中泽真平(日本山梨医科大学小儿科)
关键词:细胞系;受体,红细胞生成素;信号传递;酪氨酸磷酸化
中华血液学杂志000604 【摘要】 目的 检测白血病细胞系红细胞生成素受体(EpoR)的表达并阐明EpoR介导的白血病细胞系KOCL-33增殖信号传导途径。方法 用生物素酰基化Epo及流式细胞仪检测白血病细胞系EpoR的表达;3H-TdR掺入法检测各细胞系对Epo刺激的增殖反应;免疫沉淀法和Western印迹法检测KOCL-33细胞中几种信号传导蛋白的酪氨酸磷酸化。结果 ①除T淋巴细胞系外,其余细胞系EpoR表达均为阳性,阳性率为18%~99%,均值52%。不同类型的细胞系EpoR阳性率的差异没有统计学意义。②9株细胞中7株细胞因受刺激而显著地增殖,P值<0.05。EpoR阳性率与增殖反应不相一致。③Epo可引起KOCL-33细胞的增殖,刺激后1min, EpoR形成同源二聚体、出现酪氨酸磷酸化,JAK2酪氨酸磷酸化;5min时STAT5被酪氨酸磷酸化。结论 ①白血病细胞系可有EpoR的表达;②Epo可引起部分白血病细胞系的增殖;③在EpoR 介导的KOCL-33细胞增殖信号的传导中,EpoR形成同源二聚体、出现酪氨酸磷酸化,JAK2、STAT5参与了增殖信号的传导。
, http://www.100md.com
Proliferative signal transmission mediated by EpoR in leukemic cell lines
FAN Hua,Sukida Kanji,ZHAI Ming,et al.
(Department of Hematology,The First Clinical College, China Medical University, Shenyang 110001,China)
【Abstract】 Objective To investigate the expression of erythropoietin receptor (EpoR) in leukemic cell lines and to clearify the mechanism of proliferative signal transmission in the leukemic cell line KOCL-33 mediated by EpoR. Methods Biotinylated Epo and flow cytometry were used for EpoR expression,3H-TdR incorporation for cell proliferation, immunoprecipitation and Western blot analysis for the tyrosine phosphorylation of signal transmission proteins. Results ①All the cell lines tested expressed EpoR except for T-lymphoid cell lines. The positivity rates ranged from 18% to 99% with an average of 52%, and was no difference among T, B and non-lymphoid cells. ②The cell proliferation was significantly enhanced in response to Epo in 7 of 9 cell lines tested. The stimulating effects of Epo did not correlate with the densities of EpoR expressed on the cells. ③The proliferation of KOCL-33 cells was significantly enhanced in response to Epo. Dimerization and tyrosine phosphorylation of EpoR and tyrosine phosphorylation of JAK2 occurred in 1min and tyrosine phosphorylation of STAT5 in 5 minutes after Epo stimulation. Conclusion ①There was EpoR expression in leukemic cell lines. ②The cell proliferation could be stimulated by Epo in some leukemic cell lines. The stimulating effect of Epo did not correlate with the densities of EpoR expressed on the cells.③Dimerization and tyosine phosphorylation of EpoR occurred,and JAK2, STAT5 involved in the proliferative signal transmission in KOCL-33 cells mediated by EpoR.
, http://www.100md.com
【Key words】 Cell line; Receptor, erythropoietin(EpoR); Proliferative signal transduction; Tyrosine phosphorylation
红细胞生成素(Epo)与幼红细胞表面Epo受体(EpoR)结合后,EpoR形成二聚体,再通过JAK/STAT[1,2]和Ras/MAP激酶[3]等信号传导途径调节红系的增殖和分化。EpoR不仅存在于幼红细胞,在其它细胞中也发现了EpoR。这就提示Epo的作用不仅仅限于红系。因此,我们检测了来源于白血病的细胞系,明确了一些细胞系表达EpoR,且对Epo 刺激有显著扩增反应。进而选择对Epo 刺激有显著增殖反应的细胞系KOCL-33进行了有关信号传导蛋白的酪氨酸磷酸化的检测,探讨Epo/EpoR在KOCL-33中的增殖信号传递途径。
材料和方法
, http://www.100md.com
1 白血病细胞系 T淋巴细胞系:KOPT-5、KOPT-K1; B淋巴细胞系:KOPN-30bi、KOPN-55bi、KOPN-57bi、KOPN-1、KOCL-33、KOCL-69、KOPN-34、KOPN-35、KOPN-56、KOPN-60、KOPN-62、KOPN-70、KOPN-87;非淋巴细胞系:KOPM-28、U937、HL-60、K562,共19株。除U937、HL-60、K562细胞系外,其余均为山梨医科大学小儿科用小儿急性白血病来源细胞建立的。其中KOCL-33是从小儿急性B淋巴细胞白血病细胞建立的细胞系,核型为t(11;19)。
2 主要试剂 抗EpoR(Anti-EpoR)、STAT5(Anti-STAT5)为相对分子质量55×103,92×103 的抗体(TL产品)。抗Ptyr(Anti-Ptyr)抗体为UBI公司产品。抗JAK2(Anti-JAK2)为相对分子质量130×103的抗体(UBI公司产品)。
, http://www.100md.com
3 荧光染色法 按照文献[4]方法制备生物素酰基化Epo,将其与细胞共孵育,再加PE-Avidin。用流式细胞仪检测EpoR的阳性率。不加生物素酰基化Epo作为阴性对照。阳性细胞比<10%判为阴性。并且,对KOCL-33细胞用不同浓度未生物素酰基化Epo对生物素酰基化Epo进行竞争抑制试验。
4 3H-TdR掺入法 选择9株细胞接种到96孔培养板的微孔池中。对照组只加含体积分数为10%胎牛血清(FCS)的RPMI 1640培养液。实验组分别加Epo 2.5,5.0,10.0U/ml,培养72h。用液体闪烁计数仪计数放射性核素每分钟闪烁计数(CPM)值,测定3H-TdR掺入量。
5 Western印迹法 KOCL-33细胞用D-MEM/F12洗3次, 再将其悬浮于D-MEM/F12中,放入CO2孵箱中, 使细胞饥饿2h。再取出分装于6支试管中,每支试管中细胞数为2×106,于37℃水浴槽中,对照不加Epo,另5管加Epo 5U,分别1,5,15,30,60min时中止反应。然后裂解细胞,提取蛋白质,进行SDS-聚丙烯酰胺凝胶电泳(PAGE)及转移电泳。再分别用一、二抗标记。用增强的化学发光法(ECL)显像于X线胶片上。
, 百拇医药
6 免疫沉淀法(immunoprecipitation,IP) 于裂解的细胞上清液中,按需要分别加入抗信号传导蛋白的抗体。4℃轻摇动过夜。然后加蛋白A琼脂糖珠匀浆40μl,于4℃轻摇动过夜。其余同Western印迹法。按需要更换一抗。
7 抗体的去除和再标记 将已标记一、二抗的硝酸纤维素膜上的抗体去除,再重新标记相应的抗体。硝酸纤维素膜放入55℃的抗体去除液中,振荡30min,取出膜。余同Western印迹法,按需要更换一抗。
8 统计学分析 T淋巴细胞系、B淋巴细胞系、非淋巴细胞系之间EpoR阳性率的差异用成组秩和检验法作分析。样本3H-TdR掺入量的差异用配对t检验。
结 果
1 白血病细胞系EpoR的阳性率 除KOPT5、KOPT-K1外,其余细胞系均为阳性,EpoR阳性率为18%~99%(均值52%)。B淋巴细胞系为18%~99%(均值69%);非淋巴细胞系为53%~96%(均值71%)。三系间的EpoR阳性率差异没有统计学意义。KOCL-33 EpoR的阳性率为82%;随着未生物素酰基化Epo浓度的增加KOCL-33的EpoR表达减少,当Epo为2U时,EpoR阳性率为89%,Epo增至80U时,EpoR阳性率降低到8%。其中生物素酰基化Epo为2U。
, http://www.100md.com
2 Epo刺激的增殖反应 9株细胞中7株细胞显著地因被刺激而增殖(P<0.05)。KOCL-33、KOPN-60、K562细胞的刺激指数(SI)>1.5(表1)。Epo 5U/ml时KOCL-33刺激反应最大,3H-TdR最大掺入量与对照组相比差异有显著意义,P值为0.0044(见表2)。
表1 白血病细胞系EpoR的表达和对Epo刺激的增殖反应 细胞系
EpoR阳性率
(%)
对照组3H-TdR
掺入量(CPM)
最大3H-TdR
掺入量(CPM)
, http://www.100md.com
Epo最佳浓度
(U/ml)
P值
KOPT-5
5
80449±4356
80528±901
10.0
0.0635
KOPN-57bi
66
39111±919
, 百拇医药 53317±440
5.0
0.0004
KOCL-33
82
52873±4338
85306±1957
5.0
0.0044
KOPN-34
99
16575±399
, 百拇医药 18502±256
10.0
0.0018
KOPN-35
20
35551±2877
48105±1399
5.0
0.0200
KOPN-60
74
41258±1862
, 百拇医药 62250±301
5.0
0.0034
KOPN-62
99
12099±342
12512±505
10.0
0.4440
KOPM-28
75
7357±312
8686±106
, http://www.100md.com
10.0
0.0259
K562
61
104973±7901
259813±6032
2.5
0.0002
注:表中数值为3个孔的均值±标准差表2 不同浓度Epo 刺激72h KOCL-33细胞3H-TdR
掺入量(CMP) Epo浓度(U/ml)
样本数
, http://www.100md.com
3 H-TdR掺入量
P值
0
3
52873±4338
2.5
3
57426±4556
0.1617
5.0
3
85306±1957
, 百拇医药
0.0044
10.0
3
79191±979
0.0106
注:*与Epo浓度为0组比较的P值
3 Western印迹结果 一抗为抗PTyr。图1可见在相对分子质量(46~210)×103间出现若干蛋白带。Epo刺激后1min出现酪氨酸磷酸化或酪氨酸磷酸化增强。

1:对照;2~6:5U/ml Epo刺激0,1,5,15,30,60min
, 百拇医药
图1 Western印迹法检测Epo刺激不同时间KOCL-33
中蛋白质酪氨酸磷酸化水平的变化
4 免疫沉淀法鉴定蛋白性质 ①用抗PTyr免疫沉淀后,再行Western印迹,一抗为抗EpoR。图2可见Epo刺激后1min,于相对分子质量110×103处见一明显的蛋白带发生酪氨酸磷酸化,5min脱磷酸。②用抗JAK2进行免疫沉淀后,再行Western印迹,一抗为抗PTyr抗体。从图3a中可见在相对分子质量为(111~210)×103的蛋白带,于1min出现酪氨酸磷酸化,60min仍未完全脱磷酸;将图3a膜除掉抗体后用抗JAK2重新标记,结果证实该蛋白是相对分子质量130×103的JAK2(图3b)。③用抗PTyr免疫沉淀后,再行Western印迹,一抗为抗STAT5。从图4可见相对分子质量为92×103的蛋白带(STAT5)于5min出现酪氨酸磷酸化,15min脱磷酸。
, http://www.100md.com
讨 论
EpoR是细胞因子受体超家族的一员,由507个氨基酸组成。包括细胞外部分、跨膜区域、胞浆部分。胞浆部分缺少酪氨酸激酶的特征排列顺序,所以不具有酪氨酸激酶活性。EpoR是否也存在于非红系中大量的研究表明,在血管内皮细胞[5]、神经细胞[6]、B淋巴细胞[7]有EpoR的表达。我们检测了白血病细胞系EpoR的表达,结果于所检测的全部B淋巴细胞白血病细胞系和非淋巴细胞白血病细胞系中均发现了EpoR的表达。为了排除非特异荧光所致假阳性的可能,我们对KOCL-33又进行了非生物素酰基化Epo的竞争抑制试验。结果可见生物素和非生物素酰基化Epo二者间存在着竞争抑制作用,可以排除非特异荧光所致的假阳性。

1:对照;2~6:Epo刺激1,5,15,30,60min
, 百拇医药
图2 免疫沉淀后Western印迹法检测Epo刺激不同时间
KOCL-33中EpoR的酪氨酸磷酸化水平的变化

1:对照;2~6:Epo刺激1,5,15,30,60min
图3 免疫沉淀后Western印迹法检测Epo刺激不同时间
KOCL-33中JAK2的酪氨酸磷酸化水平的变化

1:对照;2~6:Epo刺激1,5,15,30,60min
图4 免疫沉淀后Western印迹法检测Epo刺激不同时间
, 百拇医药
KOCL-33中STAT5的酪氨酸磷酸化水平的变化
为了阐明EpoR的作用,我们检测了Epo对白血病细胞系的刺激作用。结果表明,部分白血病细胞系能被Epo刺激而增殖。这提示白血病细胞系表达的是功能性的EpoR。有趣的是白血病细胞系EpoR阳性率并不与Epo刺激的增殖反应相一致。从表1中可见KOPN-62不为Epo所刺激,但却高水平地表达EpoR。而KOPN-35可因Epo刺激而显著地增殖,但只是低水平地表达EpoR。这提示细胞对Epo的敏感性是依赖于能将信号从EpoR传导到细胞核的细胞内传导系统的存在与否,而不单纯依赖于细胞表面EpoR的数目,并且Neumann等[8]报道了红细胞表面EpoR至多为每个细胞1000个,大部分存在于细胞内,因而不能仅凭细胞表面EpoR阳性率来推断增殖反应的强弱。
关于Epo是如何通过EpoR调节红系的增殖,1990年Yoshimura等[9]的研究结果证实,当Epo与EpoR结合时,受体形成同源二聚体,再通过JAK/STAT途径调节红系的增殖和分化。
, 百拇医药
在红系及依赖Epo增殖的细胞系中,JAK2/STAT5途径发挥着主要作用。我们选择了对Epo刺激有显著扩增反应的细胞系KOCL-33进行了Epo刺激前后EpoR 、JAK2、STAT5的酪氨酸磷酸化的检测。图2可见KOCL-33在Epo刺激后1min,于相对分子质量110×103处有一明显的蛋白带发生酪氨酸磷酸化,鉴于EpoR可以互相聚合,而凝胶加样缓冲液短时间煮沸的处理有时并不能使聚合体解聚,并且我们所用抗EpoR抗体的相对分子质量为55×103,推测此蛋白带可能为EpoR的同源二聚体。
本实验也证实了Epo刺激1min时JAK2的酪氨酸磷酸化和5min时STAT5的酪氨酸磷酸化。这说明与EpoR形成二聚体、酪氨酸磷酸化的同时出现了JAK2的酪氨酸磷酸化增强,其后STAT5被磷酸化,这提示有增殖信号的传导,表明了白血病细胞系增殖信号传导过程中JAK/STAT途径的参与。
总之,我们的实验提示,Epo/EpoR除了特异地作用于红系外,对非红系的白血病细胞系也具有刺激其增殖的作用。
, http://www.100md.com
参考文献
1,Sawyer ST, Kalyani P. Association of JAK2 and STAT5 with erythropoietin receptors. J Biol Chem, 1996, 271:3243-3248.
2,Oda A, Sawada K, Druker BJ, et al. Erythropoietin induces tyrosine phosphorylation of JAK2, STAT5A, and STAT5B in primary cultured human erythroid precursors. Blood, 1998, 92: 443-451.
3,Miura Y, Miura O, Ihle JN, et al. Activation of the Mitogen activated protein kinase pathway by the erythropoietin receptor. J Biol Chem, 1994, 269:29962-29969.
, http://www.100md.com
4,Shimoda K, Okamura S, Harada N, et al. Granulocyte colony stimulating factor receptors on human acute leukemia: biphenotypic leukemic cells prossess granulocyte colony stimulating factor receptors. Cancer Res, 1992, 52:3052-3055.
5,Anagnostou A, Lee ES, Kessimian N, et al. Erythropoietin has a mitogenic and positive chemotactic effect on endothelial cells. Proc Natl Acad Sci U S A, 1990, 87:5978-5982.
6,Juul SE, Anderson DK,Li Y, et al. Erythropoietin and erythropoietin receptor in the developing human central nervous system. Pedia Res, 1998, 43:40-43.
, 百拇医药
7,Kimata H, Yoshida A,Ishioka C, et al. Human recombinant erythropoietin directly stimulates B cell immunoglobin production and proliferation in serum-free medium. Clin Exp Immunol,1991,85:151-156.
8,Neumann D,Wikstrom L, Watowich SS, et al. Intermediates in degradation of the erythropoietin receptor accumulate and are degraded in lysosomes. J Biol Chem, 1993, 268:13639-13642.
9,Yoshimura A, Longmore G, Lodish HF, et al. Point mutation in the exoplasmic domain of the erythropoietin receptor resulting in hormone-independent activation and tumourigenicity. Nature,1990,348:647-649.
(收稿日期:1999-08-12)
, 百拇医药