单核细胞趋化蛋白-1转基因对膀胱肿瘤生物学行为的影响
杨航 宋波 熊恩庆 金锡御 陈昭颉 方强
摘 要 目的:观察单核细胞趋化蛋白-1(MCP-1)局部表达对膀胱肿瘤生物学行为的影响。方法:通过脂质体介导,利用逆转录病毒载体将MCP-1基因导入膀胱肿瘤皮下模型的瘤细胞中。观察肿瘤生长情况,测瘤重及病理学检查。结果:转基因组肿瘤生长受抑制,第15天后生长曲线明显下降,瘤体湿重(2.68±0.61)g,较对照组(3.87±0.78)g和空白组(3.98±0.70)g显著减轻。转基因组肿瘤向周围组织的侵袭力减弱,瘤内呈弥漫分布的点状或小片状坏死,并以单核细胞和淋巴细胞浸润为主。结论:MCP-1对免疫细胞的趋化与活化在抗膀胱肿瘤的免疫效应中有重要作用。
关键词:膀胱肿瘤 癌 生物学 基因
单核细胞趋化蛋白-1(MCP-1)是趋化因子超家族β亚族的主要成员,对多种免疫细胞具有趋化和激活的双重功能。目前认为,活化的免疫细胞早期在肿瘤内部浸润和聚集,将对肿瘤进行直接的免疫攻击,或通过分泌多种细胞因子和介质等间接地产生杀伤与细胞毒作用,抑制肿瘤的生长和转移。本研究用小鼠膀胱肿瘤BST739细胞的同系小鼠皮下肿瘤模型,采用脂质体介导的方法,将构建有MCP-1基因的逆转录病毒载体导入瘤细胞中,探讨MCP-1局部高表达所诱导的免疫效应对肿瘤生物学行为的影响。
, 百拇医药
材料和方法
一、主要材料
全长MCP-1 cDNA,克隆于质粒pBluescript(-)中,由美国NCI的Teizo Yoshimura教授惠赠。逆转录病毒载体pLXSN(全长5874bp),由重庆西南医院梁志清博士惠赠。BST739细胞,来源于同基因系T739小鼠膀胱癌,由重庆大坪医院靳凤烁教授惠赠。近交系T739小鼠,鼠龄6~8周,体重18~22g,雌雄不拘,购自第三军医大学动物实验中心。脂质体(Dosper)转染试剂盒购自BM公司。细胞培养液RPMI1640购自Gibco公司。
二、实验方法
1.逆转录病毒载体的构建:质粒pBluescript(-)经EcoR I 酶切、回收MCP-1基因片段(741bp),插入pLXSN的多克隆位点,BamH I+BglⅡ酶切定向,BglⅡ酶切排除串联拷贝(图1)。构建成功的重组载体命名为pLXSN-MCP-1。
, http://www.100md.com
图1 病毒载体重组酶切电泳图
2.动物模型:BST739细胞常规复苏并传代三代以上,待细胞90% 融合时制备成悬液(密度1.5×107个细胞/ml),取0.1ml接种于同基因系T739小鼠左后肢外侧皮下。
3.基因转移:荷瘤T739小鼠随机分为3组,每组12只,分别于瘤体内3~4点注射RPMI-1640(空白组)、脂质体包裹的病毒载体pLXSN-MCP-1(转基因组)和pLXSN(对照组)。脂质体制备参照试剂盒说明书进行。
4.肿瘤生物学行为观察:动物接种瘤细胞和转基因后,每3天测定肿瘤长径a和短径b,推算肿瘤体积[1]:V=ab2/2,比较各组生长-时间曲线。3周后麻醉处死动物,剥取瘤体并称湿重。大体观察肿瘤与周围组织的浸润、粘连情况,组织切片HE染色并镜检。
, 百拇医药
5.统计学处理:采用Microsoft Excel 7.0单因素方差程序分析,以P<0.05作为显著性标准。
结 果
肿瘤生长情况:三组动物成瘤率100%,接种后第3天皮下可触及约绿豆大小结节。转基因组肿瘤生长速度明显减慢,15天后肿瘤体积明显小于对照组和空白组,P<0.01(图2)。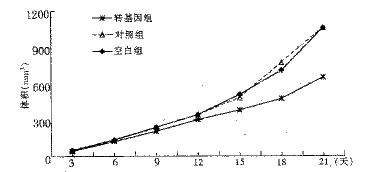
图2 各组肿瘤生长-时间曲线
瘤体重量:第21天尸检时转基因组肿瘤瘤体湿重平均为(2.68±0.61)g,对照组和空白组分别为(3.87±0.78)g和(3.98±0.70)g。转基因组与对照组和空白组相比差异均有显著性(P<0.01),而对照组与空白组之间差异无显著性(P>0.05)。
, 百拇医药
病理检查:转基因组瘤体包膜相对完整,与肌肉和骨骼轻度粘连,且易分离,其中仅2例发现肌肉浸润,而对照组和空白组肿瘤均明显侵入肌肉内生长,少数肿瘤表面有溃烂。转基因组肿瘤除中心部位有较大的片状坏死外,其它部位可见弥漫分布、数量较多的点状或小片状坏死灶,伴有大量的单核细胞和淋巴细胞浸润。对照组和空白组肿瘤则主要见中心区片状坏死,其它部位偶见点状或小片状坏死灶,浸润细胞以中性粒细胞为主。
讨 论
MCP-1是一种可趋化和激活单核细胞、T淋巴细胞和NK细胞等多种免疫细胞的细胞因子。Matsushima等[2]首先于1989年用液相色谱分析法分离得到,并发现该因子激活的单核细胞具有抑制大肠癌、黑色素瘤生长的作用。Bottazzi等[3]发现转染MCP-1基因的黑色素瘤倍增时间由平均2.9天延长到6.6天。Hoshino等[4]将转染MCP-1基因的黑色素瘤细胞注射于小鼠腹腔,发现肿瘤瘤内坏死明显增加。Huang等[5]发现转染MCP-1基因的鼠肠腺癌CT-26转移力显著下降。膀胱癌患者经BCG治疗后,其无瘤状态的维持与MCP-1表达水平有相关关系[6]。本实验结果显示:转基因组肿瘤生长受到明显抑制,瘤内有大量弥漫分布的点状坏死,无明显的肌肉浸润;空白组和对照组肿瘤生长迅速,并侵入肌肉生长,提示MCP-1对肿瘤生长和侵袭有一定的抑制作用。
, 百拇医药
Parry等[7]的体外实验证实,单核细胞经IFN-γ活化后可抑制肠腺癌HT29细胞的生长,未活化时则可能促进肿瘤细胞生长。Yamashiro等[8]发现转染MCP-1基因后,外周血单核细胞向肿瘤内部浸润增加,并处于活化状态,能显著抑制肿瘤生长,而组织局部固有的巨噬细胞则少有瘤内浸润。表明免疫细胞除数量以外,其活化状态是发挥对肿瘤免疫攻击和细胞毒作用的一个十分重要的因素。
MCP-1激活免疫细胞的作用机理为:(1)调理单核细胞吞噬功能,增加超氧阴离子、溶菌酶、氮氧化合物和细胞因子(IL-1、IL-6)产生和释放。(2)刺激T细胞生长和淋巴因子释放,促使CTL细胞脱颗粒和释放酯酶[9]。(3)增强NK细胞的杀伤活性[10],诱导产生有细胞溶解活性的CHAK细胞[11]。
MCP-1介导的免疫效应具有诱导肿瘤坏死的作用。实验发现各组肿瘤均有不同程度坏死,但空白组和对照组坏死主要位于肿瘤中心区,坏死区内以中性粒细胞浸润为主,提示坏死与肿瘤生长过大、过快,血液供应障碍等因素有关,局部中性粒细胞浸润是坏死后的炎性反应。转基因组肿瘤内则有弥漫性、多灶性的点状或小片状坏死,坏死区内有大量单核细胞和淋巴细胞浸润,提示局部聚集和活化的上述免疫细胞是导致坏死的主要原因。
, 百拇医药
本实验结果提示,MCP-1局部表达能明显抑制膀胱肿瘤的生长和浸润,并通过介导免疫效应诱导瘤内多发性坏死,一定程度上逆转其生物学行为,在抗膀胱肿瘤的免疫效应中具有重要的作用。
作者单位:杨 航(成都,成都军区总医院泌尿外科 610083)
陈昭颉(成都,成都军区总医院泌尿外科 610083)
宋 波(重庆西南医院泌尿外科)
熊恩庆(重庆西南医院泌尿外科)
金锡御(重庆西南医院泌尿外科)
方 强(重庆西南医院泌尿外科)
参考文献
[1]Lee YS, Bullard DE, Zalutsky MR, et al. Therapeutic efficacy of antiglioma mesenchymal extracellular matrix 131 I-radiolabelled murine monoclonal antibody in a human glioma xenograft model. Cancer Res, 1988,48∶559-566.
, 百拇医药
[2]Matsushima K, Larsen CG, DuBois GC, et al. Purification and characterization of a novel monocyte chemotactic and activating factor produced by a human myelomonocytic cell line. J Exp Med, 1989,169∶1485-1490.
[3]Bottazzi B, Walter S, Govoni D, et al. Monocyte chemotactic cytokine gene transfer modulates macrophage infiltration, growth, and susceptibility to IL-2 therapy of a murine melanoma. J Immunol, 1992,148∶1280-1285.
[4]Hoshino Y, Hatake K, Kasahara T, et al. Monocyte chemoattractant protein-1 stimulates tumor necrosis and recruitment of macrophages into tumors in tumor-bearing nude mice: increased granulocyte and macrophage progenitors in murine bone marrow. Exp Hematol, 1995,23∶1035-1039.
, 百拇医药
[5]Huang S, Singh RK, Xie K, et al. Expression of the JE/MCP-1 gene suppresses metastatic potential in murine colon carcinoma cells. Cancer Immuno Immunother, 1994,39∶231-238.
[6]Iantomo R, Nicolai M, Cipollone G, et al. Role of MCP-1 chemokine in the response of monocytes of patients with superficial tumors of the bladder treatment with BCG immunotherapy. Arch Ital Urol Androl, 1997,69 (suppl 1)∶71-72.
[7]Parry HJ, Rees RC. Differential effects of human blood monocytes on the growth of human tumour cell lines in vitro. Cancer Immuno Immunother, 1992,34∶355-360.
, 百拇医药
[8]Yamashiro S, Takeya M, Nishi T, et al. Tumor-derived monocyte chemoattractant protein-1 induces intratumoral infiltration of monocyte-derived macrophage subpopulation in transplanted rat tumors. Am J Pathol, 1994,145∶856-867.
[9]Taub DD, Ortaldo JR, Turcovski-Corrales SM, et al. Beta chemokines costimulate lymphocyte cytolysis, proliferation, and lymphokine production. J Leukoc Biol, 1996,59∶81-89.
[10]Taub DD, Sayets TJ, Carter CR, et al. Alpha and beta chemokines induce NK cell migration and enhance NK-mediated cytolysis. J Immunol, 1995,155∶3877-3888.
[11]Maghaazachi AA, Al-Aoukaty A, Schall TJ, et al. CC chemokines induce the generation of killer cells from CD+56 cells. Eur J Immunol, 1996,26∶315-319., http://www.100md.com
摘 要 目的:观察单核细胞趋化蛋白-1(MCP-1)局部表达对膀胱肿瘤生物学行为的影响。方法:通过脂质体介导,利用逆转录病毒载体将MCP-1基因导入膀胱肿瘤皮下模型的瘤细胞中。观察肿瘤生长情况,测瘤重及病理学检查。结果:转基因组肿瘤生长受抑制,第15天后生长曲线明显下降,瘤体湿重(2.68±0.61)g,较对照组(3.87±0.78)g和空白组(3.98±0.70)g显著减轻。转基因组肿瘤向周围组织的侵袭力减弱,瘤内呈弥漫分布的点状或小片状坏死,并以单核细胞和淋巴细胞浸润为主。结论:MCP-1对免疫细胞的趋化与活化在抗膀胱肿瘤的免疫效应中有重要作用。
关键词:膀胱肿瘤 癌 生物学 基因
单核细胞趋化蛋白-1(MCP-1)是趋化因子超家族β亚族的主要成员,对多种免疫细胞具有趋化和激活的双重功能。目前认为,活化的免疫细胞早期在肿瘤内部浸润和聚集,将对肿瘤进行直接的免疫攻击,或通过分泌多种细胞因子和介质等间接地产生杀伤与细胞毒作用,抑制肿瘤的生长和转移。本研究用小鼠膀胱肿瘤BST739细胞的同系小鼠皮下肿瘤模型,采用脂质体介导的方法,将构建有MCP-1基因的逆转录病毒载体导入瘤细胞中,探讨MCP-1局部高表达所诱导的免疫效应对肿瘤生物学行为的影响。
, 百拇医药
材料和方法
一、主要材料
全长MCP-1 cDNA,克隆于质粒pBluescript(-)中,由美国NCI的Teizo Yoshimura教授惠赠。逆转录病毒载体pLXSN(全长5874bp),由重庆西南医院梁志清博士惠赠。BST739细胞,来源于同基因系T739小鼠膀胱癌,由重庆大坪医院靳凤烁教授惠赠。近交系T739小鼠,鼠龄6~8周,体重18~22g,雌雄不拘,购自第三军医大学动物实验中心。脂质体(Dosper)转染试剂盒购自BM公司。细胞培养液RPMI1640购自Gibco公司。
二、实验方法
1.逆转录病毒载体的构建:质粒pBluescript(-)经EcoR I 酶切、回收MCP-1基因片段(741bp),插入pLXSN的多克隆位点,BamH I+BglⅡ酶切定向,BglⅡ酶切排除串联拷贝(图1)。构建成功的重组载体命名为pLXSN-MCP-1。

, http://www.100md.com
图1 病毒载体重组酶切电泳图
2.动物模型:BST739细胞常规复苏并传代三代以上,待细胞90% 融合时制备成悬液(密度1.5×107个细胞/ml),取0.1ml接种于同基因系T739小鼠左后肢外侧皮下。
3.基因转移:荷瘤T739小鼠随机分为3组,每组12只,分别于瘤体内3~4点注射RPMI-1640(空白组)、脂质体包裹的病毒载体pLXSN-MCP-1(转基因组)和pLXSN(对照组)。脂质体制备参照试剂盒说明书进行。
4.肿瘤生物学行为观察:动物接种瘤细胞和转基因后,每3天测定肿瘤长径a和短径b,推算肿瘤体积[1]:V=ab2/2,比较各组生长-时间曲线。3周后麻醉处死动物,剥取瘤体并称湿重。大体观察肿瘤与周围组织的浸润、粘连情况,组织切片HE染色并镜检。
, 百拇医药
5.统计学处理:采用Microsoft Excel 7.0单因素方差程序分析,以P<0.05作为显著性标准。
结 果
肿瘤生长情况:三组动物成瘤率100%,接种后第3天皮下可触及约绿豆大小结节。转基因组肿瘤生长速度明显减慢,15天后肿瘤体积明显小于对照组和空白组,P<0.01(图2)。

图2 各组肿瘤生长-时间曲线
瘤体重量:第21天尸检时转基因组肿瘤瘤体湿重平均为(2.68±0.61)g,对照组和空白组分别为(3.87±0.78)g和(3.98±0.70)g。转基因组与对照组和空白组相比差异均有显著性(P<0.01),而对照组与空白组之间差异无显著性(P>0.05)。
, 百拇医药
病理检查:转基因组瘤体包膜相对完整,与肌肉和骨骼轻度粘连,且易分离,其中仅2例发现肌肉浸润,而对照组和空白组肿瘤均明显侵入肌肉内生长,少数肿瘤表面有溃烂。转基因组肿瘤除中心部位有较大的片状坏死外,其它部位可见弥漫分布、数量较多的点状或小片状坏死灶,伴有大量的单核细胞和淋巴细胞浸润。对照组和空白组肿瘤则主要见中心区片状坏死,其它部位偶见点状或小片状坏死灶,浸润细胞以中性粒细胞为主。
讨 论
MCP-1是一种可趋化和激活单核细胞、T淋巴细胞和NK细胞等多种免疫细胞的细胞因子。Matsushima等[2]首先于1989年用液相色谱分析法分离得到,并发现该因子激活的单核细胞具有抑制大肠癌、黑色素瘤生长的作用。Bottazzi等[3]发现转染MCP-1基因的黑色素瘤倍增时间由平均2.9天延长到6.6天。Hoshino等[4]将转染MCP-1基因的黑色素瘤细胞注射于小鼠腹腔,发现肿瘤瘤内坏死明显增加。Huang等[5]发现转染MCP-1基因的鼠肠腺癌CT-26转移力显著下降。膀胱癌患者经BCG治疗后,其无瘤状态的维持与MCP-1表达水平有相关关系[6]。本实验结果显示:转基因组肿瘤生长受到明显抑制,瘤内有大量弥漫分布的点状坏死,无明显的肌肉浸润;空白组和对照组肿瘤生长迅速,并侵入肌肉生长,提示MCP-1对肿瘤生长和侵袭有一定的抑制作用。
, 百拇医药
Parry等[7]的体外实验证实,单核细胞经IFN-γ活化后可抑制肠腺癌HT29细胞的生长,未活化时则可能促进肿瘤细胞生长。Yamashiro等[8]发现转染MCP-1基因后,外周血单核细胞向肿瘤内部浸润增加,并处于活化状态,能显著抑制肿瘤生长,而组织局部固有的巨噬细胞则少有瘤内浸润。表明免疫细胞除数量以外,其活化状态是发挥对肿瘤免疫攻击和细胞毒作用的一个十分重要的因素。
MCP-1激活免疫细胞的作用机理为:(1)调理单核细胞吞噬功能,增加超氧阴离子、溶菌酶、氮氧化合物和细胞因子(IL-1、IL-6)产生和释放。(2)刺激T细胞生长和淋巴因子释放,促使CTL细胞脱颗粒和释放酯酶[9]。(3)增强NK细胞的杀伤活性[10],诱导产生有细胞溶解活性的CHAK细胞[11]。
MCP-1介导的免疫效应具有诱导肿瘤坏死的作用。实验发现各组肿瘤均有不同程度坏死,但空白组和对照组坏死主要位于肿瘤中心区,坏死区内以中性粒细胞浸润为主,提示坏死与肿瘤生长过大、过快,血液供应障碍等因素有关,局部中性粒细胞浸润是坏死后的炎性反应。转基因组肿瘤内则有弥漫性、多灶性的点状或小片状坏死,坏死区内有大量单核细胞和淋巴细胞浸润,提示局部聚集和活化的上述免疫细胞是导致坏死的主要原因。
, 百拇医药
本实验结果提示,MCP-1局部表达能明显抑制膀胱肿瘤的生长和浸润,并通过介导免疫效应诱导瘤内多发性坏死,一定程度上逆转其生物学行为,在抗膀胱肿瘤的免疫效应中具有重要的作用。
作者单位:杨 航(成都,成都军区总医院泌尿外科 610083)
陈昭颉(成都,成都军区总医院泌尿外科 610083)
宋 波(重庆西南医院泌尿外科)
熊恩庆(重庆西南医院泌尿外科)
金锡御(重庆西南医院泌尿外科)
方 强(重庆西南医院泌尿外科)
参考文献
[1]Lee YS, Bullard DE, Zalutsky MR, et al. Therapeutic efficacy of antiglioma mesenchymal extracellular matrix 131 I-radiolabelled murine monoclonal antibody in a human glioma xenograft model. Cancer Res, 1988,48∶559-566.
, 百拇医药
[2]Matsushima K, Larsen CG, DuBois GC, et al. Purification and characterization of a novel monocyte chemotactic and activating factor produced by a human myelomonocytic cell line. J Exp Med, 1989,169∶1485-1490.
[3]Bottazzi B, Walter S, Govoni D, et al. Monocyte chemotactic cytokine gene transfer modulates macrophage infiltration, growth, and susceptibility to IL-2 therapy of a murine melanoma. J Immunol, 1992,148∶1280-1285.
[4]Hoshino Y, Hatake K, Kasahara T, et al. Monocyte chemoattractant protein-1 stimulates tumor necrosis and recruitment of macrophages into tumors in tumor-bearing nude mice: increased granulocyte and macrophage progenitors in murine bone marrow. Exp Hematol, 1995,23∶1035-1039.
, 百拇医药
[5]Huang S, Singh RK, Xie K, et al. Expression of the JE/MCP-1 gene suppresses metastatic potential in murine colon carcinoma cells. Cancer Immuno Immunother, 1994,39∶231-238.
[6]Iantomo R, Nicolai M, Cipollone G, et al. Role of MCP-1 chemokine in the response of monocytes of patients with superficial tumors of the bladder treatment with BCG immunotherapy. Arch Ital Urol Androl, 1997,69 (suppl 1)∶71-72.
[7]Parry HJ, Rees RC. Differential effects of human blood monocytes on the growth of human tumour cell lines in vitro. Cancer Immuno Immunother, 1992,34∶355-360.
, 百拇医药
[8]Yamashiro S, Takeya M, Nishi T, et al. Tumor-derived monocyte chemoattractant protein-1 induces intratumoral infiltration of monocyte-derived macrophage subpopulation in transplanted rat tumors. Am J Pathol, 1994,145∶856-867.
[9]Taub DD, Ortaldo JR, Turcovski-Corrales SM, et al. Beta chemokines costimulate lymphocyte cytolysis, proliferation, and lymphokine production. J Leukoc Biol, 1996,59∶81-89.
[10]Taub DD, Sayets TJ, Carter CR, et al. Alpha and beta chemokines induce NK cell migration and enhance NK-mediated cytolysis. J Immunol, 1995,155∶3877-3888.
[11]Maghaazachi AA, Al-Aoukaty A, Schall TJ, et al. CC chemokines induce the generation of killer cells from CD+56 cells. Eur J Immunol, 1996,26∶315-319., http://www.100md.com