实验性变态反应性脑脊髓炎的病理研究
吕雪莹 张凤蕴 王丽群 于伟玲 张莉
摘要 目的:研究实验性变态反应性脑脊髓炎(EAE)的病理变化。方法:利用光镜、电镜观察豚鼠EAE模型的组织学改变。结果:光镜下可见脑实质及珠网膜下腔小血管充血,血管周围炎细胞浸润,呈“袖套”状改变,侧脑室旁白质及脊髓后联合、侧角出现髓鞘肿胀、崩解或消失。电镜下可见血管周围明显脱髓鞘,髓鞘呈松散状,部分区域斑块状脱落,明暗相间结构消失,轴突细胞器消失,神经元细胞尼(氏)小体消失,内质网扩张脱颗粒。结论:EAE的病理改变主要为血管周围炎性浸润及白质脱髓鞘。
关键词:实验性变态反应性脑脊髓炎 超微结构
实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis, EAE)是由T淋巴细胞介导的发生于易感动物的自身免疫病,主要特征为中枢神经系统(CNS)血管周围单个核细胞浸润和白质脱髓鞘。由于鼠EAE模型在临床及组织学上与人CNS炎性脱髓鞘病多发性硬化(MS)的相似性,而使其成为MS的理想动物模型,对研究MS的发病机制具有重要作用。目前国内对EAE病理改变的研究甚少,本实验拟通过用髓鞘碱性蛋白(myelin basic protein, MBP)免疫敏感动物豚鼠建立EAE模型,研究EAE动物在普通光镜及电镜下病理改变,从而获得一些有意义的发现。
, http://www.100md.com
1 材料和方法
1.1 EAE动物模型的制备 豚鼠由哈尔滨兽医研究所提供,2月龄,雌性,体重300g左右。实验分两组: (1) EAE组,21只,用本室按Kie方法自牛脑中提取且经SDS-PAGE证实的MBP加福(氏)完全佐剂(CFA),乳化后按体重注入豚鼠后足掌,抗原量约为按体重0.66 μg/g[1]。免疫后约8~9天发病,发病动物出现不同程度肢体无力,体重减轻,继之瘫痪,伴有尿便障碍,有的抽搐死亡。 (2) 对照组14只,注入等量生理盐水加CFA,此组动物不发病。
1.2 取材 动物处死后立即将脑和脊髓取出,除留少量组织置于3%(体积分数)戊二醛中,其余均置于40 g/L的多聚甲醛中固定,固定后2周取材,取脑室周围的脑实质,脊髓分颈、胸、腰3段。
1.3 组织病理 HE染色及Weil铁矾苏木素染色[2]。
, 百拇医药
1.4 半薄切片及超薄切片 哈尔滨医科大学电镜室制备。
2 结果与讨论
2.1 光镜所见 对照组的神经组织病理检查未见异常,这与此组未出现临床症状吻合。EAE动物大体脑组织可见脑膜血管充血,珠网膜下腔轻度混浊,脑横切面可见呈针尖状的小血管充血,弥漫分布。
EAE动物的组织病理学变化主要表现为急性血管炎伴周围髓鞘脱失,脊髓实质内、珠网膜下腔及侧脑室脉络丛小血管充血,管周有大量炎细胞浸润,形成“袖套”(cuffing)状改变(图1), 发病初期主要为中性粒细胞浸润,继之以淋巴细胞浸润为主并有少量单核细胞。
图1 血管周围炎性浸润
, http://www.100md.com
Fig 1 Inflammatory infiltration around blood vessels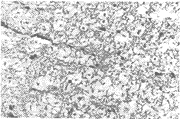
图2 白质脱髓鞘
Fig 2 Demyelination in white matter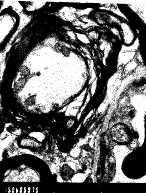
图3 髓鞘呈松散状
Fig 3 Structure of myelin sheath is divergent
等原位组织化学检测显示:病变部位浸润的淋巴细胞以辅助T淋巴细胞和巨噬细胞/小胶质细胞为主,而细胞毒性T淋巴细胞/抑制T淋巴细胞和B淋巴细胞罕见[3],小血管管壁增厚,管周间隙有浆液渗出。病灶播散在CNS白质内,病灶均累及小静脉,有的小静脉破裂,周围少量出血,可见白细胞附壁或正通过管壁,或进而游出血管向炎性区移动。脑膜和脊髓膜亦有炎细胞浸润。侧脑室旁白质尤其侧脑室角周围白质及脊髓后联合、侧角髓鞘肿胀,崩解消失,轴突肿胀,偶有轴突消失(图2),并可见大量格子细胞存在。神经元细胞无明显改变,有的出现卫星现象。以上病理改变符合文献报道[3,4]。
, 百拇医药
2.2 电镜所见 电镜下观察EAE发病动物,病变分布不规则,脱髓鞘改变以血管周围明显,大部分髓鞘环形结构呈松散状,部分区域斑块状脱落,明暗相间消失(图3),轴突细胞器消失,血管基膜增厚,部分区域局灶性坏死。神经元细胞尼(氏)小体消失,内质网扩张脱颗粒。
研究EAE动物CNS的病理改变是确定EAE动物模型成功建立的客观依据,以此为基础进行免疫组化研究对探讨EAE的发病机制,进而MS的发病机制具有重要的意义。
基金项目:黑龙江省自然科学基金资助项目(0-9622)
作者简介:吕雪莹(1972年生),女,黑龙江省五常县人,硕士,助教。
作者单位:吕雪莹(哈尔滨医科大学免疫教研室)
张凤蕴(哈尔滨医科大学免疫教研室)
, 百拇医药
王丽群(哈尔滨医科大学免疫教研室)
于伟玲(哈尔滨医科大学免疫教研室)
张 莉(哈尔滨医科大学电镜室,哈尔滨 150086)
参考文献
[1]周建年,杨贵贞. 髓磷脂碱蛋白的提取、鉴定及初步应用的研究[J]. 白求恩医科大学学报,1985,11:17-20.
[2]龚志锦,詹榕洲. 病理组织制片和染色技术[M]. 上海:上海科学技术出版社,1993. 114-116.
[3]Knoble RL, Marini JC, Goldowitz D, et al. Distribution of the blood-brain barrier heterotopic brain transplants and its relationship to the lesions of EAE[J]. J Neuropathal Exp Neurol. 1992, 51(1):36-39.
[4]Raine CS. Biology of disease: the analysis of autoimmune demyelination: its impact on multiple sclerosis[J]. Lab Invest, 1984, 50:608-635., http://www.100md.com
摘要 目的:研究实验性变态反应性脑脊髓炎(EAE)的病理变化。方法:利用光镜、电镜观察豚鼠EAE模型的组织学改变。结果:光镜下可见脑实质及珠网膜下腔小血管充血,血管周围炎细胞浸润,呈“袖套”状改变,侧脑室旁白质及脊髓后联合、侧角出现髓鞘肿胀、崩解或消失。电镜下可见血管周围明显脱髓鞘,髓鞘呈松散状,部分区域斑块状脱落,明暗相间结构消失,轴突细胞器消失,神经元细胞尼(氏)小体消失,内质网扩张脱颗粒。结论:EAE的病理改变主要为血管周围炎性浸润及白质脱髓鞘。
关键词:实验性变态反应性脑脊髓炎 超微结构
实验性变态反应性脑脊髓炎(experimental allergic encephalomyelitis, EAE)是由T淋巴细胞介导的发生于易感动物的自身免疫病,主要特征为中枢神经系统(CNS)血管周围单个核细胞浸润和白质脱髓鞘。由于鼠EAE模型在临床及组织学上与人CNS炎性脱髓鞘病多发性硬化(MS)的相似性,而使其成为MS的理想动物模型,对研究MS的发病机制具有重要作用。目前国内对EAE病理改变的研究甚少,本实验拟通过用髓鞘碱性蛋白(myelin basic protein, MBP)免疫敏感动物豚鼠建立EAE模型,研究EAE动物在普通光镜及电镜下病理改变,从而获得一些有意义的发现。
, http://www.100md.com
1 材料和方法
1.1 EAE动物模型的制备 豚鼠由哈尔滨兽医研究所提供,2月龄,雌性,体重300g左右。实验分两组: (1) EAE组,21只,用本室按Kie方法自牛脑中提取且经SDS-PAGE证实的MBP加福(氏)完全佐剂(CFA),乳化后按体重注入豚鼠后足掌,抗原量约为按体重0.66 μg/g[1]。免疫后约8~9天发病,发病动物出现不同程度肢体无力,体重减轻,继之瘫痪,伴有尿便障碍,有的抽搐死亡。 (2) 对照组14只,注入等量生理盐水加CFA,此组动物不发病。
1.2 取材 动物处死后立即将脑和脊髓取出,除留少量组织置于3%(体积分数)戊二醛中,其余均置于40 g/L的多聚甲醛中固定,固定后2周取材,取脑室周围的脑实质,脊髓分颈、胸、腰3段。
1.3 组织病理 HE染色及Weil铁矾苏木素染色[2]。
, 百拇医药
1.4 半薄切片及超薄切片 哈尔滨医科大学电镜室制备。
2 结果与讨论
2.1 光镜所见 对照组的神经组织病理检查未见异常,这与此组未出现临床症状吻合。EAE动物大体脑组织可见脑膜血管充血,珠网膜下腔轻度混浊,脑横切面可见呈针尖状的小血管充血,弥漫分布。
EAE动物的组织病理学变化主要表现为急性血管炎伴周围髓鞘脱失,脊髓实质内、珠网膜下腔及侧脑室脉络丛小血管充血,管周有大量炎细胞浸润,形成“袖套”(cuffing)状改变(图1), 发病初期主要为中性粒细胞浸润,继之以淋巴细胞浸润为主并有少量单核细胞。

图1 血管周围炎性浸润
, http://www.100md.com
Fig 1 Inflammatory infiltration around blood vessels

图2 白质脱髓鞘
Fig 2 Demyelination in white matter

图3 髓鞘呈松散状
Fig 3 Structure of myelin sheath is divergent
等原位组织化学检测显示:病变部位浸润的淋巴细胞以辅助T淋巴细胞和巨噬细胞/小胶质细胞为主,而细胞毒性T淋巴细胞/抑制T淋巴细胞和B淋巴细胞罕见[3],小血管管壁增厚,管周间隙有浆液渗出。病灶播散在CNS白质内,病灶均累及小静脉,有的小静脉破裂,周围少量出血,可见白细胞附壁或正通过管壁,或进而游出血管向炎性区移动。脑膜和脊髓膜亦有炎细胞浸润。侧脑室旁白质尤其侧脑室角周围白质及脊髓后联合、侧角髓鞘肿胀,崩解消失,轴突肿胀,偶有轴突消失(图2),并可见大量格子细胞存在。神经元细胞无明显改变,有的出现卫星现象。以上病理改变符合文献报道[3,4]。
, 百拇医药
2.2 电镜所见 电镜下观察EAE发病动物,病变分布不规则,脱髓鞘改变以血管周围明显,大部分髓鞘环形结构呈松散状,部分区域斑块状脱落,明暗相间消失(图3),轴突细胞器消失,血管基膜增厚,部分区域局灶性坏死。神经元细胞尼(氏)小体消失,内质网扩张脱颗粒。
研究EAE动物CNS的病理改变是确定EAE动物模型成功建立的客观依据,以此为基础进行免疫组化研究对探讨EAE的发病机制,进而MS的发病机制具有重要的意义。
基金项目:黑龙江省自然科学基金资助项目(0-9622)
作者简介:吕雪莹(1972年生),女,黑龙江省五常县人,硕士,助教。
作者单位:吕雪莹(哈尔滨医科大学免疫教研室)
张凤蕴(哈尔滨医科大学免疫教研室)
, 百拇医药
王丽群(哈尔滨医科大学免疫教研室)
于伟玲(哈尔滨医科大学免疫教研室)
张 莉(哈尔滨医科大学电镜室,哈尔滨 150086)
参考文献
[1]周建年,杨贵贞. 髓磷脂碱蛋白的提取、鉴定及初步应用的研究[J]. 白求恩医科大学学报,1985,11:17-20.
[2]龚志锦,詹榕洲. 病理组织制片和染色技术[M]. 上海:上海科学技术出版社,1993. 114-116.
[3]Knoble RL, Marini JC, Goldowitz D, et al. Distribution of the blood-brain barrier heterotopic brain transplants and its relationship to the lesions of EAE[J]. J Neuropathal Exp Neurol. 1992, 51(1):36-39.
[4]Raine CS. Biology of disease: the analysis of autoimmune demyelination: its impact on multiple sclerosis[J]. Lab Invest, 1984, 50:608-635., http://www.100md.com