带血管鼠膝关节冷冻保存研究
周建生 郑圣鼐 潘功平 胡妆麒 肖玉周 刘振华 王霄光 马强
摘 要:目的:探讨15%DMSO浸泡时间对冷冻保存带血管鼠膝关节生物活性、超微结构的影响。方法:40只SD大鼠带血管膝关节分别在4℃15%DMSO中浸泡0.5、1、1.5、2h,按两步冷冻保存30天后,电镜观察超微结构变化,软骨细胞台盼蓝染色及软骨细胞3H-TdR掺入率测定软骨细胞存活率及细胞活性。结果:电镜下1h组、1.5h组血管内皮细胞改变轻微;0.5h组、2h组内皮细胞超微结构损伤严重。1.5h组软骨细胞存活率及细胞活性高于其余冷冻组(P<0.01)。结论:带血管鼠膝关节在4℃15%DMSO中浸泡1.5h后两步冷冻保存效果良好。
关键词:膝关节 带血管关节 冷冻保存 浸泡时间 SD大鼠
, 百拇医药
带血管膝关节作为一复合组织,其冷冻保存后的生物活性受到诸多因素的影响。我们曾对血管、骨、软骨等组织,从冷冻温度值、冷冻维持时限、降温速度、低温保护剂浓度等方面进行了研究[1~3]。本文综合以前的研究结果,设计了带血管膝关节冷冻保存的方案,着重观察15%二甲基亚砜(DMSO)浸泡时间对SD大鼠带血管膝关节冷冻保存后生物活性、超微结构的影响。
1 材料和方法
1.1 动物准备
SD大鼠50只(中国科学院上海实验动物中心提供),体重200~300g,戊巴比妥钠(30mg/kg)腹腔内注射麻醉后,无菌操作下分离股动、静脉,自膝关节上、下各1 cm处截断股骨、胫、腓骨,于腹股沟处切断股动、静脉,用肝素生理盐水冲洗血管管腔。随机分为5组,每组10个关节,对照组不作冷冻处理,各实验组关节放入盛有15%DMSO冷冻管中,分别在4℃冰箱中留置0.5、1.0、1.5、2.0h,再放入超低温冰箱(Sanyo MDF-291AT型)中,以1℃/ min速度降温至-60℃,维持1h后投入-196℃液氮中保存30d。检测前冷冻标本采用37℃水浴复温,PBS漂洗血管腔3次。
, 百拇医药
1.2 标本观察
1.2.1 组织形态学观察 分别切取血管和关节软骨组织块,光镜标本作HE染色。电镜标本制作后日立500型透射电镜下观察血管内皮细胞超微结构变化和软骨细胞超微结构及基质的变化。
1.2.2 软骨细胞台盼蓝染色 将关节软骨剪成1 mm×1 mm×1 mm小块,接种在6孔培养板各孔中,加入1640培养液(内含1640培养基,1%丙酮酸钠,2 mmol谷氨酰胺,10%胎牛血清,100u青霉素/mL,100μg链霉素/mL),再加入终浓度为0.1%梭状芽胞杆菌胶原酶,置37℃,5%CO2培养箱中16小时后取出。将消化得到的细胞悬液离心后,吸去上清液,用PBS漂洗离心3次,吸去PBS加入1640培养液后用吸管吹打,使细胞垂悬于1640培养液中,吸取9滴细胞悬液加入1滴台盼蓝溶液,于4℃冰箱中静置20 min,血球计数板下观察计数。其中蓝染的为死亡细胞,透明者为活细胞,计数1000个细胞。
, http://www.100md.com
1.2.3 软骨细胞3H-TdR掺入率测定 将上述各组细胞悬液配制成细胞终浓度为1×106/mL,接种至96孔培养板,每孔200μL,置37℃,5%CO2培养箱中培养。96h后加入终浓度为2μci/mL的3H-TdR,继续培养24h,取出后加入终浓度为5mg/mL的木瓜蛋白酶,然后将培养箱温度调至60℃,放置5h后以多头细胞收集器将细胞抽滤到滤膜上,5%TCA淋膜,烘干后在液体闪烁计数器上计数。
1.3 统计学处理
软骨细胞台盼蓝染色细胞存活率作X列分割χ2检验。软骨细胞3H-TdR掺入率作方差分析q检验。
2 结果
2.1 组织形态学改变
, http://www.100md.com
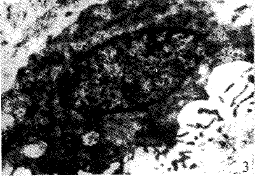
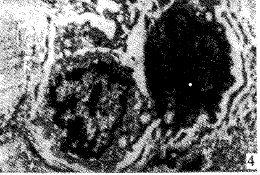
光镜下1h组及1.5h组血管内皮细胞保持连续性,偶见内皮脱失。0.5h及2h组内皮细胞连续性中断、广泛脱失。冷冻各组软骨细胞光镜下未见明显差异。透射电镜下,1h组及1.5h组,内皮细胞连接紧密,细胞核轻度变形,胞膜、核膜完整无皱缩,染色体轻微边聚,内质网、线粒体轻度肿胀,线粒体嵴可辨认(图1)。0.5h及2h组内皮细胞核膜破裂,内质网、线粒体高度肿胀、溶解,泡浆中大量空泡(图2)。冷冻各组软骨细胞超微结构均有不同程度改变,其中1.5h组改变轻微,细胞膜完整,内质网、线粒体轻度肿胀,线粒体嵴可辩认(图3)。其余各冷冻组软骨细胞胞膜破裂,线粒体、内质网高度肿胀,胞浆内出现空泡,染色质边聚严重(图4)。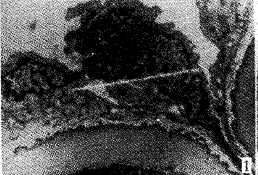

, 百拇医药
图1 1.5h组动脉血管超微结构(TEM×12000) 图2 2.0h组静脉血管超微结构(TEM×10000)
图3 1.5h组软骨细胞超微结构(TEM×16000) 图4 0.5h组软骨细胞超微结构(TEM×12000)
2.2 台盼蓝染色软骨细胞存活率
新鲜对照组90%,0.5h组24%,1h组30%,1.5h组60%,2h组19%。各冷冻组与新鲜对照组比较,软骨细胞存活率均降低(P<0.01)。各冷冻组之间比较,1.5h软骨细胞存活率高于其它各冷冻组(P<0.01或P<0.05)。
2.3 软骨细胞3H-TdR掺入率
结果见附表。
附表 不同浸泡时间对软骨冷冻保存后3H-TdR掺入率影响
, http://www.100md.com
组别
n
3H-TdR(X±s)
P
对照组
10
4632.8±309.9
-
-
-
-
1.5h组
10
, http://www.100md.com
2629.3±146.7
<0.01
-
-
-
1h组
10
1328.0±80.5
<0.01
<0.01
-
-
0.5g组
, http://www.100md.com
10
921.0±43.9
<0.01
<0.01
<0.01
-
2h组
10
456.7±34.5
0.01
0.01
0.01
0.01
, 百拇医药
3 讨论
3.1 带血管膝关节冷冻保存方法设计
由于不同组织最佳降温速度不同,DMSO在不同的组织中穿透速度不同,不同的组织对DMSO毒性耐受程度不同,因而选择一种同时适合于带血管膝关节这一复合组织的冷冻保存条件有一定的困难。我们曾经将血管组织的冷冻保存方法应用于带血管的同种异体骨保存取得成功[4],但同一方法应用于关节软骨保存并不理想。据分析这可能是由于软骨基质对DMSO的穿透速度产生影响,使其不能充分进入软骨细胞产生有效的冷冻保护作用。因此本实验设计了以15%DMSO作为冷冻保护剂,变换其浸泡时间(0.5、 1.0、 1.5、 2.0 h)的两步冷冻保存方法,以寻求对血管、软骨均适宜的冷冻保存方法。
3.2 DMSO浸泡时间对血管冷冻保存的影响
本实验结果表明:血管冷冻保存的效果,随其在15%DMSO中浸泡时间的延长而发生变化,至浸泡1h时达到最佳保存效果,将浸泡时间延长至1.5 h,效果依然良好,而延长至2 h时,其保存效果明显降低,与浸泡0.5 h结果相近。上述结果表明:当浸泡时间为0.5 h,DMSO未能在细胞内外达到渗透平衡;1 h达到渗透平衡,发挥有效的冷冻保护作用;1.5 h虽然延长了浸泡时间,尚未超出细胞耐受范围;而2 h DMSO的毒性作用增加,影响保存效果。
, http://www.100md.com
3.3 DMSO浸泡时间对软骨块冷冻保存的影响
虽然游离软骨细胞冷冻保存存活率高达90%,但软骨块冷冻保存的效果却不理想,文献中报道软骨细胞存活率20%~50%[5,6]。这一方面与软骨基质对DMSO的渗透屏障有关,另一方面软骨基质富含水分,冷冻时可引起细胞外冰晶形成,进而导致细胞内水份外流,产生溶质效应,造成细胞损伤。本实验通过适当延长DMSO浸泡时间,获得了较好的保存效果,这与DMSO能够在细胞内外充分达到渗透平衡有关。当进一步延长浸泡时间至2 h,对于较早达到DMSO渗透平衡的浅层软骨细胞,DMSO的毒性作用对其造成了损伤,使得冷冻保存的效果反而下降。
作者单位:周建生(233004 蚌埠市 蚌埠医学院附属医院骨科)
郑圣鼐(233004 蚌埠市 蚌埠医学院附属医院骨科)
潘功平(233004 蚌埠市 蚌埠医学院附属医院骨科)
, 百拇医药
胡妆麒(233004 蚌埠市 蚌埠医学院附属医院骨科)
肖玉周(233004 蚌埠市 蚌埠医学院附属医院骨科)
刘振华(233004 蚌埠市 蚌埠医学院附属医院骨科)
王霄光(233004 蚌埠市 蚌埠医学院附属医院骨科)
马强(233004 蚌埠市 蚌埠医学院附属医院骨科)
参考文献
1,周建生,胡汝麒,潘功平,等.降温速度对冷冻保存异体小静脉通畅率的影响.广东解剖学通报,1998,20(2):13
2,周建生,胡汝麒,潘功平,等.吻合血管的同种异体肋骨移植实验研究.中国修复重建外科杂志,1996,10(4):210
, 百拇医药
3,周建生,胡汝麒,潘功平,等.同种异体动脉冷冻维持温度值的实验研究.中华显微外科杂志,1999,22(2):125
4,周建生,胡汝麒,潘功平,等.冷冻保存带血管异体骨移植治疗儿童骨缺损.中华显微外科杂志,1998,21(3):183
5,Tomford WW,Mankin HJ.Experimental freeze preservation of chondrocytes.Clin Orthop,1985,197(7、8):11
6,Muldrew K,Hurting M.Localization of freeaing injury in articular cartilage.Crgobiology,1994,31:38, http://www.100md.com
摘 要:目的:探讨15%DMSO浸泡时间对冷冻保存带血管鼠膝关节生物活性、超微结构的影响。方法:40只SD大鼠带血管膝关节分别在4℃15%DMSO中浸泡0.5、1、1.5、2h,按两步冷冻保存30天后,电镜观察超微结构变化,软骨细胞台盼蓝染色及软骨细胞3H-TdR掺入率测定软骨细胞存活率及细胞活性。结果:电镜下1h组、1.5h组血管内皮细胞改变轻微;0.5h组、2h组内皮细胞超微结构损伤严重。1.5h组软骨细胞存活率及细胞活性高于其余冷冻组(P<0.01)。结论:带血管鼠膝关节在4℃15%DMSO中浸泡1.5h后两步冷冻保存效果良好。
关键词:膝关节 带血管关节 冷冻保存 浸泡时间 SD大鼠
, 百拇医药
带血管膝关节作为一复合组织,其冷冻保存后的生物活性受到诸多因素的影响。我们曾对血管、骨、软骨等组织,从冷冻温度值、冷冻维持时限、降温速度、低温保护剂浓度等方面进行了研究[1~3]。本文综合以前的研究结果,设计了带血管膝关节冷冻保存的方案,着重观察15%二甲基亚砜(DMSO)浸泡时间对SD大鼠带血管膝关节冷冻保存后生物活性、超微结构的影响。
1 材料和方法
1.1 动物准备
SD大鼠50只(中国科学院上海实验动物中心提供),体重200~300g,戊巴比妥钠(30mg/kg)腹腔内注射麻醉后,无菌操作下分离股动、静脉,自膝关节上、下各1 cm处截断股骨、胫、腓骨,于腹股沟处切断股动、静脉,用肝素生理盐水冲洗血管管腔。随机分为5组,每组10个关节,对照组不作冷冻处理,各实验组关节放入盛有15%DMSO冷冻管中,分别在4℃冰箱中留置0.5、1.0、1.5、2.0h,再放入超低温冰箱(Sanyo MDF-291AT型)中,以1℃/ min速度降温至-60℃,维持1h后投入-196℃液氮中保存30d。检测前冷冻标本采用37℃水浴复温,PBS漂洗血管腔3次。
, 百拇医药
1.2 标本观察
1.2.1 组织形态学观察 分别切取血管和关节软骨组织块,光镜标本作HE染色。电镜标本制作后日立500型透射电镜下观察血管内皮细胞超微结构变化和软骨细胞超微结构及基质的变化。
1.2.2 软骨细胞台盼蓝染色 将关节软骨剪成1 mm×1 mm×1 mm小块,接种在6孔培养板各孔中,加入1640培养液(内含1640培养基,1%丙酮酸钠,2 mmol谷氨酰胺,10%胎牛血清,100u青霉素/mL,100μg链霉素/mL),再加入终浓度为0.1%梭状芽胞杆菌胶原酶,置37℃,5%CO2培养箱中16小时后取出。将消化得到的细胞悬液离心后,吸去上清液,用PBS漂洗离心3次,吸去PBS加入1640培养液后用吸管吹打,使细胞垂悬于1640培养液中,吸取9滴细胞悬液加入1滴台盼蓝溶液,于4℃冰箱中静置20 min,血球计数板下观察计数。其中蓝染的为死亡细胞,透明者为活细胞,计数1000个细胞。
, http://www.100md.com
1.2.3 软骨细胞3H-TdR掺入率测定 将上述各组细胞悬液配制成细胞终浓度为1×106/mL,接种至96孔培养板,每孔200μL,置37℃,5%CO2培养箱中培养。96h后加入终浓度为2μci/mL的3H-TdR,继续培养24h,取出后加入终浓度为5mg/mL的木瓜蛋白酶,然后将培养箱温度调至60℃,放置5h后以多头细胞收集器将细胞抽滤到滤膜上,5%TCA淋膜,烘干后在液体闪烁计数器上计数。
1.3 统计学处理
软骨细胞台盼蓝染色细胞存活率作X列分割χ2检验。软骨细胞3H-TdR掺入率作方差分析q检验。
2 结果
2.1 组织形态学改变
, http://www.100md.com
光镜下1h组及1.5h组血管内皮细胞保持连续性,偶见内皮脱失。0.5h及2h组内皮细胞连续性中断、广泛脱失。冷冻各组软骨细胞光镜下未见明显差异。透射电镜下,1h组及1.5h组,内皮细胞连接紧密,细胞核轻度变形,胞膜、核膜完整无皱缩,染色体轻微边聚,内质网、线粒体轻度肿胀,线粒体嵴可辨认(图1)。0.5h及2h组内皮细胞核膜破裂,内质网、线粒体高度肿胀、溶解,泡浆中大量空泡(图2)。冷冻各组软骨细胞超微结构均有不同程度改变,其中1.5h组改变轻微,细胞膜完整,内质网、线粒体轻度肿胀,线粒体嵴可辩认(图3)。其余各冷冻组软骨细胞胞膜破裂,线粒体、内质网高度肿胀,胞浆内出现空泡,染色质边聚严重(图4)。




, 百拇医药
图1 1.5h组动脉血管超微结构(TEM×12000) 图2 2.0h组静脉血管超微结构(TEM×10000)
图3 1.5h组软骨细胞超微结构(TEM×16000) 图4 0.5h组软骨细胞超微结构(TEM×12000)
2.2 台盼蓝染色软骨细胞存活率
新鲜对照组90%,0.5h组24%,1h组30%,1.5h组60%,2h组19%。各冷冻组与新鲜对照组比较,软骨细胞存活率均降低(P<0.01)。各冷冻组之间比较,1.5h软骨细胞存活率高于其它各冷冻组(P<0.01或P<0.05)。
2.3 软骨细胞3H-TdR掺入率
结果见附表。
附表 不同浸泡时间对软骨冷冻保存后3H-TdR掺入率影响
, http://www.100md.com
组别
n
3H-TdR(X±s)
P
对照组
10
4632.8±309.9
-
-
-
-
1.5h组
10
, http://www.100md.com
2629.3±146.7
<0.01
-
-
-
1h组
10
1328.0±80.5
<0.01
<0.01
-
-
0.5g组
, http://www.100md.com
10
921.0±43.9
<0.01
<0.01
<0.01
-
2h组
10
456.7±34.5
0.01
0.01
0.01
0.01
, 百拇医药
3 讨论
3.1 带血管膝关节冷冻保存方法设计
由于不同组织最佳降温速度不同,DMSO在不同的组织中穿透速度不同,不同的组织对DMSO毒性耐受程度不同,因而选择一种同时适合于带血管膝关节这一复合组织的冷冻保存条件有一定的困难。我们曾经将血管组织的冷冻保存方法应用于带血管的同种异体骨保存取得成功[4],但同一方法应用于关节软骨保存并不理想。据分析这可能是由于软骨基质对DMSO的穿透速度产生影响,使其不能充分进入软骨细胞产生有效的冷冻保护作用。因此本实验设计了以15%DMSO作为冷冻保护剂,变换其浸泡时间(0.5、 1.0、 1.5、 2.0 h)的两步冷冻保存方法,以寻求对血管、软骨均适宜的冷冻保存方法。
3.2 DMSO浸泡时间对血管冷冻保存的影响
本实验结果表明:血管冷冻保存的效果,随其在15%DMSO中浸泡时间的延长而发生变化,至浸泡1h时达到最佳保存效果,将浸泡时间延长至1.5 h,效果依然良好,而延长至2 h时,其保存效果明显降低,与浸泡0.5 h结果相近。上述结果表明:当浸泡时间为0.5 h,DMSO未能在细胞内外达到渗透平衡;1 h达到渗透平衡,发挥有效的冷冻保护作用;1.5 h虽然延长了浸泡时间,尚未超出细胞耐受范围;而2 h DMSO的毒性作用增加,影响保存效果。
, http://www.100md.com
3.3 DMSO浸泡时间对软骨块冷冻保存的影响
虽然游离软骨细胞冷冻保存存活率高达90%,但软骨块冷冻保存的效果却不理想,文献中报道软骨细胞存活率20%~50%[5,6]。这一方面与软骨基质对DMSO的渗透屏障有关,另一方面软骨基质富含水分,冷冻时可引起细胞外冰晶形成,进而导致细胞内水份外流,产生溶质效应,造成细胞损伤。本实验通过适当延长DMSO浸泡时间,获得了较好的保存效果,这与DMSO能够在细胞内外充分达到渗透平衡有关。当进一步延长浸泡时间至2 h,对于较早达到DMSO渗透平衡的浅层软骨细胞,DMSO的毒性作用对其造成了损伤,使得冷冻保存的效果反而下降。
作者单位:周建生(233004 蚌埠市 蚌埠医学院附属医院骨科)
郑圣鼐(233004 蚌埠市 蚌埠医学院附属医院骨科)
潘功平(233004 蚌埠市 蚌埠医学院附属医院骨科)
, 百拇医药
胡妆麒(233004 蚌埠市 蚌埠医学院附属医院骨科)
肖玉周(233004 蚌埠市 蚌埠医学院附属医院骨科)
刘振华(233004 蚌埠市 蚌埠医学院附属医院骨科)
王霄光(233004 蚌埠市 蚌埠医学院附属医院骨科)
马强(233004 蚌埠市 蚌埠医学院附属医院骨科)
参考文献
1,周建生,胡汝麒,潘功平,等.降温速度对冷冻保存异体小静脉通畅率的影响.广东解剖学通报,1998,20(2):13
2,周建生,胡汝麒,潘功平,等.吻合血管的同种异体肋骨移植实验研究.中国修复重建外科杂志,1996,10(4):210
, 百拇医药
3,周建生,胡汝麒,潘功平,等.同种异体动脉冷冻维持温度值的实验研究.中华显微外科杂志,1999,22(2):125
4,周建生,胡汝麒,潘功平,等.冷冻保存带血管异体骨移植治疗儿童骨缺损.中华显微外科杂志,1998,21(3):183
5,Tomford WW,Mankin HJ.Experimental freeze preservation of chondrocytes.Clin Orthop,1985,197(7、8):11
6,Muldrew K,Hurting M.Localization of freeaing injury in articular cartilage.Crgobiology,1994,31:38, http://www.100md.com