三氧化二砷对HL-60细胞及NB4细胞端粒酶活性的调节
作者:陈峰 徐功立 李英 张茂宏
单位:陈峰(250012 济南,山东医科大学附属医院血液科);徐功立(山东省立医院血液科);李英(山东省立医院血液科);张茂宏(250012 济南,山东医科大学附属医院血液科)
关键词:砷剂;端粒,末端转移酶;白血病,粒细胞,急性;细胞分化;细胞凋亡
中华血液学杂志000708 【摘要】 目的 了解三氧化二砷(As2O3)对HL-60细胞及NB4细胞端粒酶活性的调节作用。方法 利用透射电镜、流式细胞仪、半定量端粒重复扩增-银染色等手段,检测细胞的分化、凋亡,bcl-2表达及端粒酶活性。结果 低浓度As2O3对HL-60及NB4细胞的诱导分化作用不及全反式维甲酸(ATRA),但对其端粒酶活性的下调作用却比ATRA强烈和迅速。较高浓度As2O3在有效诱导两种细胞凋亡过程中,伴随端粒酶活性更迅速的下调,同时bcl-2表达水平也显著下降。As2O3及ATRA对端粒酶活性均无直接的抑制作用。结论 低浓度As2O3对HL-60细胞及NB4细胞端粒酶活性的下调是分化和凋亡作用的叠加。白血病细胞的凋亡与其端粒酶活性调节之间存在相似或相关的调控体系,其中bcl-2可能起着重要作用。
, 百拇医药
Regulation of telomerase activity in HL-60 and NB4 cells by arsenic trioxide
CHEN Feng, XU Gongli, LI Ying, et al.
(Department of Hematology, Affiliated Hospital of Shandong Medical University, Jinan 250012,China)
【Abstract】 Objective To investigate the regulation of telomerase activity in HL-60 and NB4 cells exposed to arsenic trioxide (As2O3). Methods Cell morphology, intracellular DNA distribution, bcl-2 expression and telomerase activity were evaluated in HL-60 and NB4 cells exposed to As2O3 or ATRA. Results The differentiation induction of HL-60 and NB4 cells by low concentration of As2O3 was weaker than that by ATRA, but downregulation effect of As2O3 on telomerase activity was more strong and quick. Higher concentration of As2O3 induced apoptosis in HL-60 or NB4 cells accompanied by more rapid down regulation of telomerase activity and bcl-2 expression. Neither As2O3 nor ATRA showed direct inhibition effect on telomerase activity. Conclusion The downregulation of telomerase activity by low concentration of As2O3 in HL-60 and NB4 cells is the result of overlap of differentiation and apoptosis. There are similar mechanisms in the regulation of telomerase activity and apoptosis in different leukemia cells. Bcl-2 may play an important role in these mechanisms.
, 百拇医药
【Key words】 Arsenicals; Telomere, terminal transferase; Leukemia, myeloblastic, acute; Cell differentiation; Apoptosis
近年来提出的端粒-端粒酶假说认为端粒酶的活化是绝大多数肿瘤发生的终末共同通路[1]。1995年Sharma等[2]首次报道白血病细胞的诱导分化与其端粒酶活性调节之间存在密切联系。细胞凋亡与端粒酶活性之间是否存在某种联系,迄今仍罕见报道。近年来,三氧化二砷(As2O3)对白血病的治疗作用已引起广泛关注,该药物通过诱导白血病细胞分化及凋亡两条途径发挥其治疗作用[3]。我们选择人白血病细胞株HL-60及NB4细胞为模型,就As2O3诱导分化及凋亡时对其端粒酶活性的影响及作用机制进行了初步的探讨。
, 百拇医药
材料和方法
1 制剂 As2O3(Sigma公司产品)以1ml 生理盐水溶解后,用RPMI 1640配制成浓度为10-3mol/L的储存液。全反式维甲酸(ATRA,Sigma公司产品)以无水乙醇配制成浓度为10-2mol/L的储存液。使用前稀释至所需浓度。
2 细胞培养 HL-60细胞为本室冻存,NB4细胞引自上海第二医科大学、上海血液学研究所。二者均以2×105/ml 的浓度接种于含或不含上述药物的新鲜RPMI 1640培养液(内含体积分数为10%的小牛血清、100U/ml青霉素、10μg/ml链霉素)中常规培养。实验时,收集细胞,锥虫蓝(台盼蓝)拒染法计数活细胞。
3 细胞形态观察 收集细胞并滴片,干燥后经Wright-Giemsa染色,光镜下观察。同时取上述细胞1×106个,磷酸缓冲液(PBS)洗涤后,按常规电镜样品制备程序切片,透射电镜下观察。
, 百拇医药
4 细胞表面分化抗原检测 取1×106细胞,PBS洗涤后加入20μl鼠抗人CD11b-PE或CD33-FITC单克隆抗体(PharMingen公司产品),室温下避光孵育30min,PBS洗涤,弃上清,加入0.5ml PBS悬浮细胞,流式细胞仪(BD公司产品)测定,以IgG1-FITC作为阴性对照。
5 流式细胞仪检测细胞DNA含量分布 用PBS洗涤细胞2次,加入体积分数为70%的冷乙醇固定24h(4℃)。洗涤细胞,与含10μg/ml RNA酶的Tris-盐酸缓冲液(pH7.4)共同孵育(37℃)30min。然后用碘化丙锭(50μg/ml)进行细胞DNA染色。用流式细胞仪分析细胞DNA含量分布。资料均经ModFitLT软件收集、储存和分析。
6 bcl-2检测 取细胞1×106,PBS洗涤后加鼠抗人bcl-2-FITC 20μl,室温下避光孵育30min,PBS洗涤,弃上清,加0.5ml PBS悬浮细胞,用流式细胞仪测定。资料均经CELLQuest软件收集、储存和分析。
, 百拇医药
7 端粒酶活性检测及半定量分析 采用端粒重复扩增(TRAP)-银染色。由山东医科大学遗传学教研室提供端粒酶活性检测试剂盒,按说明书操作并加以改进。每次实验均取2000个细胞参加TRAP反应(此时Taq酶活性不受抑制且电泳图像也比较理想),每组实验均同时设阳性对照(未经药物处理的HL-60或NB4细胞)及阴性对照(灭活RNA酶)各一,并重复实验4次。电泳结果均经Smart View生物电泳图像分析系统(上海复日科技有限公司产品)扫描并存储图像。因端粒酶活性的强弱表现为间隔6bp梯状条带数目及辉度的不同,故我们采用各泳道的辉度减去阴性对照的辉度后,与阳性对照的辉度(其活性设为100)相比较,所得的比值作为端粒酶活性的相对值。
8 统计学分析 双变量相关性研究采用多因素分析的对数曲线拟合法,两两比较采用t检验。
结果
1 As2O3与ATRA对HL-60及NB4细胞的诱导分化及对其端粒酶活性调节作用的比较 1.0μmol/L As2O3对HL-60细胞具有一定的诱导分化作用,表现为细胞核缩小,染色质浓缩,胞浆嗜碱性减弱,细胞表面分化抗原CD11b逐渐上升而CD33下降。但相同浓度的As2O3对HL-60细胞诱导分化作用的强度不如ATRA,成熟细胞形态出现较晚且比例相对较少,CD11b及CD33的调变幅度也不及ATRA。0.1μmol/L As2O3对NB4细胞也具有一定的诱导分化作用,其细胞形态及表面分化抗原的调变作用类似HL-60细胞,与相同浓度ATRA相比,As2O3对NB4细胞的诱导分化作用强度及细胞表面分化抗原的调变幅度亦不如ATRA。
, 百拇医药
As2O3诱导两种细胞分化过程中也伴随端粒酶活性的下调,作用24h时酶活性已显著受抑,48h基本变为阴性。相同浓度的ATRA作用于两种细胞后,24h端粒酶活性仅略有下降,48~72h显著下降,96~144h基本变为阴性(图1,2)。
图1 As2O3与ATRA对HL-60细胞端粒酶活性调节作用的比较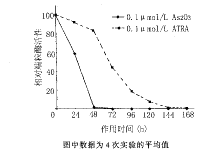
图2 As2O3与ATRA对NB4细胞端粒酶活性调节作用的比较
2 ATRA作用后相对端粒酶活性与细胞分化比例的相关性分析 以CD11b表达率代表细胞分化比例,绘制散点图,发现相对端粒酶活性(Y)与CD11b表达率(X)呈对数相关关系。通过最小二乘法求得其拟合对数曲线方程,HL-60细胞为Y=0.46-49.32 lgX,NB4细胞为 Y=2.00-44.79 lgX。
, 百拇医药
3 As2O3对HL-60及NB4细胞的诱导凋亡作用及对其端粒酶活性的调节作用 5.0μmol/L As2O3对HL-60细胞,1.0μmol/L As2O3对NB4细胞均具有显著的诱导凋亡作用,药物作用24h即呈现典型的凋亡形态学改变。流式细胞仪分析DNA含量分布,显示典型的凋亡细胞群,即出现DNA含量明显低于G1期的亚G1期细胞峰。
As2O3诱导两种细胞凋亡的同时伴随端粒酶活性下调,作用8~12h酶活性即显著受抑,20~24h基本变为阴性(图3,4)。
图3 5.0μmol/L As2O3诱导HL-60细胞凋亡时的端粒酶活性
, 百拇医药
图4 1.0μmol/L As2O3诱导NB4细胞凋亡时的端粒酶活性
4 bcl-2表达水平的变化 HL-60及NB4细胞均呈现较高水平的bcl-2表达,As2O3作用12h bcl-2表达开始明显下降,随作用时间的延长,其表达水平愈加降低。
5 ATRA对端粒酶提取液的直接作用 0.5~5.0μmol/L As2O3直接作用于HL-60或NB4细胞端粒酶裂解液,TRAP反应结果显示端粒酶活性与阳性对照相比,差异无显著性。
讨论
近年来,砷剂用于治疗白血病,尤其急性早幼粒细胞白血病取得满意效果。研究证实,As2O3对白血病细胞具有双重作用:低浓度可诱导其分化,较高浓度则诱导其凋亡[3],其具体作用机制目前尚不清楚。我们的实验结果表明,无论在诱导分化还是诱导凋亡过程中,As2O3均能显著下调HL-60及NB4细胞的端粒酶活性。因此,抑制端粒酶活性表达可能是As2O3治疗白血病的分子机制之一。通过对ATRA作用后,相对端粒酶活性与细胞分化比例的相关性分析,发现二者之间呈对数相关关系,随细胞分化比例的升高,端粒酶活性不断下降。As2O3对两种细胞的诱导分化作用弱于ATRA,但其对端粒酶活性的下调作用却更强,提示存在分化作用之外的机制在发挥效应。相应浓度的As2O3与端粒酶提取液直接作用后酶活性无显著变化,表明这一机制是由细胞介导的,而非药物与端粒酶之间简单的生化或化学抑制性反应。
, 百拇医药
我们推测上述“分化作用之外的机制”是凋亡。因为实验中发现,As2O3对HL-60及NB4细胞的诱导分化往往伴随凋亡的发生。相同浓度的As2O3与ATRA作用相同时间后,前者的细胞凋亡百分率高于后者[3,4]。为验证这一假设,我们进一步对As2O3诱导两种细胞凋亡过程中的端粒酶活性进行检测,结果表明As2O3作用24h后端粒酶活性已基本变为阴性。这一抑制作用的强度和速度不仅远大于ATRA,而且也大于低浓度As2O3对端粒酶活性的下调。据此我们认为,低浓度As2O3对两种细胞端粒酶活性的下调作用不仅仅是源于诱导分化,而是分化作用和凋亡作用的叠加。因此,尽管同样是由细胞介导的端粒酶活性抑制作用,但As2O3与ATRA的作用机制并不完全相同。
, http://www.100md.com
研究中我们还发现As2O3诱导两种细胞凋亡过程中,端粒酶活性受抑的同时伴随bcl-2蛋白表达水平的下降。国外亦有报道p53、bcl-2及c-myc等细胞凋亡通路中的一些调节基因同时具有调控端粒酶活性的作用[5-8],提示上述因子很可能是细胞凋亡与端粒酶活性调节之间的联系纽带。
参 考 文 献
1,Dahse R, Fiedler W, Ernst G. Telomere and telomerase: biological and clinical importance.Clin Chem,1997,43:708-714.
2,Sharma HW, Sokoloski JA, Perez JR, et al. Differentiation of immortal cells inhibits telomerase activity. Proc Natl Acad Sci U S A,1995,92:12343-12346.
, 百拇医药
3,唐 ,陈国强,史桂英,等. 三氧化二砷对急性早幼粒细胞白血病细胞株的双重效应研究. 中华医学杂志,1997,77:509-512.
,陈国强,史桂英,等. 三氧化二砷对急性早幼粒细胞白血病细胞株的双重效应研究. 中华医学杂志,1997,77:509-512.
4,唐 ,陈国强,沈志祥,等. 氧化砷诱导早幼粒细胞白血病细胞凋亡的体外研究. 中华血液学杂志,1997,18:623-626.
,陈国强,沈志祥,等. 氧化砷诱导早幼粒细胞白血病细胞凋亡的体外研究. 中华血液学杂志,1997,18:623-626.
5,Gollahon L, Shay JW. Immortalization of human mammary epithelial cells transfected with mutant p53 (273his). Oncogene, 1996,12:715-725.
6,Mandal M, Kumar R. Bcl-2 modulates telomerase activity. J Biol Chem, 1997,272:14183-14187.
, http://www.100md.com
7,Fujimoto K, Takahashi M. Telomerase activity in human leukemic cell lines is inhibited by antisense pentadecadeoxynucleotides targeted against c-myc mRNA. Biochem Biophys Res Commun,1997,241:775-781.
8,Wang J, Xie LY, Allan S, et al. Myc activates telomerase. Genes Dev, 1998, 12:1769-1774.
(收稿日期:1999-10-25), http://www.100md.com
单位:陈峰(250012 济南,山东医科大学附属医院血液科);徐功立(山东省立医院血液科);李英(山东省立医院血液科);张茂宏(250012 济南,山东医科大学附属医院血液科)
关键词:砷剂;端粒,末端转移酶;白血病,粒细胞,急性;细胞分化;细胞凋亡
中华血液学杂志000708 【摘要】 目的 了解三氧化二砷(As2O3)对HL-60细胞及NB4细胞端粒酶活性的调节作用。方法 利用透射电镜、流式细胞仪、半定量端粒重复扩增-银染色等手段,检测细胞的分化、凋亡,bcl-2表达及端粒酶活性。结果 低浓度As2O3对HL-60及NB4细胞的诱导分化作用不及全反式维甲酸(ATRA),但对其端粒酶活性的下调作用却比ATRA强烈和迅速。较高浓度As2O3在有效诱导两种细胞凋亡过程中,伴随端粒酶活性更迅速的下调,同时bcl-2表达水平也显著下降。As2O3及ATRA对端粒酶活性均无直接的抑制作用。结论 低浓度As2O3对HL-60细胞及NB4细胞端粒酶活性的下调是分化和凋亡作用的叠加。白血病细胞的凋亡与其端粒酶活性调节之间存在相似或相关的调控体系,其中bcl-2可能起着重要作用。
, 百拇医药
Regulation of telomerase activity in HL-60 and NB4 cells by arsenic trioxide
CHEN Feng, XU Gongli, LI Ying, et al.
(Department of Hematology, Affiliated Hospital of Shandong Medical University, Jinan 250012,China)
【Abstract】 Objective To investigate the regulation of telomerase activity in HL-60 and NB4 cells exposed to arsenic trioxide (As2O3). Methods Cell morphology, intracellular DNA distribution, bcl-2 expression and telomerase activity were evaluated in HL-60 and NB4 cells exposed to As2O3 or ATRA. Results The differentiation induction of HL-60 and NB4 cells by low concentration of As2O3 was weaker than that by ATRA, but downregulation effect of As2O3 on telomerase activity was more strong and quick. Higher concentration of As2O3 induced apoptosis in HL-60 or NB4 cells accompanied by more rapid down regulation of telomerase activity and bcl-2 expression. Neither As2O3 nor ATRA showed direct inhibition effect on telomerase activity. Conclusion The downregulation of telomerase activity by low concentration of As2O3 in HL-60 and NB4 cells is the result of overlap of differentiation and apoptosis. There are similar mechanisms in the regulation of telomerase activity and apoptosis in different leukemia cells. Bcl-2 may play an important role in these mechanisms.
, 百拇医药
【Key words】 Arsenicals; Telomere, terminal transferase; Leukemia, myeloblastic, acute; Cell differentiation; Apoptosis
近年来提出的端粒-端粒酶假说认为端粒酶的活化是绝大多数肿瘤发生的终末共同通路[1]。1995年Sharma等[2]首次报道白血病细胞的诱导分化与其端粒酶活性调节之间存在密切联系。细胞凋亡与端粒酶活性之间是否存在某种联系,迄今仍罕见报道。近年来,三氧化二砷(As2O3)对白血病的治疗作用已引起广泛关注,该药物通过诱导白血病细胞分化及凋亡两条途径发挥其治疗作用[3]。我们选择人白血病细胞株HL-60及NB4细胞为模型,就As2O3诱导分化及凋亡时对其端粒酶活性的影响及作用机制进行了初步的探讨。
, 百拇医药
材料和方法
1 制剂 As2O3(Sigma公司产品)以1ml 生理盐水溶解后,用RPMI 1640配制成浓度为10-3mol/L的储存液。全反式维甲酸(ATRA,Sigma公司产品)以无水乙醇配制成浓度为10-2mol/L的储存液。使用前稀释至所需浓度。
2 细胞培养 HL-60细胞为本室冻存,NB4细胞引自上海第二医科大学、上海血液学研究所。二者均以2×105/ml 的浓度接种于含或不含上述药物的新鲜RPMI 1640培养液(内含体积分数为10%的小牛血清、100U/ml青霉素、10μg/ml链霉素)中常规培养。实验时,收集细胞,锥虫蓝(台盼蓝)拒染法计数活细胞。
3 细胞形态观察 收集细胞并滴片,干燥后经Wright-Giemsa染色,光镜下观察。同时取上述细胞1×106个,磷酸缓冲液(PBS)洗涤后,按常规电镜样品制备程序切片,透射电镜下观察。
, 百拇医药
4 细胞表面分化抗原检测 取1×106细胞,PBS洗涤后加入20μl鼠抗人CD11b-PE或CD33-FITC单克隆抗体(PharMingen公司产品),室温下避光孵育30min,PBS洗涤,弃上清,加入0.5ml PBS悬浮细胞,流式细胞仪(BD公司产品)测定,以IgG1-FITC作为阴性对照。
5 流式细胞仪检测细胞DNA含量分布 用PBS洗涤细胞2次,加入体积分数为70%的冷乙醇固定24h(4℃)。洗涤细胞,与含10μg/ml RNA酶的Tris-盐酸缓冲液(pH7.4)共同孵育(37℃)30min。然后用碘化丙锭(50μg/ml)进行细胞DNA染色。用流式细胞仪分析细胞DNA含量分布。资料均经ModFitLT软件收集、储存和分析。
6 bcl-2检测 取细胞1×106,PBS洗涤后加鼠抗人bcl-2-FITC 20μl,室温下避光孵育30min,PBS洗涤,弃上清,加0.5ml PBS悬浮细胞,用流式细胞仪测定。资料均经CELLQuest软件收集、储存和分析。
, 百拇医药
7 端粒酶活性检测及半定量分析 采用端粒重复扩增(TRAP)-银染色。由山东医科大学遗传学教研室提供端粒酶活性检测试剂盒,按说明书操作并加以改进。每次实验均取2000个细胞参加TRAP反应(此时Taq酶活性不受抑制且电泳图像也比较理想),每组实验均同时设阳性对照(未经药物处理的HL-60或NB4细胞)及阴性对照(灭活RNA酶)各一,并重复实验4次。电泳结果均经Smart View生物电泳图像分析系统(上海复日科技有限公司产品)扫描并存储图像。因端粒酶活性的强弱表现为间隔6bp梯状条带数目及辉度的不同,故我们采用各泳道的辉度减去阴性对照的辉度后,与阳性对照的辉度(其活性设为100)相比较,所得的比值作为端粒酶活性的相对值。
8 统计学分析 双变量相关性研究采用多因素分析的对数曲线拟合法,两两比较采用t检验。
结果
1 As2O3与ATRA对HL-60及NB4细胞的诱导分化及对其端粒酶活性调节作用的比较 1.0μmol/L As2O3对HL-60细胞具有一定的诱导分化作用,表现为细胞核缩小,染色质浓缩,胞浆嗜碱性减弱,细胞表面分化抗原CD11b逐渐上升而CD33下降。但相同浓度的As2O3对HL-60细胞诱导分化作用的强度不如ATRA,成熟细胞形态出现较晚且比例相对较少,CD11b及CD33的调变幅度也不及ATRA。0.1μmol/L As2O3对NB4细胞也具有一定的诱导分化作用,其细胞形态及表面分化抗原的调变作用类似HL-60细胞,与相同浓度ATRA相比,As2O3对NB4细胞的诱导分化作用强度及细胞表面分化抗原的调变幅度亦不如ATRA。
, 百拇医药
As2O3诱导两种细胞分化过程中也伴随端粒酶活性的下调,作用24h时酶活性已显著受抑,48h基本变为阴性。相同浓度的ATRA作用于两种细胞后,24h端粒酶活性仅略有下降,48~72h显著下降,96~144h基本变为阴性(图1,2)。

图1 As2O3与ATRA对HL-60细胞端粒酶活性调节作用的比较

图2 As2O3与ATRA对NB4细胞端粒酶活性调节作用的比较
2 ATRA作用后相对端粒酶活性与细胞分化比例的相关性分析 以CD11b表达率代表细胞分化比例,绘制散点图,发现相对端粒酶活性(Y)与CD11b表达率(X)呈对数相关关系。通过最小二乘法求得其拟合对数曲线方程,HL-60细胞为Y=0.46-49.32 lgX,NB4细胞为 Y=2.00-44.79 lgX。
, 百拇医药
3 As2O3对HL-60及NB4细胞的诱导凋亡作用及对其端粒酶活性的调节作用 5.0μmol/L As2O3对HL-60细胞,1.0μmol/L As2O3对NB4细胞均具有显著的诱导凋亡作用,药物作用24h即呈现典型的凋亡形态学改变。流式细胞仪分析DNA含量分布,显示典型的凋亡细胞群,即出现DNA含量明显低于G1期的亚G1期细胞峰。
As2O3诱导两种细胞凋亡的同时伴随端粒酶活性下调,作用8~12h酶活性即显著受抑,20~24h基本变为阴性(图3,4)。

图3 5.0μmol/L As2O3诱导HL-60细胞凋亡时的端粒酶活性

, 百拇医药
图4 1.0μmol/L As2O3诱导NB4细胞凋亡时的端粒酶活性
4 bcl-2表达水平的变化 HL-60及NB4细胞均呈现较高水平的bcl-2表达,As2O3作用12h bcl-2表达开始明显下降,随作用时间的延长,其表达水平愈加降低。
5 ATRA对端粒酶提取液的直接作用 0.5~5.0μmol/L As2O3直接作用于HL-60或NB4细胞端粒酶裂解液,TRAP反应结果显示端粒酶活性与阳性对照相比,差异无显著性。
讨论
近年来,砷剂用于治疗白血病,尤其急性早幼粒细胞白血病取得满意效果。研究证实,As2O3对白血病细胞具有双重作用:低浓度可诱导其分化,较高浓度则诱导其凋亡[3],其具体作用机制目前尚不清楚。我们的实验结果表明,无论在诱导分化还是诱导凋亡过程中,As2O3均能显著下调HL-60及NB4细胞的端粒酶活性。因此,抑制端粒酶活性表达可能是As2O3治疗白血病的分子机制之一。通过对ATRA作用后,相对端粒酶活性与细胞分化比例的相关性分析,发现二者之间呈对数相关关系,随细胞分化比例的升高,端粒酶活性不断下降。As2O3对两种细胞的诱导分化作用弱于ATRA,但其对端粒酶活性的下调作用却更强,提示存在分化作用之外的机制在发挥效应。相应浓度的As2O3与端粒酶提取液直接作用后酶活性无显著变化,表明这一机制是由细胞介导的,而非药物与端粒酶之间简单的生化或化学抑制性反应。
, 百拇医药
我们推测上述“分化作用之外的机制”是凋亡。因为实验中发现,As2O3对HL-60及NB4细胞的诱导分化往往伴随凋亡的发生。相同浓度的As2O3与ATRA作用相同时间后,前者的细胞凋亡百分率高于后者[3,4]。为验证这一假设,我们进一步对As2O3诱导两种细胞凋亡过程中的端粒酶活性进行检测,结果表明As2O3作用24h后端粒酶活性已基本变为阴性。这一抑制作用的强度和速度不仅远大于ATRA,而且也大于低浓度As2O3对端粒酶活性的下调。据此我们认为,低浓度As2O3对两种细胞端粒酶活性的下调作用不仅仅是源于诱导分化,而是分化作用和凋亡作用的叠加。因此,尽管同样是由细胞介导的端粒酶活性抑制作用,但As2O3与ATRA的作用机制并不完全相同。
, http://www.100md.com
研究中我们还发现As2O3诱导两种细胞凋亡过程中,端粒酶活性受抑的同时伴随bcl-2蛋白表达水平的下降。国外亦有报道p53、bcl-2及c-myc等细胞凋亡通路中的一些调节基因同时具有调控端粒酶活性的作用[5-8],提示上述因子很可能是细胞凋亡与端粒酶活性调节之间的联系纽带。
参 考 文 献
1,Dahse R, Fiedler W, Ernst G. Telomere and telomerase: biological and clinical importance.Clin Chem,1997,43:708-714.
2,Sharma HW, Sokoloski JA, Perez JR, et al. Differentiation of immortal cells inhibits telomerase activity. Proc Natl Acad Sci U S A,1995,92:12343-12346.
, 百拇医药
3,唐
 ,陈国强,史桂英,等. 三氧化二砷对急性早幼粒细胞白血病细胞株的双重效应研究. 中华医学杂志,1997,77:509-512.
,陈国强,史桂英,等. 三氧化二砷对急性早幼粒细胞白血病细胞株的双重效应研究. 中华医学杂志,1997,77:509-512.4,唐
 ,陈国强,沈志祥,等. 氧化砷诱导早幼粒细胞白血病细胞凋亡的体外研究. 中华血液学杂志,1997,18:623-626.
,陈国强,沈志祥,等. 氧化砷诱导早幼粒细胞白血病细胞凋亡的体外研究. 中华血液学杂志,1997,18:623-626.5,Gollahon L, Shay JW. Immortalization of human mammary epithelial cells transfected with mutant p53 (273his). Oncogene, 1996,12:715-725.
6,Mandal M, Kumar R. Bcl-2 modulates telomerase activity. J Biol Chem, 1997,272:14183-14187.
, http://www.100md.com
7,Fujimoto K, Takahashi M. Telomerase activity in human leukemic cell lines is inhibited by antisense pentadecadeoxynucleotides targeted against c-myc mRNA. Biochem Biophys Res Commun,1997,241:775-781.
8,Wang J, Xie LY, Allan S, et al. Myc activates telomerase. Genes Dev, 1998, 12:1769-1774.
(收稿日期:1999-10-25), http://www.100md.com