单核细胞趋化蛋白-1在肾毒血清肾炎大鼠肾组织中的表达
作者:张爱华 陈荣华 林娜 黄松明 费莉 郭梅 潘晓勤 蔡毅 邢昌赢
单位:张爱华 陈荣华 林娜 黄松明 费莉 郭梅 潘晓勤 蔡毅(210029 南京医科大学小儿肾脏病研究中心);邢昌赢(南京医科大学第一附属医院肾内科)
关键词:单核细胞趋化蛋白-1;肾毒血清肾炎;巨噬细胞
江苏医药000802 【摘要】 目的 探讨单核细胞趋化蛋白-1(MCP-1)在肾毒血清肾炎大鼠肾组织中的表达及其意义。方法 肾毒血清肾炎应用兔抗鼠肾小球基底膜肾毒血清制备。采用免疫组化及真彩色计算机图像分析系统观察肾小球及肾小管中MCP-1的表达,并分析其与蛋白尿和肾小球细胞数之间的关系。结果 肾毒血清肾炎大鼠出现大量蛋白尿,肾小球细胞数明显增多;肾小球及肾小管中MCP-1表达显著上调,并与肾小球细胞数和蛋白尿密切相关。结论 MCP-1在肾毒血清肾炎发病机制中发挥重要作用。MCP-1的高表达可能是肾毒血清肾炎中巨噬细胞在肾脏局部浸润的重要介导因子。
, 百拇医药
Significance of monocyte chemoattractant protein-1 expression in nephrotoxic sera nephritis in rats
ZHANG Aihua,CHEN Ronghua,LIN Na,et al.
(Center of Pediatric Nephrology,Nanjing Medical University,Nanjing 210029)
【Abstract】 Objective To investigate the expression of monocyte chemoattractant protein-1(MCP-1) and their significance in the nephrotoxic sera nephritis (NTN) in rats.Methods NTN was induced by the tail vein injection of anti-GBM antibody.Immunohistochemical studies and medical imaging analysis system were performed to detect the expression of MCP-1 on formalin-fixed paraffin-embedded samples from rat kidney including control group and NTN rats and its relationship with the proteinuria and macrophage infiltration.Results Rats injected with NTN developed heavy proteinuria and macrophage infiltration in the kidney.Significant up-regulation of MCP-1 expression was observed in the glomerulus and tubular cells in NTN rats,and MCP-1 expression was closely correlated with macrophage infiltration and the proteinuria.Conclusion The MCP-1 may play a pivotal pathogenic role in NTN and may be an important mediator in inducing macrophage infiltration in NTN rat.
, 百拇医药
【Key words】Monocyte chemoattractant protein-1 Nephrotoxic sera nephritis Macrophage
大鼠抗肾小球基底膜肾毒血清性肾炎为一种进行性肾损害模型,伴有肾组织中大量的单核巨噬细胞浸润和新月体形成。浸润的单核巨噬细胞通过分泌多种炎症介质造成肾组织结构的破坏。对于单核巨噬细胞浸润机制目前尚未完全明确。单核细胞趋化蛋白-1(MCP-1)是新近被确认的对单核巨噬细胞具有趋化、激活作用的趋化因子[1]。本研究采用免疫组织化学和真彩色医学图像分析系统观察肾毒血清肾炎大鼠肾小球及肾小管中MCP-1的表达,并分析其与蛋白尿和肾小球细胞数之间的关系,旨在进一步证实MCP-1在肾小球肾炎发病机制中的作用。
材料与方法
一、实验材料
雄性SD大鼠10只,体重180~200 g,购自江苏省实验动物中心。山羊抗鼠MCP-1多克隆抗体及兔抗山羊IgG均为美国SANTACRUZ产品。兔抗鼠肾小球基底膜肾毒血清由本实验室制备。
, 百拇医药
二、方法
1.模型制备:雄性SD大鼠10只,随机分为两组:(1)模型组:尾静脉注射兔抗鼠肾小球基底膜肾毒血清(10 ml/kg体重);(2)正常对照组:尾静脉注射等量生理盐水。所有大鼠于第14天断头处死,处死前一天留取24小时尿检测尿蛋白(UpV),处死后取肾组织检查。
2.免疫组织化学染色:肾组织中MCP-1表达采用免疫组化方法。肾组织标本经10%福尔马林固定,石蜡包埋,切片厚4 μm。应用改良ABC法,免疫组化检测试剂盒购自深圳晶美生物工程有限公司,按说明书操作。阴性对照以PBS代替一抗。每只鼠肾取4张切片。
3.计算机图像分析:应用多媒体彩色病理图文分析系统MPIAS-500(同济医科大学清平影像工程公司产品),通过光学显微镜放大400倍摄取图像,输入图像分析系统内。(1)肾小球中MCP-1表达:每张切片随机选取5个肾小球,计算每个肾小球内抗体染色阳性细胞数,以均值表示每例肾小球中阳性细胞数;(2)皮质区肾小管中MCP-1表达:计算每张切片皮质区50个高倍视野下阳性小管数与总肾小管数的百分数,以均值表示每例肾小管中的阳性率。另外常规方法对肾组织切片进行HE染色,每张切片随机选取5个肾小球,计算每个肾小球细胞数。
, http://www.100md.com
三、统计学处理
实验结果以均数±标准差表示,采用组间t检验和相关分析进行统计学处理,P<0.05表示有统计学意义。
结 果
一、肾毒血清肾炎大鼠蛋白尿及肾小球细胞数的变化见图1、图2
图1 肾毒血清肾炎大鼠蛋白尿的变化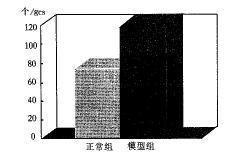
图2 肾毒血清肾炎大鼠肾小球细胞数的变化
如图1、2所示,肾毒血清肾炎大鼠出现明显的蛋白尿,模型组为84.10±8.46 mg/24h,正常组为8.61±0.93 mg/24h,两组差异有显著意义(t=23.27,P<0.0001);模型组大鼠肾小球细胞数为119.25±14.18 个/gcs,正常对照组为74.92±7.35 个/gcs,两组差异有显著意义(t=9.62,P<0.001)。
, 百拇医药
二、肾组织中MCP-1的表达
正常肾组织可见皮质区远端肾小管上皮细胞有较少量的MCP-1表达,而肾小球及近端肾小管上皮细胞均未见有MCP-1表达,髓质区肾小管上皮细胞和集合管则有较强的表达。
模型组大鼠肾小球及肾小管中MCP-1的表达显著上调,且MCP-1的表达有明显的局灶性分布趋势,主要见于球囊侧壁上皮细胞以及新月体形成的起始部位,在肾小管间质则主要见于小管损伤的部位(见表1)。
表1 肾组织中MCP-1的表达(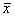 ±s)
±s)
肾小球(个/gcs)
肾小管(%)
正常对照组
, http://www.100md.com
0
11.26±6.88
模 型 组
24.37±7.06
54.78±11.49
t值
3.36
13.87
P值
<0.01
<0.01
三、MCP-1表达与蛋白尿及肾小球细胞数之间的关系
, http://www.100md.com
如表2所示,肾毒血清肾炎大鼠UpV与肾小球细胞数、肾小球及肾小管中MCP-1表达呈显著正相关;肾小球中MCP-1表达与肾小球细胞数亦呈显著正相关,而肾小管中MCP-1表达与肾小球细胞数未见有明显相关关系。表2 MCP-1表达与蛋白尿及肾小球细胞数之间的关系(r值)
UpV
肾小球细胞数
UpV
—
0.58*
肾小球MCP-1表达
0.73**
0.92**
, http://www.100md.com
肾小管MCP-1表达
0.65**
NS
注:*:P<0.05;**:P<0.01;NS:无相关关系讨 论
体内外的研究均证实单核巨噬细胞浸润在肾脏病中发挥着重要的致病作用。在病变的急性期,单核巨噬细胞通过参与新月体形成,释放活性氧、活性氮、蛋白酶、分泌细胞因子及生长因子等物质,造成组织损伤。炎症进入慢性期后,又可通过分泌转化生长因子(TGF)等细胞因子促进肾小球硬化、肾间质纤维化。单核巨噬细胞浸润到炎症局部是一个由多种粘附分子和趋化因子相互协同作用的多步骤过程,其确切机制目前尚未完全明确。
MCP-1是主要的趋化、激活单核巨噬细胞的趋化因子,属于趋化因子CC家族成员之一,为一含76个氨基酸残基的碱性蛋白。既往的研究证实,MCP-1从多方面参与了肾脏疾病的发生发展,其不仅作为单核巨噬细胞的趋化因子,同时还可上调巨噬细胞膜表面粘附分子CD11/CD18表达[2],使巨噬细胞粘附性增强;另外,MCP-1还可激活巨噬细胞,使其产生氧自由基,释放溶酶体酶等多种炎症介质,加重组织损伤。因此,观察肾组织中MCP-1的表达,研究其与单核巨噬细胞浸润的关系,对于进一步阐明肾毒血清肾炎发病机制具有重要的意义。
, 百拇医药
本研究结果发现,正常肾脏组织中MCP-1表达较少,主要见于肾髓质部的肾小管、集合管和髓袢。皮质部仅极少部分的远端肾小管有少量表达,近端肾小管和肾小球均未见有MCP-1表达。在肾毒血清肾炎大鼠,肾小球及肾小管中MCP-1表达显著上调,并与肾小球细胞数和蛋白尿明显相关。尽管MCP-1在维持肾脏生理功能和如何参与肾脏疾病病理生理过程尚未完全明了,但上述结果提示肾脏组织细胞MCP-1的过度表达在巨噬细胞介导肾脏损伤为主的新月体肾炎的发病机制中发挥着重要作用。
采用细胞培养和分子杂交技术研究发现,人和鼠类皮质肾小管上皮细胞、系膜细胞和肾小球内皮细胞均可表达和产生MCP-1,并受多种细胞因子如IL-1、肿瘤坏死因子α(TNF-α)、干扰素、集落刺激因子和低密度脂蛋白、IgG、cAMP的调节[3]。近年来研究证实蛋白尿可直接诱导近端肾小管上皮细胞MCP-1表达;给予高浓度的白蛋白、转铁蛋白等亦可促使培养的肾小管上皮细胞分泌MCP-1[4]。有研究报道,培养的肾小球系膜细胞在蛋白尿中脂质成分的刺激下,MCP-1产生亦明显增多。本研究结果也发现,在肾毒血清肾炎大鼠中,尿蛋白与肾小球内MCP-1高表达和肾小球细胞数密切相关,提示尿蛋白可通过诱导MCP-1表达而间接调控单核巨噬细胞浸润,参与肾损害。在本研究中,肾毒血清肾炎大鼠肾小管间质中,MCP-1表达的水平及强度均显著上调,尤其是有病变的肾小管(肾小管炎症、扩张和萎缩),MCP-1表达更为显著。同时,我们还观察到,MCP-1表达增强的肾小管,其周围有较多的巨噬细胞浸润,而无MCP-1表达的肾小管周围,则无或仅有较少量的巨噬细胞浸润,提示MCP-1的高表达促进了巨噬细胞的局部浸润。这些浸润的巨噬细胞产生的IL-1、TNF-α等又可促进MCP-1的进一步表达,吸引更多的巨噬细胞,形成恶性循环,加重肾脏损害。
, http://www.100md.com
总之,我们的研究结果发现,肾毒血清肾炎大鼠肾小球及肾小管中MCP-1表达显著上调,且与蛋白尿和肾小球细胞数密切相关,提示MCP-1在实验性新月体性肾炎发病机制中发挥着重要作用,从而为使用MCP-1单克隆抗体来治疗以单核巨噬细胞浸润为主的肾脏疾病提供了理论依据。
参 考 文 献
1,Nikolic-Paaterson DJ,Lan HY,Hill PA,et al.Macrophages in renal injury.Kidney Int,1994,45(Suppl45):S79-S82.
2,Yanling Jiang,David Beiller,Gyorgy Frendl,et al.Monocyte chemoattractant protein-1 regulates adhesion molecule expression and cytokine production in human monocytes.J Immunol,1992,148:2423-2428.
3,蔡松敏,李惊子,王海燕.趋化因子与肾脏疾病.国外医学泌尿系统分册,1997,17:60-62.
4,Wang Y,Chen J,Chen L,et al.Induction of monocyte chemoattractant protein-1 in proximal tubule cells by urinary protein.J Am Soc Nephrol,1997,8:1537-1545.
收稿:1999-08-17 修回:2000-02-27, http://www.100md.com
单位:张爱华 陈荣华 林娜 黄松明 费莉 郭梅 潘晓勤 蔡毅(210029 南京医科大学小儿肾脏病研究中心);邢昌赢(南京医科大学第一附属医院肾内科)
关键词:单核细胞趋化蛋白-1;肾毒血清肾炎;巨噬细胞
江苏医药000802 【摘要】 目的 探讨单核细胞趋化蛋白-1(MCP-1)在肾毒血清肾炎大鼠肾组织中的表达及其意义。方法 肾毒血清肾炎应用兔抗鼠肾小球基底膜肾毒血清制备。采用免疫组化及真彩色计算机图像分析系统观察肾小球及肾小管中MCP-1的表达,并分析其与蛋白尿和肾小球细胞数之间的关系。结果 肾毒血清肾炎大鼠出现大量蛋白尿,肾小球细胞数明显增多;肾小球及肾小管中MCP-1表达显著上调,并与肾小球细胞数和蛋白尿密切相关。结论 MCP-1在肾毒血清肾炎发病机制中发挥重要作用。MCP-1的高表达可能是肾毒血清肾炎中巨噬细胞在肾脏局部浸润的重要介导因子。
, 百拇医药
Significance of monocyte chemoattractant protein-1 expression in nephrotoxic sera nephritis in rats
ZHANG Aihua,CHEN Ronghua,LIN Na,et al.
(Center of Pediatric Nephrology,Nanjing Medical University,Nanjing 210029)
【Abstract】 Objective To investigate the expression of monocyte chemoattractant protein-1(MCP-1) and their significance in the nephrotoxic sera nephritis (NTN) in rats.Methods NTN was induced by the tail vein injection of anti-GBM antibody.Immunohistochemical studies and medical imaging analysis system were performed to detect the expression of MCP-1 on formalin-fixed paraffin-embedded samples from rat kidney including control group and NTN rats and its relationship with the proteinuria and macrophage infiltration.Results Rats injected with NTN developed heavy proteinuria and macrophage infiltration in the kidney.Significant up-regulation of MCP-1 expression was observed in the glomerulus and tubular cells in NTN rats,and MCP-1 expression was closely correlated with macrophage infiltration and the proteinuria.Conclusion The MCP-1 may play a pivotal pathogenic role in NTN and may be an important mediator in inducing macrophage infiltration in NTN rat.
, 百拇医药
【Key words】Monocyte chemoattractant protein-1 Nephrotoxic sera nephritis Macrophage
大鼠抗肾小球基底膜肾毒血清性肾炎为一种进行性肾损害模型,伴有肾组织中大量的单核巨噬细胞浸润和新月体形成。浸润的单核巨噬细胞通过分泌多种炎症介质造成肾组织结构的破坏。对于单核巨噬细胞浸润机制目前尚未完全明确。单核细胞趋化蛋白-1(MCP-1)是新近被确认的对单核巨噬细胞具有趋化、激活作用的趋化因子[1]。本研究采用免疫组织化学和真彩色医学图像分析系统观察肾毒血清肾炎大鼠肾小球及肾小管中MCP-1的表达,并分析其与蛋白尿和肾小球细胞数之间的关系,旨在进一步证实MCP-1在肾小球肾炎发病机制中的作用。
材料与方法
一、实验材料
雄性SD大鼠10只,体重180~200 g,购自江苏省实验动物中心。山羊抗鼠MCP-1多克隆抗体及兔抗山羊IgG均为美国SANTACRUZ产品。兔抗鼠肾小球基底膜肾毒血清由本实验室制备。
, 百拇医药
二、方法
1.模型制备:雄性SD大鼠10只,随机分为两组:(1)模型组:尾静脉注射兔抗鼠肾小球基底膜肾毒血清(10 ml/kg体重);(2)正常对照组:尾静脉注射等量生理盐水。所有大鼠于第14天断头处死,处死前一天留取24小时尿检测尿蛋白(UpV),处死后取肾组织检查。
2.免疫组织化学染色:肾组织中MCP-1表达采用免疫组化方法。肾组织标本经10%福尔马林固定,石蜡包埋,切片厚4 μm。应用改良ABC法,免疫组化检测试剂盒购自深圳晶美生物工程有限公司,按说明书操作。阴性对照以PBS代替一抗。每只鼠肾取4张切片。
3.计算机图像分析:应用多媒体彩色病理图文分析系统MPIAS-500(同济医科大学清平影像工程公司产品),通过光学显微镜放大400倍摄取图像,输入图像分析系统内。(1)肾小球中MCP-1表达:每张切片随机选取5个肾小球,计算每个肾小球内抗体染色阳性细胞数,以均值表示每例肾小球中阳性细胞数;(2)皮质区肾小管中MCP-1表达:计算每张切片皮质区50个高倍视野下阳性小管数与总肾小管数的百分数,以均值表示每例肾小管中的阳性率。另外常规方法对肾组织切片进行HE染色,每张切片随机选取5个肾小球,计算每个肾小球细胞数。
, http://www.100md.com
三、统计学处理
实验结果以均数±标准差表示,采用组间t检验和相关分析进行统计学处理,P<0.05表示有统计学意义。
结 果
一、肾毒血清肾炎大鼠蛋白尿及肾小球细胞数的变化见图1、图2

图1 肾毒血清肾炎大鼠蛋白尿的变化

图2 肾毒血清肾炎大鼠肾小球细胞数的变化
如图1、2所示,肾毒血清肾炎大鼠出现明显的蛋白尿,模型组为84.10±8.46 mg/24h,正常组为8.61±0.93 mg/24h,两组差异有显著意义(t=23.27,P<0.0001);模型组大鼠肾小球细胞数为119.25±14.18 个/gcs,正常对照组为74.92±7.35 个/gcs,两组差异有显著意义(t=9.62,P<0.001)。
, 百拇医药
二、肾组织中MCP-1的表达
正常肾组织可见皮质区远端肾小管上皮细胞有较少量的MCP-1表达,而肾小球及近端肾小管上皮细胞均未见有MCP-1表达,髓质区肾小管上皮细胞和集合管则有较强的表达。
模型组大鼠肾小球及肾小管中MCP-1的表达显著上调,且MCP-1的表达有明显的局灶性分布趋势,主要见于球囊侧壁上皮细胞以及新月体形成的起始部位,在肾小管间质则主要见于小管损伤的部位(见表1)。
表1 肾组织中MCP-1的表达(
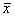 ±s)
±s)肾小球(个/gcs)
肾小管(%)
正常对照组
, http://www.100md.com
0
11.26±6.88
模 型 组
24.37±7.06
54.78±11.49
t值
3.36
13.87
P值
<0.01
<0.01
三、MCP-1表达与蛋白尿及肾小球细胞数之间的关系
, http://www.100md.com
如表2所示,肾毒血清肾炎大鼠UpV与肾小球细胞数、肾小球及肾小管中MCP-1表达呈显著正相关;肾小球中MCP-1表达与肾小球细胞数亦呈显著正相关,而肾小管中MCP-1表达与肾小球细胞数未见有明显相关关系。表2 MCP-1表达与蛋白尿及肾小球细胞数之间的关系(r值)
UpV
肾小球细胞数
UpV
—
0.58*
肾小球MCP-1表达
0.73**
0.92**
, http://www.100md.com
肾小管MCP-1表达
0.65**
NS
注:*:P<0.05;**:P<0.01;NS:无相关关系讨 论
体内外的研究均证实单核巨噬细胞浸润在肾脏病中发挥着重要的致病作用。在病变的急性期,单核巨噬细胞通过参与新月体形成,释放活性氧、活性氮、蛋白酶、分泌细胞因子及生长因子等物质,造成组织损伤。炎症进入慢性期后,又可通过分泌转化生长因子(TGF)等细胞因子促进肾小球硬化、肾间质纤维化。单核巨噬细胞浸润到炎症局部是一个由多种粘附分子和趋化因子相互协同作用的多步骤过程,其确切机制目前尚未完全明确。
MCP-1是主要的趋化、激活单核巨噬细胞的趋化因子,属于趋化因子CC家族成员之一,为一含76个氨基酸残基的碱性蛋白。既往的研究证实,MCP-1从多方面参与了肾脏疾病的发生发展,其不仅作为单核巨噬细胞的趋化因子,同时还可上调巨噬细胞膜表面粘附分子CD11/CD18表达[2],使巨噬细胞粘附性增强;另外,MCP-1还可激活巨噬细胞,使其产生氧自由基,释放溶酶体酶等多种炎症介质,加重组织损伤。因此,观察肾组织中MCP-1的表达,研究其与单核巨噬细胞浸润的关系,对于进一步阐明肾毒血清肾炎发病机制具有重要的意义。
, 百拇医药
本研究结果发现,正常肾脏组织中MCP-1表达较少,主要见于肾髓质部的肾小管、集合管和髓袢。皮质部仅极少部分的远端肾小管有少量表达,近端肾小管和肾小球均未见有MCP-1表达。在肾毒血清肾炎大鼠,肾小球及肾小管中MCP-1表达显著上调,并与肾小球细胞数和蛋白尿明显相关。尽管MCP-1在维持肾脏生理功能和如何参与肾脏疾病病理生理过程尚未完全明了,但上述结果提示肾脏组织细胞MCP-1的过度表达在巨噬细胞介导肾脏损伤为主的新月体肾炎的发病机制中发挥着重要作用。
采用细胞培养和分子杂交技术研究发现,人和鼠类皮质肾小管上皮细胞、系膜细胞和肾小球内皮细胞均可表达和产生MCP-1,并受多种细胞因子如IL-1、肿瘤坏死因子α(TNF-α)、干扰素、集落刺激因子和低密度脂蛋白、IgG、cAMP的调节[3]。近年来研究证实蛋白尿可直接诱导近端肾小管上皮细胞MCP-1表达;给予高浓度的白蛋白、转铁蛋白等亦可促使培养的肾小管上皮细胞分泌MCP-1[4]。有研究报道,培养的肾小球系膜细胞在蛋白尿中脂质成分的刺激下,MCP-1产生亦明显增多。本研究结果也发现,在肾毒血清肾炎大鼠中,尿蛋白与肾小球内MCP-1高表达和肾小球细胞数密切相关,提示尿蛋白可通过诱导MCP-1表达而间接调控单核巨噬细胞浸润,参与肾损害。在本研究中,肾毒血清肾炎大鼠肾小管间质中,MCP-1表达的水平及强度均显著上调,尤其是有病变的肾小管(肾小管炎症、扩张和萎缩),MCP-1表达更为显著。同时,我们还观察到,MCP-1表达增强的肾小管,其周围有较多的巨噬细胞浸润,而无MCP-1表达的肾小管周围,则无或仅有较少量的巨噬细胞浸润,提示MCP-1的高表达促进了巨噬细胞的局部浸润。这些浸润的巨噬细胞产生的IL-1、TNF-α等又可促进MCP-1的进一步表达,吸引更多的巨噬细胞,形成恶性循环,加重肾脏损害。
, http://www.100md.com
总之,我们的研究结果发现,肾毒血清肾炎大鼠肾小球及肾小管中MCP-1表达显著上调,且与蛋白尿和肾小球细胞数密切相关,提示MCP-1在实验性新月体性肾炎发病机制中发挥着重要作用,从而为使用MCP-1单克隆抗体来治疗以单核巨噬细胞浸润为主的肾脏疾病提供了理论依据。
参 考 文 献
1,Nikolic-Paaterson DJ,Lan HY,Hill PA,et al.Macrophages in renal injury.Kidney Int,1994,45(Suppl45):S79-S82.
2,Yanling Jiang,David Beiller,Gyorgy Frendl,et al.Monocyte chemoattractant protein-1 regulates adhesion molecule expression and cytokine production in human monocytes.J Immunol,1992,148:2423-2428.
3,蔡松敏,李惊子,王海燕.趋化因子与肾脏疾病.国外医学泌尿系统分册,1997,17:60-62.
4,Wang Y,Chen J,Chen L,et al.Induction of monocyte chemoattractant protein-1 in proximal tubule cells by urinary protein.J Am Soc Nephrol,1997,8:1537-1545.
收稿:1999-08-17 修回:2000-02-27, http://www.100md.com