羟喜树碱对人胰腺癌细胞增殖及凋亡的影响
作者:许青 高勇 王杰军 朱长力 王兵 郭静 鲍洪涛
单位:许青(第二军医大学长征医院肿瘤科,上海 200003);高勇(第二军医大学长征医院肿瘤科,上海 200003);王杰军(第二军医大学长征医院肿瘤科,上海 200003);朱长力(第二军医大学长征医院肿瘤科,上海 200003);王兵(第二军医大学长征医院肿瘤科,上海 200003)
关键词:羟喜树碱;胰腺肿瘤;凋亡;增殖
第二军医大学学报000810 [摘要] 目的:研究羟喜树碱(HCPT)体外抑制人胰腺癌细胞株SW-1990增殖并诱导其凋亡的作用。方法:体外培养的胰腺癌细胞经不同质量浓度(1.562 5, 3.125, 6.25, 12.5, 25,50, 100 μg/ml)的HCPT处理20~24 h后,用MTT法测定细胞增殖情况,再分别以AnnexinⅤ早期凋亡检测试剂盒、电子显微镜、流式细胞术和TUNEL标记以及bcl-2免疫细胞化学标记检测细胞凋亡情况。结果:(1)3.125~100 μg/ml HCPT作用24 h后,肿瘤细胞的增殖抑制率均非常显著高于对照组(P<0.01)。(2) 50 μg/ml HCPT作用20 h后,经流式细胞术及TUNEL标记检测,肿瘤细胞的凋亡率分别为13.2%和15.3%;100 μg/ml HCPT作用20 h后,两种方法检测的细胞凋亡率分别为26.1%和28.4%。 (3) 电镜及AnnexinⅤ标记荧光检测观察表明,50 μg/ml HCPT作用下,肿瘤细胞主要呈早期凋亡表现,凋亡率为18.4%。(4) 50 μg/ml HCPT作用24 h后,肿瘤细胞bcl-2表达较对照组明显减弱。结论:HCPT在体外可抑制SW-1990细胞的增殖,部分作用机制是诱导细胞凋亡;提示HCPT可作为细胞凋亡诱导剂用于胰腺癌的治疗。
, 百拇医药
[中图分类号] R 282.710.5 [文献标识码] A
[文章编号] 0258-879X(2000)08-0731-03
Effects of hydroxyl camptothecinum on proliferation and apoptosis of human pancreatic cancer cell line
XU Qing GAO Yong WANG Jie-Jun ZHU Chang-Li WANG Bing GUO Jing
(Department of Oncology, Changzheng Hospital, Second Military Medical University, Shanghai 200003,China)
, 百拇医药
BAO Hong-Tao
(Department of Medical Affair Management)
[ABSTRACT] Objective: To study the effect of hydroxyl camptothecinum (HCPT) on proliferation and apoptosis of human pancreatic cancer cell in vitro. Methods: After treated with HCPT at different concentrations (1.562 5, 3.125, 6.25, 12.5, 25, 50, 100 μg/ml) for 20-24 h, the cultured SW-1990 cell proliferation were evaluated by MTT, and apoptosis by Annexin-Ⅴ-fluos staining, electronic microscopy, flow cytometry, bcl-2 immunocytochemical staining and in situ TUNEL (TdT-mediated dUTP-X nick end labeling). Results: (1) The rate of proliferation in each group of 3.125-100 μg/ml was significantly lower than that in the control group (P<0.01) after treated with HCPT for 24 hours. (2) The apoptosis rate of pancreatic cell was 13.2% and 15.3% after treated with HCPT at the concentration of 50 μg/ml for 20 hours, the rate was 26.1% and 28.4% at 100 μg/ml. (3)Annexin-Ⅴ-fluos staining and electronic microscopy detection showed the expression of apoptosis was mainly at the early morphological stage at the concentration of 50 μg/ml and the apoptosis rate of early stage was 18.4%. (4) The expression of bcl-2 were less than the control after treated with HCPT 50 μg/ml for 24 hours. Conclusion: HCPT can depress the proliferation of SW-1990 in vitro, partially through the induction of apoptosis, and HCPT is a potential agent for pancreatic cancer chemotherapy.
, http://www.100md.com
[KEY WORDS] hydroxycamptothecinum; pancreatic neoplasms; apoptosis; proliferation
胰腺癌是一预后极差的恶性肿瘤,目前对其治疗仍缺乏有效的手段。喜树碱类药物是从我国特有的喜树中提取的生物碱,是拓扑异构酶Ⅰ的抑制剂[1],其在肿瘤防治中的作用及机制已引起众多研究者的关注。研究表明,凋亡的异常是肿瘤发生发展中的一个重要因素,在恶性肿瘤中,细胞凋亡的比例明显降低,如能诱导肿瘤细胞凋亡,使其凋亡的比例增加,则可能遏制肿瘤的发生发展[2, 3]。本研究拟了解羟喜树碱(HCPT)在体外对人胰腺癌细胞株SW-1990增殖的影响及其诱导凋亡的作用,以探讨其在胰腺癌防治中的潜在作用价值。
1 材料和方法
1.1 药物及主要试剂 HCPT注射液(吉林长春天诚药业有限公司提供,批号:吉卫药准字1996第122041号),使用时以DMEM稀释至所需浓度,加入培养的细胞中。MTT为Sigma公司产品,bcl-2免疫细胞化学检测试剂盒为武汉博士德公司进口分装,Annexin Ⅴ荧光显色试剂盒、TUNEL检测试剂盒均为德国宝灵曼公司产品。
, 百拇医药
1.2 方法
1.2.1 细胞培养与药物处理 人胰腺癌细胞株SW-1990(购自中国科学院细胞研究所),以含10%小牛血清的DMEM培养液在5% CO2, 37℃条件下培养。细胞接种24 h后,分别加入不同质量浓度(1.562 5,3.125,6.25,12.5,25,50,100 μg/ml)的HCPT,作用20~24 h后,进行各种指标测定。
1.2.2 细胞增殖检测 将SW-1990细胞按1×103 个/孔接种于96孔板,每一浓度设3复孔。加入不同质量浓度的HCPT作用24 h后,每孔加入5 mg/ml的MTT 20 μl轻轻晃匀,37℃温育4 h,去除上清液,经吸水纸吸干后,每孔加入DMSO 100 μl,振荡混匀10 min后,用96孔Biolisa酶标仪检测570 nm处的光密度值。
1.2.3 bcl-2免疫细胞化学检测 将SW-1990细胞按1×105个/孔接种于预先置好盖玻片的6孔板中,培养24 h后,加入HCPT作用24 h,取出盖玻片,用生理盐水冲洗后,以4℃预冷的丙酮固定30 min,按试剂盒说明,加入一抗后4℃过夜,DAB显色、苏木精复染,光镜下观察。
, 百拇医药
1.2.4 荧光检测 按前述将细胞接种于6孔板之盖玻片上,药物作用24 h,以生理盐水轻轻冲洗后,按Annexin Ⅴ荧光显色试剂盒说明滴加荧光显色剂,室温10 min后,荧光显微镜观察、摄片、计数。
1.2.5 细胞形态观察 将经不同质量浓度HCPT处理过的肿瘤细胞和未处理过的对照组细胞,以2%戊二醛固定,包埋,制片,电镜(Hitachi,H-500)观察并照相[4]。
1.2.6 流式细胞术分析 EDTA消化收获细胞;70%乙醇固定;相应处理后,于EPICS 751型流式细胞仪(美国Coulter公司)上分析[5]。
1.2.7 TUNEL标记检测 按试剂盒说明进行。
1.3 统计学处理 进行未配对计量资料的t检验。
, http://www.100md.com
2 结 果
2.1 MTT增殖检测结果 质量浓度分别为100, 50, 25, 12.5, 6.25, 3.125 μg/ml 的HCPT作用24 h后,对肿瘤细胞的增殖抑制率均显著高于空白对照组(P<0.01);而1.562 5 μg/ml HCPT作用24 h后,与对照组相比则无显著性差异(表1)。
表 1 HCPT对SW-1990细胞体外增殖的影响
Tab 1 Effects of HCPT on the proliferation
of SW-1990 in vitron=3, ±s) Group
±s) Group
D(570)
, http://www.100md.com
Control
0.276 3±0.003 2
HCPT (ρB/μg.ml-1)
1.562 5
0.248 5±0.010 7
3.125
0.229 2±0.004 6**
6.25
0.225 7±0.007 9**
12.5
, http://www.100md.com
0.173 8±0.008 3**
25
0.165 9±0.007 8**
50
0.188 7±0.002 5**
100
0.209 1±0.008 7**
** P<0.01 vs control group2.2 电镜下表现 50 μg/ml HCPT作用于SW-1990细胞20 h后,细胞出现凋亡现象,且以早期形态变化为主,核膜皱缩,染色质密集于核膜下(图1A)。而100 μg/ml HCPT作用20 h后,细胞出现明显的凋亡现象,且以晚期表现为多,核膜消失,染色质断裂,核分裂成碎片,有凋亡小体形成(图1B)。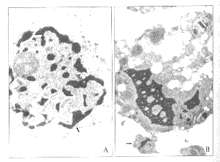
, http://www.100md.com
图 1 HCPT处理后SW-1990细胞
电镜下形态学变化(×10 000)
Fig 1 Morphological change of SW-1990 cell
after treated with HCPT(×10 000)
A:50 μg/ml,↑Chromatin; B:100 μg/ml,↑Apoptosis body
2.3 流式细胞术分析结果 50 μg/ml HCPT作用20 h后,凋亡细胞的比例为13.2%;100 μg/ml HCPT作用20 h后,凋亡细胞的比例为26.1%。
2.4 AnnexinⅤ荧光检测结果 经50 μg/ml HCPT作用24 h后,部分细胞呈绿色荧光染色,经计数,比例为18.4%;坏死细胞染成红色,占2.2%(图2,图见封三)。
, 百拇医药
2.5 bcl-2免疫细胞化学检测 经50 μg/ml HCPT 作用24 h后,bcl-2表达较对照组明显减弱(图3,图见封三)。
2.6 TUNEL标记检测结果 光镜下观察结果表明,100 μg/ml HCTP作用后,细胞凋亡率为28.4%;而在50 μg/ml时,细胞凋亡率为15.3%。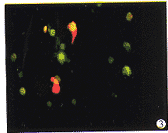

图3 Annexin V荧光检测结果
Fig3 Results of Annexin -V-flous detection
图4 bcl-2 免疫细胞化学检测结果
, 百拇医药 Fig 4 Results of bcl -2 immunocytochemical detection A:Before treated ;B:After treated
3 讨 论
HCPT作为一类极富前景的抗癌药物,已引起众多研究者关注[1]。其对肿瘤细胞的主要作用机制是抑制拓扑异构酶Ⅰ的活性,从而抑制肿瘤细胞有丝分裂、DNA复制。但有关HCPT通过诱导细胞凋亡而抑制胰腺癌细胞生长方面的研究却少见报道。
我们对HCPT体外抑制人胰腺癌细胞株SW-1990增殖并诱导其凋亡的研究结果表明:质量浓度分别为100,50,25,12.5,6.25,3.125 μg/ml 的HCPT作用24 h后,对肿瘤细胞的增殖抑制率均显著高于空白对照组(P<0.01),而1.562 5 μg/ml HCPT组与对照组相比则无显著差异,提示在3.125~100 μg/ml质量浓度下HCPT对SW-1990细胞具有明显的体外抑制增殖作用。为进一步明确HCPT抑制癌细胞增殖与诱导其凋亡之间的关系,我们在预实验的基础上,选取50和100 μg/ml两个浓度进行了凋亡相关指标的测定与检测。
, http://www.100md.com
本研究结果表明,HCPT在50 μg/ml质量浓度下,作用于体外培养的SW-1990细胞20 h后,肿瘤细胞有明显的凋亡现象发生,主要以早、中期的表现为主,凋亡率为13.2%和15.3%(流式细胞术与TUNEL检测结果);在100 μg/ml质量浓度下,细胞凋亡率为26.1%和28.4%,此时的形态学变化主要以凋亡晚期表现为主。提示HCPT抑制肿瘤细胞增殖的作用机制可能与诱导其凋亡有关。
细胞凋亡早期,主要是细胞膜发生变化[6,4]。其中的一个重要改变是磷脂酰丝氨酸(phosphatidylserine ,PS)易位,从胞膜内到胞膜外,暴露在细胞表面。Annexin Ⅴ是一种Ca2+依赖性磷脂结合蛋白,与PS有高度亲和性。虽然坏死细胞亦可出现此类表现,但由于同时结合propidium joidide DNA染色,使坏死细胞染成红色,因此可以根据染色结果排除坏死细胞。我们的实验结果显示,经50 μg/ml HCPT作用24 h后,部分细胞呈绿色荧光染色,经计数,比例为18.4%;而坏死细胞染成红色,仅占2.2%。由此也进一步证实HCPT对SW-1990细胞体外增殖的影响可能确与其诱导细胞凋亡有关。
, 百拇医药
bcl-2不同于一般意义上加速细胞增殖而致癌的癌基因,而是通过抵抗多种形式的细胞死亡,延长细胞寿命,使细胞数目累积增多来促进肿瘤形成的,是细胞凋亡的抑制基因[4,7]。本研究结果表明, 50 μg/ml HCPT作用24 h后,bcl-2表达较对照组明显减少,提示HCPT可能通过抑制bcl-2表达这一途径诱导肿瘤细胞凋亡。
本研究证明,HCPT在体外可抑制人胰腺癌细胞株SW-1990的增殖,其作用机制可能系通过抑制bcl-2表达而诱导肿瘤细胞凋亡。对HCPT类药物临床用于胰腺癌的治疗具有指导意义。
致谢 诚挚感谢本院临床实验科张玲珍、李莉,病理科叶挺军、赵奕以及血液科傅卫军等同志在本研究过程中给予的热心帮助。
[基金项目] 国家自然科学基金资助项目(39770836).
[作者简介] 许 青(1964-),男(汉族),博士,主治医师.
, 百拇医药
作者单位:郭静(第二军医大学长征医院肿瘤科,上海 200003)
鲍洪涛(医教部)
[参 考 文 献]
[1] Burris HA, Rothernberg ML, Kuhn JG, et al. Clinical trials with topoisomerase Ⅰ inhibitors[J]. Sem Oncol, 1992, 19(6):663-669.
[2] O′Connar DS, Schechner JS, Adida C. Control of apoptosis during angiogenesis by survivin expression in endothelial cells[J]. Am J Pathol, 2000, 156(2):392-399.
, http://www.100md.com
[3] Majno G, Jotis I. Apoptosis, oncosis, and necrosis: an overview of cell death[J]. Am J Pathol, 1995,146(1):3-15.
[4] Creutz CE. The annexins and exocytosis. Science, 1992, 258 (6): 924-931.
[5] 李德玲,王会信,周廷冲. 细胞程序性死亡的判定方法[J]. 生物化学与生物物理进展, 1996,23(4):322-325.
[6] Andree HA, Reutelingesperger CP, Hauptmann R, et al. Binding of vascular anticoagulant alpha (VAC alpha) to planar phospholipid bilayers[J]. J Biol Chem, 1990, 265(9):4923-4928.
[7] Voutsadakis IA. Apoptosis and the pathogenesis of lymphoma[J]. Acta Oncol, 2000,39(2):151-156.
[收稿日期] 2000-03-16
[修回日期] 2000-06-08, 百拇医药
单位:许青(第二军医大学长征医院肿瘤科,上海 200003);高勇(第二军医大学长征医院肿瘤科,上海 200003);王杰军(第二军医大学长征医院肿瘤科,上海 200003);朱长力(第二军医大学长征医院肿瘤科,上海 200003);王兵(第二军医大学长征医院肿瘤科,上海 200003)
关键词:羟喜树碱;胰腺肿瘤;凋亡;增殖
第二军医大学学报000810 [摘要] 目的:研究羟喜树碱(HCPT)体外抑制人胰腺癌细胞株SW-1990增殖并诱导其凋亡的作用。方法:体外培养的胰腺癌细胞经不同质量浓度(1.562 5, 3.125, 6.25, 12.5, 25,50, 100 μg/ml)的HCPT处理20~24 h后,用MTT法测定细胞增殖情况,再分别以AnnexinⅤ早期凋亡检测试剂盒、电子显微镜、流式细胞术和TUNEL标记以及bcl-2免疫细胞化学标记检测细胞凋亡情况。结果:(1)3.125~100 μg/ml HCPT作用24 h后,肿瘤细胞的增殖抑制率均非常显著高于对照组(P<0.01)。(2) 50 μg/ml HCPT作用20 h后,经流式细胞术及TUNEL标记检测,肿瘤细胞的凋亡率分别为13.2%和15.3%;100 μg/ml HCPT作用20 h后,两种方法检测的细胞凋亡率分别为26.1%和28.4%。 (3) 电镜及AnnexinⅤ标记荧光检测观察表明,50 μg/ml HCPT作用下,肿瘤细胞主要呈早期凋亡表现,凋亡率为18.4%。(4) 50 μg/ml HCPT作用24 h后,肿瘤细胞bcl-2表达较对照组明显减弱。结论:HCPT在体外可抑制SW-1990细胞的增殖,部分作用机制是诱导细胞凋亡;提示HCPT可作为细胞凋亡诱导剂用于胰腺癌的治疗。
, 百拇医药
[中图分类号] R 282.710.5 [文献标识码] A
[文章编号] 0258-879X(2000)08-0731-03
Effects of hydroxyl camptothecinum on proliferation and apoptosis of human pancreatic cancer cell line
XU Qing GAO Yong WANG Jie-Jun ZHU Chang-Li WANG Bing GUO Jing
(Department of Oncology, Changzheng Hospital, Second Military Medical University, Shanghai 200003,China)
, 百拇医药
BAO Hong-Tao
(Department of Medical Affair Management)
[ABSTRACT] Objective: To study the effect of hydroxyl camptothecinum (HCPT) on proliferation and apoptosis of human pancreatic cancer cell in vitro. Methods: After treated with HCPT at different concentrations (1.562 5, 3.125, 6.25, 12.5, 25, 50, 100 μg/ml) for 20-24 h, the cultured SW-1990 cell proliferation were evaluated by MTT, and apoptosis by Annexin-Ⅴ-fluos staining, electronic microscopy, flow cytometry, bcl-2 immunocytochemical staining and in situ TUNEL (TdT-mediated dUTP-X nick end labeling). Results: (1) The rate of proliferation in each group of 3.125-100 μg/ml was significantly lower than that in the control group (P<0.01) after treated with HCPT for 24 hours. (2) The apoptosis rate of pancreatic cell was 13.2% and 15.3% after treated with HCPT at the concentration of 50 μg/ml for 20 hours, the rate was 26.1% and 28.4% at 100 μg/ml. (3)Annexin-Ⅴ-fluos staining and electronic microscopy detection showed the expression of apoptosis was mainly at the early morphological stage at the concentration of 50 μg/ml and the apoptosis rate of early stage was 18.4%. (4) The expression of bcl-2 were less than the control after treated with HCPT 50 μg/ml for 24 hours. Conclusion: HCPT can depress the proliferation of SW-1990 in vitro, partially through the induction of apoptosis, and HCPT is a potential agent for pancreatic cancer chemotherapy.
, http://www.100md.com
[KEY WORDS] hydroxycamptothecinum; pancreatic neoplasms; apoptosis; proliferation
胰腺癌是一预后极差的恶性肿瘤,目前对其治疗仍缺乏有效的手段。喜树碱类药物是从我国特有的喜树中提取的生物碱,是拓扑异构酶Ⅰ的抑制剂[1],其在肿瘤防治中的作用及机制已引起众多研究者的关注。研究表明,凋亡的异常是肿瘤发生发展中的一个重要因素,在恶性肿瘤中,细胞凋亡的比例明显降低,如能诱导肿瘤细胞凋亡,使其凋亡的比例增加,则可能遏制肿瘤的发生发展[2, 3]。本研究拟了解羟喜树碱(HCPT)在体外对人胰腺癌细胞株SW-1990增殖的影响及其诱导凋亡的作用,以探讨其在胰腺癌防治中的潜在作用价值。
1 材料和方法
1.1 药物及主要试剂 HCPT注射液(吉林长春天诚药业有限公司提供,批号:吉卫药准字1996第122041号),使用时以DMEM稀释至所需浓度,加入培养的细胞中。MTT为Sigma公司产品,bcl-2免疫细胞化学检测试剂盒为武汉博士德公司进口分装,Annexin Ⅴ荧光显色试剂盒、TUNEL检测试剂盒均为德国宝灵曼公司产品。
, 百拇医药
1.2 方法
1.2.1 细胞培养与药物处理 人胰腺癌细胞株SW-1990(购自中国科学院细胞研究所),以含10%小牛血清的DMEM培养液在5% CO2, 37℃条件下培养。细胞接种24 h后,分别加入不同质量浓度(1.562 5,3.125,6.25,12.5,25,50,100 μg/ml)的HCPT,作用20~24 h后,进行各种指标测定。
1.2.2 细胞增殖检测 将SW-1990细胞按1×103 个/孔接种于96孔板,每一浓度设3复孔。加入不同质量浓度的HCPT作用24 h后,每孔加入5 mg/ml的MTT 20 μl轻轻晃匀,37℃温育4 h,去除上清液,经吸水纸吸干后,每孔加入DMSO 100 μl,振荡混匀10 min后,用96孔Biolisa酶标仪检测570 nm处的光密度值。
1.2.3 bcl-2免疫细胞化学检测 将SW-1990细胞按1×105个/孔接种于预先置好盖玻片的6孔板中,培养24 h后,加入HCPT作用24 h,取出盖玻片,用生理盐水冲洗后,以4℃预冷的丙酮固定30 min,按试剂盒说明,加入一抗后4℃过夜,DAB显色、苏木精复染,光镜下观察。
, 百拇医药
1.2.4 荧光检测 按前述将细胞接种于6孔板之盖玻片上,药物作用24 h,以生理盐水轻轻冲洗后,按Annexin Ⅴ荧光显色试剂盒说明滴加荧光显色剂,室温10 min后,荧光显微镜观察、摄片、计数。
1.2.5 细胞形态观察 将经不同质量浓度HCPT处理过的肿瘤细胞和未处理过的对照组细胞,以2%戊二醛固定,包埋,制片,电镜(Hitachi,H-500)观察并照相[4]。
1.2.6 流式细胞术分析 EDTA消化收获细胞;70%乙醇固定;相应处理后,于EPICS 751型流式细胞仪(美国Coulter公司)上分析[5]。
1.2.7 TUNEL标记检测 按试剂盒说明进行。
1.3 统计学处理 进行未配对计量资料的t检验。
, http://www.100md.com
2 结 果
2.1 MTT增殖检测结果 质量浓度分别为100, 50, 25, 12.5, 6.25, 3.125 μg/ml 的HCPT作用24 h后,对肿瘤细胞的增殖抑制率均显著高于空白对照组(P<0.01);而1.562 5 μg/ml HCPT作用24 h后,与对照组相比则无显著性差异(表1)。
表 1 HCPT对SW-1990细胞体外增殖的影响
Tab 1 Effects of HCPT on the proliferation
of SW-1990 in vitron=3,
 ±s) Group
±s) GroupD(570)
, http://www.100md.com
Control
0.276 3±0.003 2
HCPT (ρB/μg.ml-1)
1.562 5
0.248 5±0.010 7
3.125
0.229 2±0.004 6**
6.25
0.225 7±0.007 9**
12.5
, http://www.100md.com
0.173 8±0.008 3**
25
0.165 9±0.007 8**
50
0.188 7±0.002 5**
100
0.209 1±0.008 7**
** P<0.01 vs control group2.2 电镜下表现 50 μg/ml HCPT作用于SW-1990细胞20 h后,细胞出现凋亡现象,且以早期形态变化为主,核膜皱缩,染色质密集于核膜下(图1A)。而100 μg/ml HCPT作用20 h后,细胞出现明显的凋亡现象,且以晚期表现为多,核膜消失,染色质断裂,核分裂成碎片,有凋亡小体形成(图1B)。

, http://www.100md.com
图 1 HCPT处理后SW-1990细胞
电镜下形态学变化(×10 000)
Fig 1 Morphological change of SW-1990 cell
after treated with HCPT(×10 000)
A:50 μg/ml,↑Chromatin; B:100 μg/ml,↑Apoptosis body
2.3 流式细胞术分析结果 50 μg/ml HCPT作用20 h后,凋亡细胞的比例为13.2%;100 μg/ml HCPT作用20 h后,凋亡细胞的比例为26.1%。
2.4 AnnexinⅤ荧光检测结果 经50 μg/ml HCPT作用24 h后,部分细胞呈绿色荧光染色,经计数,比例为18.4%;坏死细胞染成红色,占2.2%(图2,图见封三)。
, 百拇医药
2.5 bcl-2免疫细胞化学检测 经50 μg/ml HCPT 作用24 h后,bcl-2表达较对照组明显减弱(图3,图见封三)。
2.6 TUNEL标记检测结果 光镜下观察结果表明,100 μg/ml HCTP作用后,细胞凋亡率为28.4%;而在50 μg/ml时,细胞凋亡率为15.3%。


图3 Annexin V荧光检测结果
Fig3 Results of Annexin -V-flous detection
图4 bcl-2 免疫细胞化学检测结果
, 百拇医药 Fig 4 Results of bcl -2 immunocytochemical detection A:Before treated ;B:After treated
3 讨 论
HCPT作为一类极富前景的抗癌药物,已引起众多研究者关注[1]。其对肿瘤细胞的主要作用机制是抑制拓扑异构酶Ⅰ的活性,从而抑制肿瘤细胞有丝分裂、DNA复制。但有关HCPT通过诱导细胞凋亡而抑制胰腺癌细胞生长方面的研究却少见报道。
我们对HCPT体外抑制人胰腺癌细胞株SW-1990增殖并诱导其凋亡的研究结果表明:质量浓度分别为100,50,25,12.5,6.25,3.125 μg/ml 的HCPT作用24 h后,对肿瘤细胞的增殖抑制率均显著高于空白对照组(P<0.01),而1.562 5 μg/ml HCPT组与对照组相比则无显著差异,提示在3.125~100 μg/ml质量浓度下HCPT对SW-1990细胞具有明显的体外抑制增殖作用。为进一步明确HCPT抑制癌细胞增殖与诱导其凋亡之间的关系,我们在预实验的基础上,选取50和100 μg/ml两个浓度进行了凋亡相关指标的测定与检测。
, http://www.100md.com
本研究结果表明,HCPT在50 μg/ml质量浓度下,作用于体外培养的SW-1990细胞20 h后,肿瘤细胞有明显的凋亡现象发生,主要以早、中期的表现为主,凋亡率为13.2%和15.3%(流式细胞术与TUNEL检测结果);在100 μg/ml质量浓度下,细胞凋亡率为26.1%和28.4%,此时的形态学变化主要以凋亡晚期表现为主。提示HCPT抑制肿瘤细胞增殖的作用机制可能与诱导其凋亡有关。
细胞凋亡早期,主要是细胞膜发生变化[6,4]。其中的一个重要改变是磷脂酰丝氨酸(phosphatidylserine ,PS)易位,从胞膜内到胞膜外,暴露在细胞表面。Annexin Ⅴ是一种Ca2+依赖性磷脂结合蛋白,与PS有高度亲和性。虽然坏死细胞亦可出现此类表现,但由于同时结合propidium joidide DNA染色,使坏死细胞染成红色,因此可以根据染色结果排除坏死细胞。我们的实验结果显示,经50 μg/ml HCPT作用24 h后,部分细胞呈绿色荧光染色,经计数,比例为18.4%;而坏死细胞染成红色,仅占2.2%。由此也进一步证实HCPT对SW-1990细胞体外增殖的影响可能确与其诱导细胞凋亡有关。
, 百拇医药
bcl-2不同于一般意义上加速细胞增殖而致癌的癌基因,而是通过抵抗多种形式的细胞死亡,延长细胞寿命,使细胞数目累积增多来促进肿瘤形成的,是细胞凋亡的抑制基因[4,7]。本研究结果表明, 50 μg/ml HCPT作用24 h后,bcl-2表达较对照组明显减少,提示HCPT可能通过抑制bcl-2表达这一途径诱导肿瘤细胞凋亡。
本研究证明,HCPT在体外可抑制人胰腺癌细胞株SW-1990的增殖,其作用机制可能系通过抑制bcl-2表达而诱导肿瘤细胞凋亡。对HCPT类药物临床用于胰腺癌的治疗具有指导意义。
致谢 诚挚感谢本院临床实验科张玲珍、李莉,病理科叶挺军、赵奕以及血液科傅卫军等同志在本研究过程中给予的热心帮助。
[基金项目] 国家自然科学基金资助项目(39770836).
[作者简介] 许 青(1964-),男(汉族),博士,主治医师.
, 百拇医药
作者单位:郭静(第二军医大学长征医院肿瘤科,上海 200003)
鲍洪涛(医教部)
[参 考 文 献]
[1] Burris HA, Rothernberg ML, Kuhn JG, et al. Clinical trials with topoisomerase Ⅰ inhibitors[J]. Sem Oncol, 1992, 19(6):663-669.
[2] O′Connar DS, Schechner JS, Adida C. Control of apoptosis during angiogenesis by survivin expression in endothelial cells[J]. Am J Pathol, 2000, 156(2):392-399.
, http://www.100md.com
[3] Majno G, Jotis I. Apoptosis, oncosis, and necrosis: an overview of cell death[J]. Am J Pathol, 1995,146(1):3-15.
[4] Creutz CE. The annexins and exocytosis. Science, 1992, 258 (6): 924-931.
[5] 李德玲,王会信,周廷冲. 细胞程序性死亡的判定方法[J]. 生物化学与生物物理进展, 1996,23(4):322-325.
[6] Andree HA, Reutelingesperger CP, Hauptmann R, et al. Binding of vascular anticoagulant alpha (VAC alpha) to planar phospholipid bilayers[J]. J Biol Chem, 1990, 265(9):4923-4928.
[7] Voutsadakis IA. Apoptosis and the pathogenesis of lymphoma[J]. Acta Oncol, 2000,39(2):151-156.
[收稿日期] 2000-03-16
[修回日期] 2000-06-08, 百拇医药