蜕皮甾酮对TNF所致脐静脉内皮细胞损伤的保护作用的初步观察
作者:石富胜 杨日高 狄桂平 罗向东 杨宗城 吴旭
单位:石富胜(第三军医大学解放军322医院烧伤科,大同 037006);杨日高(第三军医大学解放军322医院烧伤科,大同 037006);狄桂平(第三军医大学解放军322医院烧伤科,大同 037006);罗向东(第三军医大学附属西南医院烧伤研究所,重庆 400038);杨宗城(第三军医大学附属西南医院烧伤研究所,重庆 400038)
关键词:肿瘤坏死因子;HUVEC;NO;MDA;ET;LDH;能荷;蜕皮甾酮
第三军医大学学报000821
提 要: 目的 观察肿瘤坏死因子(TNF)对体外培养的脐静脉内皮细胞(HUVEC)分泌功能及能量代谢的影响,及应用植物药物成分蜕皮甾酮(EDS)进行防治的效果。方法 ①MTT法检测TNF对培养内皮细胞琥珀酸脱氢酶活性的影响。②内皮细胞培养上清液ET、NO、MDA、LDH、SOD测定。③采用反相高效液相色谱分析法测定内皮细胞ATP、ADP、AMP及能荷。结果 TNF与内皮细胞孵育后低浓度、早期内皮细胞被激活,随着TNF浓度增高MTT明显降低;TNF刺激后培养上清液ET、MDA、LDH、NO明显升高,EDS治疗后降低。TNF低浓度刺激VEC培养上清液SOD明显降低,EDS治疗后SOD升高;TNF同一浓度刺激后,随刺激时间延长HUVEC能量负荷降低,与正常比较12 h后明显降低,而用EDS治疗后各时相点能量负荷明显增加。结论 TNF在无血清状态下刺激后,培养HUVECs分泌功能、能量代谢出现紊乱,EDS治疗后上述紊乱得到一定程度的改善;提示TNF对体外培养的HUVECs可以直接损伤,EDS有一定的抗损伤作用。
, 百拇医药
中图法分类号: R392.11;R977.1 文献标识码: A
Protective effect of ecdysterone on TNF-induced HUVEC in vitro
SHI Fu-sheng, YANG Ri-gao, DI Gui-ping, LUO Xiang-dong, YANG Zhong-cheng, WU Xu
(Department of Burn Injury, No.322 Hospital of PLA, Datong 037006, China)
Abstract: Objective To investigate the effect of TNF on the secretion and energy metabolism of cultured human umbilical vein endothelial cell (HUVEC) and the protective effect of ecdysterone (EDS) on the damages resulting from TNF in vascular endothelial cell (VEC). Methods The effect of TNF on amber acid dehydrogenase activity in cultured VEC was studied with MTT assay. The concentrations of ET, NO, MDA, LDH and SOD were determined. The levels of ATP, ADP and AMP in the supernatant of the VEC culture medium and energy charge (EC) in VEC were measured. Results MTT assay demonstrated that VECs were activated at first and then inhibited after TNF-stimulation. The concentration of ET, NO, MDA and LDH in the supernatant were significantly increased while that of SOD was decreased on the 24 h after TNF-stimulation and EDS could attenuate the increase and decrease above with TNF-stimulation of same concentration. EC of HUVEC was reduced along with the elapse of time and it was significantly lowered compared with normal control, but EDS could markedly increase the EC at every time points. Conclusion The secretion and energy metabolism of cultured HUVEC were in disturbance after serum-free TNF-stimulation, while EDS can improve the disturbance. This indicates TNF can damage cultured HUVECs while EDS can prevent this event.
, 百拇医药
Key words: tumor necrosis factor; human umbilical vein endothelial cell; NO; MDA; ET; LDH; EC; ecdysterone
血管内皮细胞损伤在烧伤脏器损害的发生发展中具有极重要的作用,是导致“缺血再灌注”损伤、最终引起全身多脏器功能损害的重要原因。肿瘤坏死因子(Tumor necrosis factor,TNF)在中毒性休克、全身多脏器功能不全的病理过程中发挥重要作用。因此,如何针对TNF对体外培养血管内皮细胞损伤的防治,对烧伤治疗具有非常重要的意义。蜕皮甾酮(Ecdysterone,EDS)为一种植物药物成分,具有促进上皮增生的作用。我们已经报道EDS在抗凋亡方面的作用,但在TNF对体外培养脐静脉内皮细胞(HUVECs)能量代谢及分泌功能影响中的作用未见报道。
1 材料与方法
1.1 主要试剂及检测仪器
, 百拇医药
人脐静脉内皮细胞株(ECV-304)购于ATCC公司;M199细胞培养液、TNF购自军事医学科学院;细胞培养瓶、96孔培养板购自Sigma公司;胰蛋白酶为DIFCO1∶250;噻唑蓝为FLUKA公司产品;内皮素(ET)试剂盒由北京东亚免疫研究所提供;一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)试剂盒购自南京铁道医学院;荧光分光光度计(美国Beckman)、酶联仪(日本BIO RAD-450);低温离心机Biofuge 28 RS(Heraeus公司)。
1.2 细胞株的培养和实验前准备
1.2.1内皮细胞培养 本实验采用人脐静脉内皮细胞株ECV-304,细胞常规复苏后接种于75ml培养瓶中传代,培养液M199含10%胎牛血清、100U/ml青霉素、100U/ml链霉素、2mg谷氨酰胺,每48h更换培养液1次,培养24~48h用于实验。实验开始前将细胞接种于细胞培养板,在无血清培养液中于37℃5%CO2培养24h。
, 百拇医药
1.2.2 实验细胞分组 将培养板中的细胞随机分成正常对照组(Control):细胞在无血清M199培养;EDS药物对照组(EDS):无血清培养液中只加EDS(终浓度10 μg/ml);TNF致伤组(TNF):无血清培养液中加TNF(终浓度5 000 μ/ml);EDS药物治疗组(TNF+EDS):无血清培养液同时加TNF、EDS(终浓度分别5 000、10 μg/ml);细胞于37 ℃ 5%CO2孵育箱中共同孵育6、12、24 h,最后收集培养上清液待测指标。每组样本数n=6。
1.3 观察指标及方法
1.3.1 TNF对内皮细胞琥珀酸脱氢酶活性的影响[1] ECV-304细胞培养在96孔板(Costar产品)上,用TNF刺激6~48 h,治疗组同时加EDS 10 μg/ml,弃培养上清液后加入噻唑蓝(FLUKA产品,5 mg/ml,PBS)20 μl/每孔,37°C孵育4 h,显微镜下可见黑色结晶形成,加入二甲基亚砜(DMSO)100 μl,混悬使结晶溶解后,避光10 min酶标仪上570 nm波长计光密度(D570)值。
, 百拇医药
1.3.2 内皮细胞培养上清液NO测定[2] 取全部上清液加200 μl 0.1%Rivanol及400 μl 12 mol/L盐酸,加双蒸水至总体积2 ml,520 nm测定吸光度,根据标准曲线计算样本NO含量,以μl/L表示。
1.3.3 细胞培养上清液丙二醛(MDA)含量和超氧化物歧化酶(SOD)活力测定 具体操作按南京铁道医学院MDA、SOD测试药盒说明书进行。
1.3.4 培养上清液乳酸脱氢酶(LDH)活性测定 常规生化法,最后计算105细胞中LDH活性,以光密度值表示。
1.3.5 培养上清液ET测定 ET试剂盒由东亚免疫研究所提供,操作按说明书进行。
1.3.6 内皮细胞ATP、ADP、AMP及能荷(Energy charge,EC)测定 采用反相高效液相色谱分析法测定:细胞取自75 ml细胞培养瓶,常规消化后离心,置预冷的玻璃匀浆器中加入2 ml 10%高氯酸冰浴匀浆,于4°C、15 000×g离心15 min,取上清0.5 ml加入60 μl K2CO3摇匀,4°C 15 000×g离心15 min,取上清上柱测定。Glison高效液相色谱分析仪工作条件:色谱柱Sephrisorb C10 250×4.6 mm;流动相:50 mm PBS,pH 6.5;检测器:UV 260 nm;流速1 ml/min;进样量20 μl。根据ATP、ADP、AMP标准曲线,通过色谱工作站软件计算标本ATP、ADP、AMP含量,以μmol/mg Protion表示,能量负荷则按公式计算。能量负荷(EC)=(ATP+0.5×ADP)/(ATP+ADP+AMP)。
, 百拇医药
1.4 统计学分析
采用华西医科大学医学统计程序包PEMS进行样本均数t检验,结果用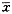 ±s
±s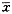 表示。
表示。
2 结果
2.1 TNF刺激后培养HUVEC线粒体琥珀酸脱氢酶的变化(MTT法)
TNF与内皮细胞孵育后内皮细胞琥珀酸脱氢酶随着TNF浓度增高而明显下降,在TNF浓度为5 000 U/ml刺激24 h后线粒体酶活性下降趋势差异显著(P<0.05,n=6)。以后的实验中TNF浓度采用5 000 U/ml。
2.2 TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA、SOD变化及EDS的作用
, 百拇医药
TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA明显升高,SOD降低;而EDS治疗后ET、LDH、NO、MDA降低,SOD则明显升高,见表1。
表1 TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA、SOD变化及EDS作用
Tab 1 Change of ET, LDH, NO, MDA, SOD in supernatant of cultured HUVECs after stimulation with TNF for 24 hours and treatment with EDS
Control
EDS
TNF
TNF+EDS
, 百拇医药
ET
126.1±11.95
134.45±8.69
314.21±4.63*
224.64±1.12# #
LDH
82.308±3.31
84.23±4.3
236.35±8.36*
151.8±7.74# #
, 百拇医药 NO
34.248±1.17
34.238±1.8
68.09±1.38*
65.53±0.51# #
MDA
0.748±0.03
0.65±0.02
1.79±0.01*
0.87±0.01# #
SOD
, http://www.100md.com
55.53±1.8
55.52±1.6
37.06±0.19*
47.58±0.6# #
*:P<0.05 vs control;# #:P<0.01 vs TNF
2.3 TNF刺激培养HUVEC后不同时间其EC变化及EDS的作用
TNF刺激后HUVEC的EC在6 h即降低,随着刺激时间的延长EC降低显著,用 EDS治疗后EC 明显升高,尤其治疗后6 h其EC升高显著,以后随刺激时间延长EDS治疗后的EC虽较0 h 组有所降低,但与损伤组比较仍相差显著,见表2。
, 百拇医药 表2 TNF不同时间刺激培养HUVEC后其EC的改变及
EDS的调节作用
Tab 2 Change of energy charge in cultured HUVECs stimulation
with TNF and treatment with EDS
TNF stimulation time(h)
0
6
12
24
TNF
, 百拇医药
0.866±0.02
0.577±0.03*
0.5±0.01*
0.463±0.02*
TNF+EDS
0.889±0.03
1.0±0.02# #
0.887±0.12# #
0.696±0.02# #
*:P<0.01 vs 0 h;# #:P<0.05 vs TNF
, 百拇医药
3 讨论
3.1 TNF使培养HUVECs损伤,EDS有一定的保护作用
TNF是由单核-巨噬细胞应答各种刺激时所产生的一种细胞因子,其生物活性广泛,与炎症关系密切[3],许多研究已经证实,TNF在感染性休克、恶病质、器官损伤及器官功能衰竭的一系列病理损伤过程中均起着非常重要作用[4]。其作用机制有两种观点:一种认为TNF单独作用能引起内毒素样休克[5~7];另一种观点则认为TNF对机体的损伤作用有赖于内毒素及其它因子的存在[8]。本实验将TNF与HUVEC在无血清的培养液中进行培养,结果培养上清液LDH、ET、MDA、NO均不同程度升高,SOD明显降低,而EDS治疗后LDH、ET、MDA、NO降低,SOD明显升高。提示TNF对培养HUVEC有直接的损伤作用,而EDS对TNF的损伤有一定的保护作用。LDH是一种糖酵解酶,广泛存在于细胞浆中,只有当在细胞膜受到损伤,通透性增高时,胞浆中LDH才大量释放到细胞外,因此EDS治疗后培养液中LDH降低,可能与EDS稳定细胞膜的作用有关。氧自由基对细胞的损害是许多疾病的病理基础之一,氧自由基可与生物膜中的主要成分多价不饱和脂肪酸作用,引发脂质过氧化反应,产生大量脂质过氧化物(LPO)及醛类产物(如丙二醛MDA),进一步损害生物膜;SOD是机体抗自由基的防御系统的主要酶,通过歧化作用消除自由基,SOD的多少反映组织细胞抗自由基氧化损害的能力。EDS治疗后培养液中MDA降低,SOD增加,可能是EDS的抗脂质过氧化作用[9]。
, http://www.100md.com
3.2 TNF对培养HUVEC能量代谢的影响及EDS保护作用的研究
细胞EC是含高能磷酸键的腺苷的比值,作为测定细胞高能磷酸状态的指标,可有效评估组织细胞的能量储备状态,机体生命活动都需要生物能量维持,由食物氧化生成的能量大多以ATP形式储备,严重烧伤后体内能量消耗急剧增加,实质脏器由于血循环障碍和内皮细胞受损以致能量代谢失常,能量储备不足而发生损害。本实验观察了无血清状态下TNF对体外培养的脐静脉内皮细胞的ATP及EC的影响及EDS的保护作用。实验证明:同一浓度的TNF(5 000 U/ml)不同时间刺激培养HUVEC,刺激后6 h ATP、EC就有下降趋势,随时间的延长而降低,刺激24 h能荷值降到最低。而用EDS治疗后培养的HUVEC的EC明显增加,尤其用药早期其能荷增加显著,几乎接近正常。提示TNF对培养HUVEC有直接的损伤作用。而EDS治疗后损伤减轻,能荷增加,说明EDS有一定的膜稳定的作用。EDS最初的发现是昆虫、甲壳动物及其它节肢动物体内分泌的一种蜕皮激素,具有淘汰角质层,代之以新生皮层的作用,后来发现许多植物如牛膝等含有该成分。研究脊椎动物的内分泌学家证明这是类固醇激素样的作用及EDS的抗氧化功能。由于EDS是一种较新的植物药物成分,对其在学上的应用仍处于实验阶段,其机制有待进一步研究。
, 百拇医药
基金项目:国家自然科学基金资助重点项目(39830400)
作者简介:石富胜(1964-),男,山西省大同市人,硕士研究生,主治医师,主要从事烧伤病人血管内皮细胞损伤防治方面的研究,发表论文10余篇。电话:(0352)20141
作者单位:吴旭(附属大坪医院野战外科研究所胸心外科,重庆 400042)
参考文献:
[1] 罗小凤,梁光萍,罗向东,等.类脂A和内毒素对人肾小球内皮细胞线粒体脱氢酶活性的影响[J].第三军医大学学报,1999,21(4):253-255.
[2] 石富胜,杨正国,张明卿,等.山莨菪碱治疗后烧伤病人血管内皮细胞及其功能变化的临床研究[J].解放军医学杂志,1998,(2):101-102.
, 百拇医药
[3] 孙耕耘,毛宝龄,吕宝璋.白细胞介素-1、肿瘤坏死因子与炎症[J].生理科学进展,1993,24(1):23-28.
[4] Fong Y, Lowry S F. Tumor necrosis factor in the pathophysiology of infection and sepsis[J]. Clin Immunol Immunopathol,1990,55(2):157-170.
[5] Maish G O 3rd, Shumate M L, Ehrlich H P, et al. Interleukin-1 receptor antagonist attenuates TNF-induced alterations in wound breaking strength[J]. J Trauma,1999,47(3):533-537.
[6] Krecic Shepard M E, Shepard D R, Mullet D, et al. Gallium nitrate suppresses the production of nitric oxide and liver damage in amurine model of LPS-induced septic shock[J]. Life Sci,1999,65(13):1 359-1 371.
, http://www.100md.com
[7] Skinner R A, Tucker V L, Curry F R, et al. Acute effects of TNF on hydraulic conductivity of mammalian postcapillary venules[J]. J Trauma,1999,47(3):486-491.
[8] 宋新明,白 涛,凌 云,等.肿瘤坏死因子静脉注入对大鼠多器官功能影响的实验观察[J].中国病理生理杂志,1995,11(4):349-352.
[9] 吴 旭,蒋耀光,范士志,等.蜕皮甾酮对缺血缺氧致HUVEC损伤的影响[J].第三军医大学学报,1998,20(4):358-359.
收稿日期:1999-12-24;修回日期:2000-03-07, 百拇医药
单位:石富胜(第三军医大学解放军322医院烧伤科,大同 037006);杨日高(第三军医大学解放军322医院烧伤科,大同 037006);狄桂平(第三军医大学解放军322医院烧伤科,大同 037006);罗向东(第三军医大学附属西南医院烧伤研究所,重庆 400038);杨宗城(第三军医大学附属西南医院烧伤研究所,重庆 400038)
关键词:肿瘤坏死因子;HUVEC;NO;MDA;ET;LDH;能荷;蜕皮甾酮
第三军医大学学报000821
提 要: 目的 观察肿瘤坏死因子(TNF)对体外培养的脐静脉内皮细胞(HUVEC)分泌功能及能量代谢的影响,及应用植物药物成分蜕皮甾酮(EDS)进行防治的效果。方法 ①MTT法检测TNF对培养内皮细胞琥珀酸脱氢酶活性的影响。②内皮细胞培养上清液ET、NO、MDA、LDH、SOD测定。③采用反相高效液相色谱分析法测定内皮细胞ATP、ADP、AMP及能荷。结果 TNF与内皮细胞孵育后低浓度、早期内皮细胞被激活,随着TNF浓度增高MTT明显降低;TNF刺激后培养上清液ET、MDA、LDH、NO明显升高,EDS治疗后降低。TNF低浓度刺激VEC培养上清液SOD明显降低,EDS治疗后SOD升高;TNF同一浓度刺激后,随刺激时间延长HUVEC能量负荷降低,与正常比较12 h后明显降低,而用EDS治疗后各时相点能量负荷明显增加。结论 TNF在无血清状态下刺激后,培养HUVECs分泌功能、能量代谢出现紊乱,EDS治疗后上述紊乱得到一定程度的改善;提示TNF对体外培养的HUVECs可以直接损伤,EDS有一定的抗损伤作用。
, 百拇医药
中图法分类号: R392.11;R977.1 文献标识码: A
Protective effect of ecdysterone on TNF-induced HUVEC in vitro
SHI Fu-sheng, YANG Ri-gao, DI Gui-ping, LUO Xiang-dong, YANG Zhong-cheng, WU Xu
(Department of Burn Injury, No.322 Hospital of PLA, Datong 037006, China)
Abstract: Objective To investigate the effect of TNF on the secretion and energy metabolism of cultured human umbilical vein endothelial cell (HUVEC) and the protective effect of ecdysterone (EDS) on the damages resulting from TNF in vascular endothelial cell (VEC). Methods The effect of TNF on amber acid dehydrogenase activity in cultured VEC was studied with MTT assay. The concentrations of ET, NO, MDA, LDH and SOD were determined. The levels of ATP, ADP and AMP in the supernatant of the VEC culture medium and energy charge (EC) in VEC were measured. Results MTT assay demonstrated that VECs were activated at first and then inhibited after TNF-stimulation. The concentration of ET, NO, MDA and LDH in the supernatant were significantly increased while that of SOD was decreased on the 24 h after TNF-stimulation and EDS could attenuate the increase and decrease above with TNF-stimulation of same concentration. EC of HUVEC was reduced along with the elapse of time and it was significantly lowered compared with normal control, but EDS could markedly increase the EC at every time points. Conclusion The secretion and energy metabolism of cultured HUVEC were in disturbance after serum-free TNF-stimulation, while EDS can improve the disturbance. This indicates TNF can damage cultured HUVECs while EDS can prevent this event.
, 百拇医药
Key words: tumor necrosis factor; human umbilical vein endothelial cell; NO; MDA; ET; LDH; EC; ecdysterone
血管内皮细胞损伤在烧伤脏器损害的发生发展中具有极重要的作用,是导致“缺血再灌注”损伤、最终引起全身多脏器功能损害的重要原因。肿瘤坏死因子(Tumor necrosis factor,TNF)在中毒性休克、全身多脏器功能不全的病理过程中发挥重要作用。因此,如何针对TNF对体外培养血管内皮细胞损伤的防治,对烧伤治疗具有非常重要的意义。蜕皮甾酮(Ecdysterone,EDS)为一种植物药物成分,具有促进上皮增生的作用。我们已经报道EDS在抗凋亡方面的作用,但在TNF对体外培养脐静脉内皮细胞(HUVECs)能量代谢及分泌功能影响中的作用未见报道。
1 材料与方法
1.1 主要试剂及检测仪器
, 百拇医药
人脐静脉内皮细胞株(ECV-304)购于ATCC公司;M199细胞培养液、TNF购自军事医学科学院;细胞培养瓶、96孔培养板购自Sigma公司;胰蛋白酶为DIFCO1∶250;噻唑蓝为FLUKA公司产品;内皮素(ET)试剂盒由北京东亚免疫研究所提供;一氧化氮(NO)、丙二醛(MDA)、超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)试剂盒购自南京铁道医学院;荧光分光光度计(美国Beckman)、酶联仪(日本BIO RAD-450);低温离心机Biofuge 28 RS(Heraeus公司)。
1.2 细胞株的培养和实验前准备
1.2.1内皮细胞培养 本实验采用人脐静脉内皮细胞株ECV-304,细胞常规复苏后接种于75ml培养瓶中传代,培养液M199含10%胎牛血清、100U/ml青霉素、100U/ml链霉素、2mg谷氨酰胺,每48h更换培养液1次,培养24~48h用于实验。实验开始前将细胞接种于细胞培养板,在无血清培养液中于37℃5%CO2培养24h。
, 百拇医药
1.2.2 实验细胞分组 将培养板中的细胞随机分成正常对照组(Control):细胞在无血清M199培养;EDS药物对照组(EDS):无血清培养液中只加EDS(终浓度10 μg/ml);TNF致伤组(TNF):无血清培养液中加TNF(终浓度5 000 μ/ml);EDS药物治疗组(TNF+EDS):无血清培养液同时加TNF、EDS(终浓度分别5 000、10 μg/ml);细胞于37 ℃ 5%CO2孵育箱中共同孵育6、12、24 h,最后收集培养上清液待测指标。每组样本数n=6。
1.3 观察指标及方法
1.3.1 TNF对内皮细胞琥珀酸脱氢酶活性的影响[1] ECV-304细胞培养在96孔板(Costar产品)上,用TNF刺激6~48 h,治疗组同时加EDS 10 μg/ml,弃培养上清液后加入噻唑蓝(FLUKA产品,5 mg/ml,PBS)20 μl/每孔,37°C孵育4 h,显微镜下可见黑色结晶形成,加入二甲基亚砜(DMSO)100 μl,混悬使结晶溶解后,避光10 min酶标仪上570 nm波长计光密度(D570)值。
, 百拇医药
1.3.2 内皮细胞培养上清液NO测定[2] 取全部上清液加200 μl 0.1%Rivanol及400 μl 12 mol/L盐酸,加双蒸水至总体积2 ml,520 nm测定吸光度,根据标准曲线计算样本NO含量,以μl/L表示。
1.3.3 细胞培养上清液丙二醛(MDA)含量和超氧化物歧化酶(SOD)活力测定 具体操作按南京铁道医学院MDA、SOD测试药盒说明书进行。
1.3.4 培养上清液乳酸脱氢酶(LDH)活性测定 常规生化法,最后计算105细胞中LDH活性,以光密度值表示。
1.3.5 培养上清液ET测定 ET试剂盒由东亚免疫研究所提供,操作按说明书进行。
1.3.6 内皮细胞ATP、ADP、AMP及能荷(Energy charge,EC)测定 采用反相高效液相色谱分析法测定:细胞取自75 ml细胞培养瓶,常规消化后离心,置预冷的玻璃匀浆器中加入2 ml 10%高氯酸冰浴匀浆,于4°C、15 000×g离心15 min,取上清0.5 ml加入60 μl K2CO3摇匀,4°C 15 000×g离心15 min,取上清上柱测定。Glison高效液相色谱分析仪工作条件:色谱柱Sephrisorb C10 250×4.6 mm;流动相:50 mm PBS,pH 6.5;检测器:UV 260 nm;流速1 ml/min;进样量20 μl。根据ATP、ADP、AMP标准曲线,通过色谱工作站软件计算标本ATP、ADP、AMP含量,以μmol/mg Protion表示,能量负荷则按公式计算。能量负荷(EC)=(ATP+0.5×ADP)/(ATP+ADP+AMP)。
, 百拇医药
1.4 统计学分析
采用华西医科大学医学统计程序包PEMS进行样本均数t检验,结果用
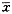 ±s
±s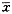 表示。
表示。2 结果
2.1 TNF刺激后培养HUVEC线粒体琥珀酸脱氢酶的变化(MTT法)
TNF与内皮细胞孵育后内皮细胞琥珀酸脱氢酶随着TNF浓度增高而明显下降,在TNF浓度为5 000 U/ml刺激24 h后线粒体酶活性下降趋势差异显著(P<0.05,n=6)。以后的实验中TNF浓度采用5 000 U/ml。
2.2 TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA、SOD变化及EDS的作用
, 百拇医药
TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA明显升高,SOD降低;而EDS治疗后ET、LDH、NO、MDA降低,SOD则明显升高,见表1。
表1 TNF刺激24 h后培养HUVEC上清液ET、LDH、NO、MDA、SOD变化及EDS作用
Tab 1 Change of ET, LDH, NO, MDA, SOD in supernatant of cultured HUVECs after stimulation with TNF for 24 hours and treatment with EDS
Control
EDS
TNF
TNF+EDS
, 百拇医药
ET
126.1±11.95
134.45±8.69
314.21±4.63*
224.64±1.12# #
LDH
82.308±3.31
84.23±4.3
236.35±8.36*
151.8±7.74# #
, 百拇医药 NO
34.248±1.17
34.238±1.8
68.09±1.38*
65.53±0.51# #
MDA
0.748±0.03
0.65±0.02
1.79±0.01*
0.87±0.01# #
SOD
, http://www.100md.com
55.53±1.8
55.52±1.6
37.06±0.19*
47.58±0.6# #
*:P<0.05 vs control;# #:P<0.01 vs TNF
2.3 TNF刺激培养HUVEC后不同时间其EC变化及EDS的作用
TNF刺激后HUVEC的EC在6 h即降低,随着刺激时间的延长EC降低显著,用 EDS治疗后EC 明显升高,尤其治疗后6 h其EC升高显著,以后随刺激时间延长EDS治疗后的EC虽较0 h 组有所降低,但与损伤组比较仍相差显著,见表2。
, 百拇医药 表2 TNF不同时间刺激培养HUVEC后其EC的改变及
EDS的调节作用
Tab 2 Change of energy charge in cultured HUVECs stimulation
with TNF and treatment with EDS
TNF stimulation time(h)
0
6
12
24
TNF
, 百拇医药
0.866±0.02
0.577±0.03*
0.5±0.01*
0.463±0.02*
TNF+EDS
0.889±0.03
1.0±0.02# #
0.887±0.12# #
0.696±0.02# #
*:P<0.01 vs 0 h;# #:P<0.05 vs TNF
, 百拇医药
3 讨论
3.1 TNF使培养HUVECs损伤,EDS有一定的保护作用
TNF是由单核-巨噬细胞应答各种刺激时所产生的一种细胞因子,其生物活性广泛,与炎症关系密切[3],许多研究已经证实,TNF在感染性休克、恶病质、器官损伤及器官功能衰竭的一系列病理损伤过程中均起着非常重要作用[4]。其作用机制有两种观点:一种认为TNF单独作用能引起内毒素样休克[5~7];另一种观点则认为TNF对机体的损伤作用有赖于内毒素及其它因子的存在[8]。本实验将TNF与HUVEC在无血清的培养液中进行培养,结果培养上清液LDH、ET、MDA、NO均不同程度升高,SOD明显降低,而EDS治疗后LDH、ET、MDA、NO降低,SOD明显升高。提示TNF对培养HUVEC有直接的损伤作用,而EDS对TNF的损伤有一定的保护作用。LDH是一种糖酵解酶,广泛存在于细胞浆中,只有当在细胞膜受到损伤,通透性增高时,胞浆中LDH才大量释放到细胞外,因此EDS治疗后培养液中LDH降低,可能与EDS稳定细胞膜的作用有关。氧自由基对细胞的损害是许多疾病的病理基础之一,氧自由基可与生物膜中的主要成分多价不饱和脂肪酸作用,引发脂质过氧化反应,产生大量脂质过氧化物(LPO)及醛类产物(如丙二醛MDA),进一步损害生物膜;SOD是机体抗自由基的防御系统的主要酶,通过歧化作用消除自由基,SOD的多少反映组织细胞抗自由基氧化损害的能力。EDS治疗后培养液中MDA降低,SOD增加,可能是EDS的抗脂质过氧化作用[9]。
, http://www.100md.com
3.2 TNF对培养HUVEC能量代谢的影响及EDS保护作用的研究
细胞EC是含高能磷酸键的腺苷的比值,作为测定细胞高能磷酸状态的指标,可有效评估组织细胞的能量储备状态,机体生命活动都需要生物能量维持,由食物氧化生成的能量大多以ATP形式储备,严重烧伤后体内能量消耗急剧增加,实质脏器由于血循环障碍和内皮细胞受损以致能量代谢失常,能量储备不足而发生损害。本实验观察了无血清状态下TNF对体外培养的脐静脉内皮细胞的ATP及EC的影响及EDS的保护作用。实验证明:同一浓度的TNF(5 000 U/ml)不同时间刺激培养HUVEC,刺激后6 h ATP、EC就有下降趋势,随时间的延长而降低,刺激24 h能荷值降到最低。而用EDS治疗后培养的HUVEC的EC明显增加,尤其用药早期其能荷增加显著,几乎接近正常。提示TNF对培养HUVEC有直接的损伤作用。而EDS治疗后损伤减轻,能荷增加,说明EDS有一定的膜稳定的作用。EDS最初的发现是昆虫、甲壳动物及其它节肢动物体内分泌的一种蜕皮激素,具有淘汰角质层,代之以新生皮层的作用,后来发现许多植物如牛膝等含有该成分。研究脊椎动物的内分泌学家证明这是类固醇激素样的作用及EDS的抗氧化功能。由于EDS是一种较新的植物药物成分,对其在学上的应用仍处于实验阶段,其机制有待进一步研究。
, 百拇医药
基金项目:国家自然科学基金资助重点项目(39830400)
作者简介:石富胜(1964-),男,山西省大同市人,硕士研究生,主治医师,主要从事烧伤病人血管内皮细胞损伤防治方面的研究,发表论文10余篇。电话:(0352)20141
作者单位:吴旭(附属大坪医院野战外科研究所胸心外科,重庆 400042)
参考文献:
[1] 罗小凤,梁光萍,罗向东,等.类脂A和内毒素对人肾小球内皮细胞线粒体脱氢酶活性的影响[J].第三军医大学学报,1999,21(4):253-255.
[2] 石富胜,杨正国,张明卿,等.山莨菪碱治疗后烧伤病人血管内皮细胞及其功能变化的临床研究[J].解放军医学杂志,1998,(2):101-102.
, 百拇医药
[3] 孙耕耘,毛宝龄,吕宝璋.白细胞介素-1、肿瘤坏死因子与炎症[J].生理科学进展,1993,24(1):23-28.
[4] Fong Y, Lowry S F. Tumor necrosis factor in the pathophysiology of infection and sepsis[J]. Clin Immunol Immunopathol,1990,55(2):157-170.
[5] Maish G O 3rd, Shumate M L, Ehrlich H P, et al. Interleukin-1 receptor antagonist attenuates TNF-induced alterations in wound breaking strength[J]. J Trauma,1999,47(3):533-537.
[6] Krecic Shepard M E, Shepard D R, Mullet D, et al. Gallium nitrate suppresses the production of nitric oxide and liver damage in amurine model of LPS-induced septic shock[J]. Life Sci,1999,65(13):1 359-1 371.
, http://www.100md.com
[7] Skinner R A, Tucker V L, Curry F R, et al. Acute effects of TNF on hydraulic conductivity of mammalian postcapillary venules[J]. J Trauma,1999,47(3):486-491.
[8] 宋新明,白 涛,凌 云,等.肿瘤坏死因子静脉注入对大鼠多器官功能影响的实验观察[J].中国病理生理杂志,1995,11(4):349-352.
[9] 吴 旭,蒋耀光,范士志,等.蜕皮甾酮对缺血缺氧致HUVEC损伤的影响[J].第三军医大学学报,1998,20(4):358-359.
收稿日期:1999-12-24;修回日期:2000-03-07, 百拇医药