维甲酸对肺纤维化大鼠肺成纤维细胞胶原表达的调控机制
王海斌 何冰 陈建 李永春
摘 要 目的 研究维甲酸(RA)对肺纤维化大鼠肺成纤维细胞胶原表达的影响及机制。方法 正常组、纤维化组和RA治疗组3组大鼠分别于肺纤维化模型制备后d 28处死,取肺组织进行肺成纤维细胞的原代培养。用Northern blot方法检测原代培养肺成纤维细胞前胶原α1(Ⅰ)mRNA表达,[3H]-脯氨酸参入法测定胶原蛋白合成,凝胶迁移率法检测核因子AP-1活性,RT-PCR方法测维甲酸受体的mRNA表达。结果 RA可诱导肺成纤维细胞RXRα mRNA的表达,使肺纤维化时增高的AP-1活性下调,并抑制前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成。结论 肺纤维化时肺成纤维细胞AP-1活性增高可能是导致胶原过度表达的重要机制。RA可能通过诱导肺成纤维细胞RXRα的表达使增高的AP-1活性得以抑制,从而下调胶原基因的表达。
, 百拇医药
关键词:维甲酸 肺纤维化 肺成纤维细胞 胶原蛋白 核因子AP-1
无论肺纤维化的病因如何,其结局均为肺成纤维细胞的聚集及胶原等细胞外基质的过度沉积,而肺成纤维细胞又是肺内胶原合成的主要细胞。因此,研究肺成纤维细胞胶原表达的调控机制并施以药物干预,有望为肺间质纤维化的治疗带来突破性的进展。近年来,维甲酸(RA)对胶原产生的调节作用日渐引起人们的重视。我们最近的研究结果表明,RA可抑制博来霉素致大鼠肺纤维化的发生发展[1],为进一步研究RA抗肺纤维化的机制,我们在用RA防治博来霉素致大鼠肺纤维化28 d后,取肺组织进行肺成纤维细胞原代培养,观察了RA对肺纤维化大鼠肺成纤维细胞I型前胶原基因表达及胶原蛋白合成的作用,并同时检测了肺成纤维细胞核转录因子激活蛋白-1(activating protein-1,AP-1)活性及6种维甲酸受体的mRNA表达,以从细胞水平探讨RA对胶原表达的调控机制。
1 材料与方法
, http://www.100md.com
1.1 主要材料 博来霉素(每支8 mg,天津太河制药有限公司,批号:970403),维甲酸胶囊(每粒10 mg,中国重庆华邦制药有限公司,批号:970701)。AP-1寡核苷酸探针(购自美国Promega公司,碱基序列为5' GTAAAGCATGAGTCAGACACC 3'),RT-PCR中所用7对引物由中科院微生物所合成,其碱基序列及引用文献见表1。
1.2 动物模型制备及肺成纤维细胞的原代培养 Wistar ♂大鼠30只(北京医科大学实验动物中心提供),体重250~300 g,随机分为以下3组各10只:①正常组;②纤维化组(BLM组);③RA治疗组(RA组)。②、③组大鼠经乙醚麻醉,气管插管,气管内一次性注入博来霉素5 mg*kg-1,制成肺间质纤维化模型,而正常组大鼠在同样实验条件下,经气管内插管注入等量生理盐水0.5 ml。RA治疗组大鼠气管内注入博来霉素后,即经胃管给予RA治疗,剂量为20 mg*kg-1,以后每日1次,每周复查体重以调整给药量。3组大鼠于模型制备后28 d经腹主动脉放血法处死,破胸分离肺脏及心脏,每鼠均以灭菌的PBS右心室灌注至肺变白为止。分离气管并插管,用100 ml预温至37℃的PBS行支气管肺泡灌洗,取肺组织进行病理学检查及肺成纤维细胞的原代培养,至其长成交汇状且占95%时提取总RNA和核蛋白。
, http://www.100md.com
1.3 观察指标及方法
1.3.1 前胶原α1(Ⅰ) mRNA表达 Northern杂交法。按异硫氰双胍一步法提取肺成纤维细胞总RNA。鼠前胶原α1(Ⅰ) cDNA探针,质粒载体puc18,850 bp,酶切位点Xhol,用随机引物法标记探针,进行Northern杂交分析,杂交带密度扫描计算相对含量。
1.3.2 胶原蛋白合成测定 [3H]-脯氨酸参入法。分别将3组肺成纤维细胞调至每孔1.5×105个,接种于24孔板,12 h后换无血清培养,继续培养48 h后,每孔加[3H]-脯氨酸2微居,再孵育24 h。收集上清,测每分钟闪烁计数值。
1.3.3 核蛋白提取[4]及AP-1活性测定[5] 按Schreiber的快速核蛋白提取法提取肺成纤维细胞核蛋白。用凝胶迁移方法(Gel mobility shift assay)测AP-1活性。用凝胶阻滞试验(Supershift assay)鉴定核蛋白与AP-1寡核苷酸链结合的特异性。
, 百拇医药
Tab 1 Primers used in RT-PCR
Gene Sense
Antisense
Expected product size(bp)
Ref
RAR-α CAGATGCACAACGCTGGC
CCGACTGTCCGCTTAGAG
397
2
RAR-β ATGCTGGCTTCGGTCCTC
, http://www.100md.com
CTGCAGCAGTGGTGACTG
470
2
RAR-γ GTGGAGACCGAATGGACC
GACAGGGATGAACACAGG
521
2
RXR-α CAATGGCGTCCTCAAGGTTC
ACTCCACCTCGTTCTCATTC
326
3
, 百拇医药
RXR-β AGATCAACTCCACAGTGTCG
TCTCCATCCCCGTCTTTGTC
388
3
RXR-γ CATCACTTCTGCCATGGGTC
ACTGGCACATTCTGCCTCAC
469
3
β-Actin GAGCTATGAGCTGCCTGACG
AGCACTTGCGGTCCACGAT
, 百拇医药
410
2
1.3.4 维甲酸受体的mRNA表达 RT-PCR法。逆转录反应体系20 μl含RNA 5 μg, oligo(dT)15 0.1 μg, RNA酶抑制剂20 U, MMLV 200 U, 25 mmol*L-1 dNTP 0.16 μl, 5×反应缓冲液4 μl, 37℃反应60 min,将RNA逆转录为cDNA。50 μl PCR反应体系含cDNA 2 μl , 上、下游引物各50 pmol, 25 mmol*L-1 dNTP 0.4 μl, Taq酶2.5 U, 25 mmol*L-1镁离子3 μl,10×反应缓冲液5 μl,每一PCR循环包括94℃变性45 s,55℃退火30 s,72℃延伸90 s,35个循环后继续72℃延伸10 min。PCR扩增产物经20 g*L-1琼脂糖凝胶电泳分析,结果用凝胶图像扫描仪测各条泳带光密度值,计算维甲酸受体mRNA的相对含量。
, 百拇医药
2 结果
2.1 RA对肺成纤维细胞前胶原α1(Ⅰ)mRNA表达的影响 Northern杂交结果显示,纤维化组大鼠肺成纤维细胞前胶原α1(Ⅰ)mRNA表达较正常组明显增高(P<0.01),而RA治疗组则较纤维化组明显下降(P<0.05,见图1)。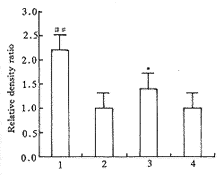
Fig 1 The effect of retinoic acid on the procollagen α1(Ⅰ)mRNA
expression of lung fibroblasts in the rats with pulmonary fibrosis
, http://www.100md.com column 1: fibrosis group; column 2、4: normal group; column 3: treatment group. Relative density ratio means the procollagen α1(Ⅰ)mRNA expression corrected by the β-actin mRNA expression from the same sample, compared between normal and fibrosis groups, ##P<0.01; compared between treatment and fibrosis groups, *P<0.05
2.2 RA对肺成纤维细胞胶原蛋白合成的影响 [3H]-脯氨酸参入试验显示,纤维化组大鼠肺成纤维细胞培养上清每分钟闪烁计数值较正常组明显增加〔(77104±13354) vs (31433±12098), P<0.01)〕 ,表明胶原蛋白合成增多;RA治疗组肺成纤维细胞胶原蛋白合成则较纤维化组下降 〔(46 559±10 432) vs (77 104±13 354), P<0.05)〕。
, http://www.100md.com
2.3 RA对肺成纤维细胞AP-1活性的影响 纤维化组大鼠肺成纤维细胞 AP-1活性较正常组增高;RA治疗后可使增高的AP-1活性下降。Supershift assay结果显示有滞后条带出现,表明核蛋白与AP-1寡核苷酸链的结合是特异性的(见图2)。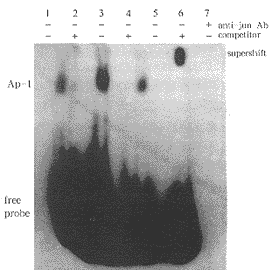
Fig 2 The effect of retinoic acid on the activity of nuclear factor
AP-1 of lung fibroblasts in the rats with pulmonary fibrosis
lane 1: normal group; lane 2: treatment group; lane 3: fibrosis group; lane 5: only with 32P-labeled AP-1 probe, without nuclear protein; lane 4、6: the results of supershift assay
, 百拇医药
2.4 维甲酸受体mRNA在肺成纤维细胞中的表达 6种维甲酸核受体除RXRα未测到外,余均在正常大鼠肺成纤维细胞中表达。纤维化组大鼠肺成纤维细胞维甲酸受体表达与正常组相比无差异。RA治疗后则可诱导RXRα的mRNA表达,而对其它核受体的表达无明显影响。
3 讨论
博莱霉素复制的大鼠肺间质纤维化模型与人类肺间质纤维化的病理过程相似,成为国际上普遍采用的方法。本实验肺组织病理学检查见纤维化组大鼠肺间质纤维增生明显,肺泡结构异常,部分塌陷或消失,间质出现大量胶原纤维和成纤维细胞,表明肺纤维化模型制备是成功的。
体外研究发现,RA可减低人肺成纤维细胞I型胶原mRNA的转录及成熟mRNA的稳定性,且抑制TGF-β诱导的I型胶原的合成[6] ,但RA在复杂的体内环境中对肺成纤维细胞表达胶原的作用如何,尚未见报道。原代培养的肺成纤维细胞刚离开机体,生物学性状与原体内细胞比较接近,能更好地反映药物在体内对其功能的影响。
, 百拇医药
Ⅰ型胶原是肺纤维化时细胞外基质的主要成分,其组分前胶原α1(Ⅰ)基因启动子中含有核转录因子AP-1的结合位点,AP-1活性增高可促使前胶原α1(Ⅰ)基因表达[7]。本实验分别用3组大鼠肺组织原代培养的肺成纤维细胞核提取物与AP-1识别的寡核苷酸序列共同孵育后,发现纤维化组的核提取物AP-1结合活性较正常组明显增强,肺成纤维细胞前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成也相应地增加;RA治疗后,可使增高的AP-1活性下调,伴随着肺成纤维细胞前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成相应地减少。由此可见,肺纤维化时肺成纤维细胞AP-1活性增高可能是导致其胶原过度表达的重要机制;而RA抑制肺成纤维细胞胶原的表达可能是通过下调AP-1的活性来介导的。
RA在体内通过与维甲酸受体(包括RARα、β、γ及RXRα、β、γ)结合而发挥其生物学效应。维甲酸受体作为配体依赖性的核转录因子,除通过直接与维甲酸反应元件(RARE)结合来调控靶基因的转录活性外,还参与对细胞内其它转录因子的调节,尤其是对核因子AP-1的调节。维甲酸受体与AP-1是一对有相互拮抗作用的核转录因子,维甲酸受体的表达增加可抑制AP-1应答基因的转录[8],且这种抑制作用可被维甲酸受体拮抗剂所逆转[9]。为进一步研究RA调节肺成纤维细胞AP-1活性是否与维甲酸受体的改变有关,我们用RT-PCR的方法检测了肺成纤维细胞所有维甲酸受体的mRNA表达。结果表明,正常组和纤维化组大鼠肺成纤维细胞未测到的RXRα可在RA的诱导下表达,而RXRα/RARs二聚体被认为是拮抗AP-1活性的主要形式[10]。由此推测,RA下调AP-1活性可能是通过诱导肺成纤维细胞RXRα的表达来实现的。
, 百拇医药
综上所述,肺纤维化时,肺成纤维细胞胶原的过度表达与核转录因子AP-1活性增高密切相关;RA可能通过诱导其自身核受体的表达使增高的AP-1活性得以抑制,从而下调肺成纤维细胞胶原基因的表达。
作者简介:王海斌,男,34岁,博士生;
何冰,女,67岁,教授,博士生导师
王海斌(北京医科大学附属第一医院呼吸内科,北京 100034)
何冰(北京医科大学附属第一医院呼吸内科,北京 100034)
陈建(北京医科大学附属第一医院呼吸内科,北京 100034)
李永春(北京医科大学附属第一医院呼吸内科,北京 100034)
, 百拇医药 参考文献
1.王海斌,何 冰,陈 建 et al.维甲酸治疗肺间质纤维化的实验研究. 基础医学与临床,1999;19:533~7
2.Wan YJ, Wang YL, Wu CJ. Detection of retinoic acid receptor mRNA in rat tissues by reverse transcriptase-polymerase chain reaction, J Mol Endocrinol. 1992;15:336~42
3.Mangelsdorf DJ, Borgmeyer U, Heymen RA et al. Characterization of three RXR genes that mediate the action of 9-cis retinoic acid. Genes & Cev, 1992;6:329~44
, http://www.100md.com
4.Schreiber E, Matthias P,Michael M et al. Rapid detection of octamer bindingproteins with "mini-extracts", prepared for a small number of cells. Nucleic Acids Research, 1989;17:6419
5.Asanuma M, Kondo Y, Nishibayashi S. Aged-related changes in composition of transcription factor, AP-1 complex in the rat brain. Neuroscience Letters, 1995;201:127~30
6.Krupsky M, Fine A, Berk JK et al. Retinoic acid-induced inhibition of type I collagen gene expression in human lung fibroblasts. Biochimim et Bioph Acta, 1994;1219:335~41
, http://www.100md.com
7.Borunda JA, Simkevich CP, Boy N et al. Activation of Ito cells involves regulation of AP-1 binding proteins and induction of type I collagen gene expression. Biochem J, 1994;304:817~21
8.Schule R, Rangarajan P, Yang N et al. Retinoic acid is a negative regulator of AP-1-responsive genes. Proc Natl Acad Sci, 1991;88:6092~6
9.Lee HY, Walsh GL, Dawson MI et al. All-trans-retinoic acid inhibits jun N-terminal kinase-dependent signaling pathways. J Bio Chem, 1998;273:7066~71
10.Salbert G, Fanjul A, Piedrafita FJ et al. Retinoic acid receptors and retinoid X receptor-α down-regulate the transforming growth factor-α1 promoter by antagonizing AP-1 activity. Mol Endo, 1993;7:1347~56, http://www.100md.com
摘 要 目的 研究维甲酸(RA)对肺纤维化大鼠肺成纤维细胞胶原表达的影响及机制。方法 正常组、纤维化组和RA治疗组3组大鼠分别于肺纤维化模型制备后d 28处死,取肺组织进行肺成纤维细胞的原代培养。用Northern blot方法检测原代培养肺成纤维细胞前胶原α1(Ⅰ)mRNA表达,[3H]-脯氨酸参入法测定胶原蛋白合成,凝胶迁移率法检测核因子AP-1活性,RT-PCR方法测维甲酸受体的mRNA表达。结果 RA可诱导肺成纤维细胞RXRα mRNA的表达,使肺纤维化时增高的AP-1活性下调,并抑制前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成。结论 肺纤维化时肺成纤维细胞AP-1活性增高可能是导致胶原过度表达的重要机制。RA可能通过诱导肺成纤维细胞RXRα的表达使增高的AP-1活性得以抑制,从而下调胶原基因的表达。
, 百拇医药
关键词:维甲酸 肺纤维化 肺成纤维细胞 胶原蛋白 核因子AP-1
无论肺纤维化的病因如何,其结局均为肺成纤维细胞的聚集及胶原等细胞外基质的过度沉积,而肺成纤维细胞又是肺内胶原合成的主要细胞。因此,研究肺成纤维细胞胶原表达的调控机制并施以药物干预,有望为肺间质纤维化的治疗带来突破性的进展。近年来,维甲酸(RA)对胶原产生的调节作用日渐引起人们的重视。我们最近的研究结果表明,RA可抑制博来霉素致大鼠肺纤维化的发生发展[1],为进一步研究RA抗肺纤维化的机制,我们在用RA防治博来霉素致大鼠肺纤维化28 d后,取肺组织进行肺成纤维细胞原代培养,观察了RA对肺纤维化大鼠肺成纤维细胞I型前胶原基因表达及胶原蛋白合成的作用,并同时检测了肺成纤维细胞核转录因子激活蛋白-1(activating protein-1,AP-1)活性及6种维甲酸受体的mRNA表达,以从细胞水平探讨RA对胶原表达的调控机制。
1 材料与方法
, http://www.100md.com
1.1 主要材料 博来霉素(每支8 mg,天津太河制药有限公司,批号:970403),维甲酸胶囊(每粒10 mg,中国重庆华邦制药有限公司,批号:970701)。AP-1寡核苷酸探针(购自美国Promega公司,碱基序列为5' GTAAAGCATGAGTCAGACACC 3'),RT-PCR中所用7对引物由中科院微生物所合成,其碱基序列及引用文献见表1。
1.2 动物模型制备及肺成纤维细胞的原代培养 Wistar ♂大鼠30只(北京医科大学实验动物中心提供),体重250~300 g,随机分为以下3组各10只:①正常组;②纤维化组(BLM组);③RA治疗组(RA组)。②、③组大鼠经乙醚麻醉,气管插管,气管内一次性注入博来霉素5 mg*kg-1,制成肺间质纤维化模型,而正常组大鼠在同样实验条件下,经气管内插管注入等量生理盐水0.5 ml。RA治疗组大鼠气管内注入博来霉素后,即经胃管给予RA治疗,剂量为20 mg*kg-1,以后每日1次,每周复查体重以调整给药量。3组大鼠于模型制备后28 d经腹主动脉放血法处死,破胸分离肺脏及心脏,每鼠均以灭菌的PBS右心室灌注至肺变白为止。分离气管并插管,用100 ml预温至37℃的PBS行支气管肺泡灌洗,取肺组织进行病理学检查及肺成纤维细胞的原代培养,至其长成交汇状且占95%时提取总RNA和核蛋白。
, http://www.100md.com
1.3 观察指标及方法
1.3.1 前胶原α1(Ⅰ) mRNA表达 Northern杂交法。按异硫氰双胍一步法提取肺成纤维细胞总RNA。鼠前胶原α1(Ⅰ) cDNA探针,质粒载体puc18,850 bp,酶切位点Xhol,用随机引物法标记探针,进行Northern杂交分析,杂交带密度扫描计算相对含量。
1.3.2 胶原蛋白合成测定 [3H]-脯氨酸参入法。分别将3组肺成纤维细胞调至每孔1.5×105个,接种于24孔板,12 h后换无血清培养,继续培养48 h后,每孔加[3H]-脯氨酸2微居,再孵育24 h。收集上清,测每分钟闪烁计数值。
1.3.3 核蛋白提取[4]及AP-1活性测定[5] 按Schreiber的快速核蛋白提取法提取肺成纤维细胞核蛋白。用凝胶迁移方法(Gel mobility shift assay)测AP-1活性。用凝胶阻滞试验(Supershift assay)鉴定核蛋白与AP-1寡核苷酸链结合的特异性。
, 百拇医药
Tab 1 Primers used in RT-PCR
Gene Sense
Antisense
Expected product size(bp)
Ref
RAR-α CAGATGCACAACGCTGGC
CCGACTGTCCGCTTAGAG
397
2
RAR-β ATGCTGGCTTCGGTCCTC
, http://www.100md.com
CTGCAGCAGTGGTGACTG
470
2
RAR-γ GTGGAGACCGAATGGACC
GACAGGGATGAACACAGG
521
2
RXR-α CAATGGCGTCCTCAAGGTTC
ACTCCACCTCGTTCTCATTC
326
3
, 百拇医药
RXR-β AGATCAACTCCACAGTGTCG
TCTCCATCCCCGTCTTTGTC
388
3
RXR-γ CATCACTTCTGCCATGGGTC
ACTGGCACATTCTGCCTCAC
469
3
β-Actin GAGCTATGAGCTGCCTGACG
AGCACTTGCGGTCCACGAT
, 百拇医药
410
2
1.3.4 维甲酸受体的mRNA表达 RT-PCR法。逆转录反应体系20 μl含RNA 5 μg, oligo(dT)15 0.1 μg, RNA酶抑制剂20 U, MMLV 200 U, 25 mmol*L-1 dNTP 0.16 μl, 5×反应缓冲液4 μl, 37℃反应60 min,将RNA逆转录为cDNA。50 μl PCR反应体系含cDNA 2 μl , 上、下游引物各50 pmol, 25 mmol*L-1 dNTP 0.4 μl, Taq酶2.5 U, 25 mmol*L-1镁离子3 μl,10×反应缓冲液5 μl,每一PCR循环包括94℃变性45 s,55℃退火30 s,72℃延伸90 s,35个循环后继续72℃延伸10 min。PCR扩增产物经20 g*L-1琼脂糖凝胶电泳分析,结果用凝胶图像扫描仪测各条泳带光密度值,计算维甲酸受体mRNA的相对含量。
, 百拇医药
2 结果
2.1 RA对肺成纤维细胞前胶原α1(Ⅰ)mRNA表达的影响 Northern杂交结果显示,纤维化组大鼠肺成纤维细胞前胶原α1(Ⅰ)mRNA表达较正常组明显增高(P<0.01),而RA治疗组则较纤维化组明显下降(P<0.05,见图1)。

Fig 1 The effect of retinoic acid on the procollagen α1(Ⅰ)mRNA
expression of lung fibroblasts in the rats with pulmonary fibrosis
, http://www.100md.com column 1: fibrosis group; column 2、4: normal group; column 3: treatment group. Relative density ratio means the procollagen α1(Ⅰ)mRNA expression corrected by the β-actin mRNA expression from the same sample, compared between normal and fibrosis groups, ##P<0.01; compared between treatment and fibrosis groups, *P<0.05
2.2 RA对肺成纤维细胞胶原蛋白合成的影响 [3H]-脯氨酸参入试验显示,纤维化组大鼠肺成纤维细胞培养上清每分钟闪烁计数值较正常组明显增加〔(77104±13354) vs (31433±12098), P<0.01)〕 ,表明胶原蛋白合成增多;RA治疗组肺成纤维细胞胶原蛋白合成则较纤维化组下降 〔(46 559±10 432) vs (77 104±13 354), P<0.05)〕。
, http://www.100md.com
2.3 RA对肺成纤维细胞AP-1活性的影响 纤维化组大鼠肺成纤维细胞 AP-1活性较正常组增高;RA治疗后可使增高的AP-1活性下降。Supershift assay结果显示有滞后条带出现,表明核蛋白与AP-1寡核苷酸链的结合是特异性的(见图2)。

Fig 2 The effect of retinoic acid on the activity of nuclear factor
AP-1 of lung fibroblasts in the rats with pulmonary fibrosis
lane 1: normal group; lane 2: treatment group; lane 3: fibrosis group; lane 5: only with 32P-labeled AP-1 probe, without nuclear protein; lane 4、6: the results of supershift assay
, 百拇医药
2.4 维甲酸受体mRNA在肺成纤维细胞中的表达 6种维甲酸核受体除RXRα未测到外,余均在正常大鼠肺成纤维细胞中表达。纤维化组大鼠肺成纤维细胞维甲酸受体表达与正常组相比无差异。RA治疗后则可诱导RXRα的mRNA表达,而对其它核受体的表达无明显影响。
3 讨论
博莱霉素复制的大鼠肺间质纤维化模型与人类肺间质纤维化的病理过程相似,成为国际上普遍采用的方法。本实验肺组织病理学检查见纤维化组大鼠肺间质纤维增生明显,肺泡结构异常,部分塌陷或消失,间质出现大量胶原纤维和成纤维细胞,表明肺纤维化模型制备是成功的。
体外研究发现,RA可减低人肺成纤维细胞I型胶原mRNA的转录及成熟mRNA的稳定性,且抑制TGF-β诱导的I型胶原的合成[6] ,但RA在复杂的体内环境中对肺成纤维细胞表达胶原的作用如何,尚未见报道。原代培养的肺成纤维细胞刚离开机体,生物学性状与原体内细胞比较接近,能更好地反映药物在体内对其功能的影响。
, 百拇医药
Ⅰ型胶原是肺纤维化时细胞外基质的主要成分,其组分前胶原α1(Ⅰ)基因启动子中含有核转录因子AP-1的结合位点,AP-1活性增高可促使前胶原α1(Ⅰ)基因表达[7]。本实验分别用3组大鼠肺组织原代培养的肺成纤维细胞核提取物与AP-1识别的寡核苷酸序列共同孵育后,发现纤维化组的核提取物AP-1结合活性较正常组明显增强,肺成纤维细胞前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成也相应地增加;RA治疗后,可使增高的AP-1活性下调,伴随着肺成纤维细胞前胶原α1(Ⅰ)mRNA表达及胶原蛋白合成相应地减少。由此可见,肺纤维化时肺成纤维细胞AP-1活性增高可能是导致其胶原过度表达的重要机制;而RA抑制肺成纤维细胞胶原的表达可能是通过下调AP-1的活性来介导的。
RA在体内通过与维甲酸受体(包括RARα、β、γ及RXRα、β、γ)结合而发挥其生物学效应。维甲酸受体作为配体依赖性的核转录因子,除通过直接与维甲酸反应元件(RARE)结合来调控靶基因的转录活性外,还参与对细胞内其它转录因子的调节,尤其是对核因子AP-1的调节。维甲酸受体与AP-1是一对有相互拮抗作用的核转录因子,维甲酸受体的表达增加可抑制AP-1应答基因的转录[8],且这种抑制作用可被维甲酸受体拮抗剂所逆转[9]。为进一步研究RA调节肺成纤维细胞AP-1活性是否与维甲酸受体的改变有关,我们用RT-PCR的方法检测了肺成纤维细胞所有维甲酸受体的mRNA表达。结果表明,正常组和纤维化组大鼠肺成纤维细胞未测到的RXRα可在RA的诱导下表达,而RXRα/RARs二聚体被认为是拮抗AP-1活性的主要形式[10]。由此推测,RA下调AP-1活性可能是通过诱导肺成纤维细胞RXRα的表达来实现的。
, 百拇医药
综上所述,肺纤维化时,肺成纤维细胞胶原的过度表达与核转录因子AP-1活性增高密切相关;RA可能通过诱导其自身核受体的表达使增高的AP-1活性得以抑制,从而下调肺成纤维细胞胶原基因的表达。
作者简介:王海斌,男,34岁,博士生;
何冰,女,67岁,教授,博士生导师
王海斌(北京医科大学附属第一医院呼吸内科,北京 100034)
何冰(北京医科大学附属第一医院呼吸内科,北京 100034)
陈建(北京医科大学附属第一医院呼吸内科,北京 100034)
李永春(北京医科大学附属第一医院呼吸内科,北京 100034)
, 百拇医药 参考文献
1.王海斌,何 冰,陈 建 et al.维甲酸治疗肺间质纤维化的实验研究. 基础医学与临床,1999;19:533~7
2.Wan YJ, Wang YL, Wu CJ. Detection of retinoic acid receptor mRNA in rat tissues by reverse transcriptase-polymerase chain reaction, J Mol Endocrinol. 1992;15:336~42
3.Mangelsdorf DJ, Borgmeyer U, Heymen RA et al. Characterization of three RXR genes that mediate the action of 9-cis retinoic acid. Genes & Cev, 1992;6:329~44
, http://www.100md.com
4.Schreiber E, Matthias P,Michael M et al. Rapid detection of octamer bindingproteins with "mini-extracts", prepared for a small number of cells. Nucleic Acids Research, 1989;17:6419
5.Asanuma M, Kondo Y, Nishibayashi S. Aged-related changes in composition of transcription factor, AP-1 complex in the rat brain. Neuroscience Letters, 1995;201:127~30
6.Krupsky M, Fine A, Berk JK et al. Retinoic acid-induced inhibition of type I collagen gene expression in human lung fibroblasts. Biochimim et Bioph Acta, 1994;1219:335~41
, http://www.100md.com
7.Borunda JA, Simkevich CP, Boy N et al. Activation of Ito cells involves regulation of AP-1 binding proteins and induction of type I collagen gene expression. Biochem J, 1994;304:817~21
8.Schule R, Rangarajan P, Yang N et al. Retinoic acid is a negative regulator of AP-1-responsive genes. Proc Natl Acad Sci, 1991;88:6092~6
9.Lee HY, Walsh GL, Dawson MI et al. All-trans-retinoic acid inhibits jun N-terminal kinase-dependent signaling pathways. J Bio Chem, 1998;273:7066~71
10.Salbert G, Fanjul A, Piedrafita FJ et al. Retinoic acid receptors and retinoid X receptor-α down-regulate the transforming growth factor-α1 promoter by antagonizing AP-1 activity. Mol Endo, 1993;7:1347~56, http://www.100md.com