毒蕈碱和NMDA受体拮抗剂对吗啡依赖大鼠脊髓和脑干前脑啡肽原和前强啡肽原mRNA表达的影响
脑啡肽原和前强啡肽原mRNA表达的影响*
刘惠芬 谢小虎 周文华 杨国栋
摘 要 目的 观察毒蕈碱(M)受体拮抗剂对吗啡依赖大鼠脊髓和脑干前脑啡肽原(preproenkephalin,PPE)和前强啡肽原(preprodynorphin,PPD)mRNA表达的影响。方法 本文利用逆转录聚合酶链反应(RT-PCR),以β-actin mRNA为内标检测了PPE和PPD mRNA。 结果 吗啡依赖大鼠脊髓和脑干PPE基因表达和正常大鼠相比都略有增加,吗啡依赖大鼠注射纳洛酮激发戒断反应后,脊髓PPE基因表达增加,而脑干中变化不明显。吗啡依赖大鼠脊髓和脑干PPD基因表达都低于正常大鼠组,吗啡戒断反应时脊髓PPD基因表达在1 h变化不明显,2 h时增加到峰值,4 h时仍高于依赖组,而脑干强啡肽基因表达在1 h、2 h和4 h时都明显减少。经M受体拮抗剂甲基东莨菪碱和M1拮抗剂pirenzepine处理后大鼠脊髓和脑干PPE和PPD基因表达较戒断1 h组有不同程度的增加;经NMDA受体拮抗剂MK 801处理后, 脊髓和脑干中PPE基因较戒断组1 h无明显差异,脊髓和脑干PPD基因表达较戒断组明显增加;而经NOS抑制剂L-N-硝基精氨酸甲酯(L-NAME)处理后大鼠脊髓和脑干PPE基因表达较戒断1 h组有不同程度的增加,脊髓和脑干PPD基因表达变化不明显。脊髓和脑干中β-actin基因表达在各处理组之间没有差别。结论 M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂在吗啡戒断反应时增加,PPE 和PPD基因表达增加可能是它们有效控制吗啡戒断症状的机制之一。
, http://www.100md.com
关键词:吗啡 戒断反应 前脑啡肽原 前强啡肽原 一氧化氮合酶 毒蕈碱受体 NMDA受体
自发现内源性阿片肽以来,大量的研究提示内源性阿片肽系统参与许多病理生理反应,例如镇痛、应激反应和休克等。内源性阿片肽如强啡肽和脑啡肽与吗啡依赖和耐受产生过程有关,但参与的作用机制迄今为止仍然不清楚。已有报道,吗啡慢性处理后强啡肽和脑啡肽免疫反应物质和前强啡肽和前脑啡肽mRNA在不同脑区中发生改变[1],侧脑室或鞘内注射强啡肽和脑啡肽具有镇痛作用,并可控制部分吗啡戒断症状[2,3]。新近,Simonia等[4]通过κ阿片受体缺失的小鼠证实κ阿片受体对内脏痛、低边缘运动和κ阿片受体激动剂U-50、488H的镇痛和厌恶效应起关键作用,以及参与吗啡戒断症状的表达。Fukunaga等[5]报道吗啡戒断时大脑导水管周围灰质区(cPAG)PPE mRNA增加,注射脑啡肽同系物到cPAG能减少动物的跳跃数。因此,内源性强啡肽和脑啡肽与它们的特异性结合的阿片受体κ和δ之间的平衡在吗啡依赖和戒断中发挥作用。本实验室研究发现毒蕈碱(M)受体拮抗剂[6]、NMDA受体拮抗剂[7]和NOS抑制剂[8]在吗啡依赖和戒断反应中起类似作用,推测它们对阿片依赖有着共同的作用基础。迄今仍没有M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂对吗啡依赖和戒断时大鼠PPE和PPD mRNA影响的报道。本文采用RT-PCR方法检测吗啡依赖和戒断大鼠脊髓和脑干PPE和PPD mRNA的表达,观察阻断这些受体对PPE和PPD mRNA的表达的影响。
, http://www.100md.com
1 材料和方法
1.1 试剂 吗啡系沈阳第一制药厂产品(批号980401),纳洛酮,MK 801,pirenzepine,甲基东莨菪碱,L-N-Nitro-arginine methylester(L-NAME)等系Sigma公司产品。总RNA提取试剂盒,RNA逆转录试剂盒均为Promega公司产品。PCR试剂盒,琼脂糖,PCR Marker系华美公司产品。DEPC系Fluka公司产品。其它试剂均为分析纯。
1.2 动物材料处理及分组 ♂ Sprague-Dawley大鼠由上海动物中心提供,体重(250±20)g。参照文献[6],大鼠皮下注射,首日10 mg.kg-1(bid);隔日每次增加10 mg.kg-1,至d 6末次注射50 mg.kg-1吗啡,建立吗啡依赖模型。此组动物为吗啡依赖组,腹腔注射纳洛酮4 mg.kg-1可激发戒断症状,此组动物为吗啡戒断组。纳洛酮激发戒断症状1 h、2 h、4 h后处死的大鼠分别为戒断1 h组,戒断2 h组,戒断4 h组。在纳洛酮激发前30 min腹腔注射MK 801(0.125 mg.kg-1)、M1受体拮抗剂pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)和NOS抑制剂L-NAME(10 mg.kg-1),激发戒断症状1 h处死的大鼠为MK801处理组、pirenzepine处理组、甲基东莨菪碱处理组和L-NAME处理组。
, http://www.100md.com
1.3 引物设计 由上海生物工程公司合成,参照文献,三条引物序列分别为:PPE[9]:上游引物:5GTC CAC CAT TGG TTC AGA AGG 3,下游引物:5ACC GCA TAA AGC CTC CGT ATC 3,扩增长723 bp的片段。PPD[10]:上游引物5CTG CCG ATC TTT GTT AGC CTC TG 3,下游引物5 ATC CAA GAT GCA GAA GGA GCC 3,扩增长602 bp的片段。β-actin[11]:上游引物A:5TCA TGA AGT GTG ACG TTG ACA TCC GTA AAG 3,下游引物B:5CCT AGA AGC ATT TGC GGT GCA CGA TGG AGG 3,扩增长409 bp的片段。
1.4 总RNA提取 大鼠断头处死,迅速分离取出脊髓和脑干约100 mg,按试剂盒说明操作,得到RNA沉淀,用20 μl无RNase的水溶解,紫外分光光度计测定总RNA浓度,A260 nm/A280 nm为1.8~2.0,并用甲醛变性凝胶电泳鉴定质量。提取总RNA于-70℃保存。
, http://www.100md.com
1.5 逆转录反应 取2 μg RNA 65℃变性3 min后,加入反应缓冲液,总体积为20 μl,包含Tris-HCl 10 mmol.L-1,pH 8.3,KCl 50 mmol.L-1,Triton X-100 0.1%,MgCl2 2.5 mmol.L-1,dNTPs 0.2 mmol.L-1,DTT 5 mmol.L-1,RNA酶抑制剂20 U,AMV逆转录酶23 U,oligo(dT) 0.5 μg。42℃反应60 min,95℃ 5 min终止反应,加水稀释至100 μl。
1.6 PCR反应 取逆转录反应液20 μl,分别进行PPE、PPD和β-actin基因的PCR扩增。PCR反应液总体积为50 μl,包含Tris-HCl 10 mmol.L-1,pH 8.3,KCl 50 mmol.L-1,Triton X-100 0.1%,MgCl2 1.5 mmol.L-1,dNTPs 0.2 mmol.L-1,DTT 5 mmol.L-1,上、下游引物各50 pmol,95℃变性10 min,加Taq DNA聚合酶2.5 U,再覆盖石蜡油50 μl,94℃变性3 min后进行PCR循环(AMPLITRON公司PCR仪)。条件为:94℃变性30 s,59℃退火30 s,72℃延伸1 min,完成35个循环后,72℃再延伸10 min,置冰浴中。取10 μl PCR产物在1.5%的琼脂糖凝胶上电泳,5 V/cm,50 min,用自动成像仪(FOTODYNE公司)观察拍照。
, 百拇医药
2 结果
2.1 吗啡依赖大鼠脊髓和脑干前脑啡肽原mRNA的表达 提取的RNA甲醛变性凝胶电泳上可以清晰看到28S和18S两条带,其亮度之比为2∶1,表明RNA带完整,没有降解,可作为逆转录反应的模板。以PPE引物扩增出的片段长约700 bp,与设计的PPE扩增片段长723 bp相一致。图1和图2所示,当吗啡依赖时脊髓和脑干PPE扩增产物略有增加;纳洛酮激发后1 h、2 h和4 h,脊髓中PPE扩增产物较吗啡依赖组明显增加,而脑干PPE扩增产物较依赖组没有明显差异。在纳洛酮激发前30 min腹腔分别注射M1受体拮抗剂pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)或NOS抑制剂L-NAME(10 mg.kg-1)后,脊髓和脑干中PPE扩增产物较戒断1 h组明显增加;pirenzepine 处理组脊髓中PPE扩增产物增加最显著,其次为甲基东莨菪碱和L-NAME处理组,后二者处理组结果类似;而脑干中甲基东莨菪碱处理组PPE扩增产物增加最为明显,其次为L-NAME组。MK 801(0.125 mg.kg-1)处理后,脊髓和脑干中PPE扩增产物较戒断组1 h无明显差异。各组β-actin表达量没有差异(图1和图2)。
, http://www.100md.com
Fig 1 Agrose gel electrophoresis of preproenkaphalin and
β-actin specific RT-PCR products in spinal cord
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h;E:morphine withdrawal 2 h;F:morphine withdrawal 4 h;G:MK801 treatment;H: pirenzepine treatment; I: scopolamine pretreatment;J: L-NAME treatment.Upper: the specific product bands for proenkaphalin. Lower: the specific product bands for β-actin.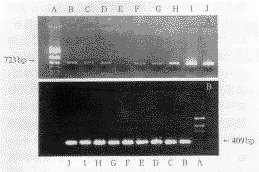
, http://www.100md.com
Fig 2 Agrose gel electrophoresis of proenkaphalin and
β-actin specific RT-PCR products in brain stem
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h; E:morphine withdrawal 2 h; F: morphine withdrawal 4 h; G: MK 801 treatment; H: pirenzepine treatment; I: scopolamine treatment;J: L-NAME treatment.Upper: the specific product bands for proenkaphalin. Lower: the specific product bands for β-actin.
, 百拇医药
2.2 吗啡依赖大鼠脊髓和脑干前强啡肽原mRNA的表达 以PPD引物扩增出的片段长约600 bp,与设计的PPD扩增片段长602 bp相一致。图3显示, 当吗啡依赖时脊髓和脑干PPD扩增产物减少,纳洛酮激发1 h,脊髓和脑干PPD扩增产物明显减少;激发2 h和4 h后,脊髓中PPD扩增产物较依赖组明显增加,而脑干中PPD扩增产物较吗啡依赖组减少。 在纳洛酮激发前30 min腹腔注射pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)或MK 801(0.125 mg.kg-1)后,脊髓和脑干中PPD扩增产物较戒断1 h组明显增加,pirenzepine处理组PPD扩增产物增加最为显著;L-NAME(10 mg.kg-1)处理后脊髓中PPD扩增产物较戒断组1 h无明显差异,脑干PPD扩增产物较戒断组1 h减少。各组β-actin表达量没有差异(图1和图2)。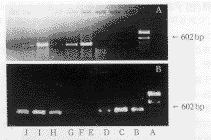
, 百拇医药
Fig 3 Agrose gel electrophoresis of prodynorphin specific
RT-PCR products in spinal cord and brainstern
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h; E: morphine withdrawal 2 h; F: morphine withdrawal 4 h; G: MK 801 treatment; H: pirenzepine treatment; I: scopolamine treatment;J: L-NAME treatment.Upper: the specific product bands for prodynorphin in spinal cord. Lower: the specific product bands for prodynorphin in brain stem.
, 百拇医药
3 讨论
与阿片受体κ和δ结合的内源性阿片肽为强啡肽和脑啡肽。有报道吗啡慢性处理后,内源性阿片肽如强啡肽和脑啡肽的免疫反应物质和mRNA发生变化,注射这些阿片肽不仅具有镇痛作用,并可控制部分吗啡戒断症状。本实验发现吗啡慢性处理后脊髓和脑干PPE基因扩增产物略有增加,而脊髓和脑干PPD基因表达都低于正常大鼠。吗啡依赖大鼠注射纳洛酮激发戒断反应1 h后脊髓PPE基因表达增加,2 h后PPD基因表达增加,而脑干中PPE基因表达变化不明显,PPD基因表达明显减少。脊髓和脑干是介导吗啡身体依赖的主要部位,甲硫脑啡肽和亮脑啡肽侧脑室注射可抑制小鼠的跳跃反应,静脉注射D-Ala,D-Leu脑啡肽(DADLE)(60 μg.kg-1)抑制海洛因依赖者的戒断症状[2]。Dyn A(1-13)静脉注射或鞘内注射可抑制湿狗摇动,腹痉挛和竖毛,但侧脑室注射没有效果,还可抑制海洛因依赖者的戒断症状[3]。最近,Simonia等[4]通过κ阿片受体缺失的小鼠证实κ阿片受体对内脏痛、低边缘运动和κ阿片受体激动剂U-50 488H的镇痛和厌恶效应起关键作用,并且参与吗啡戒断症状的表达。有报道应用反义RNA技术证实δ阿片受体参与吗啡的奖赏效应和戒断反应[13]。因此,增加内源性脑啡肽和强啡肽的基因表达对于控制吗啡的戒断症状是有益的。
, http://www.100md.com
本文显示M1受体拮抗剂pirenzepine和甲基东莨菪碱处理后大鼠脊髓和脑干PPE基因和PPD基因表达较戒断1 h组有不同程度的增加;有报道鞘内注射小剂量强啡肽和脑啡肽镇痛作用有协同作用[14]。因此,M受体阻断后脊髓和脑干中内源性PPE和PPD增加可能是胆碱能受体拮抗剂控制阿片戒断症状的机制之一[6]。有报道鞘内注射强啡肽所产生的病理生理作用是通过NMDA受体起作用,内源性强啡肽可能通过突触前促进兴奋性神经氨基酸的释放,而NMDA受体拮抗剂不仅阻止强啡肽致瘫痪作用,而且减少强啡肽产生的电生理和组织学改变[12]。本文发现NMDA受体拮抗剂MK801处理后, 脊髓和脑干中PPE基因较戒断组无明显差异,而脊髓和脑干PPD基因表达较戒断组明显增加,结果提示NMDA受体与强啡肽之间可能存在着互相调节的机制。在本文所示剂量中MK 801对吗啡戒断症状有一定的作用,因而结果表明NMDA受体拮抗剂诱导内源性强啡肽的表达可能是它对控制阿片戒断有效的作用机制。而经NOS抑制剂L-NAME处理后大鼠脊髓和脑干PPE基因表达较戒断组有不同程度的增加,脊髓和脑干PPD基因表达变化不明显。M受体拮抗剂、NMDA受体拮抗剂和NO合酶抑制剂对吗啡戒断症状均有治疗作用[8],它们对PPE和PPD基因表达调节的机制仍不清楚。由于PPE和PPD的基因序列已清楚[15,16],PPE的上游有二个cAMP结合元件,PPD的上游有AP-1的结合元件,而M受体、NMDA受体与细胞内信息传递途径如cAMP、PKC和Ca2+偶联。因此有必要探索在吗啡戒断时M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂对PPE和PPD基因表达调控差异的机制。
, http://www.100md.com
*浙江省医学科学基金资助,No 98A093
作者简介:刘惠芬,34岁,助理研究员,1987年毕业于杭州大学生物系,主要从事分子生物学的研究;
杨国栋,62岁,研究员,主要从事药物依赖的机制和防治的研究
刘惠芬(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
谢小虎(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
周文华(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
杨国栋(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
, 百拇医药
参考文献
1,Uhl GR, Ryan JP, Schwartz JP.Morphine alters preproenkephalin gene expression.Brain Res,1988;459:391~7
2,Bhargava HN. Opioid-like action of methionine-enkephalin in inhibiting morphine abstinence syndrome. Eur J Pharmacol, 1977;41:81~4
3,Takemori AE, Loh HH, Lee NM. Supression of dynorphin A (1~13) of the expression of opiate withdrawal and tolerance in mice. Eur J Pharmacol, 1992;221:223~6
, 百拇医药
4,Simonin F, Valverde O, Smadja C et al. Disruption of the kappa-opioid receptor gene in mice enhances sensitivity to chemical visceral pain, impairs pharmacological actions of the selective kappa-agonist U-50,488H and attenuates morphine withdrawal. EMBO J, 1998;17:886~97
5,Fukunaga Y, Inoue N, Miyamoto M et al. Effects of peptidase inhibitors,[D-Ala2,Mek5]-enkephaminamide and antiserum to methionine-enkaphalin microinjected into the caudal periaqueductal gray on morphine withdrawal in rats. Jpn J Pharmacol,1998;78:455~61
, http://www.100md.com
6,杨国栋,周文华,张富强等.选择性毒蕈碱受体拮抗剂减轻吗啡耐受和依赖的实验研究.中华医学杂志,1997;77:130~3
7,Thorat SN, Barjavel M, Matwyshyn GA,Bhargava HN. Comparative effects of N-monomethyl-L-arginine and MK801 on the abstinence syndrome in morphine-dependent mice. Brain Res, 1994;642:153~9
8,周文华,朱 波,谢小虎 et al.吗啡依赖大鼠脊髓和脑干一氧化氮含量和合酶活力分析.中国药物依赖性杂志, 1999;8(2):95~7
9,Rosen H, Douglass J, Herbert E. Isolation and charactrization of the rat proenkephalin gene. J Biol Chem,1984;259:14309~13
, 百拇医药
10,Douglass J, Mcmurray CT, Garrett JE et al. Characterization of the rat prodynorphin gene. Mol Endocrinol, 1989;3:2070~8
11,Tokunaga K, Taniguchi H, Yoda K et al. Nucleotide sequence of a full-length cDNA for mouse cytoskeletal beta-actin mRNA. Nucleic Acids Res,1986;14:2829~33
12,Bakshi R, Ni RX, Faden AI. N-methyl-D-aspartate(NMDA) and opioid receptors mediate dynorphin-induced spinal cord injury: behavioral and histological studies. Brain Res, 1992;580:255~64
, 百拇医药
13,Suzuki T, Ikeda H, Tsuji M et al. Antisense oligodeoxynucleotide to δ receptors attenuates morphine dependence in mice.Life Science,1997;61:165~70
14,陈晓红,韩济生,袁 毓 et al.2~15 Hz电针刺激促使人体脊髓中同时释放甲七肽和强啡肽A.北京医科大学学报,1992;24:807~9
15,Comb M, Mermod N, Hyman SE et al.Proteins bound at adjacent DNA elements act synergistically to regulate human proenkaphalin cAMP inducible transcription. EMBO J, 1988;7:3793~805
16,Civelli O, Douglass J, Goldstein A et al. Sequence and expression of the rat prodynorphin gene. Proc Natl Acad Sci USA,1985;82;4291~429, 百拇医药(脑啡肽原和前强啡肽原mRNA表达的影响*)
刘惠芬 谢小虎 周文华 杨国栋
摘 要 目的 观察毒蕈碱(M)受体拮抗剂对吗啡依赖大鼠脊髓和脑干前脑啡肽原(preproenkephalin,PPE)和前强啡肽原(preprodynorphin,PPD)mRNA表达的影响。方法 本文利用逆转录聚合酶链反应(RT-PCR),以β-actin mRNA为内标检测了PPE和PPD mRNA。 结果 吗啡依赖大鼠脊髓和脑干PPE基因表达和正常大鼠相比都略有增加,吗啡依赖大鼠注射纳洛酮激发戒断反应后,脊髓PPE基因表达增加,而脑干中变化不明显。吗啡依赖大鼠脊髓和脑干PPD基因表达都低于正常大鼠组,吗啡戒断反应时脊髓PPD基因表达在1 h变化不明显,2 h时增加到峰值,4 h时仍高于依赖组,而脑干强啡肽基因表达在1 h、2 h和4 h时都明显减少。经M受体拮抗剂甲基东莨菪碱和M1拮抗剂pirenzepine处理后大鼠脊髓和脑干PPE和PPD基因表达较戒断1 h组有不同程度的增加;经NMDA受体拮抗剂MK 801处理后, 脊髓和脑干中PPE基因较戒断组1 h无明显差异,脊髓和脑干PPD基因表达较戒断组明显增加;而经NOS抑制剂L-N-硝基精氨酸甲酯(L-NAME)处理后大鼠脊髓和脑干PPE基因表达较戒断1 h组有不同程度的增加,脊髓和脑干PPD基因表达变化不明显。脊髓和脑干中β-actin基因表达在各处理组之间没有差别。结论 M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂在吗啡戒断反应时增加,PPE 和PPD基因表达增加可能是它们有效控制吗啡戒断症状的机制之一。
, http://www.100md.com
关键词:吗啡 戒断反应 前脑啡肽原 前强啡肽原 一氧化氮合酶 毒蕈碱受体 NMDA受体
自发现内源性阿片肽以来,大量的研究提示内源性阿片肽系统参与许多病理生理反应,例如镇痛、应激反应和休克等。内源性阿片肽如强啡肽和脑啡肽与吗啡依赖和耐受产生过程有关,但参与的作用机制迄今为止仍然不清楚。已有报道,吗啡慢性处理后强啡肽和脑啡肽免疫反应物质和前强啡肽和前脑啡肽mRNA在不同脑区中发生改变[1],侧脑室或鞘内注射强啡肽和脑啡肽具有镇痛作用,并可控制部分吗啡戒断症状[2,3]。新近,Simonia等[4]通过κ阿片受体缺失的小鼠证实κ阿片受体对内脏痛、低边缘运动和κ阿片受体激动剂U-50、488H的镇痛和厌恶效应起关键作用,以及参与吗啡戒断症状的表达。Fukunaga等[5]报道吗啡戒断时大脑导水管周围灰质区(cPAG)PPE mRNA增加,注射脑啡肽同系物到cPAG能减少动物的跳跃数。因此,内源性强啡肽和脑啡肽与它们的特异性结合的阿片受体κ和δ之间的平衡在吗啡依赖和戒断中发挥作用。本实验室研究发现毒蕈碱(M)受体拮抗剂[6]、NMDA受体拮抗剂[7]和NOS抑制剂[8]在吗啡依赖和戒断反应中起类似作用,推测它们对阿片依赖有着共同的作用基础。迄今仍没有M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂对吗啡依赖和戒断时大鼠PPE和PPD mRNA影响的报道。本文采用RT-PCR方法检测吗啡依赖和戒断大鼠脊髓和脑干PPE和PPD mRNA的表达,观察阻断这些受体对PPE和PPD mRNA的表达的影响。
, http://www.100md.com
1 材料和方法
1.1 试剂 吗啡系沈阳第一制药厂产品(批号980401),纳洛酮,MK 801,pirenzepine,甲基东莨菪碱,L-N-Nitro-arginine methylester(L-NAME)等系Sigma公司产品。总RNA提取试剂盒,RNA逆转录试剂盒均为Promega公司产品。PCR试剂盒,琼脂糖,PCR Marker系华美公司产品。DEPC系Fluka公司产品。其它试剂均为分析纯。
1.2 动物材料处理及分组 ♂ Sprague-Dawley大鼠由上海动物中心提供,体重(250±20)g。参照文献[6],大鼠皮下注射,首日10 mg.kg-1(bid);隔日每次增加10 mg.kg-1,至d 6末次注射50 mg.kg-1吗啡,建立吗啡依赖模型。此组动物为吗啡依赖组,腹腔注射纳洛酮4 mg.kg-1可激发戒断症状,此组动物为吗啡戒断组。纳洛酮激发戒断症状1 h、2 h、4 h后处死的大鼠分别为戒断1 h组,戒断2 h组,戒断4 h组。在纳洛酮激发前30 min腹腔注射MK 801(0.125 mg.kg-1)、M1受体拮抗剂pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)和NOS抑制剂L-NAME(10 mg.kg-1),激发戒断症状1 h处死的大鼠为MK801处理组、pirenzepine处理组、甲基东莨菪碱处理组和L-NAME处理组。
, http://www.100md.com
1.3 引物设计 由上海生物工程公司合成,参照文献,三条引物序列分别为:PPE[9]:上游引物:5GTC CAC CAT TGG TTC AGA AGG 3,下游引物:5ACC GCA TAA AGC CTC CGT ATC 3,扩增长723 bp的片段。PPD[10]:上游引物5CTG CCG ATC TTT GTT AGC CTC TG 3,下游引物5 ATC CAA GAT GCA GAA GGA GCC 3,扩增长602 bp的片段。β-actin[11]:上游引物A:5TCA TGA AGT GTG ACG TTG ACA TCC GTA AAG 3,下游引物B:5CCT AGA AGC ATT TGC GGT GCA CGA TGG AGG 3,扩增长409 bp的片段。
1.4 总RNA提取 大鼠断头处死,迅速分离取出脊髓和脑干约100 mg,按试剂盒说明操作,得到RNA沉淀,用20 μl无RNase的水溶解,紫外分光光度计测定总RNA浓度,A260 nm/A280 nm为1.8~2.0,并用甲醛变性凝胶电泳鉴定质量。提取总RNA于-70℃保存。
, http://www.100md.com
1.5 逆转录反应 取2 μg RNA 65℃变性3 min后,加入反应缓冲液,总体积为20 μl,包含Tris-HCl 10 mmol.L-1,pH 8.3,KCl 50 mmol.L-1,Triton X-100 0.1%,MgCl2 2.5 mmol.L-1,dNTPs 0.2 mmol.L-1,DTT 5 mmol.L-1,RNA酶抑制剂20 U,AMV逆转录酶23 U,oligo(dT) 0.5 μg。42℃反应60 min,95℃ 5 min终止反应,加水稀释至100 μl。
1.6 PCR反应 取逆转录反应液20 μl,分别进行PPE、PPD和β-actin基因的PCR扩增。PCR反应液总体积为50 μl,包含Tris-HCl 10 mmol.L-1,pH 8.3,KCl 50 mmol.L-1,Triton X-100 0.1%,MgCl2 1.5 mmol.L-1,dNTPs 0.2 mmol.L-1,DTT 5 mmol.L-1,上、下游引物各50 pmol,95℃变性10 min,加Taq DNA聚合酶2.5 U,再覆盖石蜡油50 μl,94℃变性3 min后进行PCR循环(AMPLITRON公司PCR仪)。条件为:94℃变性30 s,59℃退火30 s,72℃延伸1 min,完成35个循环后,72℃再延伸10 min,置冰浴中。取10 μl PCR产物在1.5%的琼脂糖凝胶上电泳,5 V/cm,50 min,用自动成像仪(FOTODYNE公司)观察拍照。
, 百拇医药
2 结果
2.1 吗啡依赖大鼠脊髓和脑干前脑啡肽原mRNA的表达 提取的RNA甲醛变性凝胶电泳上可以清晰看到28S和18S两条带,其亮度之比为2∶1,表明RNA带完整,没有降解,可作为逆转录反应的模板。以PPE引物扩增出的片段长约700 bp,与设计的PPE扩增片段长723 bp相一致。图1和图2所示,当吗啡依赖时脊髓和脑干PPE扩增产物略有增加;纳洛酮激发后1 h、2 h和4 h,脊髓中PPE扩增产物较吗啡依赖组明显增加,而脑干PPE扩增产物较依赖组没有明显差异。在纳洛酮激发前30 min腹腔分别注射M1受体拮抗剂pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)或NOS抑制剂L-NAME(10 mg.kg-1)后,脊髓和脑干中PPE扩增产物较戒断1 h组明显增加;pirenzepine 处理组脊髓中PPE扩增产物增加最显著,其次为甲基东莨菪碱和L-NAME处理组,后二者处理组结果类似;而脑干中甲基东莨菪碱处理组PPE扩增产物增加最为明显,其次为L-NAME组。MK 801(0.125 mg.kg-1)处理后,脊髓和脑干中PPE扩增产物较戒断组1 h无明显差异。各组β-actin表达量没有差异(图1和图2)。

, http://www.100md.com
Fig 1 Agrose gel electrophoresis of preproenkaphalin and
β-actin specific RT-PCR products in spinal cord
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h;E:morphine withdrawal 2 h;F:morphine withdrawal 4 h;G:MK801 treatment;H: pirenzepine treatment; I: scopolamine pretreatment;J: L-NAME treatment.Upper: the specific product bands for proenkaphalin. Lower: the specific product bands for β-actin.

, http://www.100md.com
Fig 2 Agrose gel electrophoresis of proenkaphalin and
β-actin specific RT-PCR products in brain stem
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h; E:morphine withdrawal 2 h; F: morphine withdrawal 4 h; G: MK 801 treatment; H: pirenzepine treatment; I: scopolamine treatment;J: L-NAME treatment.Upper: the specific product bands for proenkaphalin. Lower: the specific product bands for β-actin.
, 百拇医药
2.2 吗啡依赖大鼠脊髓和脑干前强啡肽原mRNA的表达 以PPD引物扩增出的片段长约600 bp,与设计的PPD扩增片段长602 bp相一致。图3显示, 当吗啡依赖时脊髓和脑干PPD扩增产物减少,纳洛酮激发1 h,脊髓和脑干PPD扩增产物明显减少;激发2 h和4 h后,脊髓中PPD扩增产物较依赖组明显增加,而脑干中PPD扩增产物较吗啡依赖组减少。 在纳洛酮激发前30 min腹腔注射pirenzepine(10 mg.kg-1)、甲基东莨菪碱(0.5 mg.kg-1)或MK 801(0.125 mg.kg-1)后,脊髓和脑干中PPD扩增产物较戒断1 h组明显增加,pirenzepine处理组PPD扩增产物增加最为显著;L-NAME(10 mg.kg-1)处理后脊髓中PPD扩增产物较戒断组1 h无明显差异,脑干PPD扩增产物较戒断组1 h减少。各组β-actin表达量没有差异(图1和图2)。

, 百拇医药
Fig 3 Agrose gel electrophoresis of prodynorphin specific
RT-PCR products in spinal cord and brainstern
A: PCR marker; B: morphine dependence; C: control; D: morphine withdrawal 1 h; E: morphine withdrawal 2 h; F: morphine withdrawal 4 h; G: MK 801 treatment; H: pirenzepine treatment; I: scopolamine treatment;J: L-NAME treatment.Upper: the specific product bands for prodynorphin in spinal cord. Lower: the specific product bands for prodynorphin in brain stem.
, 百拇医药
3 讨论
与阿片受体κ和δ结合的内源性阿片肽为强啡肽和脑啡肽。有报道吗啡慢性处理后,内源性阿片肽如强啡肽和脑啡肽的免疫反应物质和mRNA发生变化,注射这些阿片肽不仅具有镇痛作用,并可控制部分吗啡戒断症状。本实验发现吗啡慢性处理后脊髓和脑干PPE基因扩增产物略有增加,而脊髓和脑干PPD基因表达都低于正常大鼠。吗啡依赖大鼠注射纳洛酮激发戒断反应1 h后脊髓PPE基因表达增加,2 h后PPD基因表达增加,而脑干中PPE基因表达变化不明显,PPD基因表达明显减少。脊髓和脑干是介导吗啡身体依赖的主要部位,甲硫脑啡肽和亮脑啡肽侧脑室注射可抑制小鼠的跳跃反应,静脉注射D-Ala,D-Leu脑啡肽(DADLE)(60 μg.kg-1)抑制海洛因依赖者的戒断症状[2]。Dyn A(1-13)静脉注射或鞘内注射可抑制湿狗摇动,腹痉挛和竖毛,但侧脑室注射没有效果,还可抑制海洛因依赖者的戒断症状[3]。最近,Simonia等[4]通过κ阿片受体缺失的小鼠证实κ阿片受体对内脏痛、低边缘运动和κ阿片受体激动剂U-50 488H的镇痛和厌恶效应起关键作用,并且参与吗啡戒断症状的表达。有报道应用反义RNA技术证实δ阿片受体参与吗啡的奖赏效应和戒断反应[13]。因此,增加内源性脑啡肽和强啡肽的基因表达对于控制吗啡的戒断症状是有益的。
, http://www.100md.com
本文显示M1受体拮抗剂pirenzepine和甲基东莨菪碱处理后大鼠脊髓和脑干PPE基因和PPD基因表达较戒断1 h组有不同程度的增加;有报道鞘内注射小剂量强啡肽和脑啡肽镇痛作用有协同作用[14]。因此,M受体阻断后脊髓和脑干中内源性PPE和PPD增加可能是胆碱能受体拮抗剂控制阿片戒断症状的机制之一[6]。有报道鞘内注射强啡肽所产生的病理生理作用是通过NMDA受体起作用,内源性强啡肽可能通过突触前促进兴奋性神经氨基酸的释放,而NMDA受体拮抗剂不仅阻止强啡肽致瘫痪作用,而且减少强啡肽产生的电生理和组织学改变[12]。本文发现NMDA受体拮抗剂MK801处理后, 脊髓和脑干中PPE基因较戒断组无明显差异,而脊髓和脑干PPD基因表达较戒断组明显增加,结果提示NMDA受体与强啡肽之间可能存在着互相调节的机制。在本文所示剂量中MK 801对吗啡戒断症状有一定的作用,因而结果表明NMDA受体拮抗剂诱导内源性强啡肽的表达可能是它对控制阿片戒断有效的作用机制。而经NOS抑制剂L-NAME处理后大鼠脊髓和脑干PPE基因表达较戒断组有不同程度的增加,脊髓和脑干PPD基因表达变化不明显。M受体拮抗剂、NMDA受体拮抗剂和NO合酶抑制剂对吗啡戒断症状均有治疗作用[8],它们对PPE和PPD基因表达调节的机制仍不清楚。由于PPE和PPD的基因序列已清楚[15,16],PPE的上游有二个cAMP结合元件,PPD的上游有AP-1的结合元件,而M受体、NMDA受体与细胞内信息传递途径如cAMP、PKC和Ca2+偶联。因此有必要探索在吗啡戒断时M受体拮抗剂、NMDA受体拮抗剂和NOS抑制剂对PPE和PPD基因表达调控差异的机制。
, http://www.100md.com
*浙江省医学科学基金资助,No 98A093
作者简介:刘惠芬,34岁,助理研究员,1987年毕业于杭州大学生物系,主要从事分子生物学的研究;
杨国栋,62岁,研究员,主要从事药物依赖的机制和防治的研究
刘惠芬(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
谢小虎(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
周文华(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
杨国栋(浙江省宁市波微循环与莨菪类药研究所.宁波戒毒研究中心,宁波 315010)
, 百拇医药
参考文献
1,Uhl GR, Ryan JP, Schwartz JP.Morphine alters preproenkephalin gene expression.Brain Res,1988;459:391~7
2,Bhargava HN. Opioid-like action of methionine-enkephalin in inhibiting morphine abstinence syndrome. Eur J Pharmacol, 1977;41:81~4
3,Takemori AE, Loh HH, Lee NM. Supression of dynorphin A (1~13) of the expression of opiate withdrawal and tolerance in mice. Eur J Pharmacol, 1992;221:223~6
, 百拇医药
4,Simonin F, Valverde O, Smadja C et al. Disruption of the kappa-opioid receptor gene in mice enhances sensitivity to chemical visceral pain, impairs pharmacological actions of the selective kappa-agonist U-50,488H and attenuates morphine withdrawal. EMBO J, 1998;17:886~97
5,Fukunaga Y, Inoue N, Miyamoto M et al. Effects of peptidase inhibitors,[D-Ala2,Mek5]-enkephaminamide and antiserum to methionine-enkaphalin microinjected into the caudal periaqueductal gray on morphine withdrawal in rats. Jpn J Pharmacol,1998;78:455~61
, http://www.100md.com
6,杨国栋,周文华,张富强等.选择性毒蕈碱受体拮抗剂减轻吗啡耐受和依赖的实验研究.中华医学杂志,1997;77:130~3
7,Thorat SN, Barjavel M, Matwyshyn GA,Bhargava HN. Comparative effects of N-monomethyl-L-arginine and MK801 on the abstinence syndrome in morphine-dependent mice. Brain Res, 1994;642:153~9
8,周文华,朱 波,谢小虎 et al.吗啡依赖大鼠脊髓和脑干一氧化氮含量和合酶活力分析.中国药物依赖性杂志, 1999;8(2):95~7
9,Rosen H, Douglass J, Herbert E. Isolation and charactrization of the rat proenkephalin gene. J Biol Chem,1984;259:14309~13
, 百拇医药
10,Douglass J, Mcmurray CT, Garrett JE et al. Characterization of the rat prodynorphin gene. Mol Endocrinol, 1989;3:2070~8
11,Tokunaga K, Taniguchi H, Yoda K et al. Nucleotide sequence of a full-length cDNA for mouse cytoskeletal beta-actin mRNA. Nucleic Acids Res,1986;14:2829~33
12,Bakshi R, Ni RX, Faden AI. N-methyl-D-aspartate(NMDA) and opioid receptors mediate dynorphin-induced spinal cord injury: behavioral and histological studies. Brain Res, 1992;580:255~64
, 百拇医药
13,Suzuki T, Ikeda H, Tsuji M et al. Antisense oligodeoxynucleotide to δ receptors attenuates morphine dependence in mice.Life Science,1997;61:165~70
14,陈晓红,韩济生,袁 毓 et al.2~15 Hz电针刺激促使人体脊髓中同时释放甲七肽和强啡肽A.北京医科大学学报,1992;24:807~9
15,Comb M, Mermod N, Hyman SE et al.Proteins bound at adjacent DNA elements act synergistically to regulate human proenkaphalin cAMP inducible transcription. EMBO J, 1988;7:3793~805
16,Civelli O, Douglass J, Goldstein A et al. Sequence and expression of the rat prodynorphin gene. Proc Natl Acad Sci USA,1985;82;4291~429, 百拇医药(脑啡肽原和前强啡肽原mRNA表达的影响*)