标记抗体导向的药物对巨噬细胞杀伤作用的体外研究
作者:姜振宇 王晓芳 张志清 陈唯金 聂荣国 姚程
单位:姜振宇 王晓芳 张志清 姚程(130021 长春,白求恩医科大学第一临床学院);陈唯金 聂荣国(长春生物制品研究所)
关键词:
中华血液学杂志000921 我们将静脉注射用免疫球蛋白(IVIG)与免疫抑制剂甲氨蝶呤(MTX)在体外交联制成标记抗体,使MTX通过IVIG特异地与单核巨噬细胞结合,对单核-巨噬系统起到杀伤或抑制作用,既克服了IVIG疗效短暂的缺点,又避免了免疫抑制剂的非特异性细胞毒作用。现将体外实验结果报告如下。
材料和方法
1 材料 IVIG、人血白蛋白(HSA)由卫生部长春生物制品所生产。四甲基偶氮唑盐(MTT)、碳二亚胺(EDC)、γ-马来酰亚胺基丁酸-N-羟基琥珀酰亚胺酸(GMBS)、FITC标记的羊抗人Fab片段荧光抗体购自Sigma公司,MTX购自上海华联制药有限公司。人单核细胞白血病细胞株U937及Hela细胞由白求恩医科大学免疫教研室提供。4~6周龄的昆明小白鼠由本校实验动物部提供。
, http://www.100md.com
2 标记抗体的制备[1-3]。
2.1 双功能试剂法制备标记抗体:首先用碳二亚胺法制备HSA与MTX的复合物HSA-MTX,然后用双功能试剂法制备IVIG与交联剂GMBS的复合物IVIG-GMBS。向IVIG-GMBS溶液中加入HSA-MTX的PBS,混合物于4℃反应1h后经Sephadex G-150柱层析,收集第2峰,得到标记抗体IVIG-HSA-MTX(第1峰为高分子量的聚合体,第3峰为HSA-MTX)。
2.2 标记抗体的定性与定量:采用紫外吸收光谱和吸光度(A)测定法[1]。
2.3 间接免疫荧光法测定标记抗体Fc片段结合活性[4]:小鼠巨噬细胞表面有Fc受体,标记抗体的Fc段与巨噬细胞表面的Fc受体结合,再加入FITC标记的羊抗人Fab片段荧光抗体,荧光抗体与标记抗体的Fab片段结合,在显微镜下呈现黄绿色荧光。Hela细胞表面无Fc受体,做为阴性对照。
, 百拇医药
3 标记抗体的特异性杀伤活性测定
3.1 标记抗体的特异性杀伤活性:以Fc受体阳性的小鼠巨噬细胞和U937细胞为靶细胞,共分5组:①标记抗体组;②HSA-MTX组;③游离MTX组;④游离IVIG组;⑤空白对照组。每组设3个复孔,在37℃,体积分数为5%的CO2条件下培养30min,弃上清,培养液洗2次,复悬细胞,继续培养72h, MTT法测定杀伤活性[5],即于培养结束前4h,每孔加入MTT 20μl,在体积分数为5%的CO2、37℃培养4h,吸去未反应的MTT及上清,每孔加入二甲基亚砜100μl,10min后测波长570nm的A值,计算杀伤率。
杀伤率(%
3.2 Fc受体介导的细胞特异性杀伤活性测定:以 Fc受体阳性的人单核细胞U937为靶细胞,以Fc受体阴性的Hela细胞作阴性对照。共分3组:①标记抗体组;②游离MTX组;③空白对照组。每组设3个复孔,其余步骤同标记抗体的特异性杀伤活性测定。
, 百拇医药
4 标记抗体对小鼠巨噬细胞吞噬功能影响 向浓度为1×106/ml的小鼠巨噬细胞悬液中加入终浓度为1×10-2mg/ml(以MTX含量为标准)的标记抗体,共同培养30min,用培养液洗2次,复悬细胞,继续培养72h,加入鸡红细胞,测定吞噬率和吞噬指数[6]。
5 游离IVIG对标记抗体杀伤活性的影响 实验共分2组:标记抗体组和游离MTX组。在两组分别与U937细胞共同培养的同时加入6个不同浓度的游离IVIG,每个浓度设3个复孔,以下步骤同标记抗体的特异性杀伤活性检测。
6 统计学处理 χ2检验、秩和检验、方差分析、直线相关分析。
结果
1 标记抗体的定性与定量 标记抗体在波长200~600nm之间标记抗体的紫外吸收光谱中既有MTX特征峰,又有IVIG的特征峰,证明交联成功(见图1)。标记抗体中MTX与IVIG的质量比为24.8∶1。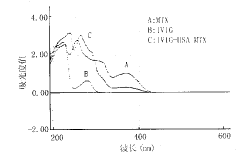
, 百拇医药
图1 IVIG-HSA-MTX在波长200~600nm的紫外吸收图谱
2 标记抗体的Fc段结合活性 间接免疫荧光检测结果显示标记抗体Fc段结合活性与游离IVIG差异无显著性(P>0.05)。Hela细胞表面无荧光或偶见荧光。
3 标记抗体的特异杀伤作用 MTT法测定结果显示:在1000ng/ml 时, IVIG-HSA-MTX对U937细胞及小鼠巨噬细胞(mM)的作用明显大于HSA-MTX、游离MTX及游离IVIG(P<0.01)。设对照组细胞杀伤率为0,结果见表1。
表1 标记抗体(1000ng/mg)对U937细胞及
小鼠巨噬细胞的特异杀伤作用 组别
样本数
细胞杀伤率(%)
, http://www.100md.com
U937
mMø
IVIG-HSA-MTX
3
90.5±3.2
89.6±2.5
HSA-MTX
3
20.3±0.6
21.2±0.7
MTX
3
, 百拇医药 30.3±1.2
29.6±0.8
IVIG
3
2.1±0.2
1.3±0.1
4 Fc受体介导的细胞特异性杀伤作用 IVIG-HSA-MTX在1000ng/ml 时对U937细胞的杀伤作用明显大于游离MTX(P<0.05);IVIG-HSA-MTX对U937细胞的杀伤作用明显大于Hela细胞(P<0.01),游离MTX对二者的杀伤作用差异无显著性(P>0.05),设对照组细胞杀伤率为0,结果见表2。表2 标记抗体对U937细胞及Hela细胞的特异杀伤作用 组别
样本数
, http://www.100md.com
细胞杀伤率(%)
U937
Hela
IVIG-HSA-MTX
3
90.5±3.2
10.4±0.4
MTX
3
30.3±1.2
31.2±0.8
5 标记抗体对小鼠巨噬细胞吞噬功能的影响 标记抗体组与空白对照组的吞噬率分别为20.4%和56.3%,二者比较差异有显著性(P<0.01),说明标记抗体可抑制巨噬细胞的吞噬功能。
, 百拇医药
6 游离IVIG对标记抗体特异杀伤作用的影响 标记抗体的杀伤活性与游离IVIG浓度呈负相关(r=-0.95,P<0.01),而MTX的杀伤活性与游离IVIG浓度无关(r=0.28,P>0.05)(见图2)。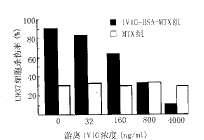
图2 游离IVIG对标记抗体U937细胞杀伤率(%)的影响
讨论
自身免疫性疾病,如血小板减少性紫癜、自身免疫性溶血性贫血等的主要发病机制是机体的免疫功能紊乱,产生抗自身细胞的抗体,抗体与血小板结合后,抗体的Fc段与单核巨噬细胞表面的Fc受体结合,通过受体介导的内吞作用,使血小板被单核巨噬系统过度破坏,因此单核巨噬细胞是破坏血小板的重要效应细胞。IVIG能够与巨噬细胞特异性地结合,竞争性地封闭Fc受体,使结合了血小板的自身抗体与巨噬细胞的结合减少,导致血小板破坏减少,但随着Fc受体的内化,IVIG不断被降解,浓度降低,封闭作用消失,使病情复发。我们将IVIG与免疫抑制剂交联在一起,利用IVIG对单核巨噬系统的特异导向作用,免疫抑制剂对靶细胞的细胞毒作用,使标记抗体在一定程度上对巨噬细胞产生持久的抑制作用,而避免了对全身细胞的毒副作用。我们的结果显示:IVIG-HSA-MTX的杀伤活性明显大于HSA-MTX和游离MTX。说明IVIG-HSA-MTX可通过IVIG与细胞特异结合发挥杀伤作用,具有细胞特异性。由于单核巨噬细胞是通过其表面的Fc受体来吞噬破坏血小板的,所以Fc受体在自身免疫性疾病中具有重要作用。Fc受体是细胞膜上与免疫球蛋白Fc段相结合的分子,它在体内分布具有细胞特异性,主要分布在单核巨噬细胞,B细胞及激活的T细胞表面[7,8]。Fc受体分布的特异性决定了IVIG的特异性导向作用,也使标记抗体具备了特异的杀伤活性。
, http://www.100md.com
IVIG可竞争性地与靶细胞表面的Fc受体结合,使标记抗体与靶细胞的结合减少,杀伤活性下降。并呈浓度依赖关系,进一步证明IVIG-HSA-MTX对单核-巨噬细胞的杀伤作用决定于抗体的Fc段与Fc受体结合特性。
由于我们的研究仅是体外实验,标记抗体IVIG-HSA-MTX的分子量较大,在体内可能会很快被降解,能否发挥较长时间的抑制作用,尚需体内实验进一步证实。
参 考 文 献
1,Endo H,Ksto Y,Takeda Y,et al,In vivo cytotoxicity of a human albulin-mediated conjugate of methotrexate with anti-MM46 monoclonal antibody.Cancer Res, 1987, 47: 1076-1080.
, 百拇医药 2,Garnett MC, Baldwin RW. An improved synothesis of a methotrexate-albulin-791T/36 monoclonal antibody conjugate cytotoxic to human osteogenie sarcoma cell lines.Cancer Res, 1986, 46:2407-2417.
3,Kortt A,Lin TY.On the mechanism of action of sereptococal proteinase Ⅰ, active sitetitration. Biochem, 1973,12:320-327.
4,高天祥,主编. 临床免疫学与实验技术. 第1版, 济南:山东科学技术出版社, 1984, 556-557.
5, 张胜本, 张平阳,主编. 肿瘤化学治疗敏感性与抗药性. 第1版, 成都:四川科学技术出版社, 1989,51-52.
, http://www.100md.com
6,徐宜为,主编. 实验免疫学技术. 第1版, 北京:科学出版社, 1985, 122-123.
7,Kinet JP. Antibody cell interaction: Fc receptors. Cell, 1989,57: 351-354.
8,Matyas Sandor Richard G. Lymch Lymphocyte Fc receptors: the special case of T cells. Immunology Today,1993,14:227-231.
(收稿日期:1999-12-13), 百拇医药
单位:姜振宇 王晓芳 张志清 姚程(130021 长春,白求恩医科大学第一临床学院);陈唯金 聂荣国(长春生物制品研究所)
关键词:
中华血液学杂志000921 我们将静脉注射用免疫球蛋白(IVIG)与免疫抑制剂甲氨蝶呤(MTX)在体外交联制成标记抗体,使MTX通过IVIG特异地与单核巨噬细胞结合,对单核-巨噬系统起到杀伤或抑制作用,既克服了IVIG疗效短暂的缺点,又避免了免疫抑制剂的非特异性细胞毒作用。现将体外实验结果报告如下。
材料和方法
1 材料 IVIG、人血白蛋白(HSA)由卫生部长春生物制品所生产。四甲基偶氮唑盐(MTT)、碳二亚胺(EDC)、γ-马来酰亚胺基丁酸-N-羟基琥珀酰亚胺酸(GMBS)、FITC标记的羊抗人Fab片段荧光抗体购自Sigma公司,MTX购自上海华联制药有限公司。人单核细胞白血病细胞株U937及Hela细胞由白求恩医科大学免疫教研室提供。4~6周龄的昆明小白鼠由本校实验动物部提供。
, http://www.100md.com
2 标记抗体的制备[1-3]。
2.1 双功能试剂法制备标记抗体:首先用碳二亚胺法制备HSA与MTX的复合物HSA-MTX,然后用双功能试剂法制备IVIG与交联剂GMBS的复合物IVIG-GMBS。向IVIG-GMBS溶液中加入HSA-MTX的PBS,混合物于4℃反应1h后经Sephadex G-150柱层析,收集第2峰,得到标记抗体IVIG-HSA-MTX(第1峰为高分子量的聚合体,第3峰为HSA-MTX)。
2.2 标记抗体的定性与定量:采用紫外吸收光谱和吸光度(A)测定法[1]。
2.3 间接免疫荧光法测定标记抗体Fc片段结合活性[4]:小鼠巨噬细胞表面有Fc受体,标记抗体的Fc段与巨噬细胞表面的Fc受体结合,再加入FITC标记的羊抗人Fab片段荧光抗体,荧光抗体与标记抗体的Fab片段结合,在显微镜下呈现黄绿色荧光。Hela细胞表面无Fc受体,做为阴性对照。
, 百拇医药
3 标记抗体的特异性杀伤活性测定
3.1 标记抗体的特异性杀伤活性:以Fc受体阳性的小鼠巨噬细胞和U937细胞为靶细胞,共分5组:①标记抗体组;②HSA-MTX组;③游离MTX组;④游离IVIG组;⑤空白对照组。每组设3个复孔,在37℃,体积分数为5%的CO2条件下培养30min,弃上清,培养液洗2次,复悬细胞,继续培养72h, MTT法测定杀伤活性[5],即于培养结束前4h,每孔加入MTT 20μl,在体积分数为5%的CO2、37℃培养4h,吸去未反应的MTT及上清,每孔加入二甲基亚砜100μl,10min后测波长570nm的A值,计算杀伤率。
杀伤率(%

3.2 Fc受体介导的细胞特异性杀伤活性测定:以 Fc受体阳性的人单核细胞U937为靶细胞,以Fc受体阴性的Hela细胞作阴性对照。共分3组:①标记抗体组;②游离MTX组;③空白对照组。每组设3个复孔,其余步骤同标记抗体的特异性杀伤活性测定。
, 百拇医药
4 标记抗体对小鼠巨噬细胞吞噬功能影响 向浓度为1×106/ml的小鼠巨噬细胞悬液中加入终浓度为1×10-2mg/ml(以MTX含量为标准)的标记抗体,共同培养30min,用培养液洗2次,复悬细胞,继续培养72h,加入鸡红细胞,测定吞噬率和吞噬指数[6]。
5 游离IVIG对标记抗体杀伤活性的影响 实验共分2组:标记抗体组和游离MTX组。在两组分别与U937细胞共同培养的同时加入6个不同浓度的游离IVIG,每个浓度设3个复孔,以下步骤同标记抗体的特异性杀伤活性检测。
6 统计学处理 χ2检验、秩和检验、方差分析、直线相关分析。
结果
1 标记抗体的定性与定量 标记抗体在波长200~600nm之间标记抗体的紫外吸收光谱中既有MTX特征峰,又有IVIG的特征峰,证明交联成功(见图1)。标记抗体中MTX与IVIG的质量比为24.8∶1。

, 百拇医药
图1 IVIG-HSA-MTX在波长200~600nm的紫外吸收图谱
2 标记抗体的Fc段结合活性 间接免疫荧光检测结果显示标记抗体Fc段结合活性与游离IVIG差异无显著性(P>0.05)。Hela细胞表面无荧光或偶见荧光。
3 标记抗体的特异杀伤作用 MTT法测定结果显示:在1000ng/ml 时, IVIG-HSA-MTX对U937细胞及小鼠巨噬细胞(mM)的作用明显大于HSA-MTX、游离MTX及游离IVIG(P<0.01)。设对照组细胞杀伤率为0,结果见表1。
表1 标记抗体(1000ng/mg)对U937细胞及
小鼠巨噬细胞的特异杀伤作用 组别
样本数
细胞杀伤率(%)
, http://www.100md.com
U937
mMø
IVIG-HSA-MTX
3
90.5±3.2
89.6±2.5
HSA-MTX
3
20.3±0.6
21.2±0.7
MTX
3
, 百拇医药 30.3±1.2
29.6±0.8
IVIG
3
2.1±0.2
1.3±0.1
4 Fc受体介导的细胞特异性杀伤作用 IVIG-HSA-MTX在1000ng/ml 时对U937细胞的杀伤作用明显大于游离MTX(P<0.05);IVIG-HSA-MTX对U937细胞的杀伤作用明显大于Hela细胞(P<0.01),游离MTX对二者的杀伤作用差异无显著性(P>0.05),设对照组细胞杀伤率为0,结果见表2。表2 标记抗体对U937细胞及Hela细胞的特异杀伤作用 组别
样本数
, http://www.100md.com
细胞杀伤率(%)
U937
Hela
IVIG-HSA-MTX
3
90.5±3.2
10.4±0.4
MTX
3
30.3±1.2
31.2±0.8
5 标记抗体对小鼠巨噬细胞吞噬功能的影响 标记抗体组与空白对照组的吞噬率分别为20.4%和56.3%,二者比较差异有显著性(P<0.01),说明标记抗体可抑制巨噬细胞的吞噬功能。
, 百拇医药
6 游离IVIG对标记抗体特异杀伤作用的影响 标记抗体的杀伤活性与游离IVIG浓度呈负相关(r=-0.95,P<0.01),而MTX的杀伤活性与游离IVIG浓度无关(r=0.28,P>0.05)(见图2)。

图2 游离IVIG对标记抗体U937细胞杀伤率(%)的影响
讨论
自身免疫性疾病,如血小板减少性紫癜、自身免疫性溶血性贫血等的主要发病机制是机体的免疫功能紊乱,产生抗自身细胞的抗体,抗体与血小板结合后,抗体的Fc段与单核巨噬细胞表面的Fc受体结合,通过受体介导的内吞作用,使血小板被单核巨噬系统过度破坏,因此单核巨噬细胞是破坏血小板的重要效应细胞。IVIG能够与巨噬细胞特异性地结合,竞争性地封闭Fc受体,使结合了血小板的自身抗体与巨噬细胞的结合减少,导致血小板破坏减少,但随着Fc受体的内化,IVIG不断被降解,浓度降低,封闭作用消失,使病情复发。我们将IVIG与免疫抑制剂交联在一起,利用IVIG对单核巨噬系统的特异导向作用,免疫抑制剂对靶细胞的细胞毒作用,使标记抗体在一定程度上对巨噬细胞产生持久的抑制作用,而避免了对全身细胞的毒副作用。我们的结果显示:IVIG-HSA-MTX的杀伤活性明显大于HSA-MTX和游离MTX。说明IVIG-HSA-MTX可通过IVIG与细胞特异结合发挥杀伤作用,具有细胞特异性。由于单核巨噬细胞是通过其表面的Fc受体来吞噬破坏血小板的,所以Fc受体在自身免疫性疾病中具有重要作用。Fc受体是细胞膜上与免疫球蛋白Fc段相结合的分子,它在体内分布具有细胞特异性,主要分布在单核巨噬细胞,B细胞及激活的T细胞表面[7,8]。Fc受体分布的特异性决定了IVIG的特异性导向作用,也使标记抗体具备了特异的杀伤活性。
, http://www.100md.com
IVIG可竞争性地与靶细胞表面的Fc受体结合,使标记抗体与靶细胞的结合减少,杀伤活性下降。并呈浓度依赖关系,进一步证明IVIG-HSA-MTX对单核-巨噬细胞的杀伤作用决定于抗体的Fc段与Fc受体结合特性。
由于我们的研究仅是体外实验,标记抗体IVIG-HSA-MTX的分子量较大,在体内可能会很快被降解,能否发挥较长时间的抑制作用,尚需体内实验进一步证实。
参 考 文 献
1,Endo H,Ksto Y,Takeda Y,et al,In vivo cytotoxicity of a human albulin-mediated conjugate of methotrexate with anti-MM46 monoclonal antibody.Cancer Res, 1987, 47: 1076-1080.
, 百拇医药 2,Garnett MC, Baldwin RW. An improved synothesis of a methotrexate-albulin-791T/36 monoclonal antibody conjugate cytotoxic to human osteogenie sarcoma cell lines.Cancer Res, 1986, 46:2407-2417.
3,Kortt A,Lin TY.On the mechanism of action of sereptococal proteinase Ⅰ, active sitetitration. Biochem, 1973,12:320-327.
4,高天祥,主编. 临床免疫学与实验技术. 第1版, 济南:山东科学技术出版社, 1984, 556-557.
5, 张胜本, 张平阳,主编. 肿瘤化学治疗敏感性与抗药性. 第1版, 成都:四川科学技术出版社, 1989,51-52.
, http://www.100md.com
6,徐宜为,主编. 实验免疫学技术. 第1版, 北京:科学出版社, 1985, 122-123.
7,Kinet JP. Antibody cell interaction: Fc receptors. Cell, 1989,57: 351-354.
8,Matyas Sandor Richard G. Lymch Lymphocyte Fc receptors: the special case of T cells. Immunology Today,1993,14:227-231.
(收稿日期:1999-12-13), 百拇医药