西藏高原红细胞增多症患者红细胞生成素低氧反应增强子多态性研究
作者:刘舒 裴澍萱 张世馥 王春荣 陈燕 赵莉敏 孔祥诚 刘艳霞
单位:刘舒(100029 北京心肺血管疾病研究所);陈燕(100029 北京心肺血管疾病研究所);赵莉敏(100029 北京心肺血管疾病研究所);刘艳霞(100029 北京心肺血管疾病研究所);裴澍萱(西藏自治区第二人民医院);张世馥(中国医学科学院基础医学研究所);王春荣(田力宝生物工程公司BECKMAN实验室);孔祥诚(田力宝生物工程公司BECKMAN实验室)
关键词:
中华血液学杂志000912 高原红细胞增多症(HAPC)是一种常见多发慢性高山病。我们前期的研究结果表明,藏族和汉族HAPC患者血浆红细胞生成素(Epo)水平显著高于相应各民族健康对照组,且汉族HAPC患者显著高于藏族HAPC患者组及汉族、藏族健康人组,但每组个例患者差异较大,无固定变化趋势。在不同民族HAPC发病机制中Epo所起的作用尚不清楚。在Epo的3′端存在一个256bp的低氧反应的增强子区域[1],为了探明HAPC患者在该低氧诱导区内是否存在特异的多态性变化,我们对该区域进行了实验研究。
, 百拇医药
对象和方法
1 病例筛选 于海拔3600~4500m的拉萨和那曲两地区对移居汉族、世居藏族志愿者作临床体检:心电图、X线胸透、腹部B超、血常规、尿常规、肝功能等检测,筛选健康人,均为男性。以Hb>200g/L,HCT>0.65,RBC>6.00×1012/L为HAPC的诊断标准[2]。将观察对象分为4组:汉族健康人(10例),汉族HAPC患者(9例),藏族健康人(7例),藏族HAPC患者(10例)。
2 样品收集与分离 取受检者静脉血20ml,用饱和EDTA 1∶100稀释抗凝,离心分离血浆,并取白细胞层提取DNA。血浆Epo含量采用R&D公司生产Epo QuantikineTM ELISA试剂盒,在MeterTech ∑960型酶标仪上检测。实验结果用SPSS统计软件分析。
3 基因多态性分析 PCR扩增:采用巢式-聚合酶链反应(NEST-PCR)法,用Omega 5.0版软件设计引物,筛选出外引物为5′-GCTGGGAAGACGCCTGAG-3′,5′-CCTGGGCAGGGTTGGCGAG-3′;PCR体系为:基因组DNA为模板200mg,外引物(上海生工公司产)各15pmol,dNTP、10×缓冲液、Mg2+、Taq酶(Promega公司产)各按照常规量[3],总反应体系50μl。程序为:95℃ 5min预变性,94℃ 1min变性,55℃ 55s退火,72℃ 90s延伸,30次循环,72℃ 5min延伸。扩增仪为KLB公司产GTC-2型PCR仪。内引物为5′-GATGCCAGGACACGCTTTGG-3′,5′-GCTGCCTTACTGCGGTGAG-3′,取第1次扩增的产物2μl,内引物各15pmol,其他体系及扩增条件同第一次扩增。产物片段经PCR产物纯化试剂盒纯化后(Promega公司产Wizard PCR Prep)进行DNA序列分析(PE公司全自动377型测序仪)。
, 百拇医药
4 连接质粒与酶切鉴定 将纯化的PCR片段与线形化的载体(T-Vector,Promega公司产)按照克分子浓度比1∶3进行连接,转染至CaCl2制备DH5α的感受态细胞,用碱裂解法小量提取质粒[3]。BstZⅠ(Promega公司产)酶切鉴定(如图1)。插入片段用M13通用引物Dye Primer法测序(PE公司全自动377型测序仪)。
1:PCR产物约为480bp;2:经Bst Z Ⅰ酶切后的质粒,切下的片段约为580bp;
3:未经酶切的阳性质粒;4:Marker/pBR322 HinfⅠ
图1 阳性质粒鉴定结果
结果
, http://www.100md.com
1 血浆Epo含量分析 本实验中由于汉族HAPC患者的Epo含量的标准差过大,为69.2±105.3mIU/ml,所以在4组样品方差分析时才有显著性,显著高于其他3组(P<0.01)。藏族HAPC患者为15.8±12.0mIU/ml,藏族健康人为6.3±3.5mIU/ml。两组进行t检验时,藏族HAPC患者高于藏族健康人(P<0.05)。汉族健康人为8.2±6.9mIU/ml。
2 多态性分析
2.1 藏、汉族HAPC患者及健康人基因组DNA经两次PCR产物测序,与Epo基因所在的基因组7q2.2和M11319基因(人类Epo基因全部序列)相比,各组受试者DNA样品都有数例发现一个国内外尚未见报道的T/G杂合位点,分别位于7q2.2的53396nt和M11319基因3541nt。
2.2 杂合样品连接至T载体后测序:结果见图2。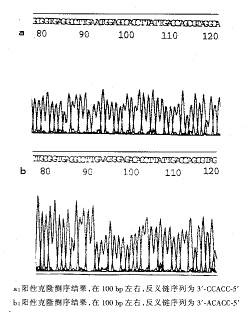
, 百拇医药
图2 杂合样品测序结果
3 T/G杂合的基因多态性与Epo值的关系 藏族患者、汉族患者、藏族健康者与汉族健康者4组样品每组分为序列含T/G杂合样品和序列与基因库一致的样品。经统计学分析并未见4组内杂合与本组基因正常受试者之间存在Epo含量的显著性差异。但根据患者与对照组是否患病与是否杂合子两个条件,计算藏族HAPC患者杂合子的疾病相对危险度,RR=(7×5)/(3×2)=6,提示可能藏族杂合与HAPC微相关(见表1)。
表1 样品杂合数量与Epo值(mIU/ml,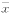 ±s) 组别
±s) 组别
T/G杂合
的Epo值
不含T/G杂合
, 百拇医药
基因的Epo值
藏族HAPC患者
19.7±12.6(7)
6.9±1.6(3)
汉族HAPC患者
147.5±169.3(2)
46.8±85.9(7)
藏族对照组
10.2±3.2(2)
4.5±2.3(5)
汉族对照组
9.9±4.5(2)
, http://www.100md.com
8.6±7.6(8)
注:括号内的数值为例数
讨论
据报道在Epo 3′端存在一个256bp的低氧反应增强子[1],在基因库有关Epo的克隆中,有许多克隆包含这一序列,如M11319克隆与基因库中Epo基因所在的基因组7q2.2染色体片段都包含这一序列(位于M11319克隆的3324nt~3579nt)。本实验中以人基因组DNA扩增出的低氧反应增强子区与基因库M11319号基因比较,会出现一个C→G突变与一个A插入两个G插入,位置分别在M11319的3434nt、3419nt、3498nt、3504nt[4,5]。经其他学者证明与红细胞增多症无关[5]。当M11319基因与Epo基因所在的基因组7q2.2相比,也存在上述四处差别。这可能是克隆的基因与人类基因组序列存在的差异。我们所有样品测序结果的上述位点全部与Epo基因所在的基因组7q2.2一致。
, http://www.100md.com
把低氧反应增强子连接到载体内,转染至Hep3B等细胞后可以在低氧或CoCl2刺激下大量表达报告基因。其中3470nt~3512nt是最小的低氧诱导增强子[6]。在3470nt~3512nt片段作为顺式调控元件有许多因子结合于其上,调节着Epo的表达:如HIF-1结合于3454nt~3464nt (Hypoxia Induced Factor-1)对低氧激活Epo转录起关键作用[7],且可由于部分缺失造成组织损伤[8];HNF-4结合于3483nt~3497nt(Hepatic Nuclear Factor 4)对该Epo起负调控作用[9]。
有学者发现在CoCl2刺激的Hep3B细胞核提取物,与低氧敏感诱导区的电泳移动分析实验(EMSA)中,加入3513nt~3579nt片段可使一些蛋白与32P标记3453nt~3579nt为探针的结合的小的复合体消失[8]。提示在钴盐诱导的低氧模型中该片段起一定作用。我们发现的杂合位点在这个区域之中(相当于M11319的3541nt),虽然杂合与该位置基因正常人的Epo含量无显著性差异,且与HAPC无显著相关,但是否突变体纯合体与基因正常Epo水平有所差异,是否与HAPC相关尚不清楚。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(39660082);卫生部科学基金资助项目(96-2-238)
参 考 文 献
1,Semenza GL, Nejfelt MK, Chi SM, et al. Hypoxia-inducible nuclear factors bind to an enhancer element located 3′ to the human erythropoietin gene. Proc Natl Acad Sci U S A, 1991, 88:5680-5684.
2,曹祯吾,车惠民,裴澍萱,等. 高原红细胞增多症. 第1版. 北京:军事医学科学院出版社,1996. 2-7.18-17.34-44.
3,J 萨姆布鲁克,EF 弗里奇,T 曼尼阿蒂多,编. 分子克隆实验指南. 金冬雁,黎孟枫,译. 第2版. 北京:科学出版社,1995. 22. 55.
, http://www.100md.com
4,Blanchard KL, Acquariva AM, Galion DL, et al. Hypoxic induction of the human erythropoietin gene cooperation between the promoter and enhancer, each of which contains steroid receptor response elements. Mol Cell Biol, 1992,12:5373-5385.
5,Percy MJ, McMullin MF, Lappin TRJ, et al. Sequence analysis of the 3′ hypoxia-responsive element of the human erythropoietin gene in patients with erythrocytosis. Biochem Mol Med, 1997, 62:132-134.
, 百拇医药
6,Leon-Velarde F, Monge CC, Vidal A, et al. Serum immunoreactive erythropoietin in high altitude natives with and without excessive erythrocytosis. Exp Hematol, 1991, 19:257-260.
7,Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropietin gene enhancer at a site required for transcriptional activation. Mol Cellul Biol, 1992, 12:5447-5454.
8,Galson DL, Chiya T, Tendler DS, et al. The orphan receptor hepatic nuclear factor 4 functions as a transcriptional activator for tissue-specific and hypoxia-specific erythropoietin gene expression and is antogonized by EAR3/COUP-TF1. Mol Cellul Biol, 1995, 12:2135-2144.
9,Yu AY, Shimoda LA, Iyer NV, et al. Impaired physiological response to chronic hypoxia in mice partially deficient for hypoxia-inducible factor 1 alpha. J Clin Invest, 1999,103:691-696.
(收稿日期:1999-11-01), 百拇医药
单位:刘舒(100029 北京心肺血管疾病研究所);陈燕(100029 北京心肺血管疾病研究所);赵莉敏(100029 北京心肺血管疾病研究所);刘艳霞(100029 北京心肺血管疾病研究所);裴澍萱(西藏自治区第二人民医院);张世馥(中国医学科学院基础医学研究所);王春荣(田力宝生物工程公司BECKMAN实验室);孔祥诚(田力宝生物工程公司BECKMAN实验室)
关键词:
中华血液学杂志000912 高原红细胞增多症(HAPC)是一种常见多发慢性高山病。我们前期的研究结果表明,藏族和汉族HAPC患者血浆红细胞生成素(Epo)水平显著高于相应各民族健康对照组,且汉族HAPC患者显著高于藏族HAPC患者组及汉族、藏族健康人组,但每组个例患者差异较大,无固定变化趋势。在不同民族HAPC发病机制中Epo所起的作用尚不清楚。在Epo的3′端存在一个256bp的低氧反应的增强子区域[1],为了探明HAPC患者在该低氧诱导区内是否存在特异的多态性变化,我们对该区域进行了实验研究。
, 百拇医药
对象和方法
1 病例筛选 于海拔3600~4500m的拉萨和那曲两地区对移居汉族、世居藏族志愿者作临床体检:心电图、X线胸透、腹部B超、血常规、尿常规、肝功能等检测,筛选健康人,均为男性。以Hb>200g/L,HCT>0.65,RBC>6.00×1012/L为HAPC的诊断标准[2]。将观察对象分为4组:汉族健康人(10例),汉族HAPC患者(9例),藏族健康人(7例),藏族HAPC患者(10例)。
2 样品收集与分离 取受检者静脉血20ml,用饱和EDTA 1∶100稀释抗凝,离心分离血浆,并取白细胞层提取DNA。血浆Epo含量采用R&D公司生产Epo QuantikineTM ELISA试剂盒,在MeterTech ∑960型酶标仪上检测。实验结果用SPSS统计软件分析。
3 基因多态性分析 PCR扩增:采用巢式-聚合酶链反应(NEST-PCR)法,用Omega 5.0版软件设计引物,筛选出外引物为5′-GCTGGGAAGACGCCTGAG-3′,5′-CCTGGGCAGGGTTGGCGAG-3′;PCR体系为:基因组DNA为模板200mg,外引物(上海生工公司产)各15pmol,dNTP、10×缓冲液、Mg2+、Taq酶(Promega公司产)各按照常规量[3],总反应体系50μl。程序为:95℃ 5min预变性,94℃ 1min变性,55℃ 55s退火,72℃ 90s延伸,30次循环,72℃ 5min延伸。扩增仪为KLB公司产GTC-2型PCR仪。内引物为5′-GATGCCAGGACACGCTTTGG-3′,5′-GCTGCCTTACTGCGGTGAG-3′,取第1次扩增的产物2μl,内引物各15pmol,其他体系及扩增条件同第一次扩增。产物片段经PCR产物纯化试剂盒纯化后(Promega公司产Wizard PCR Prep)进行DNA序列分析(PE公司全自动377型测序仪)。
, 百拇医药
4 连接质粒与酶切鉴定 将纯化的PCR片段与线形化的载体(T-Vector,Promega公司产)按照克分子浓度比1∶3进行连接,转染至CaCl2制备DH5α的感受态细胞,用碱裂解法小量提取质粒[3]。BstZⅠ(Promega公司产)酶切鉴定(如图1)。插入片段用M13通用引物Dye Primer法测序(PE公司全自动377型测序仪)。

1:PCR产物约为480bp;2:经Bst Z Ⅰ酶切后的质粒,切下的片段约为580bp;
3:未经酶切的阳性质粒;4:Marker/pBR322 HinfⅠ
图1 阳性质粒鉴定结果
结果
, http://www.100md.com
1 血浆Epo含量分析 本实验中由于汉族HAPC患者的Epo含量的标准差过大,为69.2±105.3mIU/ml,所以在4组样品方差分析时才有显著性,显著高于其他3组(P<0.01)。藏族HAPC患者为15.8±12.0mIU/ml,藏族健康人为6.3±3.5mIU/ml。两组进行t检验时,藏族HAPC患者高于藏族健康人(P<0.05)。汉族健康人为8.2±6.9mIU/ml。
2 多态性分析
2.1 藏、汉族HAPC患者及健康人基因组DNA经两次PCR产物测序,与Epo基因所在的基因组7q2.2和M11319基因(人类Epo基因全部序列)相比,各组受试者DNA样品都有数例发现一个国内外尚未见报道的T/G杂合位点,分别位于7q2.2的53396nt和M11319基因3541nt。
2.2 杂合样品连接至T载体后测序:结果见图2。

, 百拇医药
图2 杂合样品测序结果
3 T/G杂合的基因多态性与Epo值的关系 藏族患者、汉族患者、藏族健康者与汉族健康者4组样品每组分为序列含T/G杂合样品和序列与基因库一致的样品。经统计学分析并未见4组内杂合与本组基因正常受试者之间存在Epo含量的显著性差异。但根据患者与对照组是否患病与是否杂合子两个条件,计算藏族HAPC患者杂合子的疾病相对危险度,RR=(7×5)/(3×2)=6,提示可能藏族杂合与HAPC微相关(见表1)。
表1 样品杂合数量与Epo值(mIU/ml,
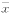 ±s) 组别
±s) 组别T/G杂合
的Epo值
不含T/G杂合
, 百拇医药
基因的Epo值
藏族HAPC患者
19.7±12.6(7)
6.9±1.6(3)
汉族HAPC患者
147.5±169.3(2)
46.8±85.9(7)
藏族对照组
10.2±3.2(2)
4.5±2.3(5)
汉族对照组
9.9±4.5(2)
, http://www.100md.com
8.6±7.6(8)
注:括号内的数值为例数
讨论
据报道在Epo 3′端存在一个256bp的低氧反应增强子[1],在基因库有关Epo的克隆中,有许多克隆包含这一序列,如M11319克隆与基因库中Epo基因所在的基因组7q2.2染色体片段都包含这一序列(位于M11319克隆的3324nt~3579nt)。本实验中以人基因组DNA扩增出的低氧反应增强子区与基因库M11319号基因比较,会出现一个C→G突变与一个A插入两个G插入,位置分别在M11319的3434nt、3419nt、3498nt、3504nt[4,5]。经其他学者证明与红细胞增多症无关[5]。当M11319基因与Epo基因所在的基因组7q2.2相比,也存在上述四处差别。这可能是克隆的基因与人类基因组序列存在的差异。我们所有样品测序结果的上述位点全部与Epo基因所在的基因组7q2.2一致。
, http://www.100md.com
把低氧反应增强子连接到载体内,转染至Hep3B等细胞后可以在低氧或CoCl2刺激下大量表达报告基因。其中3470nt~3512nt是最小的低氧诱导增强子[6]。在3470nt~3512nt片段作为顺式调控元件有许多因子结合于其上,调节着Epo的表达:如HIF-1结合于3454nt~3464nt (Hypoxia Induced Factor-1)对低氧激活Epo转录起关键作用[7],且可由于部分缺失造成组织损伤[8];HNF-4结合于3483nt~3497nt(Hepatic Nuclear Factor 4)对该Epo起负调控作用[9]。
有学者发现在CoCl2刺激的Hep3B细胞核提取物,与低氧敏感诱导区的电泳移动分析实验(EMSA)中,加入3513nt~3579nt片段可使一些蛋白与32P标记3453nt~3579nt为探针的结合的小的复合体消失[8]。提示在钴盐诱导的低氧模型中该片段起一定作用。我们发现的杂合位点在这个区域之中(相当于M11319的3541nt),虽然杂合与该位置基因正常人的Epo含量无显著性差异,且与HAPC无显著相关,但是否突变体纯合体与基因正常Epo水平有所差异,是否与HAPC相关尚不清楚。
, http://www.100md.com
基金项目:国家自然科学基金资助项目(39660082);卫生部科学基金资助项目(96-2-238)
参 考 文 献
1,Semenza GL, Nejfelt MK, Chi SM, et al. Hypoxia-inducible nuclear factors bind to an enhancer element located 3′ to the human erythropoietin gene. Proc Natl Acad Sci U S A, 1991, 88:5680-5684.
2,曹祯吾,车惠民,裴澍萱,等. 高原红细胞增多症. 第1版. 北京:军事医学科学院出版社,1996. 2-7.18-17.34-44.
3,J 萨姆布鲁克,EF 弗里奇,T 曼尼阿蒂多,编. 分子克隆实验指南. 金冬雁,黎孟枫,译. 第2版. 北京:科学出版社,1995. 22. 55.
, http://www.100md.com
4,Blanchard KL, Acquariva AM, Galion DL, et al. Hypoxic induction of the human erythropoietin gene cooperation between the promoter and enhancer, each of which contains steroid receptor response elements. Mol Cell Biol, 1992,12:5373-5385.
5,Percy MJ, McMullin MF, Lappin TRJ, et al. Sequence analysis of the 3′ hypoxia-responsive element of the human erythropoietin gene in patients with erythrocytosis. Biochem Mol Med, 1997, 62:132-134.
, 百拇医药
6,Leon-Velarde F, Monge CC, Vidal A, et al. Serum immunoreactive erythropoietin in high altitude natives with and without excessive erythrocytosis. Exp Hematol, 1991, 19:257-260.
7,Semenza GL, Wang GL. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropietin gene enhancer at a site required for transcriptional activation. Mol Cellul Biol, 1992, 12:5447-5454.
8,Galson DL, Chiya T, Tendler DS, et al. The orphan receptor hepatic nuclear factor 4 functions as a transcriptional activator for tissue-specific and hypoxia-specific erythropoietin gene expression and is antogonized by EAR3/COUP-TF1. Mol Cellul Biol, 1995, 12:2135-2144.
9,Yu AY, Shimoda LA, Iyer NV, et al. Impaired physiological response to chronic hypoxia in mice partially deficient for hypoxia-inducible factor 1 alpha. J Clin Invest, 1999,103:691-696.
(收稿日期:1999-11-01), 百拇医药