血小板糖蛋白Ⅰbα因子突变(A156V)导致其与血管性血友病因子相互作用缺陷
作者:董京飞 Chester Li Alicia J. Schade Lily Sun Larry V. McIntire Jose A. Lopez
单位:Division of Hematology,Department of Internal Medicine,and Department of Molecular and Human Genetics.Baylor College of Medicine and Veterans Affairs Medical Center Houston TX.Cax Laboratory for Bioengineerung,Rice University Houston TX 77030,U S A
关键词:糖蛋白类;突变;流体切应力;血管性血友病因子
中华血液学杂志000901
, 百拇医药
【摘要】 目的 研究在流体切应力作用下表达突变的细胞与固着的血管性血友病因子(vWF)相互作用中GPⅠbα突变(A156V)的意义。方法 在GPⅠbα cDNA中直接诱发的突变克隆到哺乳类表达载体pDX的EcoRⅠ位点,随后将突变的cDNA转染在CHOβⅨ细胞。人的vWF通过甘氨酸和氯化钠沉淀及在Sepharose 4B柱分离的方法从血液冷沉淀制剂中纯化。纯化的vWF固着在盖玻片上,在平行板液流室中进行细胞滚动研究,用相差电视显微镜观察。结果 表达GPⅠb-Ⅸ-Ⅴ复合物的CHO细胞能粘附于并滚动在固着的vWF表面,当用表达A156V突变的细胞进行试验时,这些细胞虽然能粘附于并滚动在固着的vWF表面,但是它们滚动的速度明显快于其野生型,这表明突变的GPⅠbα与vWF之间的受体配体键的解离速度受损,单克隆抗体AN51与突变的GPⅠbα结合明显减少,表明A156V突变产生了GPⅠbα氨基端配体结合区的构象改变。结论 突变致使A156V突变细胞与固着的vWF产生较快的解离速度。突变的多肽在GPⅠbα氨基端配体结合区发生构象改变。平行板液流室在评价GPⅠbα与vWF之间相互作用中是一种有用的工具。
, http://www.100md.com
A mutation of platelet glycoprotein Ⅰbα results in defects in its interaction with immobilized vWF
DONG Jingfei Chester LI Alicia J. Schade
Division of Hematology/Oncology, Department of Internal Medicine, and Department of Molecular and Human Genetics. Baylor College of Medicine and Veterans Affairs Medical Center Houston TX, Cax Laboratory for Bioengineering, Rice University Houston TX 77030,U S A)
, http://www.100md.com
【Abstract】 Objective To study the importance of glycoprotein(GP)Ⅰbα mutation (A156V) in interaction between mutant expressing cell and immobilized vWF under fluid shear stress. Methods Mutant GPⅠbα cDNA was cloned into the EcoRⅠ site of the mammalian expression vector pDX, mutant cDNA was then transfected into CHO βⅨ cells. Human vWF was purified from blood cryoprecipitate by glycine and NaCl precipitation and subsequent separation on sepharose 4B column. The purified vWF was immobilized onto a coverslip. Cell rolling was induced in a parallel-plate flow chamber and observed by phase-contrast video microscope. Results CHO cells expressing GPⅠb-Ⅸ-Ⅴ complex could adhere to and roll on immobilized vWF. The A156V mutant cells retained the ability to adhere and roll on vWF matrix, but the rolling speed was significantly faster than that of wild type cells, indicating that the off-rate of the ligand-receptor bond between the mutant and vWF was impaired. Binding of monoclonal antibody AN51 to mutant GPⅠbα decreased significantly, indicating that the A156V mutation altered the conformation of the N-terminal ligand-binding region of GPⅠbα. Conclusion The mutant GPⅠbα has a faster off-rate for its interaction with immobilized vWF. The mutant polypeptide adopts an altered conformation in N-terminal ligand-binding region of GPⅠbα. The parallel-plate flow chamber is an extremely useful system in evaluating interaction between GPⅠbα and vWF.
, 百拇医药
【Key words】 Glycoprotein; mutation; Fluid shear stress; von Willebrand factor
在血管受损处形成的血块可防止血管损伤所致的血液流失。血块形成包括两个过程:血小板粘附于受损血管的内皮下组织以及血小板聚集。这两个过程均是由血小板糖蛋白(GP)Ⅰ-Ⅸ-Ⅴ复合物与内皮下组织中的血管性血友病因子(vWF)的相互作用而始动的[1]。GPⅠb-Ⅸ-Ⅴ复合物由四个单位组成,它们分别由4个不同基因所编码,均属于富含亮氨酸的蛋白家族,这个家族蛋白的共同特点是存在一个或数个亮氨酸重复序列[1,2]。在非流体系统中,GPⅠb-Ⅸ-Ⅴ复合物与vWF的结合需要有诱导剂的存在,或者vWF固着在固体表面发生。在流体系统中,该复合物仅在高切应力条件下(例如在动脉狭窄部位),切应力诱导其受体与配体的结合,这种结合在血栓形成中起着关键作用。近年来,锥板粘度计及平行板液流室在研究流动条件下的受体与配体相互作用中日益受到重视,应用这些方法,人们发现血小板可粘附于固着的vWF表面,并在其表面滚动。滚动的血小板随后被激活而粘附于vWF基质上[3]。我们测定了表达血小板GPⅠb-Ⅸ-Ⅴ复合物的中国仓鼠卵(CHO)细胞在高切应力条件下于vWF基质上的滚动[4,5],同时也观察了带有GPⅠbα突变[156丙氨酸(A)→缬氨酸(V)]的CHO细胞与vWF基质相互作用特征,这是在Bolzano变异型巨大血小板综合症(Bernard-Soulier Syndrome, BSS)时发生的突变。通过这项研究,以阐明GPⅠbα的A156V突变在细胞与vWF相互作用中的意义。
, http://www.100md.com
材料和方法
1 突变诱发 采用PCR诱发试剂盒(Quick ChangeTM公司产品),将GPⅠbα cDNA克隆到哺乳类表达载体pDX的EcoR位点上,直接进行突变诱发[6],使A156(GCT)的编码子转变为缬氨酸的编码子(GTT),诱发突变的GPⅠbα cDNA通过序列测定予以确认,DNA序列测定于ABI-373A型DNA测序仪中进行。
2 DNA转染及细胞系 将含有GPⅠbα突变的DNA重组体转染到能长期表达GPⅠbβ和GPⅨ的CHO细胞,并在CHO细胞同时转染另一载体,以利于以后实验中的药物选择。转染的细胞在含有体积分数为10%热灭活的小牛血清的α-培养基(生命科技公司)中生长3 d,随后加入终浓度为0.5g/L的Hygromycin。阳性细胞通过分检法分离,并予以培养。细胞分离方法如下:用0.53mmol/L的EDTA溶液使细胞从生长皿壁分离,并使其重新悬浮于含有10g/L牛血清白蛋白的磷酸缓冲液(PBS)中,将阳性细胞在室温下与GPⅠb单抗WM23孵育30min,随后再与绵羊抗小鼠IgG包被的磁性小球于室温下孵育,与阳性细胞结合的磁性小球通过磁性收集器收集。
, 百拇医药
3 流式细胞术检测 表达A156V突变的细胞和正常的细胞用荧光标记的WM23抗体进行标记[7,8],随后在流式细胞仪中进行测定[9]。作流式细胞术检测的细胞是用0.53mmol/L EDTA从培养皿壁分离的,随后用PBS洗涤,最后悬浮于含有10g/L牛血清白蛋白的PBS中。将1μg/ml WM23抗体加入于上述细胞悬液,并于室温下孵育60min,细胞用PBS洗涤后,再与FITC标记的兔抗鼠IgG于室温下孵育30min,随后在流式细胞仪中对标记细胞进行检测,在荧光检测中,激发光波长为488nm,吸收光波长为530nm。
在流式细胞仪中也分析了数种抗体与GPⅠbα的结合,以确定突变是否会影响GPⅠb配体结合区的三维结构变化,这些抗体包括AN51,AK2,MB45和SZ2,在以往的资料中已确定了这些抗体可以阻断vWF与GPⅠbα的结合[10,11]。
4 vWF纯化及包被 用血浆冷沉淀物,通过甘氨酸和氯化钠沉淀,并经Sepharose 4B层析柱纯化而获得人vWF[12,13]。纯化物中的vWF含量用休斯顿Ramo实验室提供的试剂盒测定。
, 百拇医药
将纯化的vWF包被于盖玻片上,vWF包被液浓度为40μg/ml,在室温下包被45min,随后用生理盐水冲洗掉未包被在玻片的vWF。
5 平行板液流室 该装置由硅胶、vWF包被的盖玻片及用Polycarbonate材料制成的液流室三部分组成,液流室与恒流泵相连,将PBS以一定速率通过液流室,以达到所需的壁切变率[14]。装配后的液流室被置于倒置显微镜(Nikon公司产品)的镜台上,录像机(Hammatus,Waltman,MA)与显微镜相连以记录细胞移动,整个实验均在37℃进行。
6 细胞流动实验 实验分成二组,一组将细胞悬液(10000细胞/ml)按每分钟0.6ml的流量流经液流室,另一组是将细胞与vWF基质预先孵育1min后,按上述流量将细胞(500000细胞/ml)流经过液流室。细胞在液流室内移动状况通过录像机记录,通过录像带分析滚动细胞的数量及速度[15]。
, 百拇医药
7 统计学处理 实验资料均作Studsnt t检验。
结果
1 表达血小板GPⅠb-Ⅸ-Ⅴ复合物的细胞在vWF基质上的滚动 当表达GPⅠb-Ⅸ-Ⅴ复合物的细胞与vWF基质孵育1分钟后再经受切应力作用时,这些细胞均能粘附并滚动于vWF基质表面,平均滚动速度为(62.4±5.8)μm/s(图1)。这种滚动是由GPⅠbα与vWF之间的相互作用介导的,因为抗GPⅠb抗体AK2和抗vWFA1区抗体5D2均能阻止细胞滚动。但抗GPⅠbα抗体WM23并不阻止细胞滚动,因为它与GPⅠbα的结合区位于配体结合区外[7,8]。当细胞悬液直接向液流室灌注时,细胞仍可粘附于vWF基质上滚动。
a为细胞先与vWF基质孵育1min,随后受10g.cm.s-2.cm-2切应力;
, http://www.100md.com
b为20幅/s摄像系统获得的图像
CHOαβⅨ为表达野生型GPⅠb-Ⅸ细胞;CHO βⅨ不含GPⅠbα的细胞
图1 CHO细胞在壁切应力10 g.cm.s-2.cm-2条件下在固着的vWF上滚动的电视影像
2 突变GPⅠbα的配基结合区的结构变化 为了确定A156V的突变是否会引起GPⅠbα的配基结合区结构改变,我们采用一组抗GPⅠbα抗体与这种突变的GPⅠbα结合试验来检测,已知这组抗体的结合区均位于GPⅠbα配体结合区内,并均能阻断由诱导剂诱导的GPⅠbα与vWF的结合[10,11,]。图2所示,除AN51外,其余的抗GPⅠbα抗体均能正常地与这种突变的GPⅠbα结合,与AN51的结合率则不到正常的一半。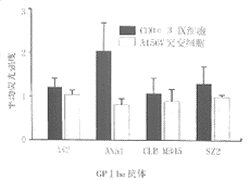
, http://www.100md.com
图2 不同抗GPⅠbα单克隆抗体与突变GPⅠbα结合实验结果
3 突变细胞与vWF基质在液流条件下的相互作用 在10 g.cm.s-2.cm-2的切应力条件下,表达A156V突变的细胞在vWF基质表面发生滚动,但滚动速度明显地比未突变的细胞快。
当这种突变的细胞在液流室直接予以灌注时,仍可在vWF基质表面上滚动,而滚动速度在5及10 g.cm.s-2.cm-2加应力下均快于未突变细胞(图3)。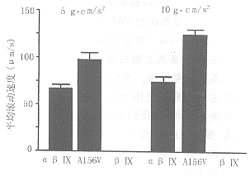
图3 每平方厘米不同切应力作用下表达A156V突变的细胞
, 百拇医药 在固着的vWF表面的滚动实验结果
讨论
我们应用平行板液流室系统证明了表达血小板GPⅠb-Ⅸ-Ⅴ复合物的细胞可以在流动时的高切应力作用下于vWF基质上滚动,细胞在该状态下的滚动由GPⅠbα与vWF的相互作用所介导,因为这种滚动可以被抗GPⅠbα抗体或抗vWF抗体所阻断。
我们的实验结果显示GPⅠb-Ⅸ-Ⅴ复合物与vWF之间的相互作用是一个快速结合与解离的过程。快速的结合可使vWF基质捕捉到在液体中流动的细胞并使其与固着的vWF相互作用,而快速的解离则使细胞能于vWF基质上滚动而不发生直接粘附。这种快速的结合和解离对流动条件下的受体与配体之间的相互作用是极为重要的。这种GPⅠbα的突变(A156V)导致临床上Bolzano变异型BSS的发生。
我们的研究结果证明突变的GPⅠbα可以在CHO细胞上表达,其表达水平与正常的GPⅠbα表达水平无差异[16]。但是A516V突变产生了配基结合区结构的改变,其部位位于氨基端,这一结论来自于一组抗GPⅠbα抗体与A156V突变GPⅠbα结合实验的结果,所用的4种抗体中(AK2,AN51,MB45和SZ2)只有AN51的结合降至正常水平的50%以上,已知在GPⅠbα上的结合区位于N端35个氨基酸片段内[17]。这种抗体也能阻断诱导剂或高切应力下诱导的GPⅠbα与vWF结合。但一种与AN51结合区相同的抗GPⅠbα抗体LJ-1B1也未能与突变的GPⅠbα相结合,提示了A156V突变使N端35氨基酸区的三维结构发生改变。
, 百拇医药
为了探讨A156V突变对GPⅠbα功能的影响,我们在能稳定表达GPⅠbβ和GPⅨ的CHO细胞中表达这种突变,随后在切应力条件下观察这种细胞在固着的vWF表面的粘附和滚动能力。我们发现当这种突变的细胞在与vWF基质经1min孵育后再在10 g.cm*s-2*cm-2切应力的条件下作灌注时,这种细胞在vWF基质上能粘附和滚动,但其滚动的速度明显高于正常细胞。我们试验的不足之处在于不能观察这种突变对受体与配体相互作用的结合率,为了解决这个问题,我们将细胞直接灌注到液流室,并再次 发现A156V突变的细胞滚动速度明显快于正常细胞。这些结果证明了A156V的突变导致GPⅠbα与固定的vWF相互作用具有较正常GPⅠbα更快的解离速度。
细胞滚动可视为血细胞在血管内移动速度降低,这个现象起初是在白细胞通过P选择素与PSG1-1相互作用在内皮细胞表面上滚动而发现的。一个滚动的细胞应有快速结合与解离的受体-配体相互作用。前者使细胞在血液流动中被固着的基质所捕捉,因而,在这种快速结合出现缺陷时,流动细胞与固着的基质相互作用的数量就会明显减少。此外,细胞滚动速度作为受体与配体的快速结合与解离的一个总体的结果中,它能更大程度上反映解离速度,而这种解离速度的变化则是A156V突变引起的缺陷所致。
, 百拇医药
通过这项研究,我们认为平行板液流室系统是研究受体-配体在流动条件下相互作用的一种有用的实验工具。
参 考 文 献
1,Lopez JA. The platelet glycoprotein Ⅰb-Ⅸ complex. Blood Coagul Fibrinolysis, 1994, 5:97-119.
2,Lopez JA, Dong JF. Structure and function of the glycoprotein Ⅰb-Ⅸ-Ⅴ complex. Curr Opin Hematol, 1997, 4:323-329.
3,Savage B, Saldivar E, Ruggeri ZM. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von willebrand factor. Cell,1996,84:289-297.
, 百拇医药
4,Fredrickson BJ, Dong JF. McIntire LV, et al. Shear-dependent rolling on von Willebrand factor of mammalian cells expression the platelet glycoprotein Ⅰb-Ⅸ-Ⅴ complex. Blood, 1998, 92:3684-3693.
5,Cranmer SL, Ulsemer P, Cooke BM, et al. Glycoprotein (GP)Ⅰb-Ⅸ-Ⅴ transfected cells roll on a von Willebrand factor matrix under flow. Importence of the GPⅠb/actin-binding (ABP-280) interaction in maintaining adhesion under high shear. J Biol Chem, 1999,247:6097-6106.
, http://www.100md.com
6,Lopez JA, Leung B, Reynolds CC, et al.Efficient plasma membrane expression of a functional platelet glycoprotein Ⅰb-Ⅸ complex requires the presence of its three subunits. J Biol Chem, 1992, 267:12851-12859.
7,Berndt MC, Du X, Booth WJ. Ristocetin-dependent reconstitution of binding of von Willebrand factor to purified human platelet membrane glycoprotein Ⅰb-Ⅸ complex. Biochemistry, 1988, 27:633-640.
8,Andrews RK, Booth WJ, Gorman JJ, et al. Purification of botrocetin from Bothrops jararaca venom. Analysis of the botrocetin-mediated interaction between von Willebrand factor and the human platelet membrane glycoprotein Ⅰb-Ⅸ complex. Biochemistry, 1989, 28:2817-8326.
, http://www.100md.com
9,Dong JF, Li CQ, Sae-Tung G, et al. The cytoplasmic domain of glycoprotein (GP) Ⅰbα constranins the lateral diffusion of the GPⅠb-Ⅸ complex and modulates von Willebarnd factor binding. Biochemistry, 1997, 36:12421-12427.
10,Ward CM, Qndrews RK, Smith AI, et al. Mocarhagin, a novel cobra veom metalloproteinase, cleaves the platelet von Willebrand factor receptor glycoprotein Ⅰbα. Identification of the sulfated tyrosine/anionic sequence Tyr-276-Glu-282 of glycoprotein Ⅰbα as a binding site for von Willebrand factor and alpha-thrombin. Biochemstry, 1996, 35:4929-4938.
, http://www.100md.com
11,Ruan C, Tobelem G, McMichael AJ, et al. Monoclonal antibody to human platelet glycoprotein LIL. Effects on human platelet function. Br J Haematol, 1981, 49:511-519.
12,Thorell L, Blomback B. Purification of the factor Ⅷ complex. Thromb Res, 1984, 35:431-450.
13,Moake JL, Turner NA, Stathopoulos NA, et al. Involvement of large plasma von Willebrand factor(vWF) multimers and unusually large vWF forms derived from endothelial cells in shear stress-induced platelet aggregation. J Clin Invest, 1986, 78:1456-1461.
, 百拇医药
14,Russel SD, Roth GJ. Pseudo-von Willebrand disease: a mutation in the platelet glycoprotein Ⅰb alpha gene assocciated with a hyperactive surface receptor. Blood, 1993, 81:1787-1791.
15,Kukreti S, Konstantopouls K, Smith CW, et al. Molecular mechanisms of monocyte adhesion to interleukin-1 beta-stimulated endothelial cells under physiologic flow conditions. Blood, 1997, 89:4104-4111.
16,Dong JF, Gao S, Lopez JA. Synthesis assembly and intracellular transport of the platelet glycoprotein Ⅰb-Ⅸ-Ⅴ complex. J Biol Chem, 1998,273:31449-31454.
17,Berndt MC, Shen Y, Dong J, et al. Requirement of leucine-rich repeats of GPⅠbα for shear-dependent and static binding of von Willebrand factor to the platelet membrane GPⅠb-Ⅸ-Ⅴ comblex. Blood, 2000, 95:903-910.
(收稿日期:2000-04-15), http://www.100md.com
单位:Division of Hematology,Department of Internal Medicine,and Department of Molecular and Human Genetics.Baylor College of Medicine and Veterans Affairs Medical Center Houston TX.Cax Laboratory for Bioengineerung,Rice University Houston TX 77030,U S A
关键词:糖蛋白类;突变;流体切应力;血管性血友病因子
中华血液学杂志000901
, 百拇医药
【摘要】 目的 研究在流体切应力作用下表达突变的细胞与固着的血管性血友病因子(vWF)相互作用中GPⅠbα突变(A156V)的意义。方法 在GPⅠbα cDNA中直接诱发的突变克隆到哺乳类表达载体pDX的EcoRⅠ位点,随后将突变的cDNA转染在CHOβⅨ细胞。人的vWF通过甘氨酸和氯化钠沉淀及在Sepharose 4B柱分离的方法从血液冷沉淀制剂中纯化。纯化的vWF固着在盖玻片上,在平行板液流室中进行细胞滚动研究,用相差电视显微镜观察。结果 表达GPⅠb-Ⅸ-Ⅴ复合物的CHO细胞能粘附于并滚动在固着的vWF表面,当用表达A156V突变的细胞进行试验时,这些细胞虽然能粘附于并滚动在固着的vWF表面,但是它们滚动的速度明显快于其野生型,这表明突变的GPⅠbα与vWF之间的受体配体键的解离速度受损,单克隆抗体AN51与突变的GPⅠbα结合明显减少,表明A156V突变产生了GPⅠbα氨基端配体结合区的构象改变。结论 突变致使A156V突变细胞与固着的vWF产生较快的解离速度。突变的多肽在GPⅠbα氨基端配体结合区发生构象改变。平行板液流室在评价GPⅠbα与vWF之间相互作用中是一种有用的工具。
, http://www.100md.com
A mutation of platelet glycoprotein Ⅰbα results in defects in its interaction with immobilized vWF
DONG Jingfei Chester LI Alicia J. Schade
Division of Hematology/Oncology, Department of Internal Medicine, and Department of Molecular and Human Genetics. Baylor College of Medicine and Veterans Affairs Medical Center Houston TX, Cax Laboratory for Bioengineering, Rice University Houston TX 77030,U S A)
, http://www.100md.com
【Abstract】 Objective To study the importance of glycoprotein(GP)Ⅰbα mutation (A156V) in interaction between mutant expressing cell and immobilized vWF under fluid shear stress. Methods Mutant GPⅠbα cDNA was cloned into the EcoRⅠ site of the mammalian expression vector pDX, mutant cDNA was then transfected into CHO βⅨ cells. Human vWF was purified from blood cryoprecipitate by glycine and NaCl precipitation and subsequent separation on sepharose 4B column. The purified vWF was immobilized onto a coverslip. Cell rolling was induced in a parallel-plate flow chamber and observed by phase-contrast video microscope. Results CHO cells expressing GPⅠb-Ⅸ-Ⅴ complex could adhere to and roll on immobilized vWF. The A156V mutant cells retained the ability to adhere and roll on vWF matrix, but the rolling speed was significantly faster than that of wild type cells, indicating that the off-rate of the ligand-receptor bond between the mutant and vWF was impaired. Binding of monoclonal antibody AN51 to mutant GPⅠbα decreased significantly, indicating that the A156V mutation altered the conformation of the N-terminal ligand-binding region of GPⅠbα. Conclusion The mutant GPⅠbα has a faster off-rate for its interaction with immobilized vWF. The mutant polypeptide adopts an altered conformation in N-terminal ligand-binding region of GPⅠbα. The parallel-plate flow chamber is an extremely useful system in evaluating interaction between GPⅠbα and vWF.
, 百拇医药
【Key words】 Glycoprotein; mutation; Fluid shear stress; von Willebrand factor
在血管受损处形成的血块可防止血管损伤所致的血液流失。血块形成包括两个过程:血小板粘附于受损血管的内皮下组织以及血小板聚集。这两个过程均是由血小板糖蛋白(GP)Ⅰ-Ⅸ-Ⅴ复合物与内皮下组织中的血管性血友病因子(vWF)的相互作用而始动的[1]。GPⅠb-Ⅸ-Ⅴ复合物由四个单位组成,它们分别由4个不同基因所编码,均属于富含亮氨酸的蛋白家族,这个家族蛋白的共同特点是存在一个或数个亮氨酸重复序列[1,2]。在非流体系统中,GPⅠb-Ⅸ-Ⅴ复合物与vWF的结合需要有诱导剂的存在,或者vWF固着在固体表面发生。在流体系统中,该复合物仅在高切应力条件下(例如在动脉狭窄部位),切应力诱导其受体与配体的结合,这种结合在血栓形成中起着关键作用。近年来,锥板粘度计及平行板液流室在研究流动条件下的受体与配体相互作用中日益受到重视,应用这些方法,人们发现血小板可粘附于固着的vWF表面,并在其表面滚动。滚动的血小板随后被激活而粘附于vWF基质上[3]。我们测定了表达血小板GPⅠb-Ⅸ-Ⅴ复合物的中国仓鼠卵(CHO)细胞在高切应力条件下于vWF基质上的滚动[4,5],同时也观察了带有GPⅠbα突变[156丙氨酸(A)→缬氨酸(V)]的CHO细胞与vWF基质相互作用特征,这是在Bolzano变异型巨大血小板综合症(Bernard-Soulier Syndrome, BSS)时发生的突变。通过这项研究,以阐明GPⅠbα的A156V突变在细胞与vWF相互作用中的意义。
, http://www.100md.com
材料和方法
1 突变诱发 采用PCR诱发试剂盒(Quick ChangeTM公司产品),将GPⅠbα cDNA克隆到哺乳类表达载体pDX的EcoR位点上,直接进行突变诱发[6],使A156(GCT)的编码子转变为缬氨酸的编码子(GTT),诱发突变的GPⅠbα cDNA通过序列测定予以确认,DNA序列测定于ABI-373A型DNA测序仪中进行。
2 DNA转染及细胞系 将含有GPⅠbα突变的DNA重组体转染到能长期表达GPⅠbβ和GPⅨ的CHO细胞,并在CHO细胞同时转染另一载体,以利于以后实验中的药物选择。转染的细胞在含有体积分数为10%热灭活的小牛血清的α-培养基(生命科技公司)中生长3 d,随后加入终浓度为0.5g/L的Hygromycin。阳性细胞通过分检法分离,并予以培养。细胞分离方法如下:用0.53mmol/L的EDTA溶液使细胞从生长皿壁分离,并使其重新悬浮于含有10g/L牛血清白蛋白的磷酸缓冲液(PBS)中,将阳性细胞在室温下与GPⅠb单抗WM23孵育30min,随后再与绵羊抗小鼠IgG包被的磁性小球于室温下孵育,与阳性细胞结合的磁性小球通过磁性收集器收集。
, 百拇医药
3 流式细胞术检测 表达A156V突变的细胞和正常的细胞用荧光标记的WM23抗体进行标记[7,8],随后在流式细胞仪中进行测定[9]。作流式细胞术检测的细胞是用0.53mmol/L EDTA从培养皿壁分离的,随后用PBS洗涤,最后悬浮于含有10g/L牛血清白蛋白的PBS中。将1μg/ml WM23抗体加入于上述细胞悬液,并于室温下孵育60min,细胞用PBS洗涤后,再与FITC标记的兔抗鼠IgG于室温下孵育30min,随后在流式细胞仪中对标记细胞进行检测,在荧光检测中,激发光波长为488nm,吸收光波长为530nm。
在流式细胞仪中也分析了数种抗体与GPⅠbα的结合,以确定突变是否会影响GPⅠb配体结合区的三维结构变化,这些抗体包括AN51,AK2,MB45和SZ2,在以往的资料中已确定了这些抗体可以阻断vWF与GPⅠbα的结合[10,11]。
4 vWF纯化及包被 用血浆冷沉淀物,通过甘氨酸和氯化钠沉淀,并经Sepharose 4B层析柱纯化而获得人vWF[12,13]。纯化物中的vWF含量用休斯顿Ramo实验室提供的试剂盒测定。
, 百拇医药
将纯化的vWF包被于盖玻片上,vWF包被液浓度为40μg/ml,在室温下包被45min,随后用生理盐水冲洗掉未包被在玻片的vWF。
5 平行板液流室 该装置由硅胶、vWF包被的盖玻片及用Polycarbonate材料制成的液流室三部分组成,液流室与恒流泵相连,将PBS以一定速率通过液流室,以达到所需的壁切变率[14]。装配后的液流室被置于倒置显微镜(Nikon公司产品)的镜台上,录像机(Hammatus,Waltman,MA)与显微镜相连以记录细胞移动,整个实验均在37℃进行。
6 细胞流动实验 实验分成二组,一组将细胞悬液(10000细胞/ml)按每分钟0.6ml的流量流经液流室,另一组是将细胞与vWF基质预先孵育1min后,按上述流量将细胞(500000细胞/ml)流经过液流室。细胞在液流室内移动状况通过录像机记录,通过录像带分析滚动细胞的数量及速度[15]。
, 百拇医药
7 统计学处理 实验资料均作Studsnt t检验。
结果
1 表达血小板GPⅠb-Ⅸ-Ⅴ复合物的细胞在vWF基质上的滚动 当表达GPⅠb-Ⅸ-Ⅴ复合物的细胞与vWF基质孵育1分钟后再经受切应力作用时,这些细胞均能粘附并滚动于vWF基质表面,平均滚动速度为(62.4±5.8)μm/s(图1)。这种滚动是由GPⅠbα与vWF之间的相互作用介导的,因为抗GPⅠb抗体AK2和抗vWFA1区抗体5D2均能阻止细胞滚动。但抗GPⅠbα抗体WM23并不阻止细胞滚动,因为它与GPⅠbα的结合区位于配体结合区外[7,8]。当细胞悬液直接向液流室灌注时,细胞仍可粘附于vWF基质上滚动。

a为细胞先与vWF基质孵育1min,随后受10g.cm.s-2.cm-2切应力;
, http://www.100md.com
b为20幅/s摄像系统获得的图像
CHOαβⅨ为表达野生型GPⅠb-Ⅸ细胞;CHO βⅨ不含GPⅠbα的细胞
图1 CHO细胞在壁切应力10 g.cm.s-2.cm-2条件下在固着的vWF上滚动的电视影像
2 突变GPⅠbα的配基结合区的结构变化 为了确定A156V的突变是否会引起GPⅠbα的配基结合区结构改变,我们采用一组抗GPⅠbα抗体与这种突变的GPⅠbα结合试验来检测,已知这组抗体的结合区均位于GPⅠbα配体结合区内,并均能阻断由诱导剂诱导的GPⅠbα与vWF的结合[10,11,]。图2所示,除AN51外,其余的抗GPⅠbα抗体均能正常地与这种突变的GPⅠbα结合,与AN51的结合率则不到正常的一半。

, http://www.100md.com
图2 不同抗GPⅠbα单克隆抗体与突变GPⅠbα结合实验结果
3 突变细胞与vWF基质在液流条件下的相互作用 在10 g.cm.s-2.cm-2的切应力条件下,表达A156V突变的细胞在vWF基质表面发生滚动,但滚动速度明显地比未突变的细胞快。
当这种突变的细胞在液流室直接予以灌注时,仍可在vWF基质表面上滚动,而滚动速度在5及10 g.cm.s-2.cm-2加应力下均快于未突变细胞(图3)。

图3 每平方厘米不同切应力作用下表达A156V突变的细胞
, 百拇医药 在固着的vWF表面的滚动实验结果
讨论
我们应用平行板液流室系统证明了表达血小板GPⅠb-Ⅸ-Ⅴ复合物的细胞可以在流动时的高切应力作用下于vWF基质上滚动,细胞在该状态下的滚动由GPⅠbα与vWF的相互作用所介导,因为这种滚动可以被抗GPⅠbα抗体或抗vWF抗体所阻断。
我们的实验结果显示GPⅠb-Ⅸ-Ⅴ复合物与vWF之间的相互作用是一个快速结合与解离的过程。快速的结合可使vWF基质捕捉到在液体中流动的细胞并使其与固着的vWF相互作用,而快速的解离则使细胞能于vWF基质上滚动而不发生直接粘附。这种快速的结合和解离对流动条件下的受体与配体之间的相互作用是极为重要的。这种GPⅠbα的突变(A156V)导致临床上Bolzano变异型BSS的发生。
我们的研究结果证明突变的GPⅠbα可以在CHO细胞上表达,其表达水平与正常的GPⅠbα表达水平无差异[16]。但是A516V突变产生了配基结合区结构的改变,其部位位于氨基端,这一结论来自于一组抗GPⅠbα抗体与A156V突变GPⅠbα结合实验的结果,所用的4种抗体中(AK2,AN51,MB45和SZ2)只有AN51的结合降至正常水平的50%以上,已知在GPⅠbα上的结合区位于N端35个氨基酸片段内[17]。这种抗体也能阻断诱导剂或高切应力下诱导的GPⅠbα与vWF结合。但一种与AN51结合区相同的抗GPⅠbα抗体LJ-1B1也未能与突变的GPⅠbα相结合,提示了A156V突变使N端35氨基酸区的三维结构发生改变。
, 百拇医药
为了探讨A156V突变对GPⅠbα功能的影响,我们在能稳定表达GPⅠbβ和GPⅨ的CHO细胞中表达这种突变,随后在切应力条件下观察这种细胞在固着的vWF表面的粘附和滚动能力。我们发现当这种突变的细胞在与vWF基质经1min孵育后再在10 g.cm*s-2*cm-2切应力的条件下作灌注时,这种细胞在vWF基质上能粘附和滚动,但其滚动的速度明显高于正常细胞。我们试验的不足之处在于不能观察这种突变对受体与配体相互作用的结合率,为了解决这个问题,我们将细胞直接灌注到液流室,并再次 发现A156V突变的细胞滚动速度明显快于正常细胞。这些结果证明了A156V的突变导致GPⅠbα与固定的vWF相互作用具有较正常GPⅠbα更快的解离速度。
细胞滚动可视为血细胞在血管内移动速度降低,这个现象起初是在白细胞通过P选择素与PSG1-1相互作用在内皮细胞表面上滚动而发现的。一个滚动的细胞应有快速结合与解离的受体-配体相互作用。前者使细胞在血液流动中被固着的基质所捕捉,因而,在这种快速结合出现缺陷时,流动细胞与固着的基质相互作用的数量就会明显减少。此外,细胞滚动速度作为受体与配体的快速结合与解离的一个总体的结果中,它能更大程度上反映解离速度,而这种解离速度的变化则是A156V突变引起的缺陷所致。
, 百拇医药
通过这项研究,我们认为平行板液流室系统是研究受体-配体在流动条件下相互作用的一种有用的实验工具。
参 考 文 献
1,Lopez JA. The platelet glycoprotein Ⅰb-Ⅸ complex. Blood Coagul Fibrinolysis, 1994, 5:97-119.
2,Lopez JA, Dong JF. Structure and function of the glycoprotein Ⅰb-Ⅸ-Ⅴ complex. Curr Opin Hematol, 1997, 4:323-329.
3,Savage B, Saldivar E, Ruggeri ZM. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von willebrand factor. Cell,1996,84:289-297.
, 百拇医药
4,Fredrickson BJ, Dong JF. McIntire LV, et al. Shear-dependent rolling on von Willebrand factor of mammalian cells expression the platelet glycoprotein Ⅰb-Ⅸ-Ⅴ complex. Blood, 1998, 92:3684-3693.
5,Cranmer SL, Ulsemer P, Cooke BM, et al. Glycoprotein (GP)Ⅰb-Ⅸ-Ⅴ transfected cells roll on a von Willebrand factor matrix under flow. Importence of the GPⅠb/actin-binding (ABP-280) interaction in maintaining adhesion under high shear. J Biol Chem, 1999,247:6097-6106.
, http://www.100md.com
6,Lopez JA, Leung B, Reynolds CC, et al.Efficient plasma membrane expression of a functional platelet glycoprotein Ⅰb-Ⅸ complex requires the presence of its three subunits. J Biol Chem, 1992, 267:12851-12859.
7,Berndt MC, Du X, Booth WJ. Ristocetin-dependent reconstitution of binding of von Willebrand factor to purified human platelet membrane glycoprotein Ⅰb-Ⅸ complex. Biochemistry, 1988, 27:633-640.
8,Andrews RK, Booth WJ, Gorman JJ, et al. Purification of botrocetin from Bothrops jararaca venom. Analysis of the botrocetin-mediated interaction between von Willebrand factor and the human platelet membrane glycoprotein Ⅰb-Ⅸ complex. Biochemistry, 1989, 28:2817-8326.
, http://www.100md.com
9,Dong JF, Li CQ, Sae-Tung G, et al. The cytoplasmic domain of glycoprotein (GP) Ⅰbα constranins the lateral diffusion of the GPⅠb-Ⅸ complex and modulates von Willebarnd factor binding. Biochemistry, 1997, 36:12421-12427.
10,Ward CM, Qndrews RK, Smith AI, et al. Mocarhagin, a novel cobra veom metalloproteinase, cleaves the platelet von Willebrand factor receptor glycoprotein Ⅰbα. Identification of the sulfated tyrosine/anionic sequence Tyr-276-Glu-282 of glycoprotein Ⅰbα as a binding site for von Willebrand factor and alpha-thrombin. Biochemstry, 1996, 35:4929-4938.
, http://www.100md.com
11,Ruan C, Tobelem G, McMichael AJ, et al. Monoclonal antibody to human platelet glycoprotein LIL. Effects on human platelet function. Br J Haematol, 1981, 49:511-519.
12,Thorell L, Blomback B. Purification of the factor Ⅷ complex. Thromb Res, 1984, 35:431-450.
13,Moake JL, Turner NA, Stathopoulos NA, et al. Involvement of large plasma von Willebrand factor(vWF) multimers and unusually large vWF forms derived from endothelial cells in shear stress-induced platelet aggregation. J Clin Invest, 1986, 78:1456-1461.
, 百拇医药
14,Russel SD, Roth GJ. Pseudo-von Willebrand disease: a mutation in the platelet glycoprotein Ⅰb alpha gene assocciated with a hyperactive surface receptor. Blood, 1993, 81:1787-1791.
15,Kukreti S, Konstantopouls K, Smith CW, et al. Molecular mechanisms of monocyte adhesion to interleukin-1 beta-stimulated endothelial cells under physiologic flow conditions. Blood, 1997, 89:4104-4111.
16,Dong JF, Gao S, Lopez JA. Synthesis assembly and intracellular transport of the platelet glycoprotein Ⅰb-Ⅸ-Ⅴ complex. J Biol Chem, 1998,273:31449-31454.
17,Berndt MC, Shen Y, Dong J, et al. Requirement of leucine-rich repeats of GPⅠbα for shear-dependent and static binding of von Willebrand factor to the platelet membrane GPⅠb-Ⅸ-Ⅴ comblex. Blood, 2000, 95:903-910.
(收稿日期:2000-04-15), http://www.100md.com