随机扩增多态性DNA技术在中药红曲基原菌系统分类中的应用
作者:宓鹤鸣 邢旺兴 程荣珍 贺祥 吴玉田
单位:宓鹤鸣(第二军医大学药学院药物分析教研室,上海 200433);邢旺兴(第二军医大学药学院药物分析教研室,上海 200433);程荣珍(杭州尖峰德康药业有限公司);贺祥(第二军医大学科研部);吴玉田(第二军医大学药学院药物分析教研室,上海 200433)
关键词:红曲;红曲霉菌;随机扩增多态性DNA;分类
第二军医大学学报001013 [摘要] 目的:建立中药红曲基原菌的随 机扩增多态性DNA(RAPD)分析方法。方法:以CTAB法提取紫色红曲霉等 7种红曲霉和1株土曲霉的基因组DNA;溴化乙啶荧光强度和分光光度双重测定法确定DNA浓度 ;琼脂糖凝胶电泳法检测PCR扩增产物,PHYLIP 3.5c 进行聚类分析。结果:从60个随机引物中筛选出S282等10个引物的扩增产物谱带多,特征好;红曲霉 属种间指纹图谱差异较大,呈现出明显的DNA扩增产物多态性。结论: RAPD分析技术可作为真菌系统分类的客观而有效的手段之一。
, http://www.100md.com
[中图分类号] R 282.710.3 [文献标识码] A
[文章编号] 0258-879X(2000)10-0944-03
Application of random amplified polymorphism DNA technique in systematic classif ication of origin fungi of Chinese traditional medicine Red Kojic
MI He-Ming,XING Wang-Xing,WU Yu-Tian
(Department of Pharmaceutical Analysis, College of Pharmacy, Second Mil itary Medical University, Shanghai 200433, China)
, 百拇医药
CHENG Rong-Zhen
(Hangzhou Jianfeng Dekang P harmaceutical Limited Company)
HE Xiang
(Department of Science Research, Second Military Medical University)
[ABSTRACT] Objective:To establish a random amplified polymor phism DNA(RAPD) method for classification of origin fungi of the Chinese traditi onal medicine Red Kojic. Methods:The genome DNA of 7 ordin ary species Monascus including M. purpureus and a strain of Aspergillu s terreus were extracted by CTAB. The content of DNA was assayed doubly by flu orescence intensity of ethidium bromide (EB) and spectrometer. Amplification pro ducts were detected by agarose gel electrophoresis and clustering analysis by PH YLIP 3.5c. Results:A characteristic pattern was produced depend on one of the 10 primers screened from 60 random primers, and the genome was am plified. The diversities of the fingerprint patterns of Monascus was obvious , by which Monascus can be distinguished easily. The results were consistent with that of morphologic study. Conclusion:RAPD is a new assay technique. It can be used to classify and identify of Monascus fungi.
, 百拇医药
[KEY WORDS]Red Kojic; Monascus; random amplified polymorphism DN A; classification
中药红曲具有降脂、降压、降糖和抑制肿瘤生长等多种重要作用,但红曲的基原菌在分 类学上尚有争议[1]。DNA分子作为遗传信息的载体,不受外界因素和生物体发育阶 段及器官组织差异的影响,每一个体的任一体细胞均含有相同的遗传信息;利用DNA分子特 征作为遗传标记,即DNA分子遗传标记,进行物种鉴别较形态学、血清学、同工酶等更为准确 可靠[2]。随机扩增多态性DNA(RAPD)技术是一种运用PCR原理,以一 条随机设计的寡核苷酸单链为引物,对模板DNA进行PCR扩增的遗传标记技术。此项技术出现 后,很快被用于动植物的物种形成、系统演化关系、微生物和昆虫鉴别等各个领域的研究中 [3~5]。鉴于红曲霉菌的分子生物学研究至今未见报道,其DNA等分子生物学背景 尚不清楚,故常规分子生物学技术等不适用,本实验首次运用RAPD分析技术,在分子水平上 研究了红曲霉属的遗传背景差异及其系统分类学意义。
, 百拇医药
1 材料和方法
1.1 仪器与试药 Perkin Elmers 480型DNA扩增仪,Beckman J2-21M型超速离心 机,岛津UV-265FW分光光度计,FR280电泳仪、FR180A台式离心机及FR120暗箱式紫外分析 仪。TaqDNA聚合酶及随机引物(上生生物工程公司)。DNA提取缓冲液含0.1 mol/L Tris-H Cl(pH 9.0),0.2 mmol/L EDTA(pH 8.0),1.4 mol/L NaCl, 5%十六烷基三甲基溴 化铵(CTAB)及0.5% β-巯基乙醇。TE缓冲液:10 mmol/L Tris-HCl,1 mmol/L EDTA。0.1 ×TE缓冲液:10 mmol/L Tris-HCl(pH 7.6), 0.1 mmol/L EDTA(pH 8.0)。 5×TBE缓冲液 :Tris 54 g,硼酸27.5 g, 0.5 mol/L EDTA(pH 8.0) 20 ml,加蒸馏水至1 000 ml。
1.2 菌株 7种红曲霉属标准菌株及同属的1种土曲霉对照株共8株,购自 中国微生物菌种保藏管理委员会及轻工业部食品发酵研究所(表1)。
, 百拇医药
表 1 实验用红曲霉菌株及对照株
Tab 1 The name and source of strains
of Monascus fungi and control No.
Strain
Name
Source
1
5015
Monascus aurantiacus Lee
Shanxi
2
, 百拇医药
5016
M.serorubesceus Sato
Shanxi
3
5017
M.albidus Sato
Fujian
4
5021
M.barkeri Dangerd
Liaoning
5
, 百拇医药
5029
M.ruber van Tieghem
Guangdong
6
5032
M.purpureus Went
Sichuan
7
5035
M.fuliginosus Sato
Yunnan
8
, 百拇医药
9001
Aspergillus terreus
Beijing
1.3 DNA的提取与测定 采用CTAB法略作改动[6]。菌丝1 g用液氮研磨成 粉状,研磨时加入0.2 g聚乙烯吡咯烷酮(PVP)粉,立即加入2 ml提取缓冲液,58℃水浴保温 60 min。加入等体积的酚∶氯仿(1∶1),反复轻摇混匀,6 000 r/min离心5 min;重复1次 。取上层水相,再加入等体积氯仿∶异戊醇(24∶1),6 000 r/min离心5 min;重复1次。在 水相中加入2/3体积的预冷的异丙醇,于-20℃静置60 min以上或过夜。10 000 r/min离心1 0 min,沉淀用75%冰乙醇洗涤1次,10 000 r/min离心5 min,弃上清液,挥干后用100 μl 0.1×TE缓冲液溶解,-20℃保存备用。用EB荧光强度和分光光度双重测定法确定DNA大 小及 浓度,用 λ DNA/Hind Ⅲ标记物确定样品DNA分子的大小,测定D260/D 280比值并判断DNA纯度,大于1.5为佳。
, http://www.100md.com
1.4 PCR反应 通过对PCR扩增的主要影响因素,包括模板、酶、引物、镁离子浓 度及循环条件等的选择,确定PCR最佳扩增条件如下:25 μl反应总体积,25 ng DNA,3 μ mol/L引物(共试验了60个随机引物),1.2 U Taq DNAase,200 μmol/L dNTPS,10 mmol/L Tris-HCl(pH 8.3),50 mol/L KCl,3 mmol/L MgCl2,1.2 μl 甲酰胺。PCR反应温度 循环为:92℃,10 min,1个循环后改为92℃,1 min;36℃,1 min;72℃,1.5 min,40个 循环后于72℃延伸5 min。用1.5%琼脂糖(内含1 μg/ml EB)凝胶电泳检测PCR扩增产物;0.5 ×TBE电泳缓冲液电泳,电压70V,时间60 min。PCR扩增产物长度与100 bp DNA ladder(Rea dy-LoadTM, Fermentas Ltd. )标记物进行比较,UV灯下观察并照相记录结果;实验 重复1次。
, http://www.100md.com
1.5 DNA条带的计算 根据片段大小排列并记录,有条带计为“1”; 无条带计为 “0”;缺失数据计为“*”。
1.6 相似率计算 根据Nei等的相似率分析公式进行数据分析,相似率(F ab)=(2×Nab)/(Na+Nb)×100%。其中,Nab为菌株a 和b之间共有的DNA扩增片段数目,Na为个体a具有的DNA扩增片段数目,Nb为个 体b具有的DNA扩增片段数目。
1.7 聚类分析 根据原始数据0-1矩阵计算出相似矩阵及遗传距离矩阵,使用PHY LIP 3.5c (Phylogeny Inference Package)中的UPGMA聚类方法构树。
2 结 果
, 百拇医药 2.1 DNA提取 提取的红曲霉基因组DNA片段大小一致,约为21 kb,说明用本法能 提取较完整的红曲霉基因组DNA。
2.2 红曲霉RAPD产物的电泳图谱 在所用的60个随机引物中,有18个在供试材料 上获得了基因组DNA多态性指纹图谱,其中S282(CATCGCCGCA),S502(CACAGCTGCC),S710(AGCGATGCAC),S750(CGGGCAACGT),S782(GAGGTCCACA),OPH3(AGACGTCCAC),OPH4(GGAAGTCGCC),OPH5(AGTCGTCCCC),OPH7(CTGCATCGTG),OPH8(GAAACACCCC)等10个引物的扩增产物谱带多,特征好;扩增产物谱带一般有3~9条; 各材料主带1~3条,次带丰富。同一引物在不同的供试材料中具有不同的指纹图谱,但个别 引物在全部供试材料上扩增出1~3条共同带。这一方面表明了红曲霉属类群之间遗传背景的 多样性,另一方面也反映出它们同属的共性。不同种相同引物的RAPD扩增产物的电泳图谱, 既有相同条带又有差异条带,但土曲霉与7 种红曲霉的RAPD产物电泳图谱的差异很大。
, 百拇医药
2.3 DNA多态性分析 从全部材料的10个RAPD引物扩增的指纹图谱上可以看出,红 曲霉属种间指纹图谱差异较大,一般都有1~2个特征带相区别;种内不同产地居群指纹图谱 差异甚小,主带基本一致,只个别次带存在差异; 统计所有电泳结果,共获得条带总数267 条,其中多态性条带68条,占25.5%。
2.4 种间及属间RAPD分析 7种红曲霉及土曲霉的聚类分析结果见图1。红曲霉属 种间的相似率为42.1%~86.5%,平均64.3%,说明红曲霉属真菌在种间呈现出很明显的DNA扩 增产物多态性。这也特别充分地表现在红曲霉与土曲霉的相似性上,两者之间的相似率为19 .0%~30.5%,平均24.7%,远远低于红曲霉种间的相似率。表明分子系统学与基于基因 组DNA基础之上的形态分类学具有良好的吻合度,RAPD扩增产物指纹谱能较好地反映两者之 间的遗传距离,具有较强的鉴别能力。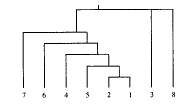
, 百拇医药
图 1 红曲霉的系统树系图
Fig 1 Average linkage clustering tree
1: 5015; 2: 5016; 3: 5017; 4: 5021;
5: 5029; 6: 5032; 7: 5035; 8: 9001
3 讨 论
红曲霉属真菌的分类、名称及其与商品红曲药材的关系一直比较混乱,新种不断出现和 学名更迭更增添了分类与鉴定的困难。因此,基于RAPD多态性分析的数值分类将从分子水平 上为揭示红曲霉属遗传背景差异及为系统分类鉴定提供更有力的现代研究手段和支持依据。
RAPD多态性聚类分析具有很好的重现性和
, http://www.100md.com
可靠性,结果与经典分类具有很大的吻合度,对某些分类学混乱和争议能做出更为明确和自然的处理。RAPD多态性分析提示在亲缘关系上,橙色 红曲霉5015与红色红曲霉5029及变红红曲霉5016较为相近,取定适当的λ值,这三者即合并 为同一群。这有相当的合理性,即便是橙色红曲霉作为新种的定名人李钟庆先生也认为 [7],红色红曲霉与橙色红曲霉比较接近,他将其定为新种的一个主要理由是橙色红曲 霉具有较高的糖化力而红色红曲霉的糖化力一般很弱。基于RAPD分析结果,我们有理由相信 ,橙色红曲霉是否继续视作新种值得进一步探讨。
利用RAPD指纹图谱所建立的聚类系统树所反映的种间关系与经典形态分类又有一定的差 异,如RAPD多态性提示5017和9001一样与其他几种红曲霉的遗传距离较远,而依经典形态学 观点,5017与其他几种红曲霉属于同一属,但土曲霉9001则不同科。造成这种现象的原因是 与不同分类水平相关的。传统分类是以菌丝、色素等形态特征为依据的,而控制这几个形态 特征的基因在整个遗传信息中所占的比例较小。RAPD分析则是通过多个不同的引物给出覆盖 整个基因组的多态性信息,并且是直接从DNA分子水平检测碱基序列的变化,因此以形态为 依据的分类系统与以DNA水平为依据的分类结果就不可能完全吻合,这也提示了RAPD分析最 好与包括形态学在内的其他分类方法相结合,以提高分类的客观性、真实性和正确性。
, 百拇医药
[基金项目]国家中医药管理局重点课题基金资助项目(97-Z-097).
[作者简介]宓鹤鸣(1947-),男(汉族),博士,副教授,硕士生导师.[参 考 文 献]
[1] 林赞峰.红曲菌研究发展之演讲[J].科学农业,1992,40(3/4):19 3-198.
[2] 邢旺兴,宓鹤鸣,田 靓,等.RAPD技术及其在生药学研究中的应用[J].解放 军药学学报,1999,15(3):25-28.
[3] Weilliams JGK,Kubelik AR. DNA polymorphism amplified by arbitrary p rimers are useful as genetic markers[J]. Nucleic Acids Res,1990,18(22):653 1-6532.
, 百拇医药
[4] 李增智,黄 勃,樊美珍,等. 利用RAPD-PCR检测三种白僵菌及球孢白僵菌种 内变异[J]. 菌物系统,1998,17(2):185-189.
[5] Birch M,Anderson MJ,Denning WD. Molecular typing of Aspergillus species [J].J Hosp Infect,1995,30(2):339-351.
[6] Sambrook J, Fritsch EF,Maniatis T, 著.分子克隆实验指南[M].第2版.金 冬雁,黎孟枫 译. 北京:科学出版社,1992. 672-692.
[7] 李钟庆. 红曲霉属的一个新种[J].微生物学报,1982,22(2):118-122.
[收稿日期] 2000-04-17
[修回日期] 2000-08-19, 百拇医药
单位:宓鹤鸣(第二军医大学药学院药物分析教研室,上海 200433);邢旺兴(第二军医大学药学院药物分析教研室,上海 200433);程荣珍(杭州尖峰德康药业有限公司);贺祥(第二军医大学科研部);吴玉田(第二军医大学药学院药物分析教研室,上海 200433)
关键词:红曲;红曲霉菌;随机扩增多态性DNA;分类
第二军医大学学报001013 [摘要] 目的:建立中药红曲基原菌的随 机扩增多态性DNA(RAPD)分析方法。方法:以CTAB法提取紫色红曲霉等 7种红曲霉和1株土曲霉的基因组DNA;溴化乙啶荧光强度和分光光度双重测定法确定DNA浓度 ;琼脂糖凝胶电泳法检测PCR扩增产物,PHYLIP 3.5c 进行聚类分析。结果:从60个随机引物中筛选出S282等10个引物的扩增产物谱带多,特征好;红曲霉 属种间指纹图谱差异较大,呈现出明显的DNA扩增产物多态性。结论: RAPD分析技术可作为真菌系统分类的客观而有效的手段之一。
, http://www.100md.com
[中图分类号] R 282.710.3 [文献标识码] A
[文章编号] 0258-879X(2000)10-0944-03
Application of random amplified polymorphism DNA technique in systematic classif ication of origin fungi of Chinese traditional medicine Red Kojic
MI He-Ming,XING Wang-Xing,WU Yu-Tian
(Department of Pharmaceutical Analysis, College of Pharmacy, Second Mil itary Medical University, Shanghai 200433, China)
, 百拇医药
CHENG Rong-Zhen
(Hangzhou Jianfeng Dekang P harmaceutical Limited Company)
HE Xiang
(Department of Science Research, Second Military Medical University)
[ABSTRACT] Objective:To establish a random amplified polymor phism DNA(RAPD) method for classification of origin fungi of the Chinese traditi onal medicine Red Kojic. Methods:The genome DNA of 7 ordin ary species Monascus including M. purpureus and a strain of Aspergillu s terreus were extracted by CTAB. The content of DNA was assayed doubly by flu orescence intensity of ethidium bromide (EB) and spectrometer. Amplification pro ducts were detected by agarose gel electrophoresis and clustering analysis by PH YLIP 3.5c. Results:A characteristic pattern was produced depend on one of the 10 primers screened from 60 random primers, and the genome was am plified. The diversities of the fingerprint patterns of Monascus was obvious , by which Monascus can be distinguished easily. The results were consistent with that of morphologic study. Conclusion:RAPD is a new assay technique. It can be used to classify and identify of Monascus fungi.
, 百拇医药
[KEY WORDS]Red Kojic; Monascus; random amplified polymorphism DN A; classification
中药红曲具有降脂、降压、降糖和抑制肿瘤生长等多种重要作用,但红曲的基原菌在分 类学上尚有争议[1]。DNA分子作为遗传信息的载体,不受外界因素和生物体发育阶 段及器官组织差异的影响,每一个体的任一体细胞均含有相同的遗传信息;利用DNA分子特 征作为遗传标记,即DNA分子遗传标记,进行物种鉴别较形态学、血清学、同工酶等更为准确 可靠[2]。随机扩增多态性DNA(RAPD)技术是一种运用PCR原理,以一 条随机设计的寡核苷酸单链为引物,对模板DNA进行PCR扩增的遗传标记技术。此项技术出现 后,很快被用于动植物的物种形成、系统演化关系、微生物和昆虫鉴别等各个领域的研究中 [3~5]。鉴于红曲霉菌的分子生物学研究至今未见报道,其DNA等分子生物学背景 尚不清楚,故常规分子生物学技术等不适用,本实验首次运用RAPD分析技术,在分子水平上 研究了红曲霉属的遗传背景差异及其系统分类学意义。
, 百拇医药
1 材料和方法
1.1 仪器与试药 Perkin Elmers 480型DNA扩增仪,Beckman J2-21M型超速离心 机,岛津UV-265FW分光光度计,FR280电泳仪、FR180A台式离心机及FR120暗箱式紫外分析 仪。TaqDNA聚合酶及随机引物(上生生物工程公司)。DNA提取缓冲液含0.1 mol/L Tris-H Cl(pH 9.0),0.2 mmol/L EDTA(pH 8.0),1.4 mol/L NaCl, 5%十六烷基三甲基溴 化铵(CTAB)及0.5% β-巯基乙醇。TE缓冲液:10 mmol/L Tris-HCl,1 mmol/L EDTA。0.1 ×TE缓冲液:10 mmol/L Tris-HCl(pH 7.6), 0.1 mmol/L EDTA(pH 8.0)。 5×TBE缓冲液 :Tris 54 g,硼酸27.5 g, 0.5 mol/L EDTA(pH 8.0) 20 ml,加蒸馏水至1 000 ml。
1.2 菌株 7种红曲霉属标准菌株及同属的1种土曲霉对照株共8株,购自 中国微生物菌种保藏管理委员会及轻工业部食品发酵研究所(表1)。
, 百拇医药
表 1 实验用红曲霉菌株及对照株
Tab 1 The name and source of strains
of Monascus fungi and control No.
Strain
Name
Source
1
5015
Monascus aurantiacus Lee
Shanxi
2
, 百拇医药
5016
M.serorubesceus Sato
Shanxi
3
5017
M.albidus Sato
Fujian
4
5021
M.barkeri Dangerd
Liaoning
5
, 百拇医药
5029
M.ruber van Tieghem
Guangdong
6
5032
M.purpureus Went
Sichuan
7
5035
M.fuliginosus Sato
Yunnan
8
, 百拇医药
9001
Aspergillus terreus
Beijing
1.3 DNA的提取与测定 采用CTAB法略作改动[6]。菌丝1 g用液氮研磨成 粉状,研磨时加入0.2 g聚乙烯吡咯烷酮(PVP)粉,立即加入2 ml提取缓冲液,58℃水浴保温 60 min。加入等体积的酚∶氯仿(1∶1),反复轻摇混匀,6 000 r/min离心5 min;重复1次 。取上层水相,再加入等体积氯仿∶异戊醇(24∶1),6 000 r/min离心5 min;重复1次。在 水相中加入2/3体积的预冷的异丙醇,于-20℃静置60 min以上或过夜。10 000 r/min离心1 0 min,沉淀用75%冰乙醇洗涤1次,10 000 r/min离心5 min,弃上清液,挥干后用100 μl 0.1×TE缓冲液溶解,-20℃保存备用。用EB荧光强度和分光光度双重测定法确定DNA大 小及 浓度,用 λ DNA/Hind Ⅲ标记物确定样品DNA分子的大小,测定D260/D 280比值并判断DNA纯度,大于1.5为佳。
, http://www.100md.com
1.4 PCR反应 通过对PCR扩增的主要影响因素,包括模板、酶、引物、镁离子浓 度及循环条件等的选择,确定PCR最佳扩增条件如下:25 μl反应总体积,25 ng DNA,3 μ mol/L引物(共试验了60个随机引物),1.2 U Taq DNAase,200 μmol/L dNTPS,10 mmol/L Tris-HCl(pH 8.3),50 mol/L KCl,3 mmol/L MgCl2,1.2 μl 甲酰胺。PCR反应温度 循环为:92℃,10 min,1个循环后改为92℃,1 min;36℃,1 min;72℃,1.5 min,40个 循环后于72℃延伸5 min。用1.5%琼脂糖(内含1 μg/ml EB)凝胶电泳检测PCR扩增产物;0.5 ×TBE电泳缓冲液电泳,电压70V,时间60 min。PCR扩增产物长度与100 bp DNA ladder(Rea dy-LoadTM, Fermentas Ltd. )标记物进行比较,UV灯下观察并照相记录结果;实验 重复1次。
, http://www.100md.com
1.5 DNA条带的计算 根据片段大小排列并记录,有条带计为“1”; 无条带计为 “0”;缺失数据计为“*”。
1.6 相似率计算 根据Nei等的相似率分析公式进行数据分析,相似率(F ab)=(2×Nab)/(Na+Nb)×100%。其中,Nab为菌株a 和b之间共有的DNA扩增片段数目,Na为个体a具有的DNA扩增片段数目,Nb为个 体b具有的DNA扩增片段数目。
1.7 聚类分析 根据原始数据0-1矩阵计算出相似矩阵及遗传距离矩阵,使用PHY LIP 3.5c (Phylogeny Inference Package)中的UPGMA聚类方法构树。
2 结 果
, 百拇医药 2.1 DNA提取 提取的红曲霉基因组DNA片段大小一致,约为21 kb,说明用本法能 提取较完整的红曲霉基因组DNA。
2.2 红曲霉RAPD产物的电泳图谱 在所用的60个随机引物中,有18个在供试材料 上获得了基因组DNA多态性指纹图谱,其中S282(CATCGCCGCA),S502(CACAGCTGCC),S710(AGCGATGCAC),S750(CGGGCAACGT),S782(GAGGTCCACA),OPH3(AGACGTCCAC),OPH4(GGAAGTCGCC),OPH5(AGTCGTCCCC),OPH7(CTGCATCGTG),OPH8(GAAACACCCC)等10个引物的扩增产物谱带多,特征好;扩增产物谱带一般有3~9条; 各材料主带1~3条,次带丰富。同一引物在不同的供试材料中具有不同的指纹图谱,但个别 引物在全部供试材料上扩增出1~3条共同带。这一方面表明了红曲霉属类群之间遗传背景的 多样性,另一方面也反映出它们同属的共性。不同种相同引物的RAPD扩增产物的电泳图谱, 既有相同条带又有差异条带,但土曲霉与7 种红曲霉的RAPD产物电泳图谱的差异很大。
, 百拇医药
2.3 DNA多态性分析 从全部材料的10个RAPD引物扩增的指纹图谱上可以看出,红 曲霉属种间指纹图谱差异较大,一般都有1~2个特征带相区别;种内不同产地居群指纹图谱 差异甚小,主带基本一致,只个别次带存在差异; 统计所有电泳结果,共获得条带总数267 条,其中多态性条带68条,占25.5%。
2.4 种间及属间RAPD分析 7种红曲霉及土曲霉的聚类分析结果见图1。红曲霉属 种间的相似率为42.1%~86.5%,平均64.3%,说明红曲霉属真菌在种间呈现出很明显的DNA扩 增产物多态性。这也特别充分地表现在红曲霉与土曲霉的相似性上,两者之间的相似率为19 .0%~30.5%,平均24.7%,远远低于红曲霉种间的相似率。表明分子系统学与基于基因 组DNA基础之上的形态分类学具有良好的吻合度,RAPD扩增产物指纹谱能较好地反映两者之 间的遗传距离,具有较强的鉴别能力。

, 百拇医药
图 1 红曲霉的系统树系图
Fig 1 Average linkage clustering tree
1: 5015; 2: 5016; 3: 5017; 4: 5021;
5: 5029; 6: 5032; 7: 5035; 8: 9001
3 讨 论
红曲霉属真菌的分类、名称及其与商品红曲药材的关系一直比较混乱,新种不断出现和 学名更迭更增添了分类与鉴定的困难。因此,基于RAPD多态性分析的数值分类将从分子水平 上为揭示红曲霉属遗传背景差异及为系统分类鉴定提供更有力的现代研究手段和支持依据。
RAPD多态性聚类分析具有很好的重现性和
, http://www.100md.com
可靠性,结果与经典分类具有很大的吻合度,对某些分类学混乱和争议能做出更为明确和自然的处理。RAPD多态性分析提示在亲缘关系上,橙色 红曲霉5015与红色红曲霉5029及变红红曲霉5016较为相近,取定适当的λ值,这三者即合并 为同一群。这有相当的合理性,即便是橙色红曲霉作为新种的定名人李钟庆先生也认为 [7],红色红曲霉与橙色红曲霉比较接近,他将其定为新种的一个主要理由是橙色红曲 霉具有较高的糖化力而红色红曲霉的糖化力一般很弱。基于RAPD分析结果,我们有理由相信 ,橙色红曲霉是否继续视作新种值得进一步探讨。
利用RAPD指纹图谱所建立的聚类系统树所反映的种间关系与经典形态分类又有一定的差 异,如RAPD多态性提示5017和9001一样与其他几种红曲霉的遗传距离较远,而依经典形态学 观点,5017与其他几种红曲霉属于同一属,但土曲霉9001则不同科。造成这种现象的原因是 与不同分类水平相关的。传统分类是以菌丝、色素等形态特征为依据的,而控制这几个形态 特征的基因在整个遗传信息中所占的比例较小。RAPD分析则是通过多个不同的引物给出覆盖 整个基因组的多态性信息,并且是直接从DNA分子水平检测碱基序列的变化,因此以形态为 依据的分类系统与以DNA水平为依据的分类结果就不可能完全吻合,这也提示了RAPD分析最 好与包括形态学在内的其他分类方法相结合,以提高分类的客观性、真实性和正确性。
, 百拇医药
[基金项目]国家中医药管理局重点课题基金资助项目(97-Z-097).
[作者简介]宓鹤鸣(1947-),男(汉族),博士,副教授,硕士生导师.[参 考 文 献]
[1] 林赞峰.红曲菌研究发展之演讲[J].科学农业,1992,40(3/4):19 3-198.
[2] 邢旺兴,宓鹤鸣,田 靓,等.RAPD技术及其在生药学研究中的应用[J].解放 军药学学报,1999,15(3):25-28.
[3] Weilliams JGK,Kubelik AR. DNA polymorphism amplified by arbitrary p rimers are useful as genetic markers[J]. Nucleic Acids Res,1990,18(22):653 1-6532.
, 百拇医药
[4] 李增智,黄 勃,樊美珍,等. 利用RAPD-PCR检测三种白僵菌及球孢白僵菌种 内变异[J]. 菌物系统,1998,17(2):185-189.
[5] Birch M,Anderson MJ,Denning WD. Molecular typing of Aspergillus species [J].J Hosp Infect,1995,30(2):339-351.
[6] Sambrook J, Fritsch EF,Maniatis T, 著.分子克隆实验指南[M].第2版.金 冬雁,黎孟枫 译. 北京:科学出版社,1992. 672-692.
[7] 李钟庆. 红曲霉属的一个新种[J].微生物学报,1982,22(2):118-122.
[收稿日期] 2000-04-17
[修回日期] 2000-08-19, 百拇医药