高三尖杉酯碱对人淋巴瘤细胞系Raji细胞作用的实验研究
作者:金洁 M Hauberg 林雄斌 R Parwaresch
单位:金洁(310003 杭州,浙江大学医学院附属第一医院);M Hauberg 林雄斌 R Parwaresch(德国基尔大学血液病理所)
关键词:
中华血液学杂志001014 为探讨高三尖杉酯碱(HHT)对恶性淋巴细胞系的影响,我们观察HHT在体外对人Burkitt 淋巴瘤细胞Raji增殖、端粒酶活性的影响及是否诱导Raji细胞凋亡。
材料和方法
1 试剂 HHT为杭州民生药厂产品,以RPMI 1640培养液配成100ng/μl,4℃保存备用。胎牛血清、谷氨酰胺为Gibco公司产品。蛋白标准品为Bio-Rad公司产品。Apoptotic DNA Ladder试剂盒为Boehringer Mannheim公司产品。牛血清清蛋白系Sigma公司产品。
, 百拇医药
2 细胞培养 Burkitt淋巴瘤细胞系Raji细胞由德国基尔大学血液病理所提供,用含体积分数为10%的灭活胎牛血清RPMI 1640培养液(内含2 mmol/L谷氨酰胺)在37℃、体积分数为5%的CO2条件下培养,2d传代1次。取对数生长期细胞用于实验。
3 引物合成 TS 引物(5′-AATCCGTCGAGCAGAGTT-3′)、CX-ext引物 (5′-CCCTTACCCTTACCCTTACCCTAA-3′)均由Eurogentec公司合成。
4 剂量反应曲线 收集对数生长期的细胞,配成浓度为1×105/ml的细胞悬液,分别加入终浓度为5,10,20,40,100ng/ml的HHT,对照组加入等体积的RPMI 1640培养液,培养48h后收集细胞,用冰冷的PBS洗涤2遍。
5 时间反应曲线 在1×105/ml对数生长期的细胞中加入HHT,使其终浓度为40ng/ml,分别于给药后0,4,8,24,48及72h收集细胞,用冰冷的PBS洗涤2遍。以上实验均分别重复3次。
, 百拇医药
6 细胞增殖及细胞形态学观察 用体积分数为10%的牛血清清蛋白调整细胞浓度至1×106/ml,离心涂片,立即进行免疫组化染色。按常规ABC法,一抗Ki-67、Ki-S2和Ki-S4均由基尔大学血液病理所自制,二抗为Dako公司产品。其余玻片进行PAP染色,光镜下观察细胞形态并进行凋亡细胞计数,每张玻片计数200个细胞。
7 DNA琼脂糖凝胶电泳 1×106细胞用冰冷PBS洗涤2次,按Apoptotic DNA Ladder试剂盒说明书抽提DNA,取10μl DNA行15g/L琼脂糖凝胶电泳,用紫外透射仪观察电泳条带并摄片。
8 端粒酶活性测定 按照Krupp改良的荧光素标记的端粒重复扩增方法(TRAP)[1]进行半定量测定。
8.1 细胞抽提物的制备:将培养48h的1×106细胞用冰冷PBS洗涤2次,离心后将上清液吸干,加入冰冷的Chaps细胞裂解液100μl [10mmol/L Tris-HCl pH 7.5, 1mmol/L MgCl2, 1mmol/L EGTA, 5% Chaps (购自Sigma公司), 5mmol/L β-巯基乙醇, 体积分数为10%的甘油, 0.1mol/L AEBSF(4-[2-aminoethyl]benzenesulfonylfluoride)(购自Sigma公司), 1U/μl RNA 酶抑制剂(后二者须新鲜加入)]。混匀后置冰中30min, 20000×g, 4℃离心30min。上清液转移到另一无菌管中, 留取5μl用于蛋白含量测定, 其余立即投入液氮中快速冷冻, 并储存在-80℃待测。
, 百拇医药
8.2 蛋白含量测定:蛋白含量按照Bradford分析法。蛋白标准品分别稀释成0,0.2,0.4,0.6,0.8,1.0,1.2,1.4mg/ml, 并于每次测定前制备标准曲线。细胞抽提物用Bio-Rad蛋白显色液(预先用蒸馏水1∶5稀释)1∶100稀释,860分光光度计测定蛋白含量。
8.3 PCR条件:反应体积为50μl, 含20 mmol/L Tris-HCl, pH 8.0, 1 mmol/L EGTA, 体积分数为0.005%的Tween 20, 1.5 mmol/L MgCl2, 63mmol/L KCl, 50μmol/L 4×dNTP (购自MBI公司),2 U Taq DNA聚合酶(购自MBI公司), 0.1 attomol PCR标准物,10 pmol TS 引物, 10 pmol CX-ext引物, 1μg蛋白含量的细胞提取物作为摸板。立即在PCR扩增仪上进行扩增。先于30 ℃孵育30min以延伸TS引物,再经95℃变性3min,然后于95℃ 30s,50℃ 30s,72℃ 30s,共30个循环。
, http://www.100md.com
8.4 端粒酶活性测定:取1μl PCR产物,加入1μl Genescan-500 ROX内泳道标准物(internal lane standard)及22μl的甲酰胺,混匀后95℃变性2min即置于冰中冷却,用DNA测序仪(ABI prism 310)进行毛细管电泳分析。取前5个峰值,相加并除以PCR标准物峰值,即为端粒酶活性。
9 统计学处理 采用卡方检验。
结果
1 HHT对Raji细胞增殖的抑制作用 HHT对Raji细胞体外增殖具有显著的抑制作用,并与剂量呈正比(表1)。
表1 HHT对Raji 细胞增殖抑制的影响结果(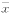 ±s) HHT浓度
±s) HHT浓度
, 百拇医药 (ng/ml)
Raji细胞抗原表达率(%)
Ki-S4
Ki-67
Ki-S2
0
94.5±5.0
95.5±5.0
57.0±3.0
10
90.5±0.5
91.5±0.5
, 百拇医药
50.0±5.0
20
82.0±3.0*
81.0±1.0*
36.5±19.5*
40
76.5±5.5#
74.5±1.5#
15.5±7.5#
100
43.5±3.5#
, 百拇医药
52.5±6.5#
14.0±3.0#
注:* 与对照组比较,P<0.01;#与对照组比较, P<0.001
2 HHT不同浓度对Raji细胞端粒酶活性的影响 HHT对端粒酶活性具有明显的抑制作用,并与浓度呈正比,当浓度为10ng/ml时,Raji细胞端粒酶活性即降低了40.2%,浓度为20ng/ml时活性下降了93.9%(图1)。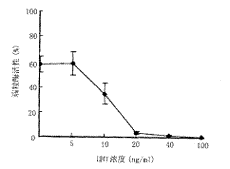
图1 不同浓度的HHT对Raji细胞端粒酶活性的影响
3 HHT不同作用时间对Raji细胞端粒酶活性的影响 HHT 40mg/ml与Raji细胞作用8h后,端粒酶活性下降了62.2%,48h达到最大的抑制(图2)。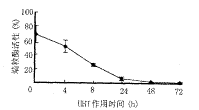
, 百拇医药
图2 HHT作用时间对Raji细胞端粒酶活性的影响
4 细胞形态观察 经HHT处理48h后,可看到细胞核固缩、核碎裂和凋亡小体形成。
5 DNA凝胶电泳 HHT作用48h后,100ng/ml、200ng/ml组可见梯状图谱。
讨论
HHT作用于肿瘤细胞的核糖体从而抑制蛋白质合成,呈剂量、时间依赖方式。药物阻止细胞从G1期进入S期,G2期进入M期。临床上主要用于治疗急性非淋巴细胞白血病,效果显著。本研究结果表明,HHT在体外可明显抑制淋巴瘤细胞增殖。药物抑制作用随浓度增加而增强。Ki-67、Ki-S4和Ki-S2是检测细胞增殖的单克隆抗体。Ki-67和Ki-S4在细胞周期S期、G2期、M期和G1期表达,而Ki-S2仅在S期、G2期和M期表达,在G1期和G0期不表达[2,3]。本研究中发现Raji细胞在无HHT作用下Ki-67、Ki-S4的表达率分别为95.5%和94.5%,而Ki-S2的表达率为57.0%,说明约有37%的细胞处于G1期。HHT作用后,Ki-67、Ki-S4和Ki-S2呈平行下降,HHT浓度为100ng/ml时,Ki-67、Ki-S4和Ki-S2阳性率分别为52.5%、43.5%和14.0%,说明HHT不是主要作用于细胞周期G1期,与国内麦文渊等[4]报道HHT主要作用于K562细胞的G1期不同。表明HHT对不同的细胞所作用的细胞周期不同。
, http://www.100md.com
端粒是真核细胞染色体末端的DNA-蛋白质结构。随着细胞生长、分裂,端粒长度逐渐缩短,直至细胞出现核型不稳定而死亡。端粒酶是一种由RNA模板,端粒酶逆转录酶及端粒相关蛋白质组成的核糖核蛋白复合物,可添加端粒重复序列于染色体末端,弥补DNA复制造成的端粒缩短,使细胞逃逸死亡。研究结果表明,绝大多数无限增殖的细胞株及85%人类原发性肿瘤均表达高的端粒酶活性[5]。因此,对端粒酶的抑制已成为恶性肿瘤治疗上的新思路。本实验结果表明,HHT对Burkitt淋巴瘤细胞的端粒酶活性具有明显的抑制作用。抑制作用呈量-效和时-效关系。结果还显示,HHT对细胞端粒酶活性的抑制于药物作用后8h即出现,而对该细胞增殖的抑制于药物作用后24h才出现,且抑制程度前者大于后者,说明药物作用后先出现端粒酶的抑制,后出现细胞增殖降低,似乎可以说明对端粒酶的抑制可能是HHT对肿瘤抑制的机制之一。
为探明HHT对Raji细胞的端粒酶活性抑制是否与细胞凋亡相关,我们观察了细胞形态变化与 DNA凝胶电泳,发现当HHT浓度为40ng/ml时,细胞形态观察即可见明显的凋亡表现,而DNA凝胶电泳则于药物浓度为100ng/ml时才出现梯形条带,200ng/ml时更明显。
, http://www.100md.com
HHT对恶性淋巴瘤细胞的端粒酶活性具有抑制作用,同时具有抑制恶性淋巴瘤细胞增殖和促凋亡作用,提示HHT可能对于淋巴细胞恶性疾病具有潜在的治疗作用。
基金项目:浙江省卫生厅科学基金部分资助项目(2000A082)
参 考 文 献
1,Krupp G, Kuehne K, Tamm S, et al. Molecular basis of artifacts in the detection of telomerase activity and a modified primer for a more robust ‘TRAP’ assay. Nucl Acids Res, 1997, 25: 919-921.
2,Bonatz G, Klapper W, Barthe A, et al. Analysis of telomerase expression and proliferative activity in the different layers of cyclic endometrium. Biochem Biophysi Res Commun, 1998, 253: 214-221.
, 百拇医药
3,Heidebrecht HJ, Buck F, Steinmann J, et al. P100: a novel proliferation-associated nuclear protein specifically restricted to cell cycle phases S, G2, and M. Blood, 1997, 90: 226-233.
4,麦文渊,林茂芳. 高三尖杉酯碱诱导K562细胞凋亡的实验研究. 中华血液学杂志,1998,19:375-376.
5,Kim NW. Clinical implications of telomerase in cancer. Eur J Cancer, 1997, 33: 781-786.
(收稿日期:1999-11-08), http://www.100md.com
单位:金洁(310003 杭州,浙江大学医学院附属第一医院);M Hauberg 林雄斌 R Parwaresch(德国基尔大学血液病理所)
关键词:
中华血液学杂志001014 为探讨高三尖杉酯碱(HHT)对恶性淋巴细胞系的影响,我们观察HHT在体外对人Burkitt 淋巴瘤细胞Raji增殖、端粒酶活性的影响及是否诱导Raji细胞凋亡。
材料和方法
1 试剂 HHT为杭州民生药厂产品,以RPMI 1640培养液配成100ng/μl,4℃保存备用。胎牛血清、谷氨酰胺为Gibco公司产品。蛋白标准品为Bio-Rad公司产品。Apoptotic DNA Ladder试剂盒为Boehringer Mannheim公司产品。牛血清清蛋白系Sigma公司产品。
, 百拇医药
2 细胞培养 Burkitt淋巴瘤细胞系Raji细胞由德国基尔大学血液病理所提供,用含体积分数为10%的灭活胎牛血清RPMI 1640培养液(内含2 mmol/L谷氨酰胺)在37℃、体积分数为5%的CO2条件下培养,2d传代1次。取对数生长期细胞用于实验。
3 引物合成 TS 引物(5′-AATCCGTCGAGCAGAGTT-3′)、CX-ext引物 (5′-CCCTTACCCTTACCCTTACCCTAA-3′)均由Eurogentec公司合成。
4 剂量反应曲线 收集对数生长期的细胞,配成浓度为1×105/ml的细胞悬液,分别加入终浓度为5,10,20,40,100ng/ml的HHT,对照组加入等体积的RPMI 1640培养液,培养48h后收集细胞,用冰冷的PBS洗涤2遍。
5 时间反应曲线 在1×105/ml对数生长期的细胞中加入HHT,使其终浓度为40ng/ml,分别于给药后0,4,8,24,48及72h收集细胞,用冰冷的PBS洗涤2遍。以上实验均分别重复3次。
, 百拇医药
6 细胞增殖及细胞形态学观察 用体积分数为10%的牛血清清蛋白调整细胞浓度至1×106/ml,离心涂片,立即进行免疫组化染色。按常规ABC法,一抗Ki-67、Ki-S2和Ki-S4均由基尔大学血液病理所自制,二抗为Dako公司产品。其余玻片进行PAP染色,光镜下观察细胞形态并进行凋亡细胞计数,每张玻片计数200个细胞。
7 DNA琼脂糖凝胶电泳 1×106细胞用冰冷PBS洗涤2次,按Apoptotic DNA Ladder试剂盒说明书抽提DNA,取10μl DNA行15g/L琼脂糖凝胶电泳,用紫外透射仪观察电泳条带并摄片。
8 端粒酶活性测定 按照Krupp改良的荧光素标记的端粒重复扩增方法(TRAP)[1]进行半定量测定。
8.1 细胞抽提物的制备:将培养48h的1×106细胞用冰冷PBS洗涤2次,离心后将上清液吸干,加入冰冷的Chaps细胞裂解液100μl [10mmol/L Tris-HCl pH 7.5, 1mmol/L MgCl2, 1mmol/L EGTA, 5% Chaps (购自Sigma公司), 5mmol/L β-巯基乙醇, 体积分数为10%的甘油, 0.1mol/L AEBSF(4-[2-aminoethyl]benzenesulfonylfluoride)(购自Sigma公司), 1U/μl RNA 酶抑制剂(后二者须新鲜加入)]。混匀后置冰中30min, 20000×g, 4℃离心30min。上清液转移到另一无菌管中, 留取5μl用于蛋白含量测定, 其余立即投入液氮中快速冷冻, 并储存在-80℃待测。
, 百拇医药
8.2 蛋白含量测定:蛋白含量按照Bradford分析法。蛋白标准品分别稀释成0,0.2,0.4,0.6,0.8,1.0,1.2,1.4mg/ml, 并于每次测定前制备标准曲线。细胞抽提物用Bio-Rad蛋白显色液(预先用蒸馏水1∶5稀释)1∶100稀释,860分光光度计测定蛋白含量。
8.3 PCR条件:反应体积为50μl, 含20 mmol/L Tris-HCl, pH 8.0, 1 mmol/L EGTA, 体积分数为0.005%的Tween 20, 1.5 mmol/L MgCl2, 63mmol/L KCl, 50μmol/L 4×dNTP (购自MBI公司),2 U Taq DNA聚合酶(购自MBI公司), 0.1 attomol PCR标准物,10 pmol TS 引物, 10 pmol CX-ext引物, 1μg蛋白含量的细胞提取物作为摸板。立即在PCR扩增仪上进行扩增。先于30 ℃孵育30min以延伸TS引物,再经95℃变性3min,然后于95℃ 30s,50℃ 30s,72℃ 30s,共30个循环。
, http://www.100md.com
8.4 端粒酶活性测定:取1μl PCR产物,加入1μl Genescan-500 ROX内泳道标准物(internal lane standard)及22μl的甲酰胺,混匀后95℃变性2min即置于冰中冷却,用DNA测序仪(ABI prism 310)进行毛细管电泳分析。取前5个峰值,相加并除以PCR标准物峰值,即为端粒酶活性。
9 统计学处理 采用卡方检验。
结果
1 HHT对Raji细胞增殖的抑制作用 HHT对Raji细胞体外增殖具有显著的抑制作用,并与剂量呈正比(表1)。
表1 HHT对Raji 细胞增殖抑制的影响结果(
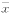 ±s) HHT浓度
±s) HHT浓度, 百拇医药 (ng/ml)
Raji细胞抗原表达率(%)
Ki-S4
Ki-67
Ki-S2
0
94.5±5.0
95.5±5.0
57.0±3.0
10
90.5±0.5
91.5±0.5
, 百拇医药
50.0±5.0
20
82.0±3.0*
81.0±1.0*
36.5±19.5*
40
76.5±5.5#
74.5±1.5#
15.5±7.5#
100
43.5±3.5#
, 百拇医药
52.5±6.5#
14.0±3.0#
注:* 与对照组比较,P<0.01;#与对照组比较, P<0.001
2 HHT不同浓度对Raji细胞端粒酶活性的影响 HHT对端粒酶活性具有明显的抑制作用,并与浓度呈正比,当浓度为10ng/ml时,Raji细胞端粒酶活性即降低了40.2%,浓度为20ng/ml时活性下降了93.9%(图1)。

图1 不同浓度的HHT对Raji细胞端粒酶活性的影响
3 HHT不同作用时间对Raji细胞端粒酶活性的影响 HHT 40mg/ml与Raji细胞作用8h后,端粒酶活性下降了62.2%,48h达到最大的抑制(图2)。

, 百拇医药
图2 HHT作用时间对Raji细胞端粒酶活性的影响
4 细胞形态观察 经HHT处理48h后,可看到细胞核固缩、核碎裂和凋亡小体形成。
5 DNA凝胶电泳 HHT作用48h后,100ng/ml、200ng/ml组可见梯状图谱。
讨论
HHT作用于肿瘤细胞的核糖体从而抑制蛋白质合成,呈剂量、时间依赖方式。药物阻止细胞从G1期进入S期,G2期进入M期。临床上主要用于治疗急性非淋巴细胞白血病,效果显著。本研究结果表明,HHT在体外可明显抑制淋巴瘤细胞增殖。药物抑制作用随浓度增加而增强。Ki-67、Ki-S4和Ki-S2是检测细胞增殖的单克隆抗体。Ki-67和Ki-S4在细胞周期S期、G2期、M期和G1期表达,而Ki-S2仅在S期、G2期和M期表达,在G1期和G0期不表达[2,3]。本研究中发现Raji细胞在无HHT作用下Ki-67、Ki-S4的表达率分别为95.5%和94.5%,而Ki-S2的表达率为57.0%,说明约有37%的细胞处于G1期。HHT作用后,Ki-67、Ki-S4和Ki-S2呈平行下降,HHT浓度为100ng/ml时,Ki-67、Ki-S4和Ki-S2阳性率分别为52.5%、43.5%和14.0%,说明HHT不是主要作用于细胞周期G1期,与国内麦文渊等[4]报道HHT主要作用于K562细胞的G1期不同。表明HHT对不同的细胞所作用的细胞周期不同。
, http://www.100md.com
端粒是真核细胞染色体末端的DNA-蛋白质结构。随着细胞生长、分裂,端粒长度逐渐缩短,直至细胞出现核型不稳定而死亡。端粒酶是一种由RNA模板,端粒酶逆转录酶及端粒相关蛋白质组成的核糖核蛋白复合物,可添加端粒重复序列于染色体末端,弥补DNA复制造成的端粒缩短,使细胞逃逸死亡。研究结果表明,绝大多数无限增殖的细胞株及85%人类原发性肿瘤均表达高的端粒酶活性[5]。因此,对端粒酶的抑制已成为恶性肿瘤治疗上的新思路。本实验结果表明,HHT对Burkitt淋巴瘤细胞的端粒酶活性具有明显的抑制作用。抑制作用呈量-效和时-效关系。结果还显示,HHT对细胞端粒酶活性的抑制于药物作用后8h即出现,而对该细胞增殖的抑制于药物作用后24h才出现,且抑制程度前者大于后者,说明药物作用后先出现端粒酶的抑制,后出现细胞增殖降低,似乎可以说明对端粒酶的抑制可能是HHT对肿瘤抑制的机制之一。
为探明HHT对Raji细胞的端粒酶活性抑制是否与细胞凋亡相关,我们观察了细胞形态变化与 DNA凝胶电泳,发现当HHT浓度为40ng/ml时,细胞形态观察即可见明显的凋亡表现,而DNA凝胶电泳则于药物浓度为100ng/ml时才出现梯形条带,200ng/ml时更明显。
, http://www.100md.com
HHT对恶性淋巴瘤细胞的端粒酶活性具有抑制作用,同时具有抑制恶性淋巴瘤细胞增殖和促凋亡作用,提示HHT可能对于淋巴细胞恶性疾病具有潜在的治疗作用。
基金项目:浙江省卫生厅科学基金部分资助项目(2000A082)
参 考 文 献
1,Krupp G, Kuehne K, Tamm S, et al. Molecular basis of artifacts in the detection of telomerase activity and a modified primer for a more robust ‘TRAP’ assay. Nucl Acids Res, 1997, 25: 919-921.
2,Bonatz G, Klapper W, Barthe A, et al. Analysis of telomerase expression and proliferative activity in the different layers of cyclic endometrium. Biochem Biophysi Res Commun, 1998, 253: 214-221.
, 百拇医药
3,Heidebrecht HJ, Buck F, Steinmann J, et al. P100: a novel proliferation-associated nuclear protein specifically restricted to cell cycle phases S, G2, and M. Blood, 1997, 90: 226-233.
4,麦文渊,林茂芳. 高三尖杉酯碱诱导K562细胞凋亡的实验研究. 中华血液学杂志,1998,19:375-376.
5,Kim NW. Clinical implications of telomerase in cancer. Eur J Cancer, 1997, 33: 781-786.
(收稿日期:1999-11-08), http://www.100md.com