豚鼠耳蜗血管纹黑色素的分布及其合成
豚鼠耳蜗血管纹黑色素的分布及其合成
钟时勋 刘兆华
摘 要:目的 观察豚鼠耳蜗血管纹中黑色素和酪氨酸酶的分布特征,进而了解血管纹黑色素的合成。方法 对12只杂色豚鼠,分别在光镜和电镜下观察血管纹中黑色素和酪氨酸酶的分布及其超微结构特征。结果 黑色素主要分布于豚鼠血管纹中间细胞内,基底细胞含少量黑色素,边缘细胞内无黑色素分布。酪氨酸酶分布于中间细胞Golgi体的分泌面和GERL囊泡,边缘细胞和基底细胞内无酪氨酸酶分布。结论 杂色豚鼠血管纹中间细胞为黑素细胞,能主动合成黑色素,而边缘细胞和基底细胞不能合成黑色素。
关键词:黑色素;酪氨酸酶;血管纹
, 百拇医药
耳蜗组织在内淋巴液的代谢以及蜗内电位的产生与维持过程中具有重要意义。一些学者观察到在杂色动物耳蜗血管纹中分布有数量不等的黑色素,但在白色动物耳蜗血管纹中没有黑色素分布[1]。目前对内耳黑色素的功能意义,尚不完全清楚。为此,本研究观察了豚鼠耳蜗血管纹中黑色素的分布及其超微结构,并探讨了其功能意义。
1 材料与方法
1.1 动物分组 健康杂色豚鼠12只,雌雄不拘,体重约300~400 g,耳廓反射灵敏,采用随机数字表法将动物随机分为2组,每组各6只,分别在光镜和电镜下观察血管纹黑色素(Ⅰa和Ⅰb组)和酪氨酸酶(Ⅱa和Ⅱb组)。
1.2 血管纹黑色素的光镜及电镜观察
注射戊巴比妥钠40 mg.kg-1于豚鼠腹腔,麻醉后开胸,心内灌注生理盐水冲净体内血液再灌注混合固定液2%多聚甲醛+0.1%戊二醛+0.1 mol/L二甲砷酸钠缓冲液(CB)(pH 7.4),断头后取出颞骨,迅速打开听泡,推压镫骨撕裂前庭窗,在圆窗膜和蜗尖各钻一小孔,从蜗尖缓慢注入混合固定液体3~5 ml,再将标本浸泡固定24 h(4 ℃),Ⅰa组以EDTA脱钙,常规石蜡包埋,沿蜗轴水平切片(5 μm)。切片染色分4组:①铵银染色;②漂白法;③常规HE染色;④不作任何染色。染色①和②如下述。
, 百拇医药
1.2.1 铵银染色[2] ①切片脱蜡,常规处理至水;②入Fontana银染液,置于室温下暗处18~20 h;③入0.2%氯化金水溶液10 min;④入5%硫代硫酸钠2 min;⑤HE复染;⑥脱水、透明封片。在上述步骤间均用蒸馏水洗涤2 min×3次。
1.2.2 漂白法 切片脱蜡至水后以0.1%~0.25% KMnO4溶液处理2~4 h,水洗后用1%草酸处理1 min,HE复染。
Ⅰb组待固定完成后,剥离出耳蜗第三回血管纹,1%锇酸后固定,丙酮梯度脱水,环氧树脂618包埋,常规透射电镜超薄切片,双铅染色,JEM-2000EX透射电镜下观察并照相。
1.3 血管纹酪氨酸酶的光镜及电镜观察
动物麻醉、固定方法同前,固定液为2%多聚甲醛+2%戊二醛+0.1mol/LCB(pH7.4)。固定完成后剥离出双侧耳蜗第三回血管纹,其中一侧血管纹以0.1mol/LCB洗涤5min×2次后,在0.1%L-DOPA液(美国sigma公司产品)中孵育18~24h(37℃水浴),每3~4h换孵育液1次,再以0.1mol/LCB洗涤5min×2次。对侧耳蜗血管纹如上法孵育,但孵育液中不加L-DOPA作为阴性对照。Ⅱa组用上述混合固定液固定过夜,梯度酒精脱水,常规石蜡包埋、切片,HE染色;Ⅱb组以1%锇酸后固定,常规透射电镜超薄切片同前,JEM-2000EX透射电镜下观察并照相。
, http://www.100md.com
2 结果
2.1 耳蜗血管纹中黑色素的分布及其超微结构 石蜡切片铵银染色显示,杂色豚鼠耳蜗各回血管纹中均可见到黑色颗粒状或成簇分布的黑色素,见图1。HE染色和不作染色也显示黑色颗粒呈点状散在或成簇分布,高锰酸钾漂白后这些黑色颗粒均消失。透射电镜下可见杂色豚鼠中间细胞与血管纹微血管紧密相邻,胞质突起较丰富,胞质及突起内线粒体、Golgi体、GERL等细胞器丰富,并含许多黑色素颗粒,主要由较多的Ⅲ、Ⅳ期和较少的Ⅱ期黑素体散在或成簇聚集而成,Ⅰ期黑素体少见。黑素体成簇聚集时可同时见到各期黑素体,Ⅰ期黑素体为球形膜性空泡,电子密度较低,Ⅱ期黑素体呈椭圆形,内含纤维样基质及板层结构,Ⅲ期黑素体基质变得致密,内部结构已看不太清,Ⅳ期黑素体则更为致密,电子不透明,已无法看清内部结构,见图2。成熟期黑素体直径约0.5~3μm,外被一层被膜包绕。部分黑素体聚集于血管纹微血管周围,二者紧密相邻。部分基底细胞中也可见到少量的黑素体,呈散在或聚集分布,其超微结构与中间细胞内的黑素体相似。边缘细胞内未见有黑素体分布。
, 百拇医药
图1 血管纹中黑色颗粒状分布的黑色素(↑) (铵银染色×400)
Fig 1 Dark granular distributed melanin in the stria vascularis(↑) (stained by Masson-Fontana method×400)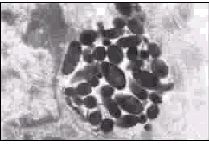
图2 中间细胞内各期黑素体成簇聚集 (TEM×15 000)
Fig 2 Different stages of melanosomes in clusters in the intermediate cells (TEM×15 000)
, 百拇医药 2.2 耳蜗血管纹中酪氨酸酶的分布及其超微结构
石蜡切片经L-DOPA组织化学反应后,光镜下可见杂色豚鼠耳蜗各回血管纹中均分布有棕黑色颗粒,这些颗粒是酪氨酸酶的特征性反应颗粒,见图3。阴性对照切片的血管纹中未见有反应颗粒。
透射电镜下,可见耳蜗血管纹中间细胞内Golgi体的分泌面和与其紧邻的GERL囊泡上有酪氨酸酶活性反应产物,为电子密度很高的黑色颗粒状沉淀,Golgi体的形成面没有此反应产物,见图4。边缘细胞和基底细胞内均未见有酶活性反应产物分布。阴性对照血管纹的各类细胞中亦未见有酪氨酸酶活性反应产物分布。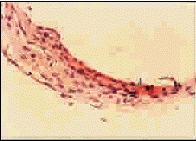
图3 血管纹内棕黑色酪氨酸酶反应产物颗粒(↑) (HE×400)
, http://www.100md.com
Fig 3 Granules (↑) of brownish-black tyrosinase reactionproducts in the stria vascularis (HE×400)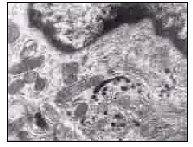
图4 中间细胞内Golgi体分泌面和GERL囊泡上黑色酪氨酸酶反应产物颗粒(↑) (TEM×12 000)
Fig 4 Reaction products of tyrosinase on trans-side of Golgi apparatus and GERL sacs in intermediate cells(↑) (TEM×12 000)
3 讨论
, http://www.100md.com
本研究采用铵银染色、HE染色及不经任何染色,在光镜下可见杂色豚鼠耳蜗各回血管纹都有黑色颗粒分布,但经高锰酸钾漂白后黑色颗粒完全消退,证实这些颗粒确为黑色素[2]。电镜观察显示,血管纹黑色素主要分布于中间细胞内,而基底细胞内较少,边缘细胞内则没有,此与大鼠血管纹中的黑色素分布相似[1]。部分黑素体与血管纹微血管紧密相邻,可能意味着这些黑色素与微血管间能相互交换物质成分。成熟期黑素体呈椭圆形,大小约0.5~3 μm,散在或聚集成簇,内部为纤维样基质及板层结构,表现出真黑素的超微结构特征。不过在猫及灰鼠血管纹中的黑色素则被认为是褐黑素,这可能与物种差异有关[3,4]。
黑色素是由酪氨酸酶催化酪氨酸形成多巴,再经一系列化学反应逐步合成的[5]。因此,本实验采用多巴作底物,经组织化学反应,检测其反应产物来检测酪氨酸酶活性反应产物的分布。电镜下,黑色的反应产物颗粒分布于中间细胞内Golgi体分泌面及紧邻的GERL囊泡,边缘细胞和基底细胞内无酶反应产物颗粒分布,与Fukazawa[5]的研究结果一致。而白色动物则正是由于其酪氨酸酶存在着遗传性缺陷,因而中间细胞不能合成黑色素[6]。
, http://www.100md.com
Wright等[4]发现,灰鼠血管纹中的黑色素主要分布于黑素细胞中,其细胞质较少,除黑素颗粒外其它细胞器较少。绝大部分色素由大小约0.5~3 μm含致密色素颗粒的物质成簇堆积而成,细胞内Golgi体和GERL很少见。而中间细胞体积较大,内有小而散在的致密色素颗粒,Golgi体和GERL系统丰富,DOPA反应强阳性。Conlee等[3]在猫血管纹中也观察到类似的现象。这两种不同形式的中间细胞,可能代表着两种不同的细胞类型,或者只是同一种细胞不同发育期的表现,即为无活性和有活性黑素细胞的表现。
在本实验中,豚鼠中间细胞与黑素细胞超微结构特征基本一致,并且胞质内也含有酪氨酸酶,意味着其能主动合成黑色素,证实豚鼠中间细胞就是黑素细胞。基底细胞虽含少量黑色素,但没有酪氨酸酶表达,而边缘细胞既无黑色素,也无酪酸酶分布,表明这两种细胞自身不能合成黑色素,基底细胞内的黑色素是从中间细胞转运而来的。
研究表明,耳蜗血管纹黑色素具有重要功能。杂色豚鼠与白色豚鼠相比,前者中间细胞体积及其与血管纹体积之比Vv都比后者大,而边缘细胞Vv则比后者小,且以耳蜗顶回的差异更为显著,这可能与前者耳蜗黑色素含量从底回向顶回增多及后者耳蜗缺乏黑色素有关[7]。氨基糖甙类抗生素作用后,杂色豚鼠血管纹内的黑色素含量显著增加,且中间细胞内的黑素体向边缘细胞及内淋巴腔移动[8],边缘细胞体积无明显变化,而白色豚鼠血管纹边缘细胞体积则显著减少,且其听功能损害亦显著大于杂色豚鼠,此即所谓的色素依赖性机制,表明内耳黑色素具有减轻氨基糖甙类抗生素耳毒性的作用[7]。此外,内耳黑色素还可作为某些二价离子的储存库参与内淋巴离子成分的调节过程,也可作为自由基的捕获剂而捕获并灭活内耳中的毒性自由基,从而防止自由基的损害作用造成细胞DNA链断裂、碱基破坏及形成DNA-蛋白交联等[9]。这些都表明,内耳黑色素对于内耳功能具有重要意义,但其作用机制仍有待于进行更深入的研究。
, http://www.100md.com
作者简介:钟时勋(1972-),男,四川省成都市人,硕士,医师,主要从事耳科学方面的研究。电话:(023)68757240
钟时勋(第三军医大学附属大坪医院野战外科研究所耳鼻咽喉-头颈外科,重庆 400042)
刘兆华(第三军医大学附属大坪医院野战外科研究所耳鼻咽喉-头颈外科,重庆 400042)
参考文献
[1] Hilding D A, Ginzburg G D. Pigmentation of the stria vascularis[J]. Acta Otolaryngol (Stockh), 1977,84(1):24-37.
[2] 刘介眉,严庆汉,路英杰.病理组织染色的理论方法和应用[M].北京:人民卫生出版社,1983.116-267.
, 百拇医药
[3] Conlee J W, Parks T N, Schwartz I R, et al. Comparative anatomy of melanin pigment in the stria vascualris. Evidence for a distribution between melanocytes and intermediate cells in the cat[J]. Acta Otolaryngol (Stockh), 1989,107(1-2):48-58.
[4] Wright C G, Lee D H. Pigmented cells of the stria vascualris and spiral ligament of the chichilla[J]. Acta Otolaryngol (Stockh), 1989,108(3-4):190-200.
[5] Fukazawa K, Sakagami M, Umemoto M, et al. Developmemt of melanosomes and cytochemical observation of tyrosinase activity in the inner ear[J]. ORL, 1994,56(5):247-252.
, http://www.100md.com
[6] Witkop C J, Quevedo W C, Fitzpatric T B. Albinism[A]. In:Stanbury J B, Wyngaarden D S, Frederickson J L, et al. eds. The metabolic basis of inherited disease[M]. New York: McGraw-Hill,1983.301-346.
[7] Conlee J W, Jensen R P, Park T N, et al. Turn-specific and pigment-dependent differences in the stria vascularis of normal and gentamicin-treated albino and pigmented guinea pigs[J]. Hear Res, 1991,55(1):57-69.
[8] Yoshihara T, Mita N, satoh M, et al. Effects of gentamicin on the melanosomes in stria vascularis of pigmented guinea pigs[J]. Acta Otolaryngol(Stockh),1997,528(Suppl):25-29.
[9] 钟时勋,刘兆华.内耳黑色素对氨基糖甙类抗生素耳毒性的影响[J].第三军医大学学报,1999,21(8增刊):S19-S22.
收稿日期:1999-11-25;修回日期:2000-03-10, 百拇医药
钟时勋 刘兆华
摘 要:目的 观察豚鼠耳蜗血管纹中黑色素和酪氨酸酶的分布特征,进而了解血管纹黑色素的合成。方法 对12只杂色豚鼠,分别在光镜和电镜下观察血管纹中黑色素和酪氨酸酶的分布及其超微结构特征。结果 黑色素主要分布于豚鼠血管纹中间细胞内,基底细胞含少量黑色素,边缘细胞内无黑色素分布。酪氨酸酶分布于中间细胞Golgi体的分泌面和GERL囊泡,边缘细胞和基底细胞内无酪氨酸酶分布。结论 杂色豚鼠血管纹中间细胞为黑素细胞,能主动合成黑色素,而边缘细胞和基底细胞不能合成黑色素。
关键词:黑色素;酪氨酸酶;血管纹
, 百拇医药
耳蜗组织在内淋巴液的代谢以及蜗内电位的产生与维持过程中具有重要意义。一些学者观察到在杂色动物耳蜗血管纹中分布有数量不等的黑色素,但在白色动物耳蜗血管纹中没有黑色素分布[1]。目前对内耳黑色素的功能意义,尚不完全清楚。为此,本研究观察了豚鼠耳蜗血管纹中黑色素的分布及其超微结构,并探讨了其功能意义。
1 材料与方法
1.1 动物分组 健康杂色豚鼠12只,雌雄不拘,体重约300~400 g,耳廓反射灵敏,采用随机数字表法将动物随机分为2组,每组各6只,分别在光镜和电镜下观察血管纹黑色素(Ⅰa和Ⅰb组)和酪氨酸酶(Ⅱa和Ⅱb组)。
1.2 血管纹黑色素的光镜及电镜观察
注射戊巴比妥钠40 mg.kg-1于豚鼠腹腔,麻醉后开胸,心内灌注生理盐水冲净体内血液再灌注混合固定液2%多聚甲醛+0.1%戊二醛+0.1 mol/L二甲砷酸钠缓冲液(CB)(pH 7.4),断头后取出颞骨,迅速打开听泡,推压镫骨撕裂前庭窗,在圆窗膜和蜗尖各钻一小孔,从蜗尖缓慢注入混合固定液体3~5 ml,再将标本浸泡固定24 h(4 ℃),Ⅰa组以EDTA脱钙,常规石蜡包埋,沿蜗轴水平切片(5 μm)。切片染色分4组:①铵银染色;②漂白法;③常规HE染色;④不作任何染色。染色①和②如下述。
, 百拇医药
1.2.1 铵银染色[2] ①切片脱蜡,常规处理至水;②入Fontana银染液,置于室温下暗处18~20 h;③入0.2%氯化金水溶液10 min;④入5%硫代硫酸钠2 min;⑤HE复染;⑥脱水、透明封片。在上述步骤间均用蒸馏水洗涤2 min×3次。
1.2.2 漂白法 切片脱蜡至水后以0.1%~0.25% KMnO4溶液处理2~4 h,水洗后用1%草酸处理1 min,HE复染。
Ⅰb组待固定完成后,剥离出耳蜗第三回血管纹,1%锇酸后固定,丙酮梯度脱水,环氧树脂618包埋,常规透射电镜超薄切片,双铅染色,JEM-2000EX透射电镜下观察并照相。
1.3 血管纹酪氨酸酶的光镜及电镜观察
动物麻醉、固定方法同前,固定液为2%多聚甲醛+2%戊二醛+0.1mol/LCB(pH7.4)。固定完成后剥离出双侧耳蜗第三回血管纹,其中一侧血管纹以0.1mol/LCB洗涤5min×2次后,在0.1%L-DOPA液(美国sigma公司产品)中孵育18~24h(37℃水浴),每3~4h换孵育液1次,再以0.1mol/LCB洗涤5min×2次。对侧耳蜗血管纹如上法孵育,但孵育液中不加L-DOPA作为阴性对照。Ⅱa组用上述混合固定液固定过夜,梯度酒精脱水,常规石蜡包埋、切片,HE染色;Ⅱb组以1%锇酸后固定,常规透射电镜超薄切片同前,JEM-2000EX透射电镜下观察并照相。
, http://www.100md.com
2 结果
2.1 耳蜗血管纹中黑色素的分布及其超微结构 石蜡切片铵银染色显示,杂色豚鼠耳蜗各回血管纹中均可见到黑色颗粒状或成簇分布的黑色素,见图1。HE染色和不作染色也显示黑色颗粒呈点状散在或成簇分布,高锰酸钾漂白后这些黑色颗粒均消失。透射电镜下可见杂色豚鼠中间细胞与血管纹微血管紧密相邻,胞质突起较丰富,胞质及突起内线粒体、Golgi体、GERL等细胞器丰富,并含许多黑色素颗粒,主要由较多的Ⅲ、Ⅳ期和较少的Ⅱ期黑素体散在或成簇聚集而成,Ⅰ期黑素体少见。黑素体成簇聚集时可同时见到各期黑素体,Ⅰ期黑素体为球形膜性空泡,电子密度较低,Ⅱ期黑素体呈椭圆形,内含纤维样基质及板层结构,Ⅲ期黑素体基质变得致密,内部结构已看不太清,Ⅳ期黑素体则更为致密,电子不透明,已无法看清内部结构,见图2。成熟期黑素体直径约0.5~3μm,外被一层被膜包绕。部分黑素体聚集于血管纹微血管周围,二者紧密相邻。部分基底细胞中也可见到少量的黑素体,呈散在或聚集分布,其超微结构与中间细胞内的黑素体相似。边缘细胞内未见有黑素体分布。

, 百拇医药
图1 血管纹中黑色颗粒状分布的黑色素(↑) (铵银染色×400)
Fig 1 Dark granular distributed melanin in the stria vascularis(↑) (stained by Masson-Fontana method×400)

图2 中间细胞内各期黑素体成簇聚集 (TEM×15 000)
Fig 2 Different stages of melanosomes in clusters in the intermediate cells (TEM×15 000)
, 百拇医药 2.2 耳蜗血管纹中酪氨酸酶的分布及其超微结构
石蜡切片经L-DOPA组织化学反应后,光镜下可见杂色豚鼠耳蜗各回血管纹中均分布有棕黑色颗粒,这些颗粒是酪氨酸酶的特征性反应颗粒,见图3。阴性对照切片的血管纹中未见有反应颗粒。
透射电镜下,可见耳蜗血管纹中间细胞内Golgi体的分泌面和与其紧邻的GERL囊泡上有酪氨酸酶活性反应产物,为电子密度很高的黑色颗粒状沉淀,Golgi体的形成面没有此反应产物,见图4。边缘细胞和基底细胞内均未见有酶活性反应产物分布。阴性对照血管纹的各类细胞中亦未见有酪氨酸酶活性反应产物分布。

图3 血管纹内棕黑色酪氨酸酶反应产物颗粒(↑) (HE×400)
, http://www.100md.com
Fig 3 Granules (↑) of brownish-black tyrosinase reactionproducts in the stria vascularis (HE×400)

图4 中间细胞内Golgi体分泌面和GERL囊泡上黑色酪氨酸酶反应产物颗粒(↑) (TEM×12 000)
Fig 4 Reaction products of tyrosinase on trans-side of Golgi apparatus and GERL sacs in intermediate cells(↑) (TEM×12 000)
3 讨论
, http://www.100md.com
本研究采用铵银染色、HE染色及不经任何染色,在光镜下可见杂色豚鼠耳蜗各回血管纹都有黑色颗粒分布,但经高锰酸钾漂白后黑色颗粒完全消退,证实这些颗粒确为黑色素[2]。电镜观察显示,血管纹黑色素主要分布于中间细胞内,而基底细胞内较少,边缘细胞内则没有,此与大鼠血管纹中的黑色素分布相似[1]。部分黑素体与血管纹微血管紧密相邻,可能意味着这些黑色素与微血管间能相互交换物质成分。成熟期黑素体呈椭圆形,大小约0.5~3 μm,散在或聚集成簇,内部为纤维样基质及板层结构,表现出真黑素的超微结构特征。不过在猫及灰鼠血管纹中的黑色素则被认为是褐黑素,这可能与物种差异有关[3,4]。
黑色素是由酪氨酸酶催化酪氨酸形成多巴,再经一系列化学反应逐步合成的[5]。因此,本实验采用多巴作底物,经组织化学反应,检测其反应产物来检测酪氨酸酶活性反应产物的分布。电镜下,黑色的反应产物颗粒分布于中间细胞内Golgi体分泌面及紧邻的GERL囊泡,边缘细胞和基底细胞内无酶反应产物颗粒分布,与Fukazawa[5]的研究结果一致。而白色动物则正是由于其酪氨酸酶存在着遗传性缺陷,因而中间细胞不能合成黑色素[6]。
, http://www.100md.com
Wright等[4]发现,灰鼠血管纹中的黑色素主要分布于黑素细胞中,其细胞质较少,除黑素颗粒外其它细胞器较少。绝大部分色素由大小约0.5~3 μm含致密色素颗粒的物质成簇堆积而成,细胞内Golgi体和GERL很少见。而中间细胞体积较大,内有小而散在的致密色素颗粒,Golgi体和GERL系统丰富,DOPA反应强阳性。Conlee等[3]在猫血管纹中也观察到类似的现象。这两种不同形式的中间细胞,可能代表着两种不同的细胞类型,或者只是同一种细胞不同发育期的表现,即为无活性和有活性黑素细胞的表现。
在本实验中,豚鼠中间细胞与黑素细胞超微结构特征基本一致,并且胞质内也含有酪氨酸酶,意味着其能主动合成黑色素,证实豚鼠中间细胞就是黑素细胞。基底细胞虽含少量黑色素,但没有酪氨酸酶表达,而边缘细胞既无黑色素,也无酪酸酶分布,表明这两种细胞自身不能合成黑色素,基底细胞内的黑色素是从中间细胞转运而来的。
研究表明,耳蜗血管纹黑色素具有重要功能。杂色豚鼠与白色豚鼠相比,前者中间细胞体积及其与血管纹体积之比Vv都比后者大,而边缘细胞Vv则比后者小,且以耳蜗顶回的差异更为显著,这可能与前者耳蜗黑色素含量从底回向顶回增多及后者耳蜗缺乏黑色素有关[7]。氨基糖甙类抗生素作用后,杂色豚鼠血管纹内的黑色素含量显著增加,且中间细胞内的黑素体向边缘细胞及内淋巴腔移动[8],边缘细胞体积无明显变化,而白色豚鼠血管纹边缘细胞体积则显著减少,且其听功能损害亦显著大于杂色豚鼠,此即所谓的色素依赖性机制,表明内耳黑色素具有减轻氨基糖甙类抗生素耳毒性的作用[7]。此外,内耳黑色素还可作为某些二价离子的储存库参与内淋巴离子成分的调节过程,也可作为自由基的捕获剂而捕获并灭活内耳中的毒性自由基,从而防止自由基的损害作用造成细胞DNA链断裂、碱基破坏及形成DNA-蛋白交联等[9]。这些都表明,内耳黑色素对于内耳功能具有重要意义,但其作用机制仍有待于进行更深入的研究。
, http://www.100md.com
作者简介:钟时勋(1972-),男,四川省成都市人,硕士,医师,主要从事耳科学方面的研究。电话:(023)68757240
钟时勋(第三军医大学附属大坪医院野战外科研究所耳鼻咽喉-头颈外科,重庆 400042)
刘兆华(第三军医大学附属大坪医院野战外科研究所耳鼻咽喉-头颈外科,重庆 400042)
参考文献
[1] Hilding D A, Ginzburg G D. Pigmentation of the stria vascularis[J]. Acta Otolaryngol (Stockh), 1977,84(1):24-37.
[2] 刘介眉,严庆汉,路英杰.病理组织染色的理论方法和应用[M].北京:人民卫生出版社,1983.116-267.
, 百拇医药
[3] Conlee J W, Parks T N, Schwartz I R, et al. Comparative anatomy of melanin pigment in the stria vascualris. Evidence for a distribution between melanocytes and intermediate cells in the cat[J]. Acta Otolaryngol (Stockh), 1989,107(1-2):48-58.
[4] Wright C G, Lee D H. Pigmented cells of the stria vascualris and spiral ligament of the chichilla[J]. Acta Otolaryngol (Stockh), 1989,108(3-4):190-200.
[5] Fukazawa K, Sakagami M, Umemoto M, et al. Developmemt of melanosomes and cytochemical observation of tyrosinase activity in the inner ear[J]. ORL, 1994,56(5):247-252.
, http://www.100md.com
[6] Witkop C J, Quevedo W C, Fitzpatric T B. Albinism[A]. In:Stanbury J B, Wyngaarden D S, Frederickson J L, et al. eds. The metabolic basis of inherited disease[M]. New York: McGraw-Hill,1983.301-346.
[7] Conlee J W, Jensen R P, Park T N, et al. Turn-specific and pigment-dependent differences in the stria vascularis of normal and gentamicin-treated albino and pigmented guinea pigs[J]. Hear Res, 1991,55(1):57-69.
[8] Yoshihara T, Mita N, satoh M, et al. Effects of gentamicin on the melanosomes in stria vascularis of pigmented guinea pigs[J]. Acta Otolaryngol(Stockh),1997,528(Suppl):25-29.
[9] 钟时勋,刘兆华.内耳黑色素对氨基糖甙类抗生素耳毒性的影响[J].第三军医大学学报,1999,21(8增刊):S19-S22.
收稿日期:1999-11-25;修回日期:2000-03-10, 百拇医药