内毒素血症时小鼠肺泡巨噬细胞CD14和清道夫受体的表达
内毒素血症时小鼠肺泡巨噬细胞CD14和清道夫受体的表达
陈永华 蒋建新 谢国旗 刘大维 周继红 朱佩芳
摘 要: 目的 探讨内毒素肺损伤时,肺泡巨噬细胞逐步由免疫防御型转变为效应型的分子机制。方法 建立内毒素肺损伤动物模型,免疫组化法观察肺泡巨噬细胞CD14及清道夫受体(SR)表达的变化,并辅以计算机图像分析;同时检测肺体指数,肺组织的病理变化及动物存活率。结果 内毒素对CD14的表达呈时间依赖性升高,但加大剂量并未使其进一步增加;SR呈时间及剂量依赖性降低。肺泡巨噬细胞SR、CD14的表达变化与小鼠肺损伤程度及存活率呈平行关系。结论 内毒素致小鼠肺损伤过程中,肺泡巨噬细胞表面SR表达下调以及CD14表达上调可能是肺泡巨噬细胞由免疫防御细胞转化为致炎效应细胞的机制之一。
, 百拇医药
关键词:肺泡巨噬细胞;内毒素;肺损伤;CD14;清道夫受体
肺泡巨噬细胞作为肺局部早期接触外来抗原的吞噬和炎性细胞,其表面既存在介导调理吞噬作用的受体,又存在激活性受体。研究表明[1,2],CD14是内毒素激活巨噬细胞的主要受体,与细胞释放炎症介质有关;巨噬细胞清道夫受体(Scavenger receptor, SR)除在动脉粥样硬化发病机制中发挥重要作用外,还是重要的防御性受体,参与内毒素的清除和灭活作用。本研究通过探讨小鼠内毒素血症时肺泡巨噬细胞表面SR、CD14表达变化及其与内毒素肺损伤的关系,从细胞受体水平为阐明严重创伤或感染后肺泡巨噬细胞逐步由正常的防御性细胞转变为致炎效应细胞的分子机制提供新的认识。
1 材料与方法
1.1 动物模型与免疫组化标本的准备 昆明种雄性小鼠64只,体重(20±2) g,随机分为正常对照组和低(1 mg/kg)、中(5 mg/kg)、高(10 mg/kg)剂量内毒素(LPS)致伤组,各内毒素组又分为注射内毒素后0.5、1、3、5、8 h组,每组4只。经尾静脉注入相应剂量的LPS(E.coli 026∶B6,DIFCO)复制内毒素血症/肺损伤模型。至相应时相点,动物麻醉后用4%多聚甲醛经右心室灌注固定,取出肺脏,后固定16~18 h,常规石蜡包埋切片,行免疫组化染色。
, 百拇医药
1.2 SR、CD14检测
采用S-P免疫组化法。石蜡切片5μm,常规脱蜡,经0.3%H2O2-甲醇灭活内源性过氧化物酶,并以5%正常羊血清封闭后,加1∶800SR(SerotecLtd,英国)和CD14(Pharmingen,美国)单抗,4℃冰箱过夜。1∶200生物素化二抗和辣根过氧化物酶标记链酶卵白素(北京中山公司)分别与切片在37℃孵育30min,DAB显色,苏木精复染。PBS代替一抗作为阴性对照。切片经TECBIAS-6803真彩色生物医学图像分析系统分析,40×10显微镜下每一切片随机观察8个视野,以积分光密度(IOD)平均值表示CD14及SR表达的相对强度。
1.3 肺损伤检测指标
1.3.1 肺体指数测定 另取昆明种雄性小鼠128只,体重(20±2)g。实验前禁食12h,自由饮水。随机分组同前,每组8只,称体重(g)并记录。内毒素动物模型的复制同前述,至相应时相点,以1%戊巴比妥钠(35mg/kg)腹腔注射麻醉后,开胸取出肺脏称重(g),计算肺重与体重的比值。
, 百拇医药
1.3.2 肺组织病理学观察 小鼠肺损伤后,至相应时相点,解剖观察大体标本;石蜡切片常规HE染色,观察光镜下肺损伤的程度。
1.4 动物死亡率观察 观察各组动物致伤后24h内死亡率。
1.5 统计学处理 实验所得计数资料用χ2检验;计量数据以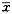 ±s表示,伤后各时相点与正常组相比采用双侧t检验;各剂量组之间相比采用单因素方差分析;SR及CD14之间应用相关性分析。
±s表示,伤后各时相点与正常组相比采用双侧t检验;各剂量组之间相比采用单因素方差分析;SR及CD14之间应用相关性分析。
2 结果
2.1 SR表达变化
正常对照组肺泡巨噬细胞表面SR表达相对较高。计算机图像分析显示,注射LPS后1h,高剂量组肺泡巨噬细胞SR平均IOD值显著低于对照组(P<0.05),而低剂量组及中等剂量组SR表达变化不明显;但注射LPS 3 h后,3个内毒素剂量组肺泡巨噬细胞表面SR表达均明显减少(P<0.01),并随时间延长而进行性下调。肺泡巨噬细胞表面SR表达变化与LPS呈明显的量效关系,即随着LPS剂量增加,肺泡巨噬细胞表达SR减少更明显,见表1。
, http://www.100md.com
表1 伤后肺组织SR表达变化(n=8,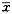 ±s)
±s)
Tab 1 The integral optical density of SR in lung after the infusion of LPS(n=8,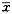 ±s)
±s)
Group
Time after challenged with LPS(h)
0.5
, 百拇医药
1
3
5
8
Control
317.8±45.4
1 mg/kg
301.4±55.1
289.4±55.7
263.5±42.3
242.9±43.6*
208.9±57.5* *
, 百拇医药
5 mg/kg
304.6±42.5
283.5±35.8
242.4±33.7*
194.6±27.4* *
152.9±25.0* *
10 mg/kg
287.9±44.2
257.7±31.4*
189.0±48.2* *
, 百拇医药
153.2±30.2* *
105.0±30.2* *
F value
0.28
1.27
6.72
13.57
13.40
P
>0.05
>0.05
<0.01
, 百拇医药
<0.01
<0.01
*:P<0.05,* *:P<0.01 vs control
2.2 CD14表达变化
CD14阳性细胞主要为肺泡巨噬细胞,少量分布于肺上皮细胞。注射LPS后1h,3组CD14平均Dλ值有增加趋势,但与正常组比无统计学意义,注射LPS后3 h,3组肺泡巨噬细胞CD14表达增加明显(P<0.05),并随时间延长均进一步增多,至8 h,3组CD14阳性产物呈弥漫性分布(P<0.01)。但3组间肺泡巨噬细胞CD14表达差异不显著,见表2。
表2 伤后肺组织CD14表达变化(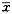 ±s)
±s)
, http://www.100md.com
Tab 2 The integral optical density of CD14 in lung after the infusion of LPS(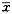 ±s)
±s)
Group
Time after challenged with LPS(h)
0.5
1
3
5
8
, http://www.100md.com
Control
118.5±18.3
1 mg/kg
126.9±20.9
135.9±11.5
164.2±29.3*
175.2±17.4* *
225.4±28.8* *
5 mg/kg
138.3±15.5
142.7±14.5
, 百拇医药
172.9±21.3*
204.0±36.2* *
234.2±33.4* *
10 mg/kg
140.7±23.4
150.1±26.1
183.8±30.6* *
209.7±37.3* *
248.1±53.0* *
F value
, http://www.100md.com
1.07
1.18
1.03
2.73
0.66
P
>0.05
>0.05
>0.05
>0.05
>0.05
*:P<0.05,* *:P<0.01 vs control
, http://www.100md.com
2.3 SR与CD14表达的相关性
相关分析表明,低、中、高剂量组SR平均Dλ值与CD14平均Dλ值变化呈显著负相关关系(r=-0.91,-0.93,-0.89,P<0.01)。
2.4 肺体指数的改变
伤后肺水肿的程度(肺体指数)进行性升高,致伤1h后3组间肺体指数差异显著(P<0.01),见表3。
表3 伤后肺体指数(1×10-3)的改变(n=8,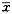 ±s)
±s)
Tab 3 Changes of lung-body index (1×10-3) after injection of LPS(n=8,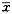 ±s)
±s)
, http://www.100md.com
Group
Time after challenged with LPS(h)
0.5
1
3
5
8
Control
6.53±0.95
1 mg/kg
6.59±0.93
7.05±0.54
, http://www.100md.com
7.20±0.89
7.31±0.51
7.38±0.58*
5 mg/kg
7.08±0.54
7.49±0.19*
7.67±1.20*
8.19±0.73* *
8.33±0.74* *
10 mg/kg
, 百拇医药
7.31±1.05
8.20±0.38* *
8.25±0.47* *
8.32±0.36* *
8.92±0.86* *
F value
1.44
17.12
9.76
7.85
8.92
, http://www.100md.com
P
>0.05
<0.01
<0.01
<0.01
<0.01
*:P<0.05,* *:P<0.01 vs control
2.5 肺组织病理学改变
注射LPS后3h,小剂量组大体观察见表面有针尖样出血点,至8h出血加重,呈斑片状出血,但不超过一侧肺叶的1/4。光镜下观察炎性细胞浸润及肺间质增厚的程度呈时间依赖性增加。大剂量组解剖观察见伤后1~3h即可出现接近肺叶1/4~1/3面积的斑片状出血点,到8h出现极重度出血,出血面积超过一侧肺叶的50%,光镜观察见大量炎性细胞浸润并可扩散到肺泡腔内,肺间质及肺泡水肿。中剂量组损伤程度介于二者之间,见图1。
, 百拇医药
图1 肺组织病理改变 (HE×400)
A:正常肺组织;B:1 mg/kg组,伤后5 h;C:5 mg/kg组,伤后5 h;D:10 mg/kg组,伤后5 h
Fig 1 Pathological changes of lung tissues (HE×400)
A:Normal lung tissue; B:1 mg/kg group 5 h after injury; C:5 mg/kg group 5 h after injury; D:10 mg/kg group 5 h after injury
2.6 内毒素血症时小鼠24 h死亡率,见表4
表4 内毒素血症/休克小鼠24 h死亡率观察
, http://www.100md.com
Tab 4 Mortality rate of endotoximia/shock mice in 24 h
Cases
Group
Mortality(%)
Survival
Death
Total
1 mg/kg
20
0
20
, 百拇医药 0
5 mg/kg
12
8
20
40*
10 mg/kg
4
16
20
80* △
*:P<0.01 vs 1 mg/kg group;△:P<0.01 vs 5 mg/kg group
, http://www.100md.com
3 讨论
急性呼吸窘迫综合征(ARDS)是严重创伤或感染后病死率较高的并发症。尽管其发病机制仍不很清楚,但目前认为,由细菌内毒素激活肺泡巨噬细胞,诱导的局部炎症反应失控及免疫防御屏障机能下降是造成肺损伤的重要原因。CD14为分子量55×103的糖基磷酯酰肌醇锚定糖蛋白,是内毒素激活髓样细胞的主要途径[3]。SR是一种由3个亚基组成的跨膜糖蛋白,存在于巨噬细胞、肝内皮细胞等表面,可与多种带有负电荷的大分子结合,并将之转移到细胞内降解,是近年发现的介导巨噬细胞吞噬降解细菌脂多糖的受体之一[1,2,4]。对该两种受体在肺损伤中作用的探讨可为阐明ARDS的发病机制提供一条崭新的认识途径。
本研究结果显示,肺内CD14阳性细胞主要为肺泡巨噬细胞,少量亦分布于肺上皮细胞[5]。正常肺泡巨噬细胞表达微弱的CD14,却表达强阳性的SR;内毒素血症过程中,肺泡巨噬细胞表面CD14表达呈进行性上调,而SR表达呈时间及剂量依赖性下调。提示在机体未受感染时,肺泡巨噬细胞具有正常的防御吞噬功能;随着感染的进行和加重,肺泡巨噬细胞表面SR表达下调,CD14表达上调,通过SR结合并降解内毒素的能力下降,而与CD14结合则增多,对肺泡巨噬细胞的激活作用增强,可诱导其合成释放过量的炎症介质加重肺损伤。Mendez等[6]体外研究也发现,经AcLDL阻断清道夫受体,可明显增强LPS对肺泡巨噬细胞TNF的诱导生成作用。给SR基因敲除小鼠注射LPS后,血中TNFα水平明显升高,小鼠死亡率显著增加[4]。因此,内毒素肺损伤过程中,肺泡巨噬细胞表面SR表达下调、CD14表达上调可能是促使肺泡巨噬细胞由防御细胞逐步转化为效应细胞的重要机制之一。
, 百拇医药
相关分析显示,内毒素肺损伤过程中,各内毒素剂量组SR与CD14的表达变化有显著性负相关,说明这两种受体之间可能存在一定的内在联系。我们推测内毒素致伤后,LPS可能首先通过CD14依赖途径激活局部或循环血中炎性细胞释放炎性介质,这些介质或其中某种介质对CD14自身表达起正调控作用,而对SR的表达起负调控作用。Hsu[7]通过实验证实TNF可以抑制清道夫受体基因的转录、蛋白表达及其与配体的结合活性,因而TNF可能就是具有这种双向调控作用的最重要的始动介质。
研究结果还显示,注射内毒素后肺组织水肿程度、肺组织病理改变及动物死亡率也与肺泡巨噬细胞表面SR、CD14表达变化呈明显的平行关系。说明随着这两种受体的表达变化,肺泡巨噬细胞吞噬防御功能减弱,致炎作用增强,造成局部炎症反应失控,进而引起急性肺损伤,甚或ARDS。对创伤或感染时这两种受体表达变化规律认识的不断深入,有助于阐明创伤后免疫机能紊乱的受体机制,可为临床治疗急性肺损伤、ARDS提供一种新的认识途径。
, 百拇医药
由于肺泡巨噬细胞表面CD14表达上调并未随着内毒素剂量的增加而增多,但不同内毒素剂量组之间动物肺损伤及死亡率却存在差异显著,提示在大剂量内毒素作用时,体内可能还存在其它低亲和力内毒素受体途径[9]。
基金项目:国家自然科学基金资助项目(38970833);全军医药卫生杰出中青年基金资助项目
作者简介:陈永华(1969-),男,河南省驻马店市人,硕士,主治医师,主要从事创伤性休克方面的研究。电话:(023)68757434
陈永华(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
蒋建新(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
谢国旗(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
, 百拇医药
刘大维(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
周继红(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
朱佩芳(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
参考文献
[1] Fenton M J, Golenbock D T. LPS-binding proteins and receptors[J]. J Leukoc Biol,1998,64(1):25-32.
[2] Suruki H, Kurihara Y, Takeya M, et al. A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J]. Nature,1997,386(6 622):292-296.
, http://www.100md.com
[3] 蒋建新.LBP/CD14系统及其与内毒素作用的关系[J].生理科学进展,1997,28(3):286-288.
[4] Gordon S. Macrophage-restricted molecules:role in differentiation and activation[J]. Immunol Lett,1999,65(1-2):5-8.
[5] Fearns C, Kravchenko V V, Ulevitch R J, et al. Murine CD14 gene expression in vivo: extramyeloid synthesis and regulation by lipopolysaccharide[J]. J Exp Med,1995,181(3):857-866.
[6] Mendez C, Ronald V. Scavenger receptor blockade augments LPS-induced TNF production by alveolar macrophages[J]. Surgi Forum,1995,46(1):41-44.
, http://www.100md.com
[7] Hsu H Y, Nicholson A C, Hajjar D P. Inhibition of macrophage scavenger receptor activity by tumor necrosis factor-α is transcriptionally and post-transcriptionally regulated[J]. J Biol Chem,1996,271(13):7 767-7 773.
[8] Takakuwa T, Kmorf H, Sing A, et al. Induction of CD14 expression in Lpsm, Lpsd and tumor necrosis factor receptro-defficient mice[J]. Eur J Immunol,1996,26(11):2 686-2 692.
[9] Malhotra R, Bird M. L-selectin: a novel receptor for lipopolysaccharide and its potential role in bacterial sepsis[J]. Bioessays,1997,19(10):919-923., http://www.100md.com
陈永华 蒋建新 谢国旗 刘大维 周继红 朱佩芳
摘 要: 目的 探讨内毒素肺损伤时,肺泡巨噬细胞逐步由免疫防御型转变为效应型的分子机制。方法 建立内毒素肺损伤动物模型,免疫组化法观察肺泡巨噬细胞CD14及清道夫受体(SR)表达的变化,并辅以计算机图像分析;同时检测肺体指数,肺组织的病理变化及动物存活率。结果 内毒素对CD14的表达呈时间依赖性升高,但加大剂量并未使其进一步增加;SR呈时间及剂量依赖性降低。肺泡巨噬细胞SR、CD14的表达变化与小鼠肺损伤程度及存活率呈平行关系。结论 内毒素致小鼠肺损伤过程中,肺泡巨噬细胞表面SR表达下调以及CD14表达上调可能是肺泡巨噬细胞由免疫防御细胞转化为致炎效应细胞的机制之一。
, 百拇医药
关键词:肺泡巨噬细胞;内毒素;肺损伤;CD14;清道夫受体
肺泡巨噬细胞作为肺局部早期接触外来抗原的吞噬和炎性细胞,其表面既存在介导调理吞噬作用的受体,又存在激活性受体。研究表明[1,2],CD14是内毒素激活巨噬细胞的主要受体,与细胞释放炎症介质有关;巨噬细胞清道夫受体(Scavenger receptor, SR)除在动脉粥样硬化发病机制中发挥重要作用外,还是重要的防御性受体,参与内毒素的清除和灭活作用。本研究通过探讨小鼠内毒素血症时肺泡巨噬细胞表面SR、CD14表达变化及其与内毒素肺损伤的关系,从细胞受体水平为阐明严重创伤或感染后肺泡巨噬细胞逐步由正常的防御性细胞转变为致炎效应细胞的分子机制提供新的认识。
1 材料与方法
1.1 动物模型与免疫组化标本的准备 昆明种雄性小鼠64只,体重(20±2) g,随机分为正常对照组和低(1 mg/kg)、中(5 mg/kg)、高(10 mg/kg)剂量内毒素(LPS)致伤组,各内毒素组又分为注射内毒素后0.5、1、3、5、8 h组,每组4只。经尾静脉注入相应剂量的LPS(E.coli 026∶B6,DIFCO)复制内毒素血症/肺损伤模型。至相应时相点,动物麻醉后用4%多聚甲醛经右心室灌注固定,取出肺脏,后固定16~18 h,常规石蜡包埋切片,行免疫组化染色。
, 百拇医药
1.2 SR、CD14检测
采用S-P免疫组化法。石蜡切片5μm,常规脱蜡,经0.3%H2O2-甲醇灭活内源性过氧化物酶,并以5%正常羊血清封闭后,加1∶800SR(SerotecLtd,英国)和CD14(Pharmingen,美国)单抗,4℃冰箱过夜。1∶200生物素化二抗和辣根过氧化物酶标记链酶卵白素(北京中山公司)分别与切片在37℃孵育30min,DAB显色,苏木精复染。PBS代替一抗作为阴性对照。切片经TECBIAS-6803真彩色生物医学图像分析系统分析,40×10显微镜下每一切片随机观察8个视野,以积分光密度(IOD)平均值表示CD14及SR表达的相对强度。
1.3 肺损伤检测指标
1.3.1 肺体指数测定 另取昆明种雄性小鼠128只,体重(20±2)g。实验前禁食12h,自由饮水。随机分组同前,每组8只,称体重(g)并记录。内毒素动物模型的复制同前述,至相应时相点,以1%戊巴比妥钠(35mg/kg)腹腔注射麻醉后,开胸取出肺脏称重(g),计算肺重与体重的比值。
, 百拇医药
1.3.2 肺组织病理学观察 小鼠肺损伤后,至相应时相点,解剖观察大体标本;石蜡切片常规HE染色,观察光镜下肺损伤的程度。
1.4 动物死亡率观察 观察各组动物致伤后24h内死亡率。
1.5 统计学处理 实验所得计数资料用χ2检验;计量数据以
2 结果
2.1 SR表达变化
正常对照组肺泡巨噬细胞表面SR表达相对较高。计算机图像分析显示,注射LPS后1h,高剂量组肺泡巨噬细胞SR平均IOD值显著低于对照组(P<0.05),而低剂量组及中等剂量组SR表达变化不明显;但注射LPS 3 h后,3个内毒素剂量组肺泡巨噬细胞表面SR表达均明显减少(P<0.01),并随时间延长而进行性下调。肺泡巨噬细胞表面SR表达变化与LPS呈明显的量效关系,即随着LPS剂量增加,肺泡巨噬细胞表达SR减少更明显,见表1。
, http://www.100md.com
表1 伤后肺组织SR表达变化(n=8,
Tab 1 The integral optical density of SR in lung after the infusion of LPS(n=8,
Group
Time after challenged with LPS(h)
0.5
, 百拇医药
1
3
5
8
Control
317.8±45.4
1 mg/kg
301.4±55.1
289.4±55.7
263.5±42.3
242.9±43.6*
208.9±57.5* *
, 百拇医药
5 mg/kg
304.6±42.5
283.5±35.8
242.4±33.7*
194.6±27.4* *
152.9±25.0* *
10 mg/kg
287.9±44.2
257.7±31.4*
189.0±48.2* *
, 百拇医药
153.2±30.2* *
105.0±30.2* *
F value
0.28
1.27
6.72
13.57
13.40
P
>0.05
>0.05
<0.01
, 百拇医药
<0.01
<0.01
*:P<0.05,* *:P<0.01 vs control
2.2 CD14表达变化
CD14阳性细胞主要为肺泡巨噬细胞,少量分布于肺上皮细胞。注射LPS后1h,3组CD14平均Dλ值有增加趋势,但与正常组比无统计学意义,注射LPS后3 h,3组肺泡巨噬细胞CD14表达增加明显(P<0.05),并随时间延长均进一步增多,至8 h,3组CD14阳性产物呈弥漫性分布(P<0.01)。但3组间肺泡巨噬细胞CD14表达差异不显著,见表2。
表2 伤后肺组织CD14表达变化(
, http://www.100md.com
Tab 2 The integral optical density of CD14 in lung after the infusion of LPS(
Group
Time after challenged with LPS(h)
0.5
1
3
5
8
, http://www.100md.com
Control
118.5±18.3
1 mg/kg
126.9±20.9
135.9±11.5
164.2±29.3*
175.2±17.4* *
225.4±28.8* *
5 mg/kg
138.3±15.5
142.7±14.5
, 百拇医药
172.9±21.3*
204.0±36.2* *
234.2±33.4* *
10 mg/kg
140.7±23.4
150.1±26.1
183.8±30.6* *
209.7±37.3* *
248.1±53.0* *
F value
, http://www.100md.com
1.07
1.18
1.03
2.73
0.66
P
>0.05
>0.05
>0.05
>0.05
>0.05
*:P<0.05,* *:P<0.01 vs control
, http://www.100md.com
2.3 SR与CD14表达的相关性
相关分析表明,低、中、高剂量组SR平均Dλ值与CD14平均Dλ值变化呈显著负相关关系(r=-0.91,-0.93,-0.89,P<0.01)。
2.4 肺体指数的改变
伤后肺水肿的程度(肺体指数)进行性升高,致伤1h后3组间肺体指数差异显著(P<0.01),见表3。
表3 伤后肺体指数(1×10-3)的改变(n=8,
Tab 3 Changes of lung-body index (1×10-3) after injection of LPS(n=8,
, http://www.100md.com
Group
Time after challenged with LPS(h)
0.5
1
3
5
8
Control
6.53±0.95
1 mg/kg
6.59±0.93
7.05±0.54
, http://www.100md.com
7.20±0.89
7.31±0.51
7.38±0.58*
5 mg/kg
7.08±0.54
7.49±0.19*
7.67±1.20*
8.19±0.73* *
8.33±0.74* *
10 mg/kg
, 百拇医药
7.31±1.05
8.20±0.38* *
8.25±0.47* *
8.32±0.36* *
8.92±0.86* *
F value
1.44
17.12
9.76
7.85
8.92
, http://www.100md.com
P
>0.05
<0.01
<0.01
<0.01
<0.01
*:P<0.05,* *:P<0.01 vs control
2.5 肺组织病理学改变
注射LPS后3h,小剂量组大体观察见表面有针尖样出血点,至8h出血加重,呈斑片状出血,但不超过一侧肺叶的1/4。光镜下观察炎性细胞浸润及肺间质增厚的程度呈时间依赖性增加。大剂量组解剖观察见伤后1~3h即可出现接近肺叶1/4~1/3面积的斑片状出血点,到8h出现极重度出血,出血面积超过一侧肺叶的50%,光镜观察见大量炎性细胞浸润并可扩散到肺泡腔内,肺间质及肺泡水肿。中剂量组损伤程度介于二者之间,见图1。

, 百拇医药
图1 肺组织病理改变 (HE×400)
A:正常肺组织;B:1 mg/kg组,伤后5 h;C:5 mg/kg组,伤后5 h;D:10 mg/kg组,伤后5 h
Fig 1 Pathological changes of lung tissues (HE×400)
A:Normal lung tissue; B:1 mg/kg group 5 h after injury; C:5 mg/kg group 5 h after injury; D:10 mg/kg group 5 h after injury
2.6 内毒素血症时小鼠24 h死亡率,见表4
表4 内毒素血症/休克小鼠24 h死亡率观察
, http://www.100md.com
Tab 4 Mortality rate of endotoximia/shock mice in 24 h
Cases
Group
Mortality(%)
Survival
Death
Total
1 mg/kg
20
0
20
, 百拇医药 0
5 mg/kg
12
8
20
40*
10 mg/kg
4
16
20
80* △
*:P<0.01 vs 1 mg/kg group;△:P<0.01 vs 5 mg/kg group
, http://www.100md.com
3 讨论
急性呼吸窘迫综合征(ARDS)是严重创伤或感染后病死率较高的并发症。尽管其发病机制仍不很清楚,但目前认为,由细菌内毒素激活肺泡巨噬细胞,诱导的局部炎症反应失控及免疫防御屏障机能下降是造成肺损伤的重要原因。CD14为分子量55×103的糖基磷酯酰肌醇锚定糖蛋白,是内毒素激活髓样细胞的主要途径[3]。SR是一种由3个亚基组成的跨膜糖蛋白,存在于巨噬细胞、肝内皮细胞等表面,可与多种带有负电荷的大分子结合,并将之转移到细胞内降解,是近年发现的介导巨噬细胞吞噬降解细菌脂多糖的受体之一[1,2,4]。对该两种受体在肺损伤中作用的探讨可为阐明ARDS的发病机制提供一条崭新的认识途径。
本研究结果显示,肺内CD14阳性细胞主要为肺泡巨噬细胞,少量亦分布于肺上皮细胞[5]。正常肺泡巨噬细胞表达微弱的CD14,却表达强阳性的SR;内毒素血症过程中,肺泡巨噬细胞表面CD14表达呈进行性上调,而SR表达呈时间及剂量依赖性下调。提示在机体未受感染时,肺泡巨噬细胞具有正常的防御吞噬功能;随着感染的进行和加重,肺泡巨噬细胞表面SR表达下调,CD14表达上调,通过SR结合并降解内毒素的能力下降,而与CD14结合则增多,对肺泡巨噬细胞的激活作用增强,可诱导其合成释放过量的炎症介质加重肺损伤。Mendez等[6]体外研究也发现,经AcLDL阻断清道夫受体,可明显增强LPS对肺泡巨噬细胞TNF的诱导生成作用。给SR基因敲除小鼠注射LPS后,血中TNFα水平明显升高,小鼠死亡率显著增加[4]。因此,内毒素肺损伤过程中,肺泡巨噬细胞表面SR表达下调、CD14表达上调可能是促使肺泡巨噬细胞由防御细胞逐步转化为效应细胞的重要机制之一。
, 百拇医药
相关分析显示,内毒素肺损伤过程中,各内毒素剂量组SR与CD14的表达变化有显著性负相关,说明这两种受体之间可能存在一定的内在联系。我们推测内毒素致伤后,LPS可能首先通过CD14依赖途径激活局部或循环血中炎性细胞释放炎性介质,这些介质或其中某种介质对CD14自身表达起正调控作用,而对SR的表达起负调控作用。Hsu[7]通过实验证实TNF可以抑制清道夫受体基因的转录、蛋白表达及其与配体的结合活性,因而TNF可能就是具有这种双向调控作用的最重要的始动介质。
研究结果还显示,注射内毒素后肺组织水肿程度、肺组织病理改变及动物死亡率也与肺泡巨噬细胞表面SR、CD14表达变化呈明显的平行关系。说明随着这两种受体的表达变化,肺泡巨噬细胞吞噬防御功能减弱,致炎作用增强,造成局部炎症反应失控,进而引起急性肺损伤,甚或ARDS。对创伤或感染时这两种受体表达变化规律认识的不断深入,有助于阐明创伤后免疫机能紊乱的受体机制,可为临床治疗急性肺损伤、ARDS提供一种新的认识途径。
, 百拇医药
由于肺泡巨噬细胞表面CD14表达上调并未随着内毒素剂量的增加而增多,但不同内毒素剂量组之间动物肺损伤及死亡率却存在差异显著,提示在大剂量内毒素作用时,体内可能还存在其它低亲和力内毒素受体途径[9]。
基金项目:国家自然科学基金资助项目(38970833);全军医药卫生杰出中青年基金资助项目
作者简介:陈永华(1969-),男,河南省驻马店市人,硕士,主治医师,主要从事创伤性休克方面的研究。电话:(023)68757434
陈永华(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
蒋建新(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
谢国旗(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
, 百拇医药
刘大维(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
周继红(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
朱佩芳(第三军医大学附属大坪医院野战外科研究所第四研究室,重庆 400042)
参考文献
[1] Fenton M J, Golenbock D T. LPS-binding proteins and receptors[J]. J Leukoc Biol,1998,64(1):25-32.
[2] Suruki H, Kurihara Y, Takeya M, et al. A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection[J]. Nature,1997,386(6 622):292-296.
, http://www.100md.com
[3] 蒋建新.LBP/CD14系统及其与内毒素作用的关系[J].生理科学进展,1997,28(3):286-288.
[4] Gordon S. Macrophage-restricted molecules:role in differentiation and activation[J]. Immunol Lett,1999,65(1-2):5-8.
[5] Fearns C, Kravchenko V V, Ulevitch R J, et al. Murine CD14 gene expression in vivo: extramyeloid synthesis and regulation by lipopolysaccharide[J]. J Exp Med,1995,181(3):857-866.
[6] Mendez C, Ronald V. Scavenger receptor blockade augments LPS-induced TNF production by alveolar macrophages[J]. Surgi Forum,1995,46(1):41-44.
, http://www.100md.com
[7] Hsu H Y, Nicholson A C, Hajjar D P. Inhibition of macrophage scavenger receptor activity by tumor necrosis factor-α is transcriptionally and post-transcriptionally regulated[J]. J Biol Chem,1996,271(13):7 767-7 773.
[8] Takakuwa T, Kmorf H, Sing A, et al. Induction of CD14 expression in Lpsm, Lpsd and tumor necrosis factor receptro-defficient mice[J]. Eur J Immunol,1996,26(11):2 686-2 692.
[9] Malhotra R, Bird M. L-selectin: a novel receptor for lipopolysaccharide and its potential role in bacterial sepsis[J]. Bioessays,1997,19(10):919-923., http://www.100md.com