小鼠胚胎分泌生长因子的量与胚胎质量的关系
小鼠胚胎分泌生长因子的量与胚胎质量的关系
李真 顾美礼 王智彪 胡凯 艾玲 杜永洪
摘 要: 目的 研究小鼠胚胎培养过程中分泌表皮生长因子(Epidermal growth factor,EGF)、转化生长因子-β1(Transforming growth factor-β1,TGF-β1)、胰岛素样生长因子-Ⅱ(Insulin-like growth factor-Ⅱ,IGF-Ⅱ)的量与胚胎质量的关系。方法 取小鼠二细胞胚胎,分为正常和异常(超声照射)两组,体外培养至囊胚期,对胚胎的形态学指标进行观测;检测胚胎培养液中3种生长因子的含量并进行比较。结果 ①正常组胚胎培养液中EGF、IGF-Ⅱ的含量显著高于异常组,且EGF含量与胚胎生长发育的形态学指标呈正相关,但与着床指标相关无显著性;IGF-Ⅱ与胚胎生长发育及着床指标均呈正相关。②TGF-β1的含量两组间差异无显著性。结论 胚胎培养液中EGF、IGF-Ⅱ含量测定可反映胚胎生长发育能力,IGF-Ⅱ还可反映胚胎着床能力,从而有利于了解胚胎功能状态及生存潜力,为胚胎质量的检测提供了一条新的思路。
, http://www.100md.com
关键词:生长因子;胚胎;功能;小鼠
在胚胎生长发育及着床过程中, 除激素外还有许多生物活性物质参与调控,其中生长因子的作用倍受关注。研究显示胚胎能以自分泌及/或旁分泌的方式产生生长因子,促进其生长发育及母-胎间信息交流[1~4]。据此,本试验选择与胚胎生长发育及着床有关的具有代表性的3种生长因子[表皮生长因子(Epidermal growth factor,EGF)、转化生长因子-β1(Transfor-ming growth factor β1,TGF-β1)、胰岛素样生长因子-Ⅱ(Insulin growth factor Ⅱ,IGF-Ⅱ)]作为研究对象,以小鼠胚胎体外培养系统为模型,用超声波照射胚胎,使其生长发育及着床能力受到损害[5],以此作为异常胚胎,比较正常与异常胚胎分泌上述生长因子的量,以研究胚胎质量与其分泌生长因子的关系,了解胚胎分泌生长因子的量能否反映胚胎质量,从而为胚胎质量的检测提供一条新的思路。
, 百拇医药
1 材料与方法
1.1 材料 ICR系实验小白鼠购自上海西普尔—必凯实验动物有限公司,饲养温度20~25 ℃,自动摄食和饮水,昼夜自然光照。Ham′S F-12培养液购自美国Sigma公司;125I-EGF放射免疫分析试剂盒购自中国原子能科学研究院;125I-IGF-Ⅱ放射免疫分析试剂盒及TGF-β1 ELSIA试剂盒购自天津四方化工有限公司。
1.2 方法
8~10周雌鼠经孕马血清+绒毛膜促性腺激素(hCG)促排卵后以雌∶雄=2∶1合笼,次晨查见阴栓为妊娠第1天。于注射hCG后48~50 h取二细胞胚,将其分为A、B两组,A组:正常胚胎;B组:异常胚胎,即经超声波照射的胚胎(用JC-A型超声治疗仪,以0.8 MHz,40 W/cm2,连续波照射5 s)。两组胚胎均置于96孔细胞培养板中,30/孔,每孔为一个样本,每组各50个样本,在37 ℃,5%CO2条件下培养,每24 h换液1/2,收集胚胎培养液,-20 ℃保存待测量;培养72 h后在倒置显微镜下计数发育至桑椹胚的胚胎数,并进行形态学评分(标准见参考文献[6]),算出每孔累积胚胎评分(Cumulative embryo score,CES=每孔胚胎的平均得分×发育至桑椹胚的胚胎数)。胚胎继续培养48 h,观察并记录每孔胚胎脱带率、贴附率、滋养细胞外延生长率[7]。用放射免疫法测各样本胚胎培养液中EGF、IGF-Ⅱ的含量,用酶联免疫法测TGF-β1含量。
, http://www.100md.com
1.3 统计学分析
结果以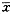 ±s表示,用t检验、χ2检验对两组胚胎质量的形态学指标及各生长因子含量进行比较;对各生长因子含量与胚胎质量的形态学指标进行直线回归的相关性检验,因目前尚无小鼠各生长因子的定量标准品,批间误差较难控制,故仅对同批的实验结果进行统计学分析。
±s表示,用t检验、χ2检验对两组胚胎质量的形态学指标及各生长因子含量进行比较;对各生长因子含量与胚胎质量的形态学指标进行直线回归的相关性检验,因目前尚无小鼠各生长因子的定量标准品,批间误差较难控制,故仅对同批的实验结果进行统计学分析。
2 结果
2.1 两组胚胎质量的形态学指标比较
两组胚胎的平均形态学评分、平均每孔发育至桑椹胚的胚胎数、平均累积胚胎评分(CES)、胚胎脱带率、胚胎贴附率、滋养细胞外延生长率结果分别见表1、2。
, 百拇医药
表1 两组胚胎的形态学指标
Tab 1 Morphological indexes of the embryo in two groups
Group
Number of embryos
/hole
Average morphol
ogical score/hole
Numbers of morula
/hole
CES
, http://www.100md.com
A
30
2.23±0.8*
13.52±2.52*
30.15±4.66*
B
30
1.17±0.43
5.17±1.61
6.05±2.21
*:P<0.01 vs B group
, 百拇医药
表2 两组胚胎脱带率、贴附率及外延生长率
Tab 2 The hatching rate, attachment rate and outgrowth rate in two groups
Hatching rate
Outgrowth rate
Attachment rate
Group
Number
Percentage(%)
Number
Precentage(%)
, http://www.100md.com
Number
Percentage(%)
A
6.78±1.10
22.60±4.33*
5.42±0.82
18.07±4.62*
5.73±0.74
19.10±5.32*
B
2.33±0.78
, http://www.100md.com
7.77±1.23
1.78±0.52
5.93±0.95
2.17±0.63
7.23±1.69
*:P<0.01 vs B group
2.2 胚胎培养液中生长因子含量测定结果
A、B两组胚胎培养液中各生长因子含量测定结果见表3。
表3 两组胚胎培养液中各生长因子含量
Tab 3 The level of growth factor in the culture media intwo groups(ρB/ng.ml-1)
, 百拇医药
Group
EGF
TGF-β1
IGF-Ⅱ
A
183.25±33.6*
134.69±42.7
2.99±0.68*
B
95.84±23.3
112.07±38.9
, http://www.100md.com 1.52±0.23
*:P<0.01 vs B group
2.3 生长因子分泌量与胚胎质量形态学指标的相关性分析
分别以A组胚胎培养液中EGF、IGF-Ⅱ含量为自变量X,每孔累积胚胎评分(CES)、胚胎贴附率为应变量Y进行直线回归相关性检验,结果EGF含量与CES呈正相关,与胚胎贴附率不相关,表明EGF测定能够反映胚胎生长发育状况,但不能反映胚胎着床能力。IGF-Ⅱ含量与CES、胚胎贴附率均呈正相关,表明IGF-Ⅱ含量测定可反映胚胎生长发育及着床能力。
3 讨论
3.1 生长因子在胚胎生长发育及着床过程中的作用
哺乳动物着床前及围着床期胚胎的生长发育及着床受诸多因素的调控,大量的研究显示多种生长因子在此过程中起重要作用:①着床前胚胎能表达多种生长因子及其受体的mRNA及蛋白,并能在胚胎培养液中检测到某些生长因子。②在胚胎培养液中加入生长因子(如EGF、IGF-Ⅰ、IGF-Ⅱ、TGF-α、TGF-β1、PAF等),能显著促进胚胎细胞的增生与分化。③在胚胎培养液中加入抗生长因子抗体或受体抑制剂,能阻断上述作用。④用基因重组技术阻断生长因子引起细胞增殖、分化的信号传导通路,可消除生长因子对胚胎生长发育的促进作用;激活该通路,则该作用得以恢复。上述试验结果表明着床前胚胎能产生、分泌多种生长因子,以自分泌的方式促进其生长发育[1~3]。此外,围着床期胚胎及子宫内膜,尤其是两者的接触部位有多种生长因子存在,EGF、TGF-α能促进滋养细胞增生;胚胎滋养细胞及子宫蜕膜细胞产生的生长因子(如IGF-Ⅱ、IGFBP-1)能以自分泌或旁分泌的方式促进滋养细胞的迁移与侵润;TGF-β则抑制滋养细胞的增殖、迁移与侵润;胚胎培养液中加入EGF、TGF-α、PDGF、FGF等能诱导子宫内膜蜕膜样变,从而提高子宫内膜对胚胎的接受性 。上述试验表明,胚胎产生的生长因子在增加子宫内膜接受性、启动胚胎与子宫内膜贴附、促进滋养细胞迁移、侵入子宫内膜等胚胎着床过程中起重要作用[4]。
, 百拇医药
3.2 胚胎质量与其生长因子分泌功能的关系
胚胎质量的检测是IVF-ET技术中不可或缺的步骤,目前常规采用的是形态学指标[6,7]。本研究以国内外常用的形态学指标为胚胎质量的评价标准,对A、B两组胚胎质量进行比较,结果显示:①胚胎经超声波照射后其生长发育及着床能力受到明显损害,即B组胚胎质量显著差于A组,从而为研究胚胎分泌生长因子的量与胚胎质量的关系提供了良好的实验模型。②A组胚胎培养液中EGF、IGF-Ⅱ的含量显著高于B组,且EGF含量与胚胎生长发育的形态学指标呈正相关,但与着床指标相关不显著;IGF-Ⅱ与胚胎生长发育、着床指标均呈正相关,表明胚胎培养中EGF、IGF-Ⅱ含量测定可反映胚胎生长发育能力,IGF-Ⅱ还可反映胚胎着床能力。③A组胚胎培养液中TGF-β1的含量虽高于B组,但统计学比较差异无显著性,由于影响生长因子分泌量的因素较多,且该结果还受测试方法的影响,因此,胚胎质量对其表达、分泌TGF-β1的影响尚需进一步研究。
, 百拇医药
作者简介:李真(1963-),女,云南省昆明市人,博士,主治医师,主要从事胎儿学方面的研究。电话:(023)68755114-74612
李真(第三军医大学附属新桥医院妇产科,重庆 400037)
顾美礼(重庆医科大学第二临床学院医院妇产科,重庆 400010)
王智彪(重庆医科大学医学超声工程研究所,重庆 400046)
胡凯(重庆医科大学医学超声工程研究所,重庆 400046)
艾玲(重庆医科大学医学超声工程研究所,重庆 400046)
杜永洪(重庆医科大学医学超声工程研究所,重庆 400046)
参考文献
, 百拇医药
[1] O′Neill C. Evidence for the requirement of autocrine growth factors for development of mouse preimplantation embryos in vitro[J]. Biol Reprod,1997,56(2):229-237.
[2] Teruel M, Smith R. Effect of embryo density and growth factors on in vitro preimplantation development of mouse embryos[J]. Acta Physiol Pharmacol Ther Latinoam,1997,47(1):87-96.
[3] Liu H C, He Z Y, Mele C A, et al. Human endometrial stromal cells improve embryo quality by enhancing the expression of insulin-like growth factors and their receptors in cocultured human preimplantation embryos[J]. Fertil Steril,1999,71(2):361-367.
, 百拇医药
[4] Simon C, Moreno C, Romohi J, et al. Molecular interactions between embryo and uterus in the adhesion phase of human implantation[J]. Hum Reprod,1998,13(Suppl 3):219-232.
[5] 于廷和,王智彪,蔡汉忠.超声波对胚胎组织的生物学效应[J].中国超声医学杂志,1997,13(1):58-60.
[6] 张丽珠,魏志新,刘 平,等.体外受精—胚胎移植中影响临床妊娠的因素[J].中华妇产科杂志,1998,33(12):727-730.
[7] 李 真,王智彪,顾美礼.胚胎着床体外培养模型的研究进展[J].国外医学:计划生育分册,1998,17(2):67-69., 百拇医药
李真 顾美礼 王智彪 胡凯 艾玲 杜永洪
摘 要: 目的 研究小鼠胚胎培养过程中分泌表皮生长因子(Epidermal growth factor,EGF)、转化生长因子-β1(Transforming growth factor-β1,TGF-β1)、胰岛素样生长因子-Ⅱ(Insulin-like growth factor-Ⅱ,IGF-Ⅱ)的量与胚胎质量的关系。方法 取小鼠二细胞胚胎,分为正常和异常(超声照射)两组,体外培养至囊胚期,对胚胎的形态学指标进行观测;检测胚胎培养液中3种生长因子的含量并进行比较。结果 ①正常组胚胎培养液中EGF、IGF-Ⅱ的含量显著高于异常组,且EGF含量与胚胎生长发育的形态学指标呈正相关,但与着床指标相关无显著性;IGF-Ⅱ与胚胎生长发育及着床指标均呈正相关。②TGF-β1的含量两组间差异无显著性。结论 胚胎培养液中EGF、IGF-Ⅱ含量测定可反映胚胎生长发育能力,IGF-Ⅱ还可反映胚胎着床能力,从而有利于了解胚胎功能状态及生存潜力,为胚胎质量的检测提供了一条新的思路。
, http://www.100md.com
关键词:生长因子;胚胎;功能;小鼠
在胚胎生长发育及着床过程中, 除激素外还有许多生物活性物质参与调控,其中生长因子的作用倍受关注。研究显示胚胎能以自分泌及/或旁分泌的方式产生生长因子,促进其生长发育及母-胎间信息交流[1~4]。据此,本试验选择与胚胎生长发育及着床有关的具有代表性的3种生长因子[表皮生长因子(Epidermal growth factor,EGF)、转化生长因子-β1(Transfor-ming growth factor β1,TGF-β1)、胰岛素样生长因子-Ⅱ(Insulin growth factor Ⅱ,IGF-Ⅱ)]作为研究对象,以小鼠胚胎体外培养系统为模型,用超声波照射胚胎,使其生长发育及着床能力受到损害[5],以此作为异常胚胎,比较正常与异常胚胎分泌上述生长因子的量,以研究胚胎质量与其分泌生长因子的关系,了解胚胎分泌生长因子的量能否反映胚胎质量,从而为胚胎质量的检测提供一条新的思路。
, 百拇医药
1 材料与方法
1.1 材料 ICR系实验小白鼠购自上海西普尔—必凯实验动物有限公司,饲养温度20~25 ℃,自动摄食和饮水,昼夜自然光照。Ham′S F-12培养液购自美国Sigma公司;125I-EGF放射免疫分析试剂盒购自中国原子能科学研究院;125I-IGF-Ⅱ放射免疫分析试剂盒及TGF-β1 ELSIA试剂盒购自天津四方化工有限公司。
1.2 方法
8~10周雌鼠经孕马血清+绒毛膜促性腺激素(hCG)促排卵后以雌∶雄=2∶1合笼,次晨查见阴栓为妊娠第1天。于注射hCG后48~50 h取二细胞胚,将其分为A、B两组,A组:正常胚胎;B组:异常胚胎,即经超声波照射的胚胎(用JC-A型超声治疗仪,以0.8 MHz,40 W/cm2,连续波照射5 s)。两组胚胎均置于96孔细胞培养板中,30/孔,每孔为一个样本,每组各50个样本,在37 ℃,5%CO2条件下培养,每24 h换液1/2,收集胚胎培养液,-20 ℃保存待测量;培养72 h后在倒置显微镜下计数发育至桑椹胚的胚胎数,并进行形态学评分(标准见参考文献[6]),算出每孔累积胚胎评分(Cumulative embryo score,CES=每孔胚胎的平均得分×发育至桑椹胚的胚胎数)。胚胎继续培养48 h,观察并记录每孔胚胎脱带率、贴附率、滋养细胞外延生长率[7]。用放射免疫法测各样本胚胎培养液中EGF、IGF-Ⅱ的含量,用酶联免疫法测TGF-β1含量。
, http://www.100md.com
1.3 统计学分析
结果以
2 结果
2.1 两组胚胎质量的形态学指标比较
两组胚胎的平均形态学评分、平均每孔发育至桑椹胚的胚胎数、平均累积胚胎评分(CES)、胚胎脱带率、胚胎贴附率、滋养细胞外延生长率结果分别见表1、2。
, 百拇医药
表1 两组胚胎的形态学指标
Tab 1 Morphological indexes of the embryo in two groups
Group
Number of embryos
/hole
Average morphol
ogical score/hole
Numbers of morula
/hole
CES
, http://www.100md.com
A
30
2.23±0.8*
13.52±2.52*
30.15±4.66*
B
30
1.17±0.43
5.17±1.61
6.05±2.21
*:P<0.01 vs B group
, 百拇医药
表2 两组胚胎脱带率、贴附率及外延生长率
Tab 2 The hatching rate, attachment rate and outgrowth rate in two groups
Hatching rate
Outgrowth rate
Attachment rate
Group
Number
Percentage(%)
Number
Precentage(%)
, http://www.100md.com
Number
Percentage(%)
A
6.78±1.10
22.60±4.33*
5.42±0.82
18.07±4.62*
5.73±0.74
19.10±5.32*
B
2.33±0.78
, http://www.100md.com
7.77±1.23
1.78±0.52
5.93±0.95
2.17±0.63
7.23±1.69
*:P<0.01 vs B group
2.2 胚胎培养液中生长因子含量测定结果
A、B两组胚胎培养液中各生长因子含量测定结果见表3。
表3 两组胚胎培养液中各生长因子含量
Tab 3 The level of growth factor in the culture media intwo groups(ρB/ng.ml-1)
, 百拇医药
Group
EGF
TGF-β1
IGF-Ⅱ
A
183.25±33.6*
134.69±42.7
2.99±0.68*
B
95.84±23.3
112.07±38.9
, http://www.100md.com 1.52±0.23
*:P<0.01 vs B group
2.3 生长因子分泌量与胚胎质量形态学指标的相关性分析
分别以A组胚胎培养液中EGF、IGF-Ⅱ含量为自变量X,每孔累积胚胎评分(CES)、胚胎贴附率为应变量Y进行直线回归相关性检验,结果EGF含量与CES呈正相关,与胚胎贴附率不相关,表明EGF测定能够反映胚胎生长发育状况,但不能反映胚胎着床能力。IGF-Ⅱ含量与CES、胚胎贴附率均呈正相关,表明IGF-Ⅱ含量测定可反映胚胎生长发育及着床能力。
3 讨论
3.1 生长因子在胚胎生长发育及着床过程中的作用
哺乳动物着床前及围着床期胚胎的生长发育及着床受诸多因素的调控,大量的研究显示多种生长因子在此过程中起重要作用:①着床前胚胎能表达多种生长因子及其受体的mRNA及蛋白,并能在胚胎培养液中检测到某些生长因子。②在胚胎培养液中加入生长因子(如EGF、IGF-Ⅰ、IGF-Ⅱ、TGF-α、TGF-β1、PAF等),能显著促进胚胎细胞的增生与分化。③在胚胎培养液中加入抗生长因子抗体或受体抑制剂,能阻断上述作用。④用基因重组技术阻断生长因子引起细胞增殖、分化的信号传导通路,可消除生长因子对胚胎生长发育的促进作用;激活该通路,则该作用得以恢复。上述试验结果表明着床前胚胎能产生、分泌多种生长因子,以自分泌的方式促进其生长发育[1~3]。此外,围着床期胚胎及子宫内膜,尤其是两者的接触部位有多种生长因子存在,EGF、TGF-α能促进滋养细胞增生;胚胎滋养细胞及子宫蜕膜细胞产生的生长因子(如IGF-Ⅱ、IGFBP-1)能以自分泌或旁分泌的方式促进滋养细胞的迁移与侵润;TGF-β则抑制滋养细胞的增殖、迁移与侵润;胚胎培养液中加入EGF、TGF-α、PDGF、FGF等能诱导子宫内膜蜕膜样变,从而提高子宫内膜对胚胎的接受性 。上述试验表明,胚胎产生的生长因子在增加子宫内膜接受性、启动胚胎与子宫内膜贴附、促进滋养细胞迁移、侵入子宫内膜等胚胎着床过程中起重要作用[4]。
, 百拇医药
3.2 胚胎质量与其生长因子分泌功能的关系
胚胎质量的检测是IVF-ET技术中不可或缺的步骤,目前常规采用的是形态学指标[6,7]。本研究以国内外常用的形态学指标为胚胎质量的评价标准,对A、B两组胚胎质量进行比较,结果显示:①胚胎经超声波照射后其生长发育及着床能力受到明显损害,即B组胚胎质量显著差于A组,从而为研究胚胎分泌生长因子的量与胚胎质量的关系提供了良好的实验模型。②A组胚胎培养液中EGF、IGF-Ⅱ的含量显著高于B组,且EGF含量与胚胎生长发育的形态学指标呈正相关,但与着床指标相关不显著;IGF-Ⅱ与胚胎生长发育、着床指标均呈正相关,表明胚胎培养中EGF、IGF-Ⅱ含量测定可反映胚胎生长发育能力,IGF-Ⅱ还可反映胚胎着床能力。③A组胚胎培养液中TGF-β1的含量虽高于B组,但统计学比较差异无显著性,由于影响生长因子分泌量的因素较多,且该结果还受测试方法的影响,因此,胚胎质量对其表达、分泌TGF-β1的影响尚需进一步研究。
, 百拇医药
作者简介:李真(1963-),女,云南省昆明市人,博士,主治医师,主要从事胎儿学方面的研究。电话:(023)68755114-74612
李真(第三军医大学附属新桥医院妇产科,重庆 400037)
顾美礼(重庆医科大学第二临床学院医院妇产科,重庆 400010)
王智彪(重庆医科大学医学超声工程研究所,重庆 400046)
胡凯(重庆医科大学医学超声工程研究所,重庆 400046)
艾玲(重庆医科大学医学超声工程研究所,重庆 400046)
杜永洪(重庆医科大学医学超声工程研究所,重庆 400046)
参考文献
, 百拇医药
[1] O′Neill C. Evidence for the requirement of autocrine growth factors for development of mouse preimplantation embryos in vitro[J]. Biol Reprod,1997,56(2):229-237.
[2] Teruel M, Smith R. Effect of embryo density and growth factors on in vitro preimplantation development of mouse embryos[J]. Acta Physiol Pharmacol Ther Latinoam,1997,47(1):87-96.
[3] Liu H C, He Z Y, Mele C A, et al. Human endometrial stromal cells improve embryo quality by enhancing the expression of insulin-like growth factors and their receptors in cocultured human preimplantation embryos[J]. Fertil Steril,1999,71(2):361-367.
, 百拇医药
[4] Simon C, Moreno C, Romohi J, et al. Molecular interactions between embryo and uterus in the adhesion phase of human implantation[J]. Hum Reprod,1998,13(Suppl 3):219-232.
[5] 于廷和,王智彪,蔡汉忠.超声波对胚胎组织的生物学效应[J].中国超声医学杂志,1997,13(1):58-60.
[6] 张丽珠,魏志新,刘 平,等.体外受精—胚胎移植中影响临床妊娠的因素[J].中华妇产科杂志,1998,33(12):727-730.
[7] 李 真,王智彪,顾美礼.胚胎着床体外培养模型的研究进展[J].国外医学:计划生育分册,1998,17(2):67-69., 百拇医药