钠氢交换体及其抑制物在急性肺损伤中的作用
作者:廖秀玉 林建东 刘宁 陈小莉 王先奉 林松元
单位:福建医科大学附 属第一医院,福州 350005
关键词:钠氢交换体;急性肺损伤;细胞因子
中国急救医学001103 [摘 要] 目的 探讨钠氢交换体及其抑制物在急性肺损伤中的作用。方法 应用内毒素(LPS,5 mg/kg)复制大鼠急性肺损伤模型。将21只SD大 鼠随机分成三组:正常对照组(NS组);内毒素组(LPS组);LPS+DMA组(L&D组),该组以钠氢 交换体抑制物DMA(5 mg/kg)预处理。大鼠均于5小时后处死。然后测定各组的肺系数(LI)及 血浆和支气管肺泡灌洗液(BALF)中的TNF、ET-1、NO的浓度变化。结果 L&D组肺系数及血浆和BALF中的TNF、ET-1、NO浓度的增加,均明显低于LPS组(P <0. 01)。结论 NHE抑制物对急性肺损伤具有保护作用,NHE确实参与了 急性肺损伤的形成。探讨钠氢交换体及其抑制物在急性肺损伤中的作用。方法 应用内毒素(LPS,5 mg/kg)复制大鼠急性肺损伤模型。将21只SD大 鼠随机分成三组:正常对照组(NS组);内毒素组(LPS组);LPS+DMA组(L&D组),该组以钠氢 交换体抑制物DMA(5 mg/kg)预处理。大鼠均于5小时后处死。然后测定各组的肺系数(LI)及 血浆和支气管肺泡灌洗液(BALF)中的TNF、ET-1、NO的浓度变化。结果 L&D组肺系数及血浆和BALF中的TNF、ET-1、NO浓度的增加,均明显低于LPS组(P <0. 01)。结论 NHE抑制物对急性肺损伤具有保护作用,NHE确实参与了 急性肺损伤的形成。
, 百拇医药
[中图分类号] R 563 [文献标识码] A [文章编号] 1002-1949(2000)11-0634-03
Effect of NHE and its inhibitor in acute lung injury
LIAO Xiu-yu,LIN jian-dong,LIU Ning
(The First Affiliated Hospital of the Fu jian Medical University,Fuzhou 350005, China)
[Abstract] Objective To investigate the effect of NHE and its inhib itor in acute lung injury.Methods Used Lipopolysaceharide(L PS,5 mg/kg)to reproduct the model of acute lung injury in rats.Twenty-one adult SD rats (170~230 g)were divided averagely into three group as follow:control gr o up;LPS group;DMA pretreative group.After five hours,killed the rats all.And then ,calculated the lung index,and detected the concentration of TNF、ET-1 and NO in the blood and the bronchealveolar lavage fluid(BALF).Result Compared with the LPS group,elevation of the LI and the concentration of the c ytokines(such as TNF、ET-1 and NO)in the blood and the BALF was eventurely less in the DMA pretreative group(P<0.01).Conclusion The N HE i nhibitor can protect acute lung injury,and NHE involves in acute lung injury exa ctly.
, 百拇医药
[Key words] NHE; Acute lung injury; Cytokines
成人呼吸窘迫综合征(ARDS)是临床较常见的、致死率极高的危重症,病死率至今高达50%。 现已知ARDS的病因虽多,但其引起的肺损伤是完全一致的,是肺泡毛细血管膜损伤及炎症介 质的作用,是过度的炎症反应。钠氢交换体(NHE)是一族涉及许多生理过程的膜转运蛋白。 最近的研究表明,NHE在细胞损伤中起着重要的作用。本研究采用内毒素复制急性肺损伤模 型,通过测定使用NHE抑制物二甲基阿米洛利得(dimethylamiloride,DMA)后炎症介质浓度 的不同,来探讨NHE及其抑制物在急性肺损伤中的作用。
1 材料和方法
1.1 实验动物分组
普通级大鼠21只,体重170~230 g(由南京军区神州总院动物科提供)。将动物随机等分成3 组,即正常对照组(NS组)、内毒素组(LPS组)以及LPS+DMA组(L&D)组。
, http://www.100md.com
1.2 实验方法
用2%氯胺酮(10 mg/100 g)给大鼠腹腔注射,麻醉后仰卧位固定,颈前常规无菌消毒,经正 中切口暴露右颈动脉、颈静脉,用BD22号留置针动、静脉穿刺置管,用肝素帽封闭,供实验 中静脉注射用,及实验后动脉放血用。完成上述操作后,平稳30分钟开始进行实验。先给 予L&D组静脉注射DMA(5 mg/kg)约0.5 ml,1小时后静脉注射LPS(5 mg/kg)约0.5 ml,并且 分别给其它两组注射NS约0.5 ml或LPS(5 mg/kg)约0.5 ml,5小时后处死动物,采集标本 备测。
1.3 观察指标及方法
1.3.1 肺系数(LI)测定 将实验结束动物动脉放血快速处死,迅速取出全肺,剔净邻近 脏器组织,用滤纸吸净肺表面的血渍。气管断端距气管叉处0.3 cm,称肺湿重。肺系数= 肺湿重/体重×100。
, http://www.100md.com
1.3.2 血浆和支气管肺泡灌洗液(BALF)中ET-1浓度测定 在动物动脉放血处死时,同时 取血2 ml放入0.5 mmol/L EDTA 30 μl和抑肽酶40 μl的试管中摇匀,于4℃下离心(3 000 r/min)20分钟,吸取血浆0.5 ml于-20℃下保存待测,BALF标本处理相同。ET-1放免试剂盒 购自解放军总医院东亚免疫技术研究所。严格按照说明书要求进行操作。
1.3.3 血浆和BALF中TNF浓度测定 标本采样、处理及放免试剂盒购置同ET-1。样本测定 严格按照说明书操作。
1.3.4 血浆和BALF中NO浓度测定 在实验结束时,取动脉血2 ml和BALF 2 ml离心(3 000 r/min)20分钟,吸取血浆0.5 ml和BALF上清液0.5 ml于-20℃下保存待测。
1.4 统计学分析
, http://www.100md.com 本研究测定的计数资料用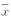 ±s表示样本均数,两两比较用t检验,显著性检 验水平α=0.05,资料计算应用SPSS和Excel 5.0统计软件。
±s表示样本均数,两两比较用t检验,显著性检 验水平α=0.05,资料计算应用SPSS和Excel 5.0统计软件。
2 结果
2.1 肺系数的变化 LPS组与NS组比较,LI明显增加,差异显著(P<0.01)。L&D组与 LPS组比较,LI明显下降,差异显著(P<0.01)。见附表。
附表 各组LI、血浆(BO)和
BALF中ET-1、TNF、NO浓度变化(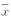 ±s) 组别
±s) 组别
ET-1(pg/ml)
, 百拇医药
TNF(ng/ml)
NO(mol/L)
LI
NS组
BO
49.97±19.90
5.06±1.37
198.00±25.88
0.51 ±0.003
BALF------
LPS组
BO
, 百拇医药
341.00±49.10*
11.10±2.96
278.91±45. 69#
1.2±0.16*
BALF
60.74±18.68
4.61±0.92
89.46±16.9
L&D组
BO
176.51±24.24△
, http://www.100md.com
7.03±1.60△
208.90±42.4 5△
0.6±0.09△
BALF
36.85±12.2△
3.36±0.53△
65.43±22.07△
*与NS组比较P<0.01;△与LPS组比较P<0.01;#与NS组比较P<0.05
2.2 血浆和BALF中ET-1浓度的变化
, http://www.100md.com
2.2.1 注射LPS后,动物血浆中的ET-1明显增加,与NS组比较差异显著(P<0.01)。 L&D组与LPS组比较,血浆中的ET-1浓度明显减少,差异显著(P<0.01)。见附表。
2.2.2 NS组BALF中的ET-1浓度低于本实验检测最小检出值,故未测出。L&D组与LPS组比 较,BALF中的ET-1明显减少,差异显著(P<0.01),见附表。
2.3 血浆和BALF中TNF浓度的变化
2.3.1 注射LPS后,动物血浆中TNF较NS组明显升高,差异显著(P<0.01)。L&D组与 LPS组比较,血浆TNF浓度明显下降,差异显著(P<0.01)。见附表。
2.3.2 本实验所用药盒无法检出NS组BALF中的TNF浓度。L&D组与LPS组BALF中TNF浓度相 比较明显下降,差异显著(P<0.01),见附表。
, 百拇医药
2.4 血浆和BALF中的NO浓度的变化
2.4.1 动物注射LPS后,LPS组血浆中NO浓度较NS组有明显增加,差异显著(P<0.05 )。L&D组与LPS组比较,血浆中NO浓度明显减小,差异显著(P<0.01)。见附表。
2.4.2 NS组BALF中NO浓度无法检出。L&D组与LPS组相比较,BALF中NO浓度明显下降, 差异显著(P<0.01),见附表。
3 讨论
自从1967年美国Ashbaugh和Petty首先提出“成人呼吸窘迫综合征”以来,人们在不断地探 讨着其发生机制及治疗方法,虽然已有了较大的进展,但仍然不够全面。目前许多学者认为,许多递质参与了肺泡——毛细血管内皮的损伤过程,其中以中性粒细胞(PMN)的激活为主 要原因,其释放的细胞因子、氧自由基、脂类介质、水解酶等,损害了内皮细胞和肺组织, 引起肺损伤。1985年Goris[1]也提出,感染、创伤引起的成人呼吸窘迫综合征等 器官功能障碍并非是细菌、毒素或组织损伤的直接结果,而是机体反应的结果。可见炎症反 应在成人呼吸窘迫综合征中起着极其重要的作用。
, http://www.100md.com
近来的实验证明,内毒素并不直接损伤组织,它是通过机体产生一种或多种内源性介质起作 用的。Chang等[2]报道,一次性注射2 mg/kg LPS,30分钟后即可发生肺损伤。本 研究采用的LPS剂量为5 mg/kg,成功复制了急性肺损伤模型。
TNF是由巨噬细胞系产生的。以往一般仅注意其抗肿瘤作用。但近来学者认为,它是一种传 递急性时相反应信号的重要介质,是细胞损伤和增殖的作用分子。细胞因子TNF的细胞毒性 作用在ARDS的肺的微血管损伤中起着重要的作用。实验动物注射纯化的TNF,即可产生类似 内毒素休克时的内环境紊乱与广泛组织损伤及典型的ARDS病理改变。Ferrari-Baliriera等 认为,TNF是导致早期ARDS肺顺应性下降的重要介质,可能是肺损伤的启动因子[3] 。TNF在炎症反应中起着中心作用,它既可影响炎症反应,使肺高压持续发展,参与急 性肺损伤,又能间接地刺激其它炎症介质的释放,促进粒细胞的游走,而参与急性肺损伤的 病理过程。NO是迄今为止在体内发现的第一个气体性信息分子和效应分子。内毒素等许多体 液性物质均可诱导一氧化氮合酶(NOS)产生大量NO。它作用广泛,参与体内众多的病理生理 过程。过多过长时间的NO生成不仅可造成细胞损伤等场理损害,同时还可以与同时产生的超 氧阴离子(O2-)生成许多衍生物,这些物质多为自由基,可产生细胞毒作用,诱导细胞 凋亡,而对机体造成很大的危害。本研究动物在注射LPS后产生急性肺损伤,其血浆和BALF 中的NO浓度显著升高(P<0.01)。可见NO参与了急性肺损伤。吸入高浓度的NO也可诱导 或加 重肺损伤,进一步证实了NO对肺损伤的作用[4]。ET-1主要是由血管内皮细胞产生 的,是产生肺部病理生理改变的重要介质。LPS和其它炎症介质,如TNF、IL-1,可增加ET-1 从人体气管上皮细胞的释放[5]。ET-1可激活中性粒细胞促进中性粒细胞的聚集, 增强中性粒细胞对内皮细胞的粘附,对血管内皮产生了损害作用,可增加肺循环血管内膜的 通透性,导致肺水肿,产生肺动脉高压,促进了急性肺损伤的形成[6]。本研究的 实验结果表明,L&D组的各参数与LPS组比较均有显著的差异,均为P<0.01。可见DMA 确实能改善LPS的急性肺损伤的作用,能抑制NHE在急性肺损伤中的作用。
, 百拇医药
高效快速的细胞内调节机制对于维持细胞的功能是非常重要的。细胞内pH值的调节是通过几 种不同的机制来完成的,主要包括:Na+/H+交换体(即NHE)、Na+/HCO3-交换体、 Na+/HCO3-/CO32-共同转运体、Cl-/HCO3-交换体及H+-ATP酶。它们 的调节作用是取决于细胞局部代谢状态及环境变化的。其中NHE是在正常情况下最重要的调 节机制,交换效率很高,对维持细胞内pH值的稳定起着重要的作用。在正常的细胞内(pH值7 .0~7.3),NHE是相对失活的,但当细胞内pH值下降至6.7时,其活性可增强10倍[ 7] 。当细胞内pH值下降时,NHE通过钠氢交换使H+离开细胞,而将Na+带入细胞内,使细胞 内 pH值正常化。动物实验证实血管内皮细胞的酸碱主要涉及NHE和NCBE机制。NHE抗细胞损伤作 用已有所研究。Houqe等证实钠氢交换抑制对离体心脏氧化应激导致的功能和代谢损害有明 显的保护作用。维持细胞内环境稳态对预防缺血、缺氧性细胞损伤有着极其重要的作用。急 性肺损伤时顽固的低氧血症,细胞内氧浓度下降,使有氧糖酵解减弱,无氧糖酵解增强,结 果细胞内乳酸等酸性物质堆积,ATP生成减少,细胞内pH值下降激活NHE。同时,急性肺损伤 时产 生的细胞因子ET-1也可进一步激活NHE[8]。NHE的活化可引起一系列的反应,最终 可使细胞内Ca2+超负荷、电稳定性破坏和细胞死亡[9],使急性肺损伤进一 步恶化。本实验结果证实,用NHE抑制剂预处理的动物,肺系数及血流和BALF中的TNF、ET-1 、NO浓度的增加明显低于LPS组,提示NHE抑制剂可较好地减轻急性肺损伤的发生。这提示NH E抑制剂可较好地减轻急性肺损伤的发生。这提示NHE抑制可能成为治疗急性肺损伤的新手段 。NHE抑制物能减弱细胞内Na+超负荷及保存ATP[10],从而使细胞内Ca2+ 超负荷减弱,减少细胞损伤,而对急性肺损伤起保护作用。至于NHE抑制导致炎性因子TNF 、ET-1、NO浓度降低的机制如何有待深入的研究。
, 百拇医药
[作者简介]廖秀玉,女,29岁,主治医师
[参考文献]
[1]Goris RJA,Boekhorst TPA,Nahrinck JKS,et al.Multiple organ failure[J ].Arch Surg,1985,120:1109.
[2]Chan SW,Fernyaks,Voelkel NF.Beneficial effect of a plareler-activati ng factor antagonist.WEB2086,on endotoxin-induced lung injury[J].Am J Physiol, 1990,258(Part 2):H153.
[3]Christopher E,Spooner,Norman P,et al.The role of Tumor Factor in Spe sis[J].Clinical immunology and immunopathology,1992,62(1):11-17.
, 百拇医药
[4]申捷.一氧化氮与肺损伤[J].国外医学麻醉与复苏分册,1998,19:356.
[5]Janakidevik MA,Daves A,Shock AJ,et al.Endothin-1 and endothin-3 indu ce chenotaxis and replication if pulmonary artery fibroblasts[J].AM J Respir C ell Mol Biol,1992,7:492-499.
[6]Halim AN,Kanayama E,EI Maradany K,et al.Activated neutrophil by endo thelin-1 caused tissue damage in human umbilical cord[J].Thormb Res,1995,77:32 1-327.
[7]Kaila K,Vaughan Jones RD.Influence of sodium-hydrogen exchange on in tracellular pH,sodium and tension in sheep cardiac Purkinfe fibres[J].J Ohysio l(Lond),1987,390:93-118.
, 百拇医药
[8]John R,Michad Boaz A,Markerwitz.Endohtelins and the lung[J].AM J R espir Crit Care Med,1996,154:555-582.
[9]Josh Levitsky MD,Daniel Gurell BA,William H,et al.Sodium Ion/Hydroge n Ion e xchange Inhibition:A new pharmacologic approach to myocardial ischemia and reper fusion injury[J].J Clin Pharmacol,1998,38:537-897.
[10]Anderson SE,Murphy E,Steenbergen C,et al.Na-Hexchange in myocardium :effect of hypoxia and acidification on Na and Ca[J].Am J Physiol,1990,259:C94 0-C948.
[收稿:1999-09-13,修回:2000-09-05], http://www.100md.com
单位:福建医科大学附 属第一医院,福州 350005
关键词:钠氢交换体;急性肺损伤;细胞因子
中国急救医学001103 [摘 要] 目的 探讨钠氢交换体及其抑制物在急性肺损伤中的作用。方法 应用内毒素(LPS,5 mg/kg)复制大鼠急性肺损伤模型。将21只SD大 鼠随机分成三组:正常对照组(NS组);内毒素组(LPS组);LPS+DMA组(L&D组),该组以钠氢 交换体抑制物DMA(5 mg/kg)预处理。大鼠均于5小时后处死。然后测定各组的肺系数(LI)及 血浆和支气管肺泡灌洗液(BALF)中的TNF、ET-1、NO的浓度变化。结果 L&D组肺系数及血浆和BALF中的TNF、ET-1、NO浓度的增加,均明显低于LPS组(P <0. 01)。结论 NHE抑制物对急性肺损伤具有保护作用,NHE确实参与了 急性肺损伤的形成。探讨钠氢交换体及其抑制物在急性肺损伤中的作用。方法 应用内毒素(LPS,5 mg/kg)复制大鼠急性肺损伤模型。将21只SD大 鼠随机分成三组:正常对照组(NS组);内毒素组(LPS组);LPS+DMA组(L&D组),该组以钠氢 交换体抑制物DMA(5 mg/kg)预处理。大鼠均于5小时后处死。然后测定各组的肺系数(LI)及 血浆和支气管肺泡灌洗液(BALF)中的TNF、ET-1、NO的浓度变化。结果 L&D组肺系数及血浆和BALF中的TNF、ET-1、NO浓度的增加,均明显低于LPS组(P <0. 01)。结论 NHE抑制物对急性肺损伤具有保护作用,NHE确实参与了 急性肺损伤的形成。
, 百拇医药
[中图分类号] R 563 [文献标识码] A [文章编号] 1002-1949(2000)11-0634-03
Effect of NHE and its inhibitor in acute lung injury
LIAO Xiu-yu,LIN jian-dong,LIU Ning
(The First Affiliated Hospital of the Fu jian Medical University,Fuzhou 350005, China)
[Abstract] Objective To investigate the effect of NHE and its inhib itor in acute lung injury.Methods Used Lipopolysaceharide(L PS,5 mg/kg)to reproduct the model of acute lung injury in rats.Twenty-one adult SD rats (170~230 g)were divided averagely into three group as follow:control gr o up;LPS group;DMA pretreative group.After five hours,killed the rats all.And then ,calculated the lung index,and detected the concentration of TNF、ET-1 and NO in the blood and the bronchealveolar lavage fluid(BALF).Result Compared with the LPS group,elevation of the LI and the concentration of the c ytokines(such as TNF、ET-1 and NO)in the blood and the BALF was eventurely less in the DMA pretreative group(P<0.01).Conclusion The N HE i nhibitor can protect acute lung injury,and NHE involves in acute lung injury exa ctly.
, 百拇医药
[Key words] NHE; Acute lung injury; Cytokines
成人呼吸窘迫综合征(ARDS)是临床较常见的、致死率极高的危重症,病死率至今高达50%。 现已知ARDS的病因虽多,但其引起的肺损伤是完全一致的,是肺泡毛细血管膜损伤及炎症介 质的作用,是过度的炎症反应。钠氢交换体(NHE)是一族涉及许多生理过程的膜转运蛋白。 最近的研究表明,NHE在细胞损伤中起着重要的作用。本研究采用内毒素复制急性肺损伤模 型,通过测定使用NHE抑制物二甲基阿米洛利得(dimethylamiloride,DMA)后炎症介质浓度 的不同,来探讨NHE及其抑制物在急性肺损伤中的作用。
1 材料和方法
1.1 实验动物分组
普通级大鼠21只,体重170~230 g(由南京军区神州总院动物科提供)。将动物随机等分成3 组,即正常对照组(NS组)、内毒素组(LPS组)以及LPS+DMA组(L&D)组。
, http://www.100md.com
1.2 实验方法
用2%氯胺酮(10 mg/100 g)给大鼠腹腔注射,麻醉后仰卧位固定,颈前常规无菌消毒,经正 中切口暴露右颈动脉、颈静脉,用BD22号留置针动、静脉穿刺置管,用肝素帽封闭,供实验 中静脉注射用,及实验后动脉放血用。完成上述操作后,平稳30分钟开始进行实验。先给 予L&D组静脉注射DMA(5 mg/kg)约0.5 ml,1小时后静脉注射LPS(5 mg/kg)约0.5 ml,并且 分别给其它两组注射NS约0.5 ml或LPS(5 mg/kg)约0.5 ml,5小时后处死动物,采集标本 备测。
1.3 观察指标及方法
1.3.1 肺系数(LI)测定 将实验结束动物动脉放血快速处死,迅速取出全肺,剔净邻近 脏器组织,用滤纸吸净肺表面的血渍。气管断端距气管叉处0.3 cm,称肺湿重。肺系数= 肺湿重/体重×100。
, http://www.100md.com
1.3.2 血浆和支气管肺泡灌洗液(BALF)中ET-1浓度测定 在动物动脉放血处死时,同时 取血2 ml放入0.5 mmol/L EDTA 30 μl和抑肽酶40 μl的试管中摇匀,于4℃下离心(3 000 r/min)20分钟,吸取血浆0.5 ml于-20℃下保存待测,BALF标本处理相同。ET-1放免试剂盒 购自解放军总医院东亚免疫技术研究所。严格按照说明书要求进行操作。
1.3.3 血浆和BALF中TNF浓度测定 标本采样、处理及放免试剂盒购置同ET-1。样本测定 严格按照说明书操作。
1.3.4 血浆和BALF中NO浓度测定 在实验结束时,取动脉血2 ml和BALF 2 ml离心(3 000 r/min)20分钟,吸取血浆0.5 ml和BALF上清液0.5 ml于-20℃下保存待测。
1.4 统计学分析
, http://www.100md.com 本研究测定的计数资料用
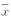 ±s表示样本均数,两两比较用t检验,显著性检 验水平α=0.05,资料计算应用SPSS和Excel 5.0统计软件。
±s表示样本均数,两两比较用t检验,显著性检 验水平α=0.05,资料计算应用SPSS和Excel 5.0统计软件。2 结果
2.1 肺系数的变化 LPS组与NS组比较,LI明显增加,差异显著(P<0.01)。L&D组与 LPS组比较,LI明显下降,差异显著(P<0.01)。见附表。
附表 各组LI、血浆(BO)和
BALF中ET-1、TNF、NO浓度变化(
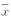 ±s) 组别
±s) 组别ET-1(pg/ml)
, 百拇医药
TNF(ng/ml)
NO(mol/L)
LI
NS组
BO
49.97±19.90
5.06±1.37
198.00±25.88
0.51 ±0.003
BALF------
LPS组
BO
, 百拇医药
341.00±49.10*
11.10±2.96
278.91±45. 69#
1.2±0.16*
BALF
60.74±18.68
4.61±0.92
89.46±16.9
L&D组
BO
176.51±24.24△
, http://www.100md.com
7.03±1.60△
208.90±42.4 5△
0.6±0.09△
BALF
36.85±12.2△
3.36±0.53△
65.43±22.07△
*与NS组比较P<0.01;△与LPS组比较P<0.01;#与NS组比较P<0.05
2.2 血浆和BALF中ET-1浓度的变化
, http://www.100md.com
2.2.1 注射LPS后,动物血浆中的ET-1明显增加,与NS组比较差异显著(P<0.01)。 L&D组与LPS组比较,血浆中的ET-1浓度明显减少,差异显著(P<0.01)。见附表。
2.2.2 NS组BALF中的ET-1浓度低于本实验检测最小检出值,故未测出。L&D组与LPS组比 较,BALF中的ET-1明显减少,差异显著(P<0.01),见附表。
2.3 血浆和BALF中TNF浓度的变化
2.3.1 注射LPS后,动物血浆中TNF较NS组明显升高,差异显著(P<0.01)。L&D组与 LPS组比较,血浆TNF浓度明显下降,差异显著(P<0.01)。见附表。
2.3.2 本实验所用药盒无法检出NS组BALF中的TNF浓度。L&D组与LPS组BALF中TNF浓度相 比较明显下降,差异显著(P<0.01),见附表。
, 百拇医药
2.4 血浆和BALF中的NO浓度的变化
2.4.1 动物注射LPS后,LPS组血浆中NO浓度较NS组有明显增加,差异显著(P<0.05 )。L&D组与LPS组比较,血浆中NO浓度明显减小,差异显著(P<0.01)。见附表。
2.4.2 NS组BALF中NO浓度无法检出。L&D组与LPS组相比较,BALF中NO浓度明显下降, 差异显著(P<0.01),见附表。
3 讨论
自从1967年美国Ashbaugh和Petty首先提出“成人呼吸窘迫综合征”以来,人们在不断地探 讨着其发生机制及治疗方法,虽然已有了较大的进展,但仍然不够全面。目前许多学者认为,许多递质参与了肺泡——毛细血管内皮的损伤过程,其中以中性粒细胞(PMN)的激活为主 要原因,其释放的细胞因子、氧自由基、脂类介质、水解酶等,损害了内皮细胞和肺组织, 引起肺损伤。1985年Goris[1]也提出,感染、创伤引起的成人呼吸窘迫综合征等 器官功能障碍并非是细菌、毒素或组织损伤的直接结果,而是机体反应的结果。可见炎症反 应在成人呼吸窘迫综合征中起着极其重要的作用。
, http://www.100md.com
近来的实验证明,内毒素并不直接损伤组织,它是通过机体产生一种或多种内源性介质起作 用的。Chang等[2]报道,一次性注射2 mg/kg LPS,30分钟后即可发生肺损伤。本 研究采用的LPS剂量为5 mg/kg,成功复制了急性肺损伤模型。
TNF是由巨噬细胞系产生的。以往一般仅注意其抗肿瘤作用。但近来学者认为,它是一种传 递急性时相反应信号的重要介质,是细胞损伤和增殖的作用分子。细胞因子TNF的细胞毒性 作用在ARDS的肺的微血管损伤中起着重要的作用。实验动物注射纯化的TNF,即可产生类似 内毒素休克时的内环境紊乱与广泛组织损伤及典型的ARDS病理改变。Ferrari-Baliriera等 认为,TNF是导致早期ARDS肺顺应性下降的重要介质,可能是肺损伤的启动因子[3] 。TNF在炎症反应中起着中心作用,它既可影响炎症反应,使肺高压持续发展,参与急 性肺损伤,又能间接地刺激其它炎症介质的释放,促进粒细胞的游走,而参与急性肺损伤的 病理过程。NO是迄今为止在体内发现的第一个气体性信息分子和效应分子。内毒素等许多体 液性物质均可诱导一氧化氮合酶(NOS)产生大量NO。它作用广泛,参与体内众多的病理生理 过程。过多过长时间的NO生成不仅可造成细胞损伤等场理损害,同时还可以与同时产生的超 氧阴离子(O2-)生成许多衍生物,这些物质多为自由基,可产生细胞毒作用,诱导细胞 凋亡,而对机体造成很大的危害。本研究动物在注射LPS后产生急性肺损伤,其血浆和BALF 中的NO浓度显著升高(P<0.01)。可见NO参与了急性肺损伤。吸入高浓度的NO也可诱导 或加 重肺损伤,进一步证实了NO对肺损伤的作用[4]。ET-1主要是由血管内皮细胞产生 的,是产生肺部病理生理改变的重要介质。LPS和其它炎症介质,如TNF、IL-1,可增加ET-1 从人体气管上皮细胞的释放[5]。ET-1可激活中性粒细胞促进中性粒细胞的聚集, 增强中性粒细胞对内皮细胞的粘附,对血管内皮产生了损害作用,可增加肺循环血管内膜的 通透性,导致肺水肿,产生肺动脉高压,促进了急性肺损伤的形成[6]。本研究的 实验结果表明,L&D组的各参数与LPS组比较均有显著的差异,均为P<0.01。可见DMA 确实能改善LPS的急性肺损伤的作用,能抑制NHE在急性肺损伤中的作用。
, 百拇医药
高效快速的细胞内调节机制对于维持细胞的功能是非常重要的。细胞内pH值的调节是通过几 种不同的机制来完成的,主要包括:Na+/H+交换体(即NHE)、Na+/HCO3-交换体、 Na+/HCO3-/CO32-共同转运体、Cl-/HCO3-交换体及H+-ATP酶。它们 的调节作用是取决于细胞局部代谢状态及环境变化的。其中NHE是在正常情况下最重要的调 节机制,交换效率很高,对维持细胞内pH值的稳定起着重要的作用。在正常的细胞内(pH值7 .0~7.3),NHE是相对失活的,但当细胞内pH值下降至6.7时,其活性可增强10倍[ 7] 。当细胞内pH值下降时,NHE通过钠氢交换使H+离开细胞,而将Na+带入细胞内,使细胞 内 pH值正常化。动物实验证实血管内皮细胞的酸碱主要涉及NHE和NCBE机制。NHE抗细胞损伤作 用已有所研究。Houqe等证实钠氢交换抑制对离体心脏氧化应激导致的功能和代谢损害有明 显的保护作用。维持细胞内环境稳态对预防缺血、缺氧性细胞损伤有着极其重要的作用。急 性肺损伤时顽固的低氧血症,细胞内氧浓度下降,使有氧糖酵解减弱,无氧糖酵解增强,结 果细胞内乳酸等酸性物质堆积,ATP生成减少,细胞内pH值下降激活NHE。同时,急性肺损伤 时产 生的细胞因子ET-1也可进一步激活NHE[8]。NHE的活化可引起一系列的反应,最终 可使细胞内Ca2+超负荷、电稳定性破坏和细胞死亡[9],使急性肺损伤进一 步恶化。本实验结果证实,用NHE抑制剂预处理的动物,肺系数及血流和BALF中的TNF、ET-1 、NO浓度的增加明显低于LPS组,提示NHE抑制剂可较好地减轻急性肺损伤的发生。这提示NH E抑制剂可较好地减轻急性肺损伤的发生。这提示NHE抑制可能成为治疗急性肺损伤的新手段 。NHE抑制物能减弱细胞内Na+超负荷及保存ATP[10],从而使细胞内Ca2+ 超负荷减弱,减少细胞损伤,而对急性肺损伤起保护作用。至于NHE抑制导致炎性因子TNF 、ET-1、NO浓度降低的机制如何有待深入的研究。
, 百拇医药
[作者简介]廖秀玉,女,29岁,主治医师
[参考文献]
[1]Goris RJA,Boekhorst TPA,Nahrinck JKS,et al.Multiple organ failure[J ].Arch Surg,1985,120:1109.
[2]Chan SW,Fernyaks,Voelkel NF.Beneficial effect of a plareler-activati ng factor antagonist.WEB2086,on endotoxin-induced lung injury[J].Am J Physiol, 1990,258(Part 2):H153.
[3]Christopher E,Spooner,Norman P,et al.The role of Tumor Factor in Spe sis[J].Clinical immunology and immunopathology,1992,62(1):11-17.
, 百拇医药
[4]申捷.一氧化氮与肺损伤[J].国外医学麻醉与复苏分册,1998,19:356.
[5]Janakidevik MA,Daves A,Shock AJ,et al.Endothin-1 and endothin-3 indu ce chenotaxis and replication if pulmonary artery fibroblasts[J].AM J Respir C ell Mol Biol,1992,7:492-499.
[6]Halim AN,Kanayama E,EI Maradany K,et al.Activated neutrophil by endo thelin-1 caused tissue damage in human umbilical cord[J].Thormb Res,1995,77:32 1-327.
[7]Kaila K,Vaughan Jones RD.Influence of sodium-hydrogen exchange on in tracellular pH,sodium and tension in sheep cardiac Purkinfe fibres[J].J Ohysio l(Lond),1987,390:93-118.
, 百拇医药
[8]John R,Michad Boaz A,Markerwitz.Endohtelins and the lung[J].AM J R espir Crit Care Med,1996,154:555-582.
[9]Josh Levitsky MD,Daniel Gurell BA,William H,et al.Sodium Ion/Hydroge n Ion e xchange Inhibition:A new pharmacologic approach to myocardial ischemia and reper fusion injury[J].J Clin Pharmacol,1998,38:537-897.
[10]Anderson SE,Murphy E,Steenbergen C,et al.Na-Hexchange in myocardium :effect of hypoxia and acidification on Na and Ca[J].Am J Physiol,1990,259:C94 0-C948.
[收稿:1999-09-13,修回:2000-09-05], http://www.100md.com