NDGA对内皮细胞增殖抑制的作用研究
NDGA对内皮细胞增殖抑制的作用研究
孙慧勤 陈意生 史景泉 卞修武 辛榕
摘 要 目的:探讨去甲二氢愈创木酸(NDGA)对内皮细胞增殖活性的影响及特点。方法:采用形态学观察、细胞计数、流式细胞仪分析、免疫组织化学等技术方法观测不同浓度NDGA作用下人脐静脉内皮细胞ECV304细胞增殖活性的变化。结果:1不同浓度(50~200 μmol/L)的NDGA处理ECV304细胞24~72 h后或一定浓度(100 μmol/L)的NDGA处理ECV304细胞不同时间(1~8 d)后,均出现NDGA抑制细胞增殖的作用,且这种作用与NDGA的浓度和作用时间有关。2NDGA处理细胞后出现细胞增殖活性降低,主要表现为有丝分裂计数和细胞增殖指数降低,细胞的生长抑制率增加,细胞生长减慢,免疫组化显示PCNA、BrdU标记指数下降等。结论:NDGA对内皮细胞增殖有明显抑制作用,此抑制作用可能是其影响血管生成的主要原因之一。
关键词:去甲二氢愈创木酸;血管生成;ECV;304细胞;内皮细胞;细胞增殖
去甲二氢愈创木酸(Nordihydroguaiaretic acid,NDGA)是从常青灌木Larrea divaricata和Guaiacum officinale中提取的一种天然药物成分,近年发现其具有抑制多种肿瘤的发生和发展的作用[1,2],但具体作用机制不清。本室既往的研究也发现NDGA对人恶性胶质瘤不但具有显著的抑制生长和诱导分化作用[3],而且亦能减低移植瘤和实验性胶质瘤的微血管密度,提示NDGA可能对胶质瘤的血管生成有影响。对此进行深入研究,不仅有利于阐明NDGA抗肿瘤机制,也为临床应用NDGA提供更多依据。在血管生成(Angiogenesis)过程中,血管内皮细胞的增殖是血管新生化发生的最基本和最重要的环节[4],本研究拟通过观测NDGA对内皮细胞增殖活性的影响,探讨NDGA抗血管生成的作用机制。
1 材料与方法
1.1 细胞培养
人脐静脉内皮细胞系ECV-304(ATCC CRI1998)细胞,在含10%新生小牛血清(BS)、双抗(青霉素100单位/ml,链霉素100 μg/ml)的M199培养基(Gibco产品)中于37°C、5%CO2混合空气的孵箱(湿度为95%) 培养,每3 d左右换液1次,约3~5 d经0.2%胰酶、0.01% EDTA消化后传代。
1.2 实验分组
试验组为NDGA组,给不同浓度的NDGA(Sigma产品);对照组为PBS组,给等体积0.01 mol/L的PBS(pH7.2)。
1.3 NDGA对内皮细胞核分裂指数影响的观察
不同浓度(50、100、150和200 μmol/L)NDGA和PBS处理后的细胞分别在倒置显微镜和经常规固定、HE染色后于普通光镜下观察,同时测算细胞的核分裂指数,其方法为随机观察500个细胞,计算其中核分裂像的细胞所占的百分比为其分裂指数,每时相点计算5次取均值。
1.4 NDGA对内皮细胞PCNA、BrdU标记影响的观察
生长于盖玻片上的细胞各经100 μmol/L NDGA和PBS处理后1~3 d,每日于收集前2 h加入BrdU液(Sigma产品),使其终浓度为5 μmol/L,作用2 h后取出,PBS洗后,4%多聚甲醛固定,以SP法进行PCNA(Dako公司,1∶10)、BrdU(Zymed公司,1∶20)免疫组化染色,结果进行半定量分析,测定标记指数(LI)。
1.5 NDGA对内皮细胞增殖动力学影响的观测
1.5.1 NDGA对生长曲线及活细胞百分率影响的测定 实验组和对照组各给100 μmol/L NDGA与PBS,于给药后的1~8 d,每日以0.4% Trypanblue染色后计算细胞密度及活细胞数,并求出细胞生长抑制率。
每组、每时相点各3孔细胞,取均值计算。
1.5.2 不同剂量NDGA对内皮细胞计数及活细胞百分率影响 实验组给50、100、150、200 μmol/L的NDGA,对照组给等体积PBS,给药后1、2、3 d进行上述指标的观测。
1.6 细胞增殖指数的检测
将100 μmol/L NDGA或PBS处理后12、24、48、72 h的细胞制成单细胞悬液,于70%冷乙醇中-20°C固定,经RNA酶37°C消化30 min,碘化丙锭染色2 h,用FACStarplus型流式细胞仪(Becton dickinson公司)检测,以CeLLFIT软件分析测定细胞周期,每个样本随机测定104个细胞,每组、每时相点3孔细胞,重复3次试验。求出细胞的增殖指数(PI),计算方法为:
1.7 统计学处理
所有计量数据均以
2 结果
2.1 NDGA对内皮细胞核分裂指数的影响
培养的ECV-304细胞多角形,呈典型的卵石状镶嵌排列,有分裂像的细胞较多。NDGA处理后,细胞稀疏,胞体变长,细胞透亮性(折光性)下降,脱落细胞及碎片增加,并可见酷似凋亡细胞及凋亡小体的形态学变化(另文发表)。此变化随给NDGA后时间的延长和剂量的增加而加重,HE染色核分裂像明显减少,核分裂指数降低(P<0.01),见表1。
表1 NDGA处理不同时间后ECV-304细胞核分裂指数的变化(%)
Tab1 Changes in proliferation index of ECV-304
cells after NDGA treatment(%)
Groups
Time(d)
1
2
3
4
5
6
7
Control
8.15±0.98
8.8±1.64
8.2±2.17
11±0.82
9.68±0.64
9.4±1.52
8.04±0.57
NDGA
2.3±1.01△
2.88±0.76△
1.8±0.84△
4.5±1.29△
3.08±0.58△
4.6±0.89△
2.8±0.63△
△:P<0.01 vs control
2.2 PCNA、BrdU免疫组织化学染色结果
ECV-304细胞的PCNA、BrdU阳性反应较强,LI分别在33%和25%左右;NDGA处理后阳性表达减弱,LI降低,分别在20%和15%左右。见图1。

图1 NDGA对ECV-304细胞PCNA(左)、BrdU(右)
标记指数的影响
Fig 1 Effects of NDGA on PCNA (left), BrdU (right)
labeling index of ECV-304 cells
2.3 NDGA对内皮细胞增殖动力学的影响
2.3.1 NDGA对ECV-304细胞生长曲线的影响 100 μmol/L的NDGA处理后1~8 d,细胞的生长明显受到抑制,24 h后细胞总数较对照组明显减少,且作用时间越长,差异越明显,虽然NDGA明显削弱了内皮细胞生长的峰值,但细胞的增殖高峰出现时间仍较一致,见图2。100 μmol/L的NDGA处理后细胞的生长抑制率1 d为75.2%,2 d为65%,3 d为65.1%,4 d为64.7%,5 d为64.2%,6 d为76.2%,7 d为62.0%,8 d为68.6%。
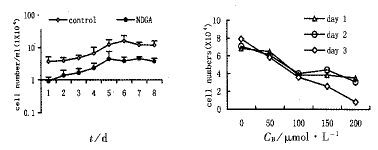
图2 NDGA对ECV-304细胞生长影响的时间效应(左)和剂量效应(右)
Fig 2 Time (left)- and dosage (right) effect of NDGA
on the growth of ECV-304 cells
2.3.2 NDGA抑制ECV-304细胞生长的剂量效应 与对照组相比,50~200 μmol/L浓度的NDGA对ECV-304细胞数均有影响,且NDGA浓度越高,这种影响越明显,即呈明显的剂量依赖性;50 μmol/L、100 μmol/L组活细胞百分率与对照组无显著差异,但150 μmol/L、200 μmol/L组其活细胞百分率则显著低于对照组,并随作用时间的延长而亦明显。50、100、150和200 μmol/L的NDGA处理细胞24 h后,细胞的生长抑制率分别为16.1%、50.2%、51%和54.7%;48 h为7.7%、45%、45.5%和72%;72 h为22%、68.7%、76.4%和92.9%。
2.4 NDGA对ECV-304细胞增殖指数的影响
与对照组相比,100 μmol/L NDGA处理后12~72 h,细胞周期中G1期细胞增多,S期和G2/M期细胞减少,细胞增殖指数降低,见表2,且这种作用程度与作用时间有关,以给NDGA的48 h最明显。
表2 NDGA对ECV-304细胞增殖指数的影响(%)
Tab2 Changes of proliferation index of ECV-304
cells after NDGA treatment(%)
Groups
Time(h)
12
24
48
72
Control
52.47
52.70
48.09
46.55
NDGA
43.85
37.98
30.43
36.15
3 讨论
本研究观察了NDGA对ECV304细胞作用的量效及时效关系,结果发现,不同浓度(50~200 μmol/L)的NDGA处理ECV-304细胞24 h以后或一定浓度(100 μmol/L)的NDGA处理ECV-304细胞不同时间,均对ECV-304细胞有明显的增殖抑制作用,表现为细胞有丝分裂计数和细胞增殖指数降低、细胞生长减慢、PCNA和BrdU表达减弱与标记指数下降等,且这种作用有明显的剂量依赖性和时间依赖性,即在50~200 μmol/L浓度范围内,NDGA浓度越高,这种作用越明显;在100 μmol/L的NDGA处理1~8 d内,以处理后48 h这种增殖抑制作用最为明显,在给药后的第2天,形态学观察也发现内皮细胞数目明显较对照组减少,并随时间延长或药量增加而愈加明显。同时本实验还发现,当将NDGA处理后的细胞置于新鲜(不含NDGA)培养基中培养,则细胞可恢复原有的增殖分裂能力,提示NDGA对ECV304细胞的这种抑制作用是可逆的,且相对无毒性,这与Dethlefsen等[5]的观察相符合。
NDGA处理后,ECV304细胞中G1(含G0)期细胞比例明显增多,S期和G2/M期细胞比例明显减少,使细胞增殖指数下降,说明NDGA对内皮细胞周期有明显的影响,即NDGA能够通过有效作用于细胞周期G1→S期,从而抑制内皮细胞生长、增殖。本室已有的研究证实NDGA对胶质瘤细胞周期的抑制是与其降低CDK4活性相关,NDGA对内皮细胞周期的作用是否也与此相关尚待进一步探讨。
NDGA是花生四烯酸代谢过程中脂氧化酶的强抑制剂。在花生四烯酸代谢过程中,其通过环氧化酶(Cyclooxygenase,COX)途径产生前列腺素、前列环素等;通过脂氧化酶(Lipoxygenase,LOX)通路产生HETES、白三烯,这些代谢产物已证明在肿瘤的增生、转移和免疫抑制等方面发挥作用从而促肿瘤生长[6]。研究还发现:花生四烯酸及其脂氧化酶通路产物通过增加细胞内钙、激活MAPKs信号通路的外部ERKs等机制而促细胞增生[7,8]。MAPKs信号通路目前认为是一系列生长因子引起细胞分裂增生的常见通道,NDGA通过抑制花生四烯酸及其脂氧化酶通路产物的产生而抑制细胞增生;同时NDGA能抑制fos-jun-DNA复合物的形成[9],抑制生长因子激活的NF-κB也可抑制细胞增生[10]。因此,本研究内皮细胞的增殖抑制可能也与上述机制有关,但对于具体涉及的通路和机制还需要进一步研究证实。对于增殖活性越高的细胞,花生四烯酸代谢越快,NDGA抑制作用就表现越强,这可能是NDGA对胶质瘤细胞的抑制作用强于对内皮细胞的原因之一。在肿瘤等血管增殖性疾病中,血管内皮细胞的增殖活性明显增强,NDGA对这些增殖强的细胞也应有强的抑制性,这也提示该药在抑制血管生成方面具有潜在的应用价值。
(本室郭德玉、郭乔楠博士分别为该研究提供了部分抗体,特此致谢!)
作者简介:孙慧勤(1964.1),女,云南省昆明市人,博士,讲师,主要从事肿瘤病理方面的研究, 发表论文5篇。
孙慧勤(第三军医大学附属西南医院病理研究所,重庆 400038)
陈意生(第三军医大学附属西南医院病理研究所,重庆 400038)
史景泉(第三军医大学附属西南医院病理研究所,重庆 400038)
卞修武(第三军医大学附属西南医院病理研究所,重庆 400038)
辛榕(第三军医大学附属西南医院病理研究所,重庆 400038)
参考文献
[1] Wang Z Y, Agarwal R, Zhou Z C, et al. Antimutagenic and antitumorigenic activities of nordihydroguaiaretic acid[J].Mutat Res,1991,261(3):153-162.
[2] Yu A, Hashimura T, Nishio Y, et al. Antipromoting effect of nordihydroguariaretic acid on NbutylN(hydroxybutyl) nitrosamine and sodium saccharininduced rat urinary bladder carcinogenesis[J]. Jpn J Cancer Res,1992,83(9):944-948.
[3] 卞修武,史景泉,辛 榕,等.二氢去甲愈创木酸对人恶性胶质瘤细胞系 SHG44 生长和分化的影响[J]. 中华病理学杂志,1997,26(5):285-288.
[4] Hanahan D, Folkman J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis[J]. Cell,1996,86(3):353-364.
[5] Dethlefsen S M, Shepro D, D′Amore P A. Arachidonic acid metabolites in bFGF,PDGF, and serumstimulated vascular cell growth[J]. Exp Cell Res,1994,212(2):262-273.
[6] Honn K V, Bockman R S, Marnett L I. Prostaglandins and cancer: A review of tumor initiation through tumor metastasis [J]. Prostaglandins,1981,21(5):833-864.
[7] Madamanchi N R, Bukoski R D, Runge M S, et al. Arachi donic acid activates Jun Nterminal Kinase in vascular smooth muscle cells[J]. Oncogene,1998,16(3):417-422.
[8] Parry E W. The prevention of fatalities in cycloheximidechallenged mice pretreated with a submicrogram dose of lipopolysaccharide or with a small volume of cellfree Ehrlich ascites tumour fluid[J]. Inflamm Res,1998,47(1):8-11.
[9] Park S, Lee D K, Yang C H. Inhibition of fosjunDNA complex formation by dihydroguaiaretic acid and in vitro cytotoxic effects on cancer cells[J]. Cancer Lett,1998,127(1~2):23-28.
[10] Brennan P, O′Neill L A. Inhibition of nuclear factor kappa B by direct modification in whole cellsmechanism of action of dihydroguaiaretic acid, curcumin and thiol modifers[J].Biochem Pharmacol,1998,55(7):965-973.
|
寰俊鏂囩珷
鍏虫敞鐧炬媷
璇勮鍑犲彞
鎼滅储鏇村
|

