用pProEXHT载体进行人FLT3配体基因的表达与产物的亲和层析纯化
郑文婕 吕 星 邢瑞云 裴雪涛 孙志贤
摘 要 目的:探讨寡聚组氨酸多肽与目标蛋白融合基因的表达及其产物的金属离子螯合亲和层析纯化方法。方法:将人FLT3配体(FL)胞外段cDNA连入pProEXHT载体,转入大肠杆菌实现表达。分离包涵体并进行复性处理后,通过Ni2+离子螯合亲和层析纯化融合蛋白表达产物。结果和结论:6×组氨酸-FL融合蛋白的表达量约占菌体蛋白总量的15%,用Ni2+离子螯合亲和层析纯化表达产物,一次过柱的纯度可达90%以上,操作程序简便省时,是日后FL基因工程产品大规模制备的可行途径。
关键词:色谱法,亲和;FLT3配体;蛋白纯化
目标基因蛋白表达产物的纯化是基因工程下游技术的关键步骤。将目标基因与一段便于纯化的多肽或蛋白基因相偶联,使之以融合体形式表达,是简化目标蛋白纯化的有效方法[1,2]。pProEXHT是一种原核表达载体,在其克隆位点上游连接了一段6个组氨酸残基(His)的编码序列,可使目标基因的表达产物在N端带上6×His寡聚多肽,以便通过金属螯合亲和层析(metal-chelating affinity chromatography, MCAC)进行纯化。我们将人FLT3配体(FMS-like tyrosine kinase 3 ligand, FL)胞外段cDNA连入pProEXHT载体,转入大肠杆菌实现表达,表达产物用Ni2+离子MCAC纯化,一次过柱的纯度可达90%以上,显示出融合基因表达继以亲和纯化的优点。
, http://www.100md.com
1 材料与方法
1.1 材料
携带人FL cDNA的pGEM-T质粒,由本研究室制备;大肠杆菌DH5α菌株为本室冻存;内切酶、T4 DNA连接酶为Promega公司产品;pProEXHT载体、Ni离子螯合亲和层析填料为Gibco BRL公司产品;IPTG购于Sigma公司;氧化型和还原型谷胱甘肽为华美公司产品;其余试剂均为分析纯。
1.2 pProEXHT连接FL cDNA重组体的构建
将携带人FL cDNA的pGEM-T质粒用EcoR Ⅰ和Kpn Ⅰ双酶切,琼脂糖电泳分离并纯化FL cDNA片段,插入至pProEXHT载体EcoR Ⅰ-Kpn Ⅰ克隆位点,构成pProEXHT-FL重组体。
1.3 FL在大肠杆菌中的表达[3]
, http://www.100md.com
pProEXHT-FL重组体转化大肠杆菌DH5α,挑取单一菌落,接种2 ml含氨苄西林(100 μg/ml)LB培养基,37℃摇菌过夜,取20 μl过夜菌液接种10 ml LB培养基,37℃摇菌约3 h,至菌液D600值在0.5~1.0时,加入IPTG使终浓度为1 mmol/L,37℃继续培养4 h,4 000 r/min离心收集菌体,超声破碎,细菌破碎液进行SDS-聚丙烯酰胺凝胶电泳(PAGE),分析表达产物。
1.4 包涵体的提取及变性与复性处理[3,4]
pProEXHT-FL重组体新鲜转化菌接种500 ml LB培养基,37℃摇菌至菌液D600值在0.5~1.0时,加入IPTG使终浓度为1 mmol/L,37℃继续培养4 h,4 000 r/min离心收集菌体,用PBS洗3遍,按菌体量加入10倍体积裂解液(50 mmol/L Tris-HCl, pH8.0, 10 mmol/L 2-巯基乙醇)、PMSF(1 mmol/L)和溶菌酶(100 μg/ml),置冰浴中30 min.,超声破碎菌体,12 000 r/min离心收集包涵体,用裂解液洗3遍,再用洗液(0.5% Triton X-100, 10 mmol/L EDTA, pH8.0))和低浓度变性液(3 mol/L尿素, 0.1 mol/L Tris-HCl, pH8.0)各洗一遍。洗涤后包涵体用高浓度变性液(8 mol/L尿素, 1% 2-巯基乙醇, 0.1 mol/L Tris-HCl, pH8.0)溶解,得到蛋白溶解液。向蛋白溶解液中缓慢滴加复性液(50 mmol/L Tris-HCl, pH8.0, 50 mmol/L NaCl, 5 mmol/L还原型谷胱甘肽, 1 mmol/L氧化型谷胱甘肽, 3.5 mmol/L尿素),至溶解液稀释100倍,4℃放置48 h。
, http://www.100md.com
1.5 Ni2+离子MCAC
取浸泡于30%乙醇保存液中的Ni2+离子MCAC填料装柱,柱体积1.0 cm×4.5 cm。用10倍柱体积蒸馏水洗去乙醇后,用A液(20 mmol/L Tris-HCl, pH8.0, 0.1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油, 20 mmol/L咪唑)平衡。将复性后蛋白液上柱,流速:0.5 ml/min,收集流出液,再次上柱,重复3次,待全部蛋白液过柱后,按10倍柱体积A液→2倍柱体积B液(20 mmol/L Tris-HCl, pH8.0, 1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油)→2倍柱体积A液的次序洗柱,随后改为C液(20 mmol/L Tris-HCl, pH8.0, 0.1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油, 0.1 mol/L咪唑)洗脱,按每管0.5 ml分步收集流出液,SDS-PAGE分析各管蛋白,将含有预期相对分子质量蛋白的各管流出液合并。
, http://www.100md.com
2 结果和讨论
pProEXHT-FL重组质粒转化菌裂解液的SDS-PAGE分析的结果见图1。由图1可见,转化菌经IPTG诱导后在相对分子质量25 000处出现一蛋白带,这与FL cDNA片段(481 bp)表达蛋白的预期分子量相符,说明转化菌表达了FL蛋白。密度扫描分析表明,FL蛋白约占菌体蛋白总量的15%。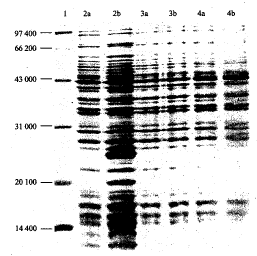
图1 人FL在大肠杆菌中的表达
1.标准分子量蛋白;2~4.依次为pProEXHT-hFL重组质粒转化菌、pProEXHT空质粒转化菌和空白对照;a.IPTG诱导前;b.IPTG诱导4 h
在确定了转化菌表达FL之后,我们对表达蛋白的存在形式作了进一步分析。结果表明,表达蛋白主要以不溶形式存在于包涵体(图2)。因此,在进行层析纯化前,必须对包涵体进行分离及相应的变性与复性处理。
, 百拇医药
图3显示复性蛋白经Ni2+离子MCAC后纯化产物的SDS-PAGE结果。密度扫描分析表明,FL蛋白的纯度为90%以上。
图2 人FL在大肠杆菌中表达的存在形式
1.标准分子量蛋白; 2~3.空菌包涵体和上清; 4~5.pProEXHT-FL转化菌包涵体和上清
图3 FL经Ni2+离子MCAC纯化后产物
, http://www.100md.com
1.标准分子量蛋白; 2~3.全菌裂解液;4~5.MCAC纯化后FL蛋白产物
MCAC时先以低浓度咪唑缓冲液平衡,目的在于封闭非特异性的弱结合位点。此后再按低盐→高盐→低盐→高浓度咪唑缓冲液的程序进行洗脱。低盐、高盐缓冲液可除去杂蛋白,而高浓度的咪唑可竞争性结合Ni2+离子,从而使N端含有His寡聚多肽的FL蛋白洗脱下来。
MCAC是利用金属离子与蛋白表面His残基中咪唑基的特异结合,通过特殊溶剂的洗脱,对蛋白进行分离与纯化的一项技术。蛋白容量大、重复使用率高和操作简便是其显著优点[2]。实验中,我们曾将大量蛋白稀释液多次过柱,仍可得到满意结果。通过融合基因的表达方式,使目标蛋白带上His寡聚多肽,具有可进行MCAC纯化的特点,层析操作只需一步即可完成,大大简化了蛋白纯化手续。
FL是一种刺激早期造血干细胞增殖和分化的造血生长因子[5,6],在骨髓损伤性疾病的治疗和造血干细胞体外扩增方面具有应用前景[7]。本研究为FL基因工程产品的大规模制备奠定了基础。■
, http://www.100md.com
基金项目 军事医学科学院高技术创新启动基金资助课题(9505104)
作者简介 郑文婕(1972~),女,山东济南人,硕士,研究实习员
郑文婕(军事医学科学院放射医学研究所,北京 100850)
吕星(军事医学科学院放射医学研究所,北京 100850)
邢瑞云(军事医学科学院放射医学研究所,北京 100850)
裴雪涛(军事医学科学院放射医学研究所,北京 100850)
孙志贤(军事医学科学院放射医学研究所,北京 100850)
参考文献
, 百拇医药 [1]Sassenfeld HM. Engineering proteins for purification[J]. Trends Biotechnol,1990, 8(4):88
[2]吕 星,陈吉中,李培峰 等. 铜离子螯合亲和层析纯化人铜锌超氧化物歧化酶[J].生物化学与生物物理学进展, 1994, 21(3):259
[3]Sambrook J, Fritsh EF, Maniatis T著,金冬雁,黎孟枫 等译. Molecular cloning:a laboratory manual[M]. 2nd ed. 北京:科学出版社, 1992. 822
[4]Aruffo A. Protein expression. In: Ausubel FM, Brent R, Kingston RE et al. eds. Short protocols in molecular biology[M]. Boston: John Wiley and Sons Inc, 1995.16
, 百拇医药
[5]Mckenna A, Chesney S, Petkau A et al. Purification of human copper, zinc superoxide dismutase by copper chelating affinity chromatography[J]. Anal Biochem, 1986, 155(1):193
[6]Haylock DN, Horsfall MJ, Dowse TL et al. Increased recruitment of hematopoietic progeniter cells underlies the ex vivo expansion potential of FLTs ligand[J]. Blood, 1997, 90(6):2260
[7]Petzer AL, Hogge DE, Lansdorp PM et al. Self-renewal of primitive human hematopoietic cells in vitro and their expansion in defined medium[J]. Proc Natl Acad Sci USA, 1996, 93(4):1470, 百拇医药
摘 要 目的:探讨寡聚组氨酸多肽与目标蛋白融合基因的表达及其产物的金属离子螯合亲和层析纯化方法。方法:将人FLT3配体(FL)胞外段cDNA连入pProEXHT载体,转入大肠杆菌实现表达。分离包涵体并进行复性处理后,通过Ni2+离子螯合亲和层析纯化融合蛋白表达产物。结果和结论:6×组氨酸-FL融合蛋白的表达量约占菌体蛋白总量的15%,用Ni2+离子螯合亲和层析纯化表达产物,一次过柱的纯度可达90%以上,操作程序简便省时,是日后FL基因工程产品大规模制备的可行途径。
关键词:色谱法,亲和;FLT3配体;蛋白纯化
目标基因蛋白表达产物的纯化是基因工程下游技术的关键步骤。将目标基因与一段便于纯化的多肽或蛋白基因相偶联,使之以融合体形式表达,是简化目标蛋白纯化的有效方法[1,2]。pProEXHT是一种原核表达载体,在其克隆位点上游连接了一段6个组氨酸残基(His)的编码序列,可使目标基因的表达产物在N端带上6×His寡聚多肽,以便通过金属螯合亲和层析(metal-chelating affinity chromatography, MCAC)进行纯化。我们将人FLT3配体(FMS-like tyrosine kinase 3 ligand, FL)胞外段cDNA连入pProEXHT载体,转入大肠杆菌实现表达,表达产物用Ni2+离子MCAC纯化,一次过柱的纯度可达90%以上,显示出融合基因表达继以亲和纯化的优点。
, http://www.100md.com
1 材料与方法
1.1 材料
携带人FL cDNA的pGEM-T质粒,由本研究室制备;大肠杆菌DH5α菌株为本室冻存;内切酶、T4 DNA连接酶为Promega公司产品;pProEXHT载体、Ni离子螯合亲和层析填料为Gibco BRL公司产品;IPTG购于Sigma公司;氧化型和还原型谷胱甘肽为华美公司产品;其余试剂均为分析纯。
1.2 pProEXHT连接FL cDNA重组体的构建
将携带人FL cDNA的pGEM-T质粒用EcoR Ⅰ和Kpn Ⅰ双酶切,琼脂糖电泳分离并纯化FL cDNA片段,插入至pProEXHT载体EcoR Ⅰ-Kpn Ⅰ克隆位点,构成pProEXHT-FL重组体。
1.3 FL在大肠杆菌中的表达[3]
, http://www.100md.com
pProEXHT-FL重组体转化大肠杆菌DH5α,挑取单一菌落,接种2 ml含氨苄西林(100 μg/ml)LB培养基,37℃摇菌过夜,取20 μl过夜菌液接种10 ml LB培养基,37℃摇菌约3 h,至菌液D600值在0.5~1.0时,加入IPTG使终浓度为1 mmol/L,37℃继续培养4 h,4 000 r/min离心收集菌体,超声破碎,细菌破碎液进行SDS-聚丙烯酰胺凝胶电泳(PAGE),分析表达产物。
1.4 包涵体的提取及变性与复性处理[3,4]
pProEXHT-FL重组体新鲜转化菌接种500 ml LB培养基,37℃摇菌至菌液D600值在0.5~1.0时,加入IPTG使终浓度为1 mmol/L,37℃继续培养4 h,4 000 r/min离心收集菌体,用PBS洗3遍,按菌体量加入10倍体积裂解液(50 mmol/L Tris-HCl, pH8.0, 10 mmol/L 2-巯基乙醇)、PMSF(1 mmol/L)和溶菌酶(100 μg/ml),置冰浴中30 min.,超声破碎菌体,12 000 r/min离心收集包涵体,用裂解液洗3遍,再用洗液(0.5% Triton X-100, 10 mmol/L EDTA, pH8.0))和低浓度变性液(3 mol/L尿素, 0.1 mol/L Tris-HCl, pH8.0)各洗一遍。洗涤后包涵体用高浓度变性液(8 mol/L尿素, 1% 2-巯基乙醇, 0.1 mol/L Tris-HCl, pH8.0)溶解,得到蛋白溶解液。向蛋白溶解液中缓慢滴加复性液(50 mmol/L Tris-HCl, pH8.0, 50 mmol/L NaCl, 5 mmol/L还原型谷胱甘肽, 1 mmol/L氧化型谷胱甘肽, 3.5 mmol/L尿素),至溶解液稀释100倍,4℃放置48 h。
, http://www.100md.com
1.5 Ni2+离子MCAC
取浸泡于30%乙醇保存液中的Ni2+离子MCAC填料装柱,柱体积1.0 cm×4.5 cm。用10倍柱体积蒸馏水洗去乙醇后,用A液(20 mmol/L Tris-HCl, pH8.0, 0.1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油, 20 mmol/L咪唑)平衡。将复性后蛋白液上柱,流速:0.5 ml/min,收集流出液,再次上柱,重复3次,待全部蛋白液过柱后,按10倍柱体积A液→2倍柱体积B液(20 mmol/L Tris-HCl, pH8.0, 1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油)→2倍柱体积A液的次序洗柱,随后改为C液(20 mmol/L Tris-HCl, pH8.0, 0.1 mol/L KCl, 10 mmol/L 2-巯基乙醇, 10%甘油, 0.1 mol/L咪唑)洗脱,按每管0.5 ml分步收集流出液,SDS-PAGE分析各管蛋白,将含有预期相对分子质量蛋白的各管流出液合并。
, http://www.100md.com
2 结果和讨论
pProEXHT-FL重组质粒转化菌裂解液的SDS-PAGE分析的结果见图1。由图1可见,转化菌经IPTG诱导后在相对分子质量25 000处出现一蛋白带,这与FL cDNA片段(481 bp)表达蛋白的预期分子量相符,说明转化菌表达了FL蛋白。密度扫描分析表明,FL蛋白约占菌体蛋白总量的15%。

图1 人FL在大肠杆菌中的表达
1.标准分子量蛋白;2~4.依次为pProEXHT-hFL重组质粒转化菌、pProEXHT空质粒转化菌和空白对照;a.IPTG诱导前;b.IPTG诱导4 h
在确定了转化菌表达FL之后,我们对表达蛋白的存在形式作了进一步分析。结果表明,表达蛋白主要以不溶形式存在于包涵体(图2)。因此,在进行层析纯化前,必须对包涵体进行分离及相应的变性与复性处理。
, 百拇医药
图3显示复性蛋白经Ni2+离子MCAC后纯化产物的SDS-PAGE结果。密度扫描分析表明,FL蛋白的纯度为90%以上。

图2 人FL在大肠杆菌中表达的存在形式
1.标准分子量蛋白; 2~3.空菌包涵体和上清; 4~5.pProEXHT-FL转化菌包涵体和上清

图3 FL经Ni2+离子MCAC纯化后产物
, http://www.100md.com
1.标准分子量蛋白; 2~3.全菌裂解液;4~5.MCAC纯化后FL蛋白产物
MCAC时先以低浓度咪唑缓冲液平衡,目的在于封闭非特异性的弱结合位点。此后再按低盐→高盐→低盐→高浓度咪唑缓冲液的程序进行洗脱。低盐、高盐缓冲液可除去杂蛋白,而高浓度的咪唑可竞争性结合Ni2+离子,从而使N端含有His寡聚多肽的FL蛋白洗脱下来。
MCAC是利用金属离子与蛋白表面His残基中咪唑基的特异结合,通过特殊溶剂的洗脱,对蛋白进行分离与纯化的一项技术。蛋白容量大、重复使用率高和操作简便是其显著优点[2]。实验中,我们曾将大量蛋白稀释液多次过柱,仍可得到满意结果。通过融合基因的表达方式,使目标蛋白带上His寡聚多肽,具有可进行MCAC纯化的特点,层析操作只需一步即可完成,大大简化了蛋白纯化手续。
FL是一种刺激早期造血干细胞增殖和分化的造血生长因子[5,6],在骨髓损伤性疾病的治疗和造血干细胞体外扩增方面具有应用前景[7]。本研究为FL基因工程产品的大规模制备奠定了基础。■
, http://www.100md.com
基金项目 军事医学科学院高技术创新启动基金资助课题(9505104)
作者简介 郑文婕(1972~),女,山东济南人,硕士,研究实习员
郑文婕(军事医学科学院放射医学研究所,北京 100850)
吕星(军事医学科学院放射医学研究所,北京 100850)
邢瑞云(军事医学科学院放射医学研究所,北京 100850)
裴雪涛(军事医学科学院放射医学研究所,北京 100850)
孙志贤(军事医学科学院放射医学研究所,北京 100850)
参考文献
, 百拇医药 [1]Sassenfeld HM. Engineering proteins for purification[J]. Trends Biotechnol,1990, 8(4):88
[2]吕 星,陈吉中,李培峰 等. 铜离子螯合亲和层析纯化人铜锌超氧化物歧化酶[J].生物化学与生物物理学进展, 1994, 21(3):259
[3]Sambrook J, Fritsh EF, Maniatis T著,金冬雁,黎孟枫 等译. Molecular cloning:a laboratory manual[M]. 2nd ed. 北京:科学出版社, 1992. 822
[4]Aruffo A. Protein expression. In: Ausubel FM, Brent R, Kingston RE et al. eds. Short protocols in molecular biology[M]. Boston: John Wiley and Sons Inc, 1995.16
, 百拇医药
[5]Mckenna A, Chesney S, Petkau A et al. Purification of human copper, zinc superoxide dismutase by copper chelating affinity chromatography[J]. Anal Biochem, 1986, 155(1):193
[6]Haylock DN, Horsfall MJ, Dowse TL et al. Increased recruitment of hematopoietic progeniter cells underlies the ex vivo expansion potential of FLTs ligand[J]. Blood, 1997, 90(6):2260
[7]Petzer AL, Hogge DE, Lansdorp PM et al. Self-renewal of primitive human hematopoietic cells in vitro and their expansion in defined medium[J]. Proc Natl Acad Sci USA, 1996, 93(4):1470, 百拇医药