前炎症细胞因子诱导人胸膜细胞释放纤溶酶原激活物抑制剂-1的研究
作者:闵锐 李淑云 王虹 张劲松 王彤
单位:南京医科大学第一附属医院呼吸内科210029
关键词:胸膜;间皮细胞;细胞因子;Ⅰ型纤溶酶原激活物抑制剂
江苏医药001206 【摘要】 目的 研究前炎症细胞因子对人胸膜间皮细胞(HPMC)释放纤溶酶原激活物 抑制剂(PAI-1)的诱导效应。方法 渗出性胸膜腔积液的6份原代 HPMC置于DMEM/F12培养液中体外孵育,观察前炎症细胞因子白细胞介素-1β (IL-1β)和肿瘤坏死因子-α(TNF-α)对HPMC纤溶活动的影响。对分离的 HPMC纯度进行光镜下细胞学形态、电镜下超微结构和免疫组化染色的鉴定,加入IL- 1β或TNF-α诱导培养第三代HPMC 24小时后对HPMC培养液中PAI-1活 性 采用底物显色法进行测定。结果 与对照组相比,下列三种浓度水平的I L-1β或TNF-α诱导培养24 小时后均能显著增加HPMC培养液中的PAI-1活性,即0.2μg/L(IL-1β :q=3.76,P<0.05;TNF-α:q=4.91,P<0. 01),2.0μg/L(IL-1β:q=10.72,P<0.01;TNF -α:q=14.49,P<0.01) and 20μg/L(IL-1β: q=22.81,P<0.01;TNF-α:q=23.47,P<0.0 1),而IL-1β和TNF-α对HPMC的诱导效应之间没有显著性差异。 结论 前炎症细胞因子在体内可能调节着HPMC释放PAI-1,由此影响着纤 维蛋白在胸膜腔内的沉积而向纤维化发展。
, http://www.100md.com
Proinflammatory cytokine-induced release of plasminogen activator inhibitor-1 by human pleural mesothelial cells
MIN Rui,LI Shuyun,WANG Hong,et al.
(Departme nt of Pulmonology,The First Affiliated H ospital of Nanjing Medical University,Na njing 210029)
【Abstract】 Objective To investigate effects of two proinflamm atory cytokines on the production of pla sminogen activator inhibitor-1(PAI-1) by human pleural mesothelial cells(HPMC).[ WTHZ〗Methods Six primary cultures of H PMC isolated from patients with exudativ e pleural effusions were incubated in DM EM/F12 medium to examine the effect of i nterleukin-1β(IL-1β) or tumor necrosis f actor-α(TNF-α) on the fibrinolytic prope rties of HPMC in vitro.The purity of the cell population was assessed by morphol ogic,ultrastuctural and immunohistochemi cal characteristics.PAI-1 activity in th e conditioned media of third passage HPM C was detected using chromogenic substra te method.Results Compared with controls,PAI-1 activity in the cond itioned media of HPMC was significantly increased by stimulation with IL-1β or T NF-α for 24 hours at the level of 0.2μg/ L(IL-1β:q=3.76,P<0.05;TNF-α:q=4.91 ,P<0.0 1),2.0μg/L(IL-1β:q=10.72,P<0.01;TNF- α:q= 14.49,P<0.01) and 20μg/L(IL-1β:q=22. 81,P< 0.01;TNF-α:q=23.47,P<0.01),but there wa s no significant difference between resp onses to IL-1β and TNF-α.Conclusion The results suggest that proinflamm atory cytokines mediate the release of P AI-1 by HPMC in vivo,and so may affect t he deposition of fibrin within the pleur al cavity and favor fibrogenesis.
, 百拇医药
【Key words】 Pleura Mesothelial cells Cytokines Plasminogen activator in hibitor-1
目前针对腹膜间皮细胞的研究在方法和观点上趋于成熟,已证 实前炎症细胞因子脂多糖(L PS)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)可诱导腹膜 间 皮细胞合成PAI-1[1~3],鉴于胸膜和腹膜在组织学上均系间皮细胞,起源 于中胚 层体腔膜,所以具有借鉴意义,为此我们分离培养了人胸膜间皮细胞(HPMC),并对细 胞因子诱导HPMC释放PAI-1效应进行研究。
材料和方法
一、研究对象
胸膜腔积液标本取自我院呼吸科住院以及门诊14例胸膜腔积液患 者,经HPMC细胞纯度鉴定有6例胸膜腔积液标本达到实验要求。
, 百拇医药
二、主要试剂
DMEM/F12细胞培养液(Hyclone公司);转铁蛋白(Sig ma公司);新生牛血清(杭州四季清生物研究所);胰蛋白酶(Sigma公司);重组 人细胞因子IL-1β、TNF-α(Promega公司);抗细胞角蛋白、抗波形蛋白 、抗第Ⅷ因子相关抗原和抗CD45抗原的鼠抗人单克隆抗体(DAKO公司);ABC kit(DAKO公司);PAI-1活性测定试剂盒(上海医科大学分子学遗传室)。[ JP〗
三、方法
1.HPMC的分离和体外培养:在无菌条件下经胸穿分别抽取胸膜腔积液200~300m l,分离HPMC后加入DMEM/F12培养液(内含青霉素100KU/L,转铁蛋白 0.5mg/L,胰岛素10U/L,15%新生牛血清等),以1×104/ml细胞 浓度接种于培养瓶内,置于37℃,5%CO2细胞培养箱中培养。
, 百拇医药
2.HPMC细胞纯度的鉴定:(1)细胞学形态观察:使用盖片细胞培养技术将第二代HP MC进行苏木素-伊红(HE)染色后于光镜下观察。(2)细胞表面标志鉴定:以卵白素 -生物素-过氧化物酶复合法(ABC)分别用抗细胞角蛋白、抗第Ⅷ因子相关抗原和抗C D45抗原的鼠抗人单克隆抗体做免疫细胞化学染色。(3)细胞超微结构观察:透射电 子显微镜观察时先取足量HPMC细胞悬液,离心后戊二醛固定,经醋酸铀染色、丙酮梯度 脱水、包埋后超薄切片,上支持膜电镜观察;扫描电子显微镜时先用盖片培养技术将HPM C分别经戊二醛和四氧化锇固定、丙酮/醋酸异戊脂脱水、临界点干燥、喷金后电镜观察 。
3.PAI-1活性检测:将第二代培养的HPMC用胰蛋白酶消化,用不含新生牛血清的D MEM/F12将第三代HPMC调成浓度为2×105/ml细胞悬液,在96孔细胞 培 养板中每孔加100μl,同时分别加入细胞因子IL-1β或TNF-α,使其终浓度分 别为A组0.02μg/L、B组0.2μg/L、C组2.0μg/L、D组20.0μ g/L,并设空白对照组,孵育24小时后吸取上清,参照张欣平等[4]的方法使用PAI-1活性测定试剂盒检测其中PAI-1活性。
, 百拇医药
四、统计学处理
实验数据以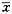 ±s表示,采用多组资料方差分析(ANOVA)F检验, 若有组间差异进行两样本均数间q检验(Newman-Keuls法),P<0 .05时有统计显著差异。
±s表示,采用多组资料方差分析(ANOVA)F检验, 若有组间差异进行两样本均数间q检验(Newman-Keuls法),P<0 .05时有统计显著差异。
结果
一、HPMC纯度鉴定
在相差显微镜下可见贴壁生长的HPMC为单层扁平细胞,呈多边 形;HPMC经HE染色后为胞浆薄染成淡粉红色、中央为一深蓝色扁圆形核;HPMC经 免疫细胞化学染色后为抗细胞角蛋白和抗波形蛋白阳性,抗第Ⅷ因子相关抗原和抗CD45 抗原阴性;在透射电子显微镜下可见HPMC细胞表面有微绒毛,细胞内有丰富的细胞浆囊 泡以及分化成熟的内质网、线粒体;在扫描电子显微镜下可见HPMC表面大量微绒毛密集 排列成丛状。
, 百拇医药
二、HPMC经不同浓度细胞因子诱导培养24小时后培养液中PAI-1活性变化
采用 直线回归法得出标准曲线方程为Y=0.899-0.145X,r=-0.996。 实验 结果显示:①细胞因子浓度为0.20μg/L组、2.0μg/L组与20.0μg/ L组均可使HPMC释放PAI-1显著增加,而0.02μg/L组没有这一显著效应(F=0.11,P>0.05);②q检验显示IL-1β和TNF-α对 HPMC的诱 导效应之间没有显著性差异(见表1,表2)。
表1 HPMC经不同浓度细胞因子诱导24h后培养液中PAI- 1活性变化(U/ml,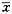 ±s)△*
±s)△*
0.02μg/L组
0.20μg/L组
, 百拇医药
2.0μg/L组
20.0μg/L组
对照
IL-1β
TNF-α
对照
IL-1β
TNF-α
对照
IL-1β
TNF-α
对照
IL-1β
, 百拇医药
TNF-α
PAI-1
活性
1.91
±0.76
2.01
±0.62
2.37
±0.92
2.33
±1.18
3.55
±0.42
, http://www.100md.com
3.92
±0.56
2.56
±0.44
9.07
±2.46
11.36
±0.6 1
2.60
±0.27
10.62
±1.35
10.85
, 百拇医药
±0.63
F值
0.11
6.57
56.50
178.65
P值
P>0.05
P<0.01
P <0.01
P<0.01
注:△每组为6例标本的第三代HPMC实验数据;*PAI-1活性 单位U/ml即在25℃,20min内抑制1.0国际单位t-PA活性的量表2 各组间均数q检验值
, 百拇医药
0.2μg/L组
2.0μg/L组
20.0μg/L组
IL-1β
TNF-α
IL-1β
TNF-α
IL-1β
TNF-α
对照
3.76*
4.91**
, http://www.100md.com
10.72**
14.49**
22.81**
23.47**
IL-1β
1.14
3.77
0.65
注:*P<0.05 **P<0.01讨论
不少全身性或肺部疾病会波及胸膜,如肺结核、细菌性肺炎、石棉肺、风湿性关节 炎、部分恶性肿瘤等,导致胸膜发生炎症反应和病理损伤,HPMC作为胸膜的主要细胞群体势必受到影响。国外晚近研究表明HPMC其作用不仅 仅 是超滤胸膜腔积液和作为分子转运的屏障,而且主动参与胸膜腔的抗感染和免疫应答反应[5]。对胸膜纤维化机制进行研究的临床意义主要在两个方面:(1)首先是在感 染 性胸膜炎,如肺炎旁渗出液(PPE)、脓胸、结核性胸膜炎等,在使用有效抗生素和充分 引流后仍不能完全避免胸膜的粘连、纤维化和胸膜增厚,重者可能形成纤维胸,导致肺膨胀 受限、呼吸功能减退。此外,在结核性胸膜炎的治疗方案上,目前国外已有学者否定在化疗 基础上 加用糖皮质类固醇激素防治胸膜粘连、纤维化的传统观点[6],所以在感染性胸膜 炎如何 进一步防治胸膜粘连、纤维化可能面临寻求新的突破口。(2)对恶性胸膜腔积液(MPE )、反复自发性气胸施行的胸膜粘连术,是一种人为形成的胸膜粘连、纤维化,却有积极的 临床意义,如遏止MPE无限增加或气胸反复发生、减轻MPE的呼吸压迫症状和避免蛋白 大量丢失。虽然胸膜粘连术已积累大量临床经验,但对其治疗机制上的认识仍不统一。总之 ,亟待对胸膜纤维化机制进行深入研究,有助于临床治疗按病情需要选择抑制或促进胸膜纤 维化进程。
, http://www.100md.com
PAI是组织型纤溶酶原激活物(t-PA)与尿激酶型纤溶酶原激活物(u-PA)的特 异性快速抑制剂。t-PA与u-PA主要生理功能是催化纤溶酶原转变为纤溶酶,后者可 水解血栓或渗出于组织内的纤维蛋白(原)。PAI-1是血浆和组织中主要的PAI,作 用远强于PAI-2,在纤溶系统中起着关键作用,以此调控着纤维蛋白在胸膜腔和腹膜腔 的沉积。在渗出性胸膜腔积液中PAI-1含量是血浆中的80~4000倍,PAI-1 可能来自毛细血管炎性渗出或胸膜腔内细胞的合成[7]。采用免疫细胞化学技术与 分子杂 交技术已证实PAI-1分布于成纤维细胞、嗜中性粒细胞、巨噬细胞等炎症细胞,Ide ll等[8]采用Northern Blot印迹法观察到体外培养的HPMC能 合成PAI- 1和PAI-2,这一过程可被放线菌素与环乙酰胺所阻断,作者认为鉴于HPMC能大量 合成和释放PAI-1,可能是胸膜腔积液中高水平PAI-1的主要来源。
HPMC对胸膜腔积液纤溶/促凝平衡的调控作用日益受到关注,改变了一些临床观念,如 过去认为损伤胸膜是取得良好胸膜粘连术疗效的先决条件,所以临床采用机械性摩擦胸膜或 胸膜部分切除术的办法,确实有一定的效果。而晚近认为在胸膜粘连术中虽然一些炎症细胞 (如嗜中性粒细胞、单核巨噬细胞、成纤维细胞)作用必不可少,但是纤维过程级联反应 的主要启动者是HPMC,越来越多的证据显示HPMC调控着胸膜腔积液纤溶/促凝水平 ,这意味着为获得最佳粘连术效果粘连剂应尽可能分布至最大面积的HPMC膜表面,如果 膜表面被肿瘤细胞、纤维蛋白所遮盖,或者处于低糖、低pH等环境,胸膜粘连术疗效将显 著降低[9]。
, 百拇医药
在本实验中我们观察到前炎症细胞因子TNF-α的诱导作用,而且观察和比较IL-1β 和TNF-α的诱导作用,与Tietze等[5]对腹膜间皮细胞类似研究的结果 基本一致。总之,对细胞因子诱导HPMC释放PAI-1进行深入研究有助于进一步 揭示胸膜 纤维化机制。
参考文献
1.Rougier JP,Guia S,Hagege J,et al.P AI-1 secretion and matrix deposition in huma n peritoneal mesothelial cell cultures:t ranscriptional regulation by IL-1β.Kidn ey Int.1998,54:87-98.
2.陈香美,董柯,傅博.不同浓度葡萄糖对大鼠间皮细胞增殖及细胞外基质产生的影响. 解放军医学杂志,1996;21:112-114.
, 百拇医药
3.Tietze L,Elbrecht A,Schauerte C,et al. Modulation of pro- and antifibrinolytic p roperties of human peritoneal mesothelia l cells by TGF-β1,IL-1β and TNF-α.Thromb Haemost,1998,79:362-370.
4.张欣平,郝勤,宋后燕,等.PAI-1 cDNA表达质粒的构建及其哺乳动物细胞 中的表达.上海医科大学学报,1996,23:176-180.
5.Antony VB,Hott JW,Kunkel SL,et al.Pleu ral mesothelial cell expression of MCP-1 and IL-8.Am J Respir Cell Mol Biol,1995 ,12:581-588.
, 百拇医药 6.Wyser C,Bernard W.Using corticosteroid s to treat tuberculous pleurisy.Chest,19 97,112:291-292.
7.Idell S,Girard W,Koenig KB,et al.A bnor moalities of pathways of fibrin turnover of the human pleural space.Am Rev Respi r Dis,1991,144:187-194.
8.Idell S,Zwieb C,Kumar A,et al.Pathways of fibrin turnover of human pleural mes othelial cell in vitro.Am J Respir Cell Mol Biol,1992,7:414-426.
9.Rodriguez PF,Antony VB.Pleurodesis:Sta te of the art.Eur Respir J,1997,10:1648- 1654.
(收稿:2000-05-08 修回:2000-07-07), 百拇医药
单位:南京医科大学第一附属医院呼吸内科210029
关键词:胸膜;间皮细胞;细胞因子;Ⅰ型纤溶酶原激活物抑制剂
江苏医药001206 【摘要】 目的 研究前炎症细胞因子对人胸膜间皮细胞(HPMC)释放纤溶酶原激活物 抑制剂(PAI-1)的诱导效应。方法 渗出性胸膜腔积液的6份原代 HPMC置于DMEM/F12培养液中体外孵育,观察前炎症细胞因子白细胞介素-1β (IL-1β)和肿瘤坏死因子-α(TNF-α)对HPMC纤溶活动的影响。对分离的 HPMC纯度进行光镜下细胞学形态、电镜下超微结构和免疫组化染色的鉴定,加入IL- 1β或TNF-α诱导培养第三代HPMC 24小时后对HPMC培养液中PAI-1活 性 采用底物显色法进行测定。结果 与对照组相比,下列三种浓度水平的I L-1β或TNF-α诱导培养24 小时后均能显著增加HPMC培养液中的PAI-1活性,即0.2μg/L(IL-1β :q=3.76,P<0.05;TNF-α:q=4.91,P<0. 01),2.0μg/L(IL-1β:q=10.72,P<0.01;TNF -α:q=14.49,P<0.01) and 20μg/L(IL-1β: q=22.81,P<0.01;TNF-α:q=23.47,P<0.0 1),而IL-1β和TNF-α对HPMC的诱导效应之间没有显著性差异。 结论 前炎症细胞因子在体内可能调节着HPMC释放PAI-1,由此影响着纤 维蛋白在胸膜腔内的沉积而向纤维化发展。
, http://www.100md.com
Proinflammatory cytokine-induced release of plasminogen activator inhibitor-1 by human pleural mesothelial cells
MIN Rui,LI Shuyun,WANG Hong,et al.
(Departme nt of Pulmonology,The First Affiliated H ospital of Nanjing Medical University,Na njing 210029)
【Abstract】 Objective To investigate effects of two proinflamm atory cytokines on the production of pla sminogen activator inhibitor-1(PAI-1) by human pleural mesothelial cells(HPMC).[ WTHZ〗Methods Six primary cultures of H PMC isolated from patients with exudativ e pleural effusions were incubated in DM EM/F12 medium to examine the effect of i nterleukin-1β(IL-1β) or tumor necrosis f actor-α(TNF-α) on the fibrinolytic prope rties of HPMC in vitro.The purity of the cell population was assessed by morphol ogic,ultrastuctural and immunohistochemi cal characteristics.PAI-1 activity in th e conditioned media of third passage HPM C was detected using chromogenic substra te method.Results Compared with controls,PAI-1 activity in the cond itioned media of HPMC was significantly increased by stimulation with IL-1β or T NF-α for 24 hours at the level of 0.2μg/ L(IL-1β:q=3.76,P<0.05;TNF-α:q=4.91 ,P<0.0 1),2.0μg/L(IL-1β:q=10.72,P<0.01;TNF- α:q= 14.49,P<0.01) and 20μg/L(IL-1β:q=22. 81,P< 0.01;TNF-α:q=23.47,P<0.01),but there wa s no significant difference between resp onses to IL-1β and TNF-α.Conclusion The results suggest that proinflamm atory cytokines mediate the release of P AI-1 by HPMC in vivo,and so may affect t he deposition of fibrin within the pleur al cavity and favor fibrogenesis.
, 百拇医药
【Key words】 Pleura Mesothelial cells Cytokines Plasminogen activator in hibitor-1
目前针对腹膜间皮细胞的研究在方法和观点上趋于成熟,已证 实前炎症细胞因子脂多糖(L PS)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)可诱导腹膜 间 皮细胞合成PAI-1[1~3],鉴于胸膜和腹膜在组织学上均系间皮细胞,起源 于中胚 层体腔膜,所以具有借鉴意义,为此我们分离培养了人胸膜间皮细胞(HPMC),并对细 胞因子诱导HPMC释放PAI-1效应进行研究。
材料和方法
一、研究对象
胸膜腔积液标本取自我院呼吸科住院以及门诊14例胸膜腔积液患 者,经HPMC细胞纯度鉴定有6例胸膜腔积液标本达到实验要求。
, 百拇医药
二、主要试剂
DMEM/F12细胞培养液(Hyclone公司);转铁蛋白(Sig ma公司);新生牛血清(杭州四季清生物研究所);胰蛋白酶(Sigma公司);重组 人细胞因子IL-1β、TNF-α(Promega公司);抗细胞角蛋白、抗波形蛋白 、抗第Ⅷ因子相关抗原和抗CD45抗原的鼠抗人单克隆抗体(DAKO公司);ABC kit(DAKO公司);PAI-1活性测定试剂盒(上海医科大学分子学遗传室)。[ JP〗
三、方法
1.HPMC的分离和体外培养:在无菌条件下经胸穿分别抽取胸膜腔积液200~300m l,分离HPMC后加入DMEM/F12培养液(内含青霉素100KU/L,转铁蛋白 0.5mg/L,胰岛素10U/L,15%新生牛血清等),以1×104/ml细胞 浓度接种于培养瓶内,置于37℃,5%CO2细胞培养箱中培养。
, 百拇医药
2.HPMC细胞纯度的鉴定:(1)细胞学形态观察:使用盖片细胞培养技术将第二代HP MC进行苏木素-伊红(HE)染色后于光镜下观察。(2)细胞表面标志鉴定:以卵白素 -生物素-过氧化物酶复合法(ABC)分别用抗细胞角蛋白、抗第Ⅷ因子相关抗原和抗C D45抗原的鼠抗人单克隆抗体做免疫细胞化学染色。(3)细胞超微结构观察:透射电 子显微镜观察时先取足量HPMC细胞悬液,离心后戊二醛固定,经醋酸铀染色、丙酮梯度 脱水、包埋后超薄切片,上支持膜电镜观察;扫描电子显微镜时先用盖片培养技术将HPM C分别经戊二醛和四氧化锇固定、丙酮/醋酸异戊脂脱水、临界点干燥、喷金后电镜观察 。
3.PAI-1活性检测:将第二代培养的HPMC用胰蛋白酶消化,用不含新生牛血清的D MEM/F12将第三代HPMC调成浓度为2×105/ml细胞悬液,在96孔细胞 培 养板中每孔加100μl,同时分别加入细胞因子IL-1β或TNF-α,使其终浓度分 别为A组0.02μg/L、B组0.2μg/L、C组2.0μg/L、D组20.0μ g/L,并设空白对照组,孵育24小时后吸取上清,参照张欣平等[4]的方法使用PAI-1活性测定试剂盒检测其中PAI-1活性。
, 百拇医药
四、统计学处理
实验数据以
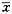 ±s表示,采用多组资料方差分析(ANOVA)F检验, 若有组间差异进行两样本均数间q检验(Newman-Keuls法),P<0 .05时有统计显著差异。
±s表示,采用多组资料方差分析(ANOVA)F检验, 若有组间差异进行两样本均数间q检验(Newman-Keuls法),P<0 .05时有统计显著差异。结果
一、HPMC纯度鉴定
在相差显微镜下可见贴壁生长的HPMC为单层扁平细胞,呈多边 形;HPMC经HE染色后为胞浆薄染成淡粉红色、中央为一深蓝色扁圆形核;HPMC经 免疫细胞化学染色后为抗细胞角蛋白和抗波形蛋白阳性,抗第Ⅷ因子相关抗原和抗CD45 抗原阴性;在透射电子显微镜下可见HPMC细胞表面有微绒毛,细胞内有丰富的细胞浆囊 泡以及分化成熟的内质网、线粒体;在扫描电子显微镜下可见HPMC表面大量微绒毛密集 排列成丛状。
, 百拇医药
二、HPMC经不同浓度细胞因子诱导培养24小时后培养液中PAI-1活性变化
采用 直线回归法得出标准曲线方程为Y=0.899-0.145X,r=-0.996。 实验 结果显示:①细胞因子浓度为0.20μg/L组、2.0μg/L组与20.0μg/ L组均可使HPMC释放PAI-1显著增加,而0.02μg/L组没有这一显著效应(F=0.11,P>0.05);②q检验显示IL-1β和TNF-α对 HPMC的诱 导效应之间没有显著性差异(见表1,表2)。
表1 HPMC经不同浓度细胞因子诱导24h后培养液中PAI- 1活性变化(U/ml,
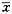 ±s)△*
±s)△*0.02μg/L组
0.20μg/L组
, 百拇医药
2.0μg/L组
20.0μg/L组
对照
IL-1β
TNF-α
对照
IL-1β
TNF-α
对照
IL-1β
TNF-α
对照
IL-1β
, 百拇医药
TNF-α
PAI-1
活性
1.91
±0.76
2.01
±0.62
2.37
±0.92
2.33
±1.18
3.55
±0.42
, http://www.100md.com
3.92
±0.56
2.56
±0.44
9.07
±2.46
11.36
±0.6 1
2.60
±0.27
10.62
±1.35
10.85
, 百拇医药
±0.63
F值
0.11
6.57
56.50
178.65
P值
P>0.05
P<0.01
P <0.01
P<0.01
注:△每组为6例标本的第三代HPMC实验数据;*PAI-1活性 单位U/ml即在25℃,20min内抑制1.0国际单位t-PA活性的量表2 各组间均数q检验值
, 百拇医药
0.2μg/L组
2.0μg/L组
20.0μg/L组
IL-1β
TNF-α
IL-1β
TNF-α
IL-1β
TNF-α
对照
3.76*
4.91**
, http://www.100md.com
10.72**
14.49**
22.81**
23.47**
IL-1β
1.14
3.77
0.65
注:*P<0.05 **P<0.01讨论
不少全身性或肺部疾病会波及胸膜,如肺结核、细菌性肺炎、石棉肺、风湿性关节 炎、部分恶性肿瘤等,导致胸膜发生炎症反应和病理损伤,HPMC作为胸膜的主要细胞群体势必受到影响。国外晚近研究表明HPMC其作用不仅 仅 是超滤胸膜腔积液和作为分子转运的屏障,而且主动参与胸膜腔的抗感染和免疫应答反应[5]。对胸膜纤维化机制进行研究的临床意义主要在两个方面:(1)首先是在感 染 性胸膜炎,如肺炎旁渗出液(PPE)、脓胸、结核性胸膜炎等,在使用有效抗生素和充分 引流后仍不能完全避免胸膜的粘连、纤维化和胸膜增厚,重者可能形成纤维胸,导致肺膨胀 受限、呼吸功能减退。此外,在结核性胸膜炎的治疗方案上,目前国外已有学者否定在化疗 基础上 加用糖皮质类固醇激素防治胸膜粘连、纤维化的传统观点[6],所以在感染性胸膜 炎如何 进一步防治胸膜粘连、纤维化可能面临寻求新的突破口。(2)对恶性胸膜腔积液(MPE )、反复自发性气胸施行的胸膜粘连术,是一种人为形成的胸膜粘连、纤维化,却有积极的 临床意义,如遏止MPE无限增加或气胸反复发生、减轻MPE的呼吸压迫症状和避免蛋白 大量丢失。虽然胸膜粘连术已积累大量临床经验,但对其治疗机制上的认识仍不统一。总之 ,亟待对胸膜纤维化机制进行深入研究,有助于临床治疗按病情需要选择抑制或促进胸膜纤 维化进程。
, http://www.100md.com
PAI是组织型纤溶酶原激活物(t-PA)与尿激酶型纤溶酶原激活物(u-PA)的特 异性快速抑制剂。t-PA与u-PA主要生理功能是催化纤溶酶原转变为纤溶酶,后者可 水解血栓或渗出于组织内的纤维蛋白(原)。PAI-1是血浆和组织中主要的PAI,作 用远强于PAI-2,在纤溶系统中起着关键作用,以此调控着纤维蛋白在胸膜腔和腹膜腔 的沉积。在渗出性胸膜腔积液中PAI-1含量是血浆中的80~4000倍,PAI-1 可能来自毛细血管炎性渗出或胸膜腔内细胞的合成[7]。采用免疫细胞化学技术与 分子杂 交技术已证实PAI-1分布于成纤维细胞、嗜中性粒细胞、巨噬细胞等炎症细胞,Ide ll等[8]采用Northern Blot印迹法观察到体外培养的HPMC能 合成PAI- 1和PAI-2,这一过程可被放线菌素与环乙酰胺所阻断,作者认为鉴于HPMC能大量 合成和释放PAI-1,可能是胸膜腔积液中高水平PAI-1的主要来源。
HPMC对胸膜腔积液纤溶/促凝平衡的调控作用日益受到关注,改变了一些临床观念,如 过去认为损伤胸膜是取得良好胸膜粘连术疗效的先决条件,所以临床采用机械性摩擦胸膜或 胸膜部分切除术的办法,确实有一定的效果。而晚近认为在胸膜粘连术中虽然一些炎症细胞 (如嗜中性粒细胞、单核巨噬细胞、成纤维细胞)作用必不可少,但是纤维过程级联反应 的主要启动者是HPMC,越来越多的证据显示HPMC调控着胸膜腔积液纤溶/促凝水平 ,这意味着为获得最佳粘连术效果粘连剂应尽可能分布至最大面积的HPMC膜表面,如果 膜表面被肿瘤细胞、纤维蛋白所遮盖,或者处于低糖、低pH等环境,胸膜粘连术疗效将显 著降低[9]。
, 百拇医药
在本实验中我们观察到前炎症细胞因子TNF-α的诱导作用,而且观察和比较IL-1β 和TNF-α的诱导作用,与Tietze等[5]对腹膜间皮细胞类似研究的结果 基本一致。总之,对细胞因子诱导HPMC释放PAI-1进行深入研究有助于进一步 揭示胸膜 纤维化机制。
参考文献
1.Rougier JP,Guia S,Hagege J,et al.P AI-1 secretion and matrix deposition in huma n peritoneal mesothelial cell cultures:t ranscriptional regulation by IL-1β.Kidn ey Int.1998,54:87-98.
2.陈香美,董柯,傅博.不同浓度葡萄糖对大鼠间皮细胞增殖及细胞外基质产生的影响. 解放军医学杂志,1996;21:112-114.
, 百拇医药
3.Tietze L,Elbrecht A,Schauerte C,et al. Modulation of pro- and antifibrinolytic p roperties of human peritoneal mesothelia l cells by TGF-β1,IL-1β and TNF-α.Thromb Haemost,1998,79:362-370.
4.张欣平,郝勤,宋后燕,等.PAI-1 cDNA表达质粒的构建及其哺乳动物细胞 中的表达.上海医科大学学报,1996,23:176-180.
5.Antony VB,Hott JW,Kunkel SL,et al.Pleu ral mesothelial cell expression of MCP-1 and IL-8.Am J Respir Cell Mol Biol,1995 ,12:581-588.
, 百拇医药 6.Wyser C,Bernard W.Using corticosteroid s to treat tuberculous pleurisy.Chest,19 97,112:291-292.
7.Idell S,Girard W,Koenig KB,et al.A bnor moalities of pathways of fibrin turnover of the human pleural space.Am Rev Respi r Dis,1991,144:187-194.
8.Idell S,Zwieb C,Kumar A,et al.Pathways of fibrin turnover of human pleural mes othelial cell in vitro.Am J Respir Cell Mol Biol,1992,7:414-426.
9.Rodriguez PF,Antony VB.Pleurodesis:Sta te of the art.Eur Respir J,1997,10:1648- 1654.
(收稿:2000-05-08 修回:2000-07-07), 百拇医药