实验性大鼠神经超冷冻保存后同种异体移植的病理学研究
作者:冯一中 郭玉华 李峰
单位:冯一中(苏州大学第二附属医院病理科251004);李峰(苏州大学第二附属医院病理科251004);郭玉华(苏州大学基 础医学部电镜室)
关键词:坐骨神经;同种异体移植;超冷冻保存;大鼠;病理学
江苏医药001215 【摘要】 目的 研究大鼠坐骨神经超冷冻保存处理后同种异体移植的病理学改变及其对修 复的影响。方法 取Wistar大鼠坐骨神经,经超冷冻保存后移植于 SD大鼠,即同种 异体神经移植实验组(A组),未处理的同种异体神经移植组(B组),及SD大鼠同系异 体神经移植组(C组),分别在术后3、8、12和16周用光镜及电镜观察移植神经的病 理变化。结果 神经轴索和雪旺细胞再生在A组同C组相似,明显优于B 组;同时就神经纤 维的变性水肿,淋巴细胞、单核细胞浸润而言,A组较C组反应程度严重,但较B组明显减 轻。结论 超冷冻保存可降低同种异体神经抗原性,减轻免疫反应。在不 用免疫抑制剂的情况下,同种异体神经移植仍具可行性。
异体神经移植成功的关键问题之一是降低其抗原性,为此有人 用酒精储存、冷冻、冷冻-干 燥、辐照等方法处理移植神经及免疫抑制药物的使用[1,2],以减少免疫反应, 但 结果并不理想。为探索同种异体神经移植的可行性,本实验利用超冷冻保存后的同种异体神 经移植,探讨能否减弱其抗原性,观察移植神经再生过程的病理形态学变化。
材料和方法
一、神经制备及超冷冻保存
6只大鼠,雄性,250~300g,10%水合氯 醛按40mg/kg腹腔注射麻醉后取出双侧坐骨神经,符合要求(长度15mm,无损伤 )的神经10条,从20℃逐步到-70℃冷冻后置液氮保存(-196℃),6个月后取 出冻融移植。
二、动物分组与取材
取SD大鼠雄性250~300g作神经移植,实验分三组每组8只 。A组:将经-196℃冷冻6个月的Wistar大鼠坐骨神经移植至SD大鼠;B组: 将未作任何处理的Wistar大鼠坐骨神经移植至SD大鼠;C组:将未作任何处理的S D大鼠坐骨神经移植至SD大鼠。所有移植神经长度为15mm,水合氯醛腹腔麻醉后,从 梨状肌下缘切除10mm坐骨神经,将鼠坐骨神经近远端与植入神经缝合。术后3周、8周 、12周、16周分别取A、B、C组各2只大鼠移植神经检测。
三、光镜标本制备
取材包括坐骨神经移植近侧端和远侧端两个部位,10%甲醛固定24 h,石蜡包埋,分别作纵切面和横断面连续切成5μm,HE常规染色,光镜观察。
四、电镜标本制备
标本一律取自移植神经中段,4%戊二醛固定,按常规制成超薄切片 ,用H-600透射电镜观察。
结果
一、光镜观察
A组:移植3周组神经纤维变粗,大小不一,髓鞘肿胀及空泡变性如泡沫状,神经轴索崩解 、断裂,神经内膜管连续性好。神经束膜、神经内膜和神经外膜均有较多单核细胞、淋巴细 胞浸润,神经内膜和神经束膜有大量新生毛细血管,内皮细胞肿胀。移植8周组神经纤维仍 有水肿,可见稀疏再生轴束出现。移植12周组神经纤维肿胀及淋巴细胞、单核细胞浸润较 前两组减轻,雪旺细胞增生明显,轴索数量较前增加。16周组又较12周组有好转,大量 再生轴索出现,接近正常神经纤维密度,淋巴细胞、单核细胞集中在移植神经远端和神经束 膜及神经外膜(图1见封三)。
B组:移植3周组神经纤维和神经内膜水肿,神经纤维肿胀溶解,空泡变性 ,轴索崩解断裂 ,淋巴细胞、单核细胞浸润,且程度上都较A组3周组严重,新生毛细血管数量较A组少。 移植8周组神经纤维仍肿胀溶解。神经内膜水肿,部分失去连续性,断裂融合成形状不规则 大泡状,部分区域神经内膜难以辨认,炎细胞浸润较3周组有所减轻。12周组炎细胞反应 较8周组减轻,神经内膜和束膜区仍有水肿,空泡变性,部分区域有少量轴索再生。16周 组炎细胞浸润,组织水肿,毛细血管数量均较前减少,再生轴索数量和胶原纤维进一步增加 (图2见封三)。
C组:移植3周组神经纤维间,髓鞘水肿,轴突数量减少,炎细胞浸润 程度和新生毛细血 管数量均少于A组。8周组神经纤维间水肿,新生毛细血管与A组相似,再生轴索数量较A 组多,单核细胞、淋巴细胞浸润程度较A组、B组轻。12和16周组C组炎症反应,组织 水肿均较A组、B组轻,轴索再生稍多于A组,明显多于B组(图3见封三)。
二、电镜观察
A组:移植3周组神经束膜断裂,束膜上皮细胞及雪旺细胞胞浆内含大量脂滴,髓鞘质膜 分离,束内神经纤维自溶,空泡变性,髓鞘大小不等,粗细不均。移植8周组神经束膜完 整,见大量有髓、无髓神经和再生轴索。移植12周组轴索位于椭圆形雪旺细胞一侧,髓 鞘粗细大小不均,束膜外胶原增生。移植16周组:神经束膜、束膜上皮、神经内膜、神经 外膜完整,束内雪旺细胞包缠多个有髓、无髓神经纤维(图4见封三),再生轴索发育良好 ,微丝、微管、核糖体、粗面内质网均较丰富。
B组:移植3周组:神经束膜、外膜断裂、束膜与外膜之间水肿严重,有 大量巨核、单核细 胞浸润,神经纤维崩解,雪旺细胞空泡变性,神经纤维再生缺如,比同期A组差。移植8周 、12周组:再生神经纤维少,部分轴索破坏,束膜不完整,另有大量胶原增生,有髓神经 水肿,部分脱髓鞘。移植16周组:神经内膜、外膜、束膜完好,但其间水肿明显,束膜内 雪旺细胞增生,髓鞘粗细不一,再生轴索良好,细胞器丰富,但也有束内髓鞘和轴索溶解, 束内纤维组织增生,束膜外胶原增生(图5见封三),比同期A组差。
C组:移植3周组神经束膜、内膜、外膜均不完整,有的脱髓鞘,或有的 髓鞘水肿,质膜 呈细丝状,排列紊乱,轴索破坏。有新生血管,病变比同期A组、B组为轻,移植8周组 束内神经纤维之间轻度水肿,大多再生轴索好,少数水肿,髓鞘粗细大小不均,比同期A组 、B组好。移植12周组:有髓神经纤维数量较无髓神经纤维多,再生轴索好,细胞器丰富 ,比同期B组好,稍优于A组。移植16周组:神经内膜、神经外膜、束膜完整,可见束膜 上皮,神经细胞多个神经束膜内见有髓与无髓神经纤维。雪旺细胞细胞器丰富,包缠多个 髓鞘,髓鞘呈致密带,多层,多个轴索可见微丝、微管、线粒体小泡、质膜反褶(图6见封 三)。

图1 A组神经移植后16周,大理再生轴索和雪旺细胞出现,接近正常神经密度,仍可见少量炎细胞浸润。HE×400
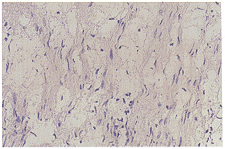
图2 B组神经移植后16周,再生轴索数量和胶原纤维进一步增加,神经内膜,神经束膜仍有水肿和空泡变性。HE×200
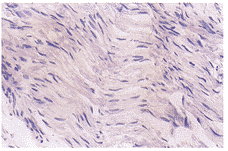
图3 C组神经移植后16周。轴索和雪旺细胞再生明显,炎症反应与组织水肿均较同期A组,B组轻。HE×400

图4 A组移植后16,周,神经外膜,束膜内膜完整,束内见雪量细胞包缠有髓,无髓神经纤维×3750
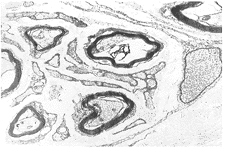
图5 B组移植后16周,神经原纤维间,束膜水肿明显,髓蒜粗细胞大小不均,束膜外胶原增生。×7500
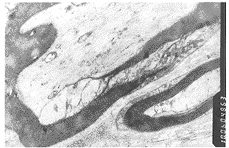
图6 C组移植后16周,有髓神经纤维贺索内可见微丝,微管,线粒体,小泡,质膜反褶×1500
讨论
外周神经同种异体移植遭宿主免疫排斥是阻止移植神经修复成功的关键因素[3]。 尽管宿主免疫抑制剂的使用可有效阻止同种异体神经移植排斥反应,但长期使用也会产生不 利于神经损伤修复的作用。据报道超冷冻保存法可降低移植神经抗原性[4]。本实 验用超冷冻保 存后的同种异体神经移植修复大鼠坐骨神经缺损(A组),并以未冷冻处理同种异体神经移 植(B组)和同系异体神经移植(C组)对照。根据形态学观察,C组优于A组,两组均明 显优于B组。A组和B组除了前者异体神经作超冷冻处理外,其它供体和受体条件都是相同 的,但两组炎症反应和轴索再生都有明显区别,A组优于B组。进一步证实冷冻处理可使神 经抗原性降低,排斥反应减弱。
有人认为神经移植前冷冻处理的最大益处在于可迅速移除和杀伤雪旺细胞和髓鞘碎片后,保 留雪旺细胞基底膜,清除和降低同种异体移植中对雪旺细胞的免疫反应,使雪旺细胞基底膜 可成再生轴索的有效导管。实验显示移植段雪旺细胞成活数量与移植段神经轴索生长并形成 有髓神经中起重要作用。髓鞘是雪旺细胞膜的衍生物质,在维持神经正常传导功能方面起重 要作用。本实验超微结构发现在不同实验组,髓鞘的再生程度有差异。A、B、C三组中, B组再生过程中髓鞘较薄。
结论 经超冷冻保存处理的同种异体神经移植,神经轴索再生与同系异体神经移植相似,明 显优于未处理的同种异体神经移植,说明超冷冻处理可降低同种异体移植神经的抗原性,减 少排斥反应,在不使用免疫抑制剂的情况下,同种异体神经移植仍具可行性,为同种异体神 经移植进行了有益的探索。
参考文献
1.Zalewsk AA,Gulati AK.Evaluation of his tocompatibility as a factor in the repai r of nerve with a frozen nerve allograft .J Neurosurg,1982,56:550-554.
2.Zalewsk AA,Gulati AK.Survival of nerve allografts in sensitized rats treated w ith cyclosporin A J Neurosury,1984,60:82 8-834.
3.Dumont CE,Hentz VR,Enhancement of axon growth by detergent-extracted nerve gra fts,Transplantation,1997,63:1210-1215.
4.Tajima K,Tohyama K,Ide C,et al,Regener ation through nerve allograft in the cyn omolgus monkey (macaca fascicularis),J B one Joint Surg,1991,73:172-182.
(收稿:2000-06-20 修回:2000-09-12)
|
閻庣敻鍋婇崰鏇熺┍婵犲洤妫橀柛銉㈡櫇瑜帮拷
闂佺ǹ绻楀▍鏇㈠极閻愮儤鍎岄柣鎰靛墮椤庯拷
闁荤姴娲ょ€氼垶顢欓幋锕€绀勯柣妯诲絻缂嶏拷
闂佺懓鍚嬬划搴ㄥ磼閵娾晛鍗抽柡澶嬪焾濡拷
|

