白细胞介素2对大鼠垂体前叶细胞雌激素受体蛋白含量和基因表达的影响
 |
 |
 |
第四军医大学基础部生理教研室;西安 710032 张庆红;朱运龙;胡玉珍;张万会;陈健康;王复周
关键词:白细胞介素2;雌激素受体;信号转导;垂体
摘要:采用原代无血清细胞培养技术结合免疫组织(细胞)化学和半定量反转录-PCR方法, 观察白细胞介素2 (IL-2)对大鼠垂体前叶雌激素受体(ER)蛋白含量和基因表达的影响, 以探讨IL-2和ER在大鼠垂体前叶的相互关系。结果显示: 在大鼠垂体前叶细胞有IL-2受体表达。在无血清培养条件下, IL-2能增加ERα蛋白含量, 促进ERα基因表达, 而对ERβ的作用正好相反。rhIL-2 (10 μg/L)作用48 h后, ERα阳性细胞平均光密度值从48.740±4.567增高到81.188±6.619, ERβ从102.560±6.250减少到72.718±7.623; ERα/β-actin mRNA比值从0.1511增加到0.4334, ERβ/β-actin mRNA比值从0.3822降低到0.1528。结果表明: 在无血清细胞培养条件下, IL-2可影响大鼠垂体前叶ERα和ERβ蛋白水平和基因表达, 提示在大鼠垂体前叶IL-2对ER有调控作用。
, 百拇医药
白细胞介素2(IL-2)是神经免疫内分泌系统间共享的信息分子, 它不仅调节淋巴细胞增殖和分化, 对垂体前叶细胞增殖和激素分泌也有影响。雌激素受体(ER)是一种核受体, 属于类固醇受体超家族, 介导雌激素对垂体前叶细胞增殖和激素分泌作用[1]。ER有两个亚型, α和β, 两者介导的信号转导效应几乎完全相反[2]。Newton等报道IL-2能促进GH3垂体瘤细胞系ER的转录活性, 并可促进ER所调控的孕激素受体和催乳素蛋白水平升高[3]。本研究从细胞和分子水平观察了IL-2对大鼠垂体前叶细胞ER表达的影响, 以阐明细胞因子对神经内分泌系统可能的调节作用。
1 材料和方法
1.1 大鼠垂体前叶细胞原代培养 雌性SD大鼠(150~200 g)由本校动物中心提供。 戊巴比妥钠(40 mg/kg)腹腔麻醉, 用无菌注射器从左心室向主动脉方向灌注无菌生理盐水20 ml, 冲净垂体中的血细胞。将大鼠浸于70%的酒精中10 min, 暴露垂体, 小心去掉垂体后叶, 收集垂体前叶于小瓶中剪碎。 用0.25%的胰酶和1% DNA酶(华美公司) 1∶1消化2次, 每次10~15 min。用含血清的培养基终止胰酶的消化作用, 离心10 min, 弃上清, 将细胞重悬于含10% FCS的D/F12 (Gibco)培养基中, 细胞浓度为4×105~5×105/ml, 铺于90 mm的培养皿中或24孔板内用多聚赖氨酸包被的小盖玻片上, 于含5% CO2的37℃孵箱中孵育。第2天换有血清培养基, 第4天用无血清培养基洗2遍后, 在加有添加剂的无血清培养液中继续培养48 h。添加剂包括30 nmol/L硒酸钠和10 mg/L转铁蛋白(Sigma)、 0.6 g/L谷胺酰胺、 5 mg/L胰岛素、 100 μmol/L腐胺、 5 g/L葡萄糖、 1 g/L牛血清白蛋白、 青霉素、 链霉素、 10 mmol/L HEPES(国产分析纯试剂)。最后在含添加剂的无血清培养液中加入rhIL-2 (10 μg/L, Promega), 和对照组一起继续培养48 h。
, 百拇医药
1.2 免疫组织(细胞)化学染色 将雌性SD大鼠用戊巴比妥钠麻醉, 经心脏插管至升主动脉, 用生理盐水50 ml冲去垂体中血液, 将垂体固定于Bouin′s液中4~6 h, 常规石蜡包埋, 从垂体腹侧向背侧行厚7 μm切片, 进行IL-2Rβ和ERβ的ABC法免疫组化双重染色。 24孔板内小盖玻片上的细胞用Bouin氏液固定, 进行兔抗鼠ERα或羊抗鼠ERβ (Santa Cruz 1∶1?000)常规ABC法染色, 每组4个孔, 硫酸镍铵-DAB法显色。阴性对照中正常兔血清(1∶20)取代第一抗体。
1.3 显微摄影图像分析及数据处理 用Olympus显微镜对ERs阳性细胞进行显微摄影。用Leitz图像分析仪对ER阳性细胞进行检测, 每组抽取4张切片, 测量50个阳性细胞的光密度, 用均数±标准差表示, 用t检验进行统计学处理。
1.4 总RNA提取 在Φ90 mm的培养皿中, 采用异硫氰酸胍提取总RNA。首先用DEPC-0.01 mol/L PBS冲洗细胞3次, 每平皿加入1 ml TRIzo1 (Gibco BRL, USA), 室温放置10 min, 用细胞刮刀收集细胞于Eppendorf管中, 加入0.2 ml氯仿, 震荡混匀, 以9?000 r/min离心10 min, 取上层水相, 加等体积异丙酮混合, 室温孵育10 min。于4℃以15?000 r/min离心15 min,弃上清。沉淀块用70%乙醇冲洗后, 以20 μl DEPC处理的去离子水溶解。将溶解的总RNA加入含0.01 mol/L Tris-HCl、0.05 mol/L KCl、1.5 mmol/L MgCl2、2.5 mmol/L DTT、 1 U Dnase I (Boehringer Mannheim,Germany)的溶液中, 37℃水浴中孵育1 h, 然后于95℃处理3 min, 用酚/氯仿/异戊醇抽提, 以乙酸钠/乙醇沉淀。将RNA沉淀溶解于DEPC处理的水中, 用分光光度计(Hitachi U-2001, Japan)测量RNA浓度, 于-80℃保存备用。
, http://www.100md.com
1.5 反转录合成 在50 μl的反应体积中加入5 μg总RNA, 5×反应缓冲液10 μl, 10 mmol/L dNTPs 5 μl, Rnasin (WAKO, Japan 40 U/μl) 0.5 μl, oligod (T) 12~15 (Gibco BRL) 0.25 μg,反转录酶(M-MLV, Gibco BRL, 200 U/μl) 3 μl, 0.1 mol/L DTT 0.5 μl, 置于37℃孵育1 h, 然后在65℃加热5 min, 储存于-20℃。
1.6 引物设计和合成 按照已报道的ERα、ERβ和β-actin的特异性引物序列,由Applied Biosystems Model 394 DNA合成仪合成引物。 ERα: 正链5′-GGT CCA ATT CTG ACA ATC GAG C -3′, 反链5′-TTT CGT ATC CCG CCT TTC ATC,304 bp; ERβ: 正链5′-AAC ACT TGC GAA GTC GGC AG-3′, 反链5′-AAC CTC AAA AGA GTC CTT GGT GTG-3′173 bp; β-actin: 正链5′-TGG TGG GTA TGG GTC AGA AGG ACT C-3′,反链5′- CAT GGC TGG GGT GTT GAA GGT CTC A -3′, 265 bp。合成的引物用18%的变性聚丙烯酰胺凝胶电泳进行检测。
, 百拇医药
1.7 PCR扩增 在25 μl的反应体积中加入合成的cDNA 0.1 μg, 10×PCR缓冲液2.5 μl, d NTPs (2 mmol/L) 2.5 μl, MgCl2 (25 mmol/L) 2.5 μl, 各引物(20 pmol/μl) 1 μl, TaqDNA聚合酶(5 U/μl, Takara,Japan)0.5 μl。使用PTC-100 PCR仪(PTC-100 MJ Research, USA)进行热循环。循环条件: 93℃ 1 min, 60℃ 30 s, 72℃ 1 min, 进行1个循环; 93℃ 30 s, 60℃ 30 s, 72℃ 1 min, 进行35个循环, 72℃延伸8 min。取各扩增产物5 μl, 经3% 琼脂糖(FMC, USA)凝胶电泳, 溴化乙锭染色后, 用UVP成像系统进行检测, 并用Labworks软件对各阳性条带的密度进行测定。
2 结果
2.1 大鼠垂体前叶IL-2Rβ的分布
, 百拇医药
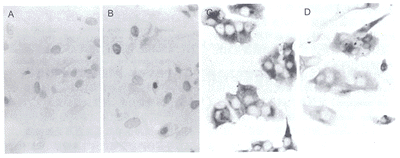
大鼠垂体前叶有IL-2Rβ免疫反应阳性细胞分布, IL-2Rβ免疫反应阳性物质呈蓝色, 位于细胞膜。ERβ免疫反应阳性物质呈棕褐色, 位于细胞浆, 和IL-2Rβ共存于一个细胞(图1)。
图 1. IL-2Rβ 免疫反应阳性细胞在大鼠垂体前叶的分布
Fig. 1. Distribution of IL-2Rβ immunoreactive cells in the an~terior pituitary of rats. ×200.
2.2 IL-2 对ER mRNA 表达的影响
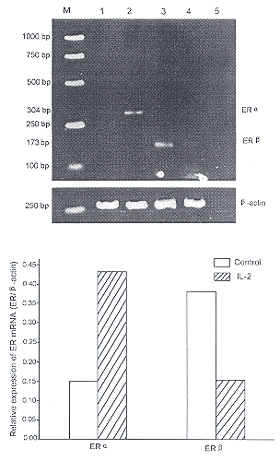
用RT-PCR法在正常雌性大鼠垂体前叶原代培养细胞中检测到的ERα和ERβ mRNA, 分别为304 bp和173 bp, 符合设计的片段大小。在无血清培养条件下, 细胞内ERα mRNA 表达水平较低, 低于ERβ; IL-2 (10 μg/L)作用48 h后, ERα mRNA 表达增加, 而ERβ mRNA 表达减少(图2), ERα/β-actin mRNA 比值从0.1511增加到0.4334, ER β/β-actin mRNA 比值从0.3822减少到0.1528。
, http://www.100md.com
2.3 IL-2对ER蛋白含量的影响
ERα阳性细胞为胞核染色, ERβ为胞浆染色。在无血清培养条件下, 仍旧能检测到有较低水平的ERα免疫反应阳性物质(48.740±4.567, 图3A), hrIL-2 (10 μg/L)能提高ERα免疫反应阳性物质含量(81.188±6.619, P<0.01, 图3B), 表现在细胞数和细胞光密度都明显增加, 此外细胞体积也增大。hrIL-2却能降低ERβ免疫反应阳性物质含量(图3C: 102.560±6.250, 图3D: 72.718±7.623, P<0.01)。
图 2. RT-PCR 扩增的大鼠垂体前叶细胞ERs mRNA 电泳分析
Fig. 2. Electrophoresis analysis of ERs mRNA (upper panel) expression in the anterior pituitary cells by RT-PCR. Lower panel: β-actin; M: DNA marker; lane 1 and 3: normal pituitary cell; lane 2 and 4: pituitary cell after IL-2 treatment; lane 5: blank control which contains no templates.
, 百拇医药
图 3. IL-2对无血清培养的大鼠垂体前叶细胞ER表达的影响
Fig. 3. Influence of IL-2 on the expression of ERα (A,B) and ERβ (C,D) in control cells (A,C) or cells treated with IL-2 for 48 h (B,D). ×400.
3 讨论
IL-2可促进大鼠垂体前叶细胞增殖和激素分泌[4], 在大鼠垂体前叶也广泛分布着IL-2及其受体[5], IL-2受体有3个亚单位α、β和γ。我们也发现, 在大鼠垂体前叶存在IL-2Rα、β和γ免疫反应阳性细胞, 以IL-2Rβ含量最多, 且和ERβ共存, 提示IL-2可能以旁分泌或自分泌方式调节垂体前叶细胞的功能。
, 百拇医药 IL-2受体的3个亚单位均无内在的酪氨酸激酶活性, 因此必须通过胞内酪氨酸激酶转导信号, 该信号系统中的一些分子被多种生长因子受体所共享,而多肽生长因子和ER存在交互作用, 生长因子能直接激活ER[6]。因此, 我们推测细胞因子IL-2和生长因子可能有相似的信号转导通路。本实验结果表明, 在无血清细胞培养条件下, IL-2可影响大鼠垂体前叶ER的蛋白含量和基因表达, 表明IL-2对ER有直接调控作用。
我们发现IL-2对大鼠垂体前叶ERα和β的调控作用相反, 提示ERα和β在介导IL-2的促细胞增殖效应中作用不同。文献报道, 雌二醇可促进ERα转录活性, 而抑制ERβ转录活性, 雌激素阻断剂可上调ERβ而抑制ERα, 表明ERα和β对配体的调控反应不同[7]。ERα和β在氨基酸序列上有高度同源性, 但C-末端的转录激活功能区序列明显不同, 因而两者转录激活方式不同; 此外, ERβ还可抑制ERα转录活性。受体的这种自身调节, 可使细胞避免对配体的反应过强而引起不良反应。
, http://www.100md.com
Wilson发现, 在体的成年雌性大鼠垂体ERα mRNA 表达高于ERβ mRNA, 而青春期雌性大鼠的ERα mRNA 表达低于ERβ mRNA[8]。 但在我们的实验中, 成年雌性大鼠垂体在无血清培养的条件下ERα mRNA 表达低于ERβ mRNA, 这可能是因为缺少生长因子和细胞因子的刺激所致, 也提示ERβ对刺激的反应和ERα迥然不同。另外, 细胞内两个亚型的相对表达水平, 也决定了细胞对外界信号的不同反应[1]。如在垂体, 有的细胞两个亚型都有表达, 有的只表达其中一种类型, 这就决定了不同的细胞对拮抗剂或协同剂反应不同, 这也是雌激素组织选择作用的基础。
Supported by the National Natural Science Foundation of China (No.39870319)
朱运龙,Corresponding author. Tel: 029-3374571; E-mail: Zhuyl@fmmu.edu.cn
, 百拇医药
张庆红(第四军医大学基础部生理教研室, 西安 710032)
朱运龙(第四军医大学基础部生理教研室, 西安 710032)
胡玉珍(第四军医大学基础部生理教研室, 西安 710032)
张万会(第四军医大学基础部生理教研室, 西安 710032)
陈健康(第四军医大学基础部生理教研室, 西安 710032)
王复周(第四军医大学基础部生理教研室, 西安 710032)
参 考 文 献
[1] Hall JM, Mcdonnell DP. The estrogen receptor-isoform (ERβ) of the human estrogen receptor modulates ERα transcriptional activity and is a key regulator of the cellular response to estrogen and antiestrogen. Endocrinology, 1999, 140 (12): 5566~5578.
, 百拇医药
[2] Kato S, Endoh H, Masuhiro Y et al. Activation of the estrogen receptor through phosphorylation by mitogen-activated protein kinase. Science, 1995, 270 (5241): 1491~1494.
[3] Newton CJ,Arzt E,Stalla GK. Involvement of the estrogen re~ceptor in the growth response of pituitary tumor cells to interleukin-2. Biochem Biophys Res Commun, 1994, 205 (3): 1930~1937.
[4] Arzt E,Buric R,Stelzer G et al. Interleukin involvement in anterior pituitary cell growth regulation: effects of IL-2 and IL-6. Endocrinology, 1993, 132 (1): 459~477.
, 百拇医药
[5] Arzt E, Stelzer G, Renner U et al. Interleukin-2 and in~terleukin-2 receptor expression in human corticotrophic adenoma and murine pituitary cell cultures. J Clin Invest, 1992, 90 (5): 1944~1951.
[6] Ignar-Trowbridge DM, Pimentel M, Parker MG et al. Peptide growth factor cross-talk with the estrogen receptor requires the A/B domain and occurs independently of protein kinase C or estradiol. Endocrinology, 137 (5): 1735~1744.
, http://www.100md.com [7] Paech K, Webb P, Kuiper GGJM et al. Differential ligand ac~tiva~tion of estrogen receptor ERα and ERβ at AP1 sites. Science, 1997, 277 (5331): 1508~1510.
[8] Wilson ME, Price RH, Handa RJ. Estrogen receptor-β mes~sen~ger ribonucleic acid expression in the pituitary gland. Endocrinology, 1998, 139 (12): 5151~5156.
Received 2000-04-24 Accepted 2000-06-26, 百拇医药