雌激素诱发大鼠原位与移植垂体催乳素瘤中催乳素基因与TGFα和TGFβ1基因的表达
 |
 |
 |
吴雪梅;张荣;许荣;中国医学科学院基础医学研究所;中国协和医科大学基础医学院生理研究室;北京;100005;许建萍中国医学科学院、;中国协和医科大学肿瘤医院内科;北京;100021 吴雪梅;许建萍;张荣;许荣焜
关键词:PRL瘤;移植;转化生长因子;Northern印迹杂交
摘要:利用本实验室建立的17β-雌二醇(17β-estradiol, E2)诱致Sprague-Dawley (SD)大鼠原位垂体和异体移植于肾囊的垂体同时形成催乳素(prolactin, PRL)瘤的动物模型, 采用Northern印迹杂交方法, 我们观察了E2长期作用(120 d)后诱发的原位与移植垂体 PRL瘤中PRL基因和两种转化生长因子(transforming growth factor, TGF) TGFα和TGFβ1基因表达水平的改变。结果表明: 在E2长期作用后, 原位垂体与异体移植于肾囊, 从而远离下丘脑的垂体均可形成垂体PRL瘤; 原位与移植垂体PRL瘤中均表现PRL基因的高表达, 但移植瘤中的PRL基因表达水平低于原位垂体瘤; 此外, 仅在原位垂体PRL瘤中发现上述两种转化生长因子呈较高水平的表达, 移植垂体PRL瘤与正常垂体中均检测不到这两种转化生长因子的表达。上述结果提示, TGFα和TGFβ1可能涉及E2诱发的原位垂体PRL瘤形成; E2诱发原位与移植垂体形成PRL瘤的机制可能不尽相同。
, 百拇医药
垂体催乳素(prolactin, PRL)瘤的发病原因一直是人们争论的焦点之一, 即垂体PRL瘤的发生是继发于下丘脑病变还是原发于腺垂体本身[1]; 此外, 17β-雌二醇(E2)长期作用可以诱发敏感种系大鼠形成垂体PRL瘤并伴发高PRL血症[2], 其机制至今尚不完全清楚。近年来, 生长因子作为机体内广泛存在的自分泌/旁分泌调节性多肽, 在肿瘤发生过程中的作用越来越引起重视。在雌激素敏感性乳腺癌的研究中发现, 生长因子, 特别是转化生长因子(transforming growth factor, TGF) TGFα和TGFβ1可能是雌激素作用的局部介质[3]。在正常垂体前叶细胞中已发现了某些生长因子(如表皮生长因子, 转化生长因子α和β1等)及其受体的表达, 表明生长因子可能是垂体生长与功能的生理性调节因子; 在垂体瘤或垂体瘤细胞株中某些生长因子的表达和/或功能发生改变, 又提示这些生长因子可能参与垂体瘤的形成[4]。本实验首先采用SD大鼠垂体异体移植及背部埋植药泵方法, 观察在E2长期作用条件下对原位与移植垂体重量及血浆PRL水平的影响, 证明了E2诱发的垂体PRL瘤可以原发于腺垂体水平; 随后利用Northern印迹杂交检测了原位与移植垂体瘤中PRL、TGFα和TGFβ1 mRNA表达水平的改变, 从整体与分子水平探讨了E2诱发垂体PRL瘤形成的部分机制。
, 百拇医药
实验选用SD大鼠, 雄性, 体重80~100 g。17β-雌二醇为美国Sigma公司产品; PRL放免(RIA)测定试剂盒由美国NIDDK提供; PRL-SP65#I质粒 (含PRL cDNA, 725 bp EcoRI)由美国Iowa大学R.A. Maurer博士惠赠; pmTGFβ1-A质粒 (含TGFβ1 cDNA, 900 bp, SmaI)、pMMTV-TGFα质粒(含TGFα cDNA, 974 bp, EcoRI)由美国Vanderbilt大学H.L. Mose博士赠送; DNA随机引物标记试剂盒购于美国Promega公司; [α-32P]dATP购于亚辉生物医学公司。其它试剂为国产分析纯。
E2诱发垂体异体移植大鼠形成PRL瘤动物模型的制备 取体重及年龄相匹配的大鼠分别作为垂体供体鼠与受体鼠, 将一只大鼠断头处死, 无菌条件下迅速取出垂体, 置于生理盐水中; 同时麻醉另一只大鼠, 无菌手术暴露左侧肾脏, 将前面取出的垂体移植于肾包膜下, 缝合切口。然后使其俯卧位, 在腰椎右侧剪开皮肤, 游离皮下组织, 植入装有10 mg E2的硅橡胶管(长1 cm, 内径1.5 mm), 缝合皮肤。设正常大鼠为对照, 背部植入空的硅橡胶管。上述大鼠于洁净环境饲养120 d, 断头处死, 称原位与移植垂体重量, 冻存于液氮中; 取血留作RIA用。
, 百拇医药
PRL的RIA测定 按照NIDDK提供的标准程序改进后测定血浆PRL浓度。
垂体组织总RNA提取 取约100 mg的垂体组织(正常垂体、 原位垂体瘤、 移植垂体瘤), 置于组织匀浆器中, 加入1.2 ml冰预冷变性液(42 mmol/L柠檬酸钠、0.83%十二烷基肌氨酸、0.2 mmol/L β巯基乙醇、 4 mol/L异硫氰酸胍), 冰浴中高速匀浆30 s, 加入1/10体积2 mol/L NaAc (pH 4.0), 充分混匀, 加等体积酸酚/氯仿/异戊醇(25∶24∶1)抽提1次, 转移水相, 加等体积异丙醇-20℃沉淀过夜, 离心(10?000 r/min、 4℃、 15 min), 弃上清, 70%乙醇洗沉淀1次, 干燥后溶于100 μl无RNase水中, 测OD260/OD280确定RNA浓度与纯度, -70℃贮存备用。
Northern印迹杂交 cDNA探针的放射性同位素标记按照Promega公司提供的标准程序进行。 3种垂体总RNA各取22 μg, 在1%甲醛变性琼脂糖凝胶 (含2.2 mol/L 甲醛)中电泳分离RNA, 凝胶经0.1% DEPC水淋洗、 0.05 mol/L NaOH浸泡、 再经0.1% DEPC水淋洗后, 以20×SSC为介质, 虹吸法转膜 (硝酸纤维素膜) 18 h, 剥离硝酸纤维素膜, 6×SSC浸泡后, 80℃干燥1 h; 将膜放入杂交袋, 68℃预杂交2 h, 加入变性的α-32P标记探针 (25 ng), 68℃杂交16~24 h, 依次用含或不含SDS的2×、 0.1×SSC洗膜, 保鲜膜包裹滤膜, 置于暗盒中, 压X光片1~2张, -70℃放射自显影24~48 h, 暗室中取出X光片, 显影、 定影后观察。
, 百拇医药
数据处理 将Northern杂交结果在Pharmacia L K B Ultroscan XL激光光密度计上于633 nm波长下作灰度扫描, 以其吸收峰的积分值作为mRNA含量的参数; Northern印迹杂交重复3次(n=3)。以两小样本均数的t检验进行统计分析。
实验结果如下:
1. E2长期作用对垂体异体移植大鼠原位与移植垂体的影响
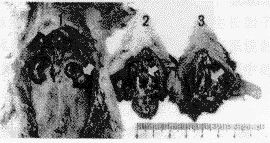
E2作用120 d后, 原位垂体与移植于肾囊的异位垂体体积与重量均较正常大鼠垂体显著升高(图1), 达对照组的3倍以上(P<0.05~0.001); 同时血浆PRL水平较正常大鼠显著升高, 可达对照组的200倍(P<0.001)(表1)。 根据Clifton等[2]的标准, 垂体重量升高为正常大鼠的3倍以上, 并伴高PRL血症即可诊断为垂体PRL腺瘤形成。本实验E2长期作用后的原位垂体与移植垂体均达到形成垂体PRL瘤的诊断标准。
, 百拇医药
图1 E2给药120 d后SD大鼠原位和移植垂体同时形成PRL瘤
Fig.1 Eutopic and ectopic pituitary PRL tumors in SD rats formed simul~tan~eously after treatment with E2 for 120 days
1. Ectopic pituitary treated with E2 for 120 d. 2. Eutopic pituitary treated with E2 for 120 d. 3. Normal pituitary of control rat.
表1 E2诱发SD大鼠形成PRL瘤期间大鼠垂体重量和血浆PRL水平的比较
, http://www.100md.com
Table 1 Comparison of the weight of the pituitary and plasma PRL level during the formation of prolactinoma induced by E2
Group
n
PW (eutopic)
PW (ectopic)
Plasma PRL
(mg,x±Sx)
(ng/ml,mg,x±Sx))
Control
, 百拇医药
10
9.5±0.5
14.2±4.6
Transplantation+E2
11
171.1±44.4**
28.8±7.2*
3082.7±226.5**
*P<0.05, **P<0.001 vs control group.
2. E2诱发的原位与移植垂体PRL瘤中PRL、TGFα和TGFβ1基因表达水平的改变
, http://www.100md.com
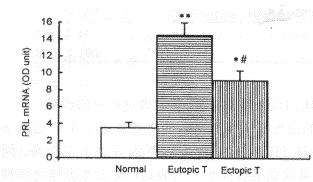
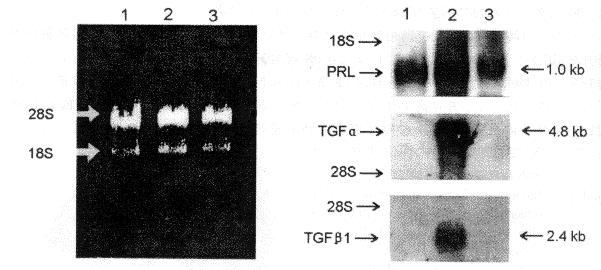
Northern印迹杂交结果表明, E2诱发的原位与移植垂体PRL瘤中PRL基因的表达水平均较正常对照组显著增高, 其中又以原位垂体PRL瘤组织中PRL基因表达水平最高; 同时, 原位垂体PRL瘤组织中TGFα和TGFβ1基因也呈较高水平的表达, 而正常垂体与移植垂体瘤组织中检测不到上述两种转化生长因子基因的表达(图2)。对PRL基因的Northern印迹杂交结果进行灰度扫描, 表明原位与移植垂体PRL瘤中PRL基因的表达水平分别为正常对照组的4.1倍和2.6倍(P<0.05~0.01); 原位垂体PRL瘤中PRL基因的表达水平显著高于移植垂体PRL瘤, 约为后者的1.6倍(P<0.05)(图3)。
图2 大鼠正常垂体、原位和移植垂体PRL瘤中PRL、TGFα和TGFβ1 mRNA含量的Northern印迹分析
Fig.2 Northern blot analysis of the PRL, TGFα and TGFβ1 mRNA contents in normal pituitary, and eutopic and ectopic pituitary PRL tumors of SD rats
, http://www.100md.com
1. Normal pituitary. 2. Eutopic pituitary tumor. 3. Ectopic pituitary tumor. Left: staining of total RNA with ethidium bromide after electrophoresis
图3 大鼠正常垂体、原位和移植垂体PRL瘤中PRL mRNA含量的比较
Fig.3 Comparison of the PRL mRNA con~tent in normal pituitary, and eutopic and ectopic pituitary PRL tumors of rats*P<0.05,**P<0.01 vs normal pituitary; #P<0.05 vs eutopic pituitary tumor.
, http://www.100md.com
以前的工作已表明, E2长期作用于敏感种系大鼠可以导致原位垂体前叶PRL细胞增生、PRL大量分泌, 以及PRL腺瘤形成[5~7]。虽然体内许多因素都可以导致血浆PRL水平升高, 但除垂体PRL腺瘤外, 一般不超过200 ng/ml[8]。这种动物模型虽然已被公认是一种最佳的PRL瘤的实验模型, 但不能判断PRL瘤形成的病因是继发于下丘脑异常还是原发于腺垂体的功能自主性腺瘤。为了判断PRL瘤原发于腺垂体的可能性, 我们把一异体垂体移植于外周远离下丘脑的肾囊, 但E2诱发移植于肾囊的垂体PRL瘤的生长远小于原位垂体瘤, 根据形态学的观察结果, 推测可能与肾包膜限制其生长有关。本结果表明在E2作用120 d后, 原位和移植垂体均可同时达到垂体PRL瘤形成的诊断标准, 说明E2对远离下丘脑的移植垂体同样具有诱致PRL瘤作用, 从而证明垂体PRL瘤的发病机制之一有原发于腺垂体的可能性。但本实验研究尚未排除PRL瘤继发于下丘脑异常的另一可能性, 后者正在进一步研究中。
, 百拇医药
转化生长因子最初得名于其体外促细胞转化的功能[9]。近年来, 在多种正常成熟组织中也发现了转化生长因子及其受体的表达。McAndrew等[10]用转基因方法使小鼠PRL细胞内TGFα基因过表达, 可导致垂体PRL瘤形成, 表明TGFα基因的高表达可能与垂体PRL瘤发生有关。本实验中E2诱发的原位垂体PRL瘤中TGFα基因表达增高, 与上述报道一致。TGFβ1是多种上皮来源细胞的生长抑制因子[11], 我们以前的工作也发现TGFβ1抑制体外原代培养的大鼠垂体前叶细胞的增殖活性及PRL基因的表达(本实验室待发表资料)。 但本研究结果却表明, E2诱发的原位垂体PRL瘤中TGFβ1基因表达水平升高, 鉴于这种矛盾现象, 我们认为有以下可能性, 一是离体实验的结果有时不一定能与在体实验结果完全一致; 二是在体比较复杂的情况下, E2可能有促进TGFβ1的多种生理和病理生理功能中除生长抑制外的肿瘤形成的作用, 诸如抑制免疫功能、促血管形成等[11], 从而最终导致PRL瘤的形成; 还有一种可能性是, 虽然TGFβ1的表达水平升高, 但垂体腺瘤细胞对TGFβ1的反应性可能降低, 因为已有报道称E2诱发F344大鼠形成的垂体PRL瘤中TGFβ1的Ⅱ型受体TβR2表达下降[12], 似支持上述推论。
, 百拇医药
此外, 在E2诱发的移植垂体PRL瘤中, 虽然PRL基因也呈较高水平的表达, 但仍低于原位垂体瘤; 而且两种转化生长因子的表达与正常垂体组织相比无显著差异。这些结果一方面提示E2诱发原位与移植垂体形成PRL瘤的机制可能不尽相同; 另一方面, 似又提示神经-内分泌-免疫网络可能涉及原位垂体PRL腺瘤的形成, 因为上述两种转化生长因子也是免疫来源的细胞因子[4], 加之原位垂体的生理和病理生理功能受下丘脑和免疫系统的调节已是众所周知的事实。因此, 关于神经-内分泌免疫网络在垂体PRL瘤形成过程中的作用值得进一步探讨。
*国家自然科学基金资助项目 (No.39770287; No.39870341)
联系作者. Tel: 许荣焜 010-65296462
本工作承蒙帆成实业发展(深圳)有限公司董事长孙敏毅先生的支持和赞助, 特此致谢。
, 百拇医药
作者单位:吴雪梅 张荣 许荣 中国医学科学院基础医学研究所、 中国协和医科大学基础医学院生理研究室, 北京 100005;
许建萍 中国医学科学院、 中国协和医科大学肿瘤医院内科, 北京 100021
*Supported by the National Natural Science Foundation of China (No.39770287; No.39870341)
Corresponding author. Tel: 010-65296462
参考文献
[1] Xia P (夏 朴), Shi YF (史轶繁). Etiology and pathogenesis of pituitary prolactin-producing tumors. For Med Sci (Endocrinol) (国外医学内分泌学分册), 1989, 1: 1~4 (in Chinese).
, 百拇医药
[2] Clifton HK, Meyer RK. Mechanism of anterior pituitary tumor induction by estrogen. Anac Rec, 1956, 125: 65~81.
[3] Dickson RB, Lippman ME. Growth factors in breast cancer. Endocrinol Rev, 16 (5): 559~589.
[4] Renner U, Pagotto U, Arzt E, et al. Autocrine and paracrine roles of polypeptide growth factors, cytokines and vasogenic substances in normal and tumorous pituitary function and growth: a review. Euro J Endocrinol, 1996, 135: 515~532.
, 百拇医药
[5] Lieberman ME. Prolactin synthesis in primary cultures of pituitary cells: regulation by estradiol. Mol Cell Endocrinol, 1982, 25: 277~281.
[6] Daniel RC. Estrogen receptors in human nontarget tissues: biological and clinical implications. Endocr Rev, 1995, 16 (1): 35~62.
[7] Xu RK (许荣焜), Guo CH (郭传海), Huang MY(黄曼影), et al. Induction of rat prolactinoma by 17β-estradiol and its relation to expression of c-myc oncogene. Dev Reprod Biology, 1995, 4 (1): 64~69.
, 百拇医药
[8] Kovacs K. Prolactin-producing tumors of the human pituitary: morphologic features. In: Macleod RM, Thorner, Scapagnini U eds. Prolactin, Basic and Clinical Correlates. Padova: Liviana Press, 1985, 683~692.
[9] Goustin AS, Leof EB, Shipley GD, et al. Growth factors and cancer. Cancer Res, 1986, 46: 1015~1029.
[10] McAndrew J, Paterson AJ, Asa SL, et al. Targeting of transforming growth factor-α expression to pituitary lactotrophs in transgenic mice results in selective lactotroph proliferation and adenomas. Endocrinology, 1995, 136: 4479~4488.
, 百拇医药
[11] Roberts AB, Sporn MB. The transforming growth factor-betas. In: Sporn MB, Roberts AB eds. Peptide Growth Factors and their Receptors: Handbook of Experimental Pharmacology. Springer-Verlag, 1990, 95: 410~472.
[12] Pastorcic M, De A, Boyadjieva N, et al. Reduction in the expression and action of transforming growth factor β1 on lactotropes during estrogen-induced tumorigenesis in the anterior pituitary. Cancer Res, 1995, 55: 4892~4898.
1999-01-30收稿
1999-04-12修回, 百拇医药