不同病程糖尿病大鼠肾脏一氧化氮变化与氧自由基的关系
作者:吴 静 韩秀云 周 军 荆照政 唐 剑
单位:吴 静 韩秀云(附属湘雅医院内分泌科 长沙 410008);周 军(组织胚胎学教研室 长沙 410078);荆照政 唐 剑(附属湘雅医院中心实验室 长沙 410078)
关键词:糖尿病;肾脏;一氧化氮;氧自由基;疾病模型;动物;大鼠
湖南医科大学学报990613
提要 为探讨糖尿病(DM)大鼠肾脏一氧化氮(NO)变化与氧自由基的关系,测定链脲佐菌素(STZ)诱导的DM大鼠及对照组(NC)于病程2,8,16周时肾组织NO含量和一氧化氮合酶(NOS)活性,脂质过氧化物(LPO)水平及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性变化。结果表明:DM大鼠肾脏NO水平及NOS活性随病程的延长由升高至下降;各病程DM大鼠肾脏LPO水平均高于同批NC组,8与16周时,肾组织SOD,POD,CAT活性低于同批NC组。提示STZ诱导的DM大鼠肾脏NO水平的动态变化可能与高血糖所致的肾脏抗氧化机能改变有关。
, http://www.100md.com
中国图书分类号 R587.1
Relationship between nitric oxide and oxygen free radicals in
different duration of diabetes in rat kidney
Wu Jing Han Xiuyun
(Department of Endocrinology, Xiangya Hospital, Hunan Medical Universi ty, Changsha 410008)
Zhou Jun
(Department of Histology and Embryology, Hunan Medical University, Changs ha 410078)
, 百拇医药
To study the relationship between nitric oxide(NO) and oxygen free radi cals in rat kidney of diabetes mellitus(DM), the authors examined the changes of renal tissue NO level and nitric oxide synthase(NOS) activity, lipid peroxidation(LPO) level and superoxide dismutase(SOD), peroxidase(POD) and catalase(CAT) a ctivities in streptozotocin(STZ)-induced diabetic rats and normal controls(NC) at the 2nd, 8th- and 16th-week. The results showed that renal-tissue NO leve land NOS activity were increased at the 2nd week, but decreased at the 8th-and 16th-week; LPO levels were significantly elevated in all DM groups than those in NC groups. SOD, POD and CAT activities dcreased significantly in the 8th and 16th week DM groups compared with those in NC groups. The results suggest that NO level in kidney of STZ-induced diabetic rats dynamically change with the disease course of dvelopment. This change may be related with the change of antioxidation in kidney which high glucose induces.
, 百拇医药
Key words diabetes; kidney; nitric oxide; oxygen free radica ls; disease model,animal; rats
糖尿病肾病(DN)是糖尿病(DM)常见的并发症之一。最近有研究表明,一氧化氮(NO)所致内皮源性舒张机能异常亦参与DN的发病机制,且其变化与氧自由基产生有关[1~3]。氧自由基主要指超氧阴离子(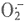 )、羟自由基(OH.)和过氧化氢(H2O2)。糖尿病人在葡萄糖氧化过程中产生大量自由基,而同时肾脏自由基防御机能下降,肾脏抗氧化酶活性减弱[4]。故通过检测肾脏抗氧化酶活性及脂质过氧化物(LPO)水平变化可推测肾脏自由基代谢紊乱的程度。DM自由基和NO的动态变化及其相互关系目前未见深入研究的报道。本实验通过观察不同病程链脲佐菌素(STZ)诱导的DM大鼠肾组织NO含量和一氧化氮合酶(NOS)活性及肾脏抗氧化机能的改变,探讨DM内源性NO的动态变化及相关机制。
)、羟自由基(OH.)和过氧化氢(H2O2)。糖尿病人在葡萄糖氧化过程中产生大量自由基,而同时肾脏自由基防御机能下降,肾脏抗氧化酶活性减弱[4]。故通过检测肾脏抗氧化酶活性及脂质过氧化物(LPO)水平变化可推测肾脏自由基代谢紊乱的程度。DM自由基和NO的动态变化及其相互关系目前未见深入研究的报道。本实验通过观察不同病程链脲佐菌素(STZ)诱导的DM大鼠肾组织NO含量和一氧化氮合酶(NOS)活性及肾脏抗氧化机能的改变,探讨DM内源性NO的动态变化及相关机制。
, 百拇医药
1 材料与方法
1.1 糖尿病动物模型的建立和分组 选择体重150~200g的健康雄性SD大鼠60只(由本院动物室提供),随机分为DM组和正常对照组(NC)。禁食12h后DM组一次性腹腔注射STZ65mg.kg-1(美国Sigma公司生产,用0.1mol.L-1pH4.5的柠檬酸缓冲液配成2%的溶液),3d后选择尿糖强阳性、血糖≥16.7mmol.L-1者为DM大鼠。NC组注射等体积柠檬酸缓冲液。
1.2 取材 于DM形成后2,8,16周,两组各取相同例数的动物,禁食12h后麻醉,采静脉血备测血糖(FBS)。取双肾:右肾于液氮中速冻保存,备测肾组织NO含量、NOS活性、超氧化物歧化酶(SOD)活性及LPO水平;左肾立即冰冻切片,备测过氧化物酶(POD)及过氧化氢酶(CAT)活性。
, 百拇医药
1.3 检测指标与方法 ①血糖测定用葡萄糖氧化酶法。②肾组织NO含量检测用重氮化反应法[5];NOS活性检测用分光光度法[6],其活性单位以每克组织每分钟产生的NO量(nmol.min-1.g-1)表示。药盒均由北京军事医学科学研究所提供。③肾组织SOD活性用黄嘌呤氧化法测定;LPO水平采用化学比色法,以丙二醛(MDA)表示。药盒均由南京建成生物工程研究所提供。④用酶组织化学法测定POD和CAT活性;用MIAS-300型自动图像分析系统进行酶反应定量分析。结果以灰度值表示。酶反应活性与其灰度值呈反比。
1.4 统计学分析 各项指标以均数±标准差(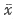 ±s)表示;组间比较用t检验或方差分析;两指标间相互关系用直线相关分析。
±s)表示;组间比较用t检验或方差分析;两指标间相互关系用直线相关分析。
2 结 果
, 百拇医药
2.1 血糖、肾组织NO含量及NOS活性变化 表1示,各病程DM大鼠血糖均显著高于同批对照组(P<0.05),但不同病程DM大鼠血糖无显著差别。DM大鼠于2周病程时肾脏NO水平、NOS活性均明显高于对照组(P<0.05),8,16周时则低于同批对照组 (P<0.05);不同病程对照组的肾脏NO水平及NOS活性差异无显著性(P>0.05)。
表1 各组大鼠血糖、肾组织NO含量、NOS活 性变化(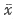 ±s) 病程
±s) 病程
(周)
组 别
n
FBS
(mmol.L-1)
, http://www.100md.com
NO
(μmol.L-1)
NOS
(nmol.min-1.g-1)
2
DM
8
20.56±6.24①
6.38±0.48①
1.190±0.190①
, http://www.100md.com
NC
8
4.27±0.48
4.99±0.23
0.826±0.172
8
DM
7
21.06±0.48①
3.71±0.31①②
0.639±0.090①②
, 百拇医药 NC
7
6.11±0.92
5.03±0.23
0.833±0.147
16
DM
7
17.19±2.90①
3.17±0.25 ①②③
0.486±0.098①②③
NC
, http://www.100md.com
7
4.30±0.77
5.07±0.21
0.805±0.175
①与同批对照组比较P<0.05;②与2周DM组比较P<0.05;③与8周DM组比较P <0.05
2.2 肾组织SOD,CAT,POD活性及LPO水平变化 表2示,DM大鼠在2周病程时肾组织SOD,CAT活性下降不显著,POD活性则高于NC组(P<0.05), 而在8,16周时,SOD,CAT和POD活性均显著低于同批NC组(P<0.05);各病程DM大鼠肾组织L PO水平均显著高于同批NC组(P<0.05),且随病程的延长而呈不断增高趋势。
表2 各组大鼠SOD,LPO,POD及CAT活性变化 (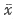 ±s) 病程(周)
±s) 病程(周)
, 百拇医药
组别
n
SOD(Nu.ml-1)
LPO(μmol.ml-1)
POD(灰度值)
CAT(灰度值)
2
DM
8
101.16±6.05
19.77±1.65①
, 百拇医药
49.13±5.30①
46.99±1.35
NC
8
122.93±7.31
11.03±2.54
59.00± 6.57
51.71±1.53
8
DM
7
95.82±15.99①
, 百拇医药
23.39±3.48①
67.97±2.38①
67.90±2.94①
NC
7
123.65±7.12
12.33±1.54
54.93±1.45
52.00±5.25
16
DM
, 百拇医药
7
88.38±11.74①
28.84±4.38①
70.71±5.47①
69.57±3.78①
NC
7
112.28±10.40
19.77±1.65
52.86±8.44
48.14±7.20
, 百拇医药
①与同批对照组比较P<0.05
2.3 DM大鼠肾脏NO与肾组织NOS活性的关系 各病程DM大鼠NO水平与NOS活性呈直线正相关(r=0.887,P<0.01)。
3 讨 论
NO是一种重要的生物调节剂,由NOS以L-Arg为底物合成。本实验DM大鼠NO水平与NOS活性呈直线正相关,表明NO与NOS的一致性。有研究发现,糖尿病早期NO合成过多[2],而进展后期却存在NO源性内皮机能障碍[7]。故有人推测DM内源性NO变化可能是先升高后下降的双相过程,且其变化主要与高血糖的持续时间有关[8]。本实验中各病程DM大鼠血糖均高于同批对照组,但相互之间却无显著差别,其肾组织NO水平,NOS活性则表现为由第2周的升高至第8,16周的下降过程;而在血糖水平较低且无差别的各相应对照组,NO水平及NOS活性无变化。在DM大鼠中,肾脏NO水平与血糖浓度关系不大,而与高血糖持续时间呈负相关。此结果表明高血糖是导致糖尿病肾组织NO改变的重要原因,且NO由早期升高到后期下降的动态变化又主要与高血糖的持续时间有关。
, 百拇医药
DM内源性NO变化机制与多种因素有关。有资料表明,高血糖所致氧自由基的产生是糖尿病NO变化的重要原因之一。Graier[3]研究发现,糖尿病初期,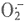 增多能刺激NO的生物合成,其机制可能是使Ca2+内流和释放增加,激活结构型NOS(cNOS)而使NO产生增多。然而,研究又表明,
增多能刺激NO的生物合成,其机制可能是使Ca2+内流和释放增加,激活结构型NOS(cNOS)而使NO产生增多。然而,研究又表明,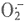 亦是NO的清除剂,且SOD等抗氧化酶活性的下降对NOS具有抑制作用。Ohishi[9]等通过观察STZ诱导的DM大鼠肾小球出球动脉在经SOD处理后对L-硝基-精氨酸(L-NNA)的反应性,发现SOD活性抑制可降低NO对肾动脉的影响。Graier[3]认为,DM早期,作为血管壁保护因子和自由基清除因子的NO的合成增多,主要是对
亦是NO的清除剂,且SOD等抗氧化酶活性的下降对NOS具有抑制作用。Ohishi[9]等通过观察STZ诱导的DM大鼠肾小球出球动脉在经SOD处理后对L-硝基-精氨酸(L-NNA)的反应性,发现SOD活性抑制可降低NO对肾动脉的影响。Graier[3]认为,DM早期,作为血管壁保护因子和自由基清除因子的NO的合成增多,主要是对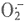 增多的一种代偿反应;随着DM发展,自由基不断增多,抗氧化酶活性减弱,NO的合成则表现为受抑制的趋势。本实验DM大鼠在两周病程时LPO水平升高,SOD和CAT活性下降不显著,而POD活性却高于对照组,肾组织NO产生增多。此现象表明病程初期,由于高血糖的影响,自由基产生已开始增多,脂质过氧化增强。但肾组织对氧化反应增强的一种适应性代偿反应可出现部分抗氧化酶活性的适度增高[4]。此时
增多的一种代偿反应;随着DM发展,自由基不断增多,抗氧化酶活性减弱,NO的合成则表现为受抑制的趋势。本实验DM大鼠在两周病程时LPO水平升高,SOD和CAT活性下降不显著,而POD活性却高于对照组,肾组织NO产生增多。此现象表明病程初期,由于高血糖的影响,自由基产生已开始增多,脂质过氧化增强。但肾组织对氧化反应增强的一种适应性代偿反应可出现部分抗氧化酶活性的适度增高[4]。此时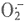 对肾脏的影响主要表现为刺激NO的合成作用。然而,在8和16周病程时,DM大鼠肾组织LPO水平进一步升高,SOD,POD及CAT活性均显著低于同批对照组,NO水平及NOS活性下降。表明病程后期自由基产生进一步增多,肾脏抗氧化酶活性逐渐下降,NO表现为受抑制的趋势。
对肾脏的影响主要表现为刺激NO的合成作用。然而,在8和16周病程时,DM大鼠肾组织LPO水平进一步升高,SOD,POD及CAT活性均显著低于同批对照组,NO水平及NOS活性下降。表明病程后期自由基产生进一步增多,肾脏抗氧化酶活性逐渐下降,NO表现为受抑制的趋势。
, 百拇医药
总之,DM大鼠肾组织NO水平表现为随病程延长而先升高后下降的动态变化。这一变化与高血糖所致的肾组织抗氧化机能改变有关。提示NO与氧自由基的相互作用可能在DM的发生发展中起重要作用。
参 考 文 献
1 Cohen RA. Dysfunction of vascular endothelium in diabetes me llitus. Circulation, 1993,87(Suppl. V):v67~v76
2 Tolins JP, Shultz PJ, Raij L, et al. Abnormal renal hemodynamic response to reduced renal perfusions pressure in diabetic rats: role of NO. Am J Physiol, 1993,265:F886~F895
, 百拇医药
3 Graier WF, Simecek S, Kuokvetz WR, et al. High d-glucose-induced changes in endothelial Ca2+/EDRF signaling are due to generation of superoxide a rions. Diabetes, 1996,45:1386~1395
4 李才,张秀云,候方玉,等.实验性糖尿病大鼠肾脏自由基防御机能的改变及其意义.中国病理生理杂志,1995,11(6):638~640
5 Archer S. Measurement of nitric oxide in biological models. FASEB J, 1993,7:3 49~360
6 Knowles RG, Salter M, Brools SL, et al. Anti-inflammatory glucocorticoid s inhibit the induction by endotoxin of nitric oxide synthase in the lung, liver and aorta of the rat. Biochem Biophys Res Commun, 1990,172:1042~1048
, http://www.100md.com
7 Graven PA, Studer RK, Derubertis FR. Impaired nitric oxide release by glomeru li from diabetic rats. Metabolism, 1995,44(6):695~698
8 Washer TC, Graier WF, Bahadori B, et al. Time course of endothelial dysfu nction in diabetes mellitus. Circulation, 1994,90:1109
9 Ohishik, Carmines PK. Superoxide dismutase restores the influence of nitric o xide on renal arterioles in diabetes mellitus. J Am Soc Nephrol, 1995,5(8):1559 ~1566, 百拇医药
单位:吴 静 韩秀云(附属湘雅医院内分泌科 长沙 410008);周 军(组织胚胎学教研室 长沙 410078);荆照政 唐 剑(附属湘雅医院中心实验室 长沙 410078)
关键词:糖尿病;肾脏;一氧化氮;氧自由基;疾病模型;动物;大鼠
湖南医科大学学报990613
提要 为探讨糖尿病(DM)大鼠肾脏一氧化氮(NO)变化与氧自由基的关系,测定链脲佐菌素(STZ)诱导的DM大鼠及对照组(NC)于病程2,8,16周时肾组织NO含量和一氧化氮合酶(NOS)活性,脂质过氧化物(LPO)水平及超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性变化。结果表明:DM大鼠肾脏NO水平及NOS活性随病程的延长由升高至下降;各病程DM大鼠肾脏LPO水平均高于同批NC组,8与16周时,肾组织SOD,POD,CAT活性低于同批NC组。提示STZ诱导的DM大鼠肾脏NO水平的动态变化可能与高血糖所致的肾脏抗氧化机能改变有关。
, http://www.100md.com
中国图书分类号 R587.1
Relationship between nitric oxide and oxygen free radicals in
different duration of diabetes in rat kidney
Wu Jing Han Xiuyun
(Department of Endocrinology, Xiangya Hospital, Hunan Medical Universi ty, Changsha 410008)
Zhou Jun
(Department of Histology and Embryology, Hunan Medical University, Changs ha 410078)
, 百拇医药
To study the relationship between nitric oxide(NO) and oxygen free radi cals in rat kidney of diabetes mellitus(DM), the authors examined the changes of renal tissue NO level and nitric oxide synthase(NOS) activity, lipid peroxidation(LPO) level and superoxide dismutase(SOD), peroxidase(POD) and catalase(CAT) a ctivities in streptozotocin(STZ)-induced diabetic rats and normal controls(NC) at the 2nd, 8th- and 16th-week. The results showed that renal-tissue NO leve land NOS activity were increased at the 2nd week, but decreased at the 8th-and 16th-week; LPO levels were significantly elevated in all DM groups than those in NC groups. SOD, POD and CAT activities dcreased significantly in the 8th and 16th week DM groups compared with those in NC groups. The results suggest that NO level in kidney of STZ-induced diabetic rats dynamically change with the disease course of dvelopment. This change may be related with the change of antioxidation in kidney which high glucose induces.
, 百拇医药
Key words diabetes; kidney; nitric oxide; oxygen free radica ls; disease model,animal; rats
糖尿病肾病(DN)是糖尿病(DM)常见的并发症之一。最近有研究表明,一氧化氮(NO)所致内皮源性舒张机能异常亦参与DN的发病机制,且其变化与氧自由基产生有关[1~3]。氧自由基主要指超氧阴离子(
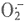 )、羟自由基(OH.)和过氧化氢(H2O2)。糖尿病人在葡萄糖氧化过程中产生大量自由基,而同时肾脏自由基防御机能下降,肾脏抗氧化酶活性减弱[4]。故通过检测肾脏抗氧化酶活性及脂质过氧化物(LPO)水平变化可推测肾脏自由基代谢紊乱的程度。DM自由基和NO的动态变化及其相互关系目前未见深入研究的报道。本实验通过观察不同病程链脲佐菌素(STZ)诱导的DM大鼠肾组织NO含量和一氧化氮合酶(NOS)活性及肾脏抗氧化机能的改变,探讨DM内源性NO的动态变化及相关机制。
)、羟自由基(OH.)和过氧化氢(H2O2)。糖尿病人在葡萄糖氧化过程中产生大量自由基,而同时肾脏自由基防御机能下降,肾脏抗氧化酶活性减弱[4]。故通过检测肾脏抗氧化酶活性及脂质过氧化物(LPO)水平变化可推测肾脏自由基代谢紊乱的程度。DM自由基和NO的动态变化及其相互关系目前未见深入研究的报道。本实验通过观察不同病程链脲佐菌素(STZ)诱导的DM大鼠肾组织NO含量和一氧化氮合酶(NOS)活性及肾脏抗氧化机能的改变,探讨DM内源性NO的动态变化及相关机制。, 百拇医药
1 材料与方法
1.1 糖尿病动物模型的建立和分组 选择体重150~200g的健康雄性SD大鼠60只(由本院动物室提供),随机分为DM组和正常对照组(NC)。禁食12h后DM组一次性腹腔注射STZ65mg.kg-1(美国Sigma公司生产,用0.1mol.L-1pH4.5的柠檬酸缓冲液配成2%的溶液),3d后选择尿糖强阳性、血糖≥16.7mmol.L-1者为DM大鼠。NC组注射等体积柠檬酸缓冲液。
1.2 取材 于DM形成后2,8,16周,两组各取相同例数的动物,禁食12h后麻醉,采静脉血备测血糖(FBS)。取双肾:右肾于液氮中速冻保存,备测肾组织NO含量、NOS活性、超氧化物歧化酶(SOD)活性及LPO水平;左肾立即冰冻切片,备测过氧化物酶(POD)及过氧化氢酶(CAT)活性。
, 百拇医药
1.3 检测指标与方法 ①血糖测定用葡萄糖氧化酶法。②肾组织NO含量检测用重氮化反应法[5];NOS活性检测用分光光度法[6],其活性单位以每克组织每分钟产生的NO量(nmol.min-1.g-1)表示。药盒均由北京军事医学科学研究所提供。③肾组织SOD活性用黄嘌呤氧化法测定;LPO水平采用化学比色法,以丙二醛(MDA)表示。药盒均由南京建成生物工程研究所提供。④用酶组织化学法测定POD和CAT活性;用MIAS-300型自动图像分析系统进行酶反应定量分析。结果以灰度值表示。酶反应活性与其灰度值呈反比。
1.4 统计学分析 各项指标以均数±标准差(
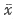 ±s)表示;组间比较用t检验或方差分析;两指标间相互关系用直线相关分析。
±s)表示;组间比较用t检验或方差分析;两指标间相互关系用直线相关分析。2 结 果
, 百拇医药
2.1 血糖、肾组织NO含量及NOS活性变化 表1示,各病程DM大鼠血糖均显著高于同批对照组(P<0.05),但不同病程DM大鼠血糖无显著差别。DM大鼠于2周病程时肾脏NO水平、NOS活性均明显高于对照组(P<0.05),8,16周时则低于同批对照组 (P<0.05);不同病程对照组的肾脏NO水平及NOS活性差异无显著性(P>0.05)。
表1 各组大鼠血糖、肾组织NO含量、NOS活 性变化(
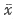 ±s) 病程
±s) 病程(周)
组 别
n
FBS
(mmol.L-1)
, http://www.100md.com
NO
(μmol.L-1)
NOS
(nmol.min-1.g-1)
2
DM
8
20.56±6.24①
6.38±0.48①
1.190±0.190①
, http://www.100md.com
NC
8
4.27±0.48
4.99±0.23
0.826±0.172
8
DM
7
21.06±0.48①
3.71±0.31①②
0.639±0.090①②
, 百拇医药 NC
7
6.11±0.92
5.03±0.23
0.833±0.147
16
DM
7
17.19±2.90①
3.17±0.25 ①②③
0.486±0.098①②③
NC
, http://www.100md.com
7
4.30±0.77
5.07±0.21
0.805±0.175
①与同批对照组比较P<0.05;②与2周DM组比较P<0.05;③与8周DM组比较P <0.05
2.2 肾组织SOD,CAT,POD活性及LPO水平变化 表2示,DM大鼠在2周病程时肾组织SOD,CAT活性下降不显著,POD活性则高于NC组(P<0.05), 而在8,16周时,SOD,CAT和POD活性均显著低于同批NC组(P<0.05);各病程DM大鼠肾组织L PO水平均显著高于同批NC组(P<0.05),且随病程的延长而呈不断增高趋势。
表2 各组大鼠SOD,LPO,POD及CAT活性变化 (
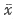 ±s) 病程(周)
±s) 病程(周), 百拇医药
组别
n
SOD(Nu.ml-1)
LPO(μmol.ml-1)
POD(灰度值)
CAT(灰度值)
2
DM
8
101.16±6.05
19.77±1.65①
, 百拇医药
49.13±5.30①
46.99±1.35
NC
8
122.93±7.31
11.03±2.54
59.00± 6.57
51.71±1.53
8
DM
7
95.82±15.99①
, 百拇医药
23.39±3.48①
67.97±2.38①
67.90±2.94①
NC
7
123.65±7.12
12.33±1.54
54.93±1.45
52.00±5.25
16
DM
, 百拇医药
7
88.38±11.74①
28.84±4.38①
70.71±5.47①
69.57±3.78①
NC
7
112.28±10.40
19.77±1.65
52.86±8.44
48.14±7.20
, 百拇医药
①与同批对照组比较P<0.05
2.3 DM大鼠肾脏NO与肾组织NOS活性的关系 各病程DM大鼠NO水平与NOS活性呈直线正相关(r=0.887,P<0.01)。
3 讨 论
NO是一种重要的生物调节剂,由NOS以L-Arg为底物合成。本实验DM大鼠NO水平与NOS活性呈直线正相关,表明NO与NOS的一致性。有研究发现,糖尿病早期NO合成过多[2],而进展后期却存在NO源性内皮机能障碍[7]。故有人推测DM内源性NO变化可能是先升高后下降的双相过程,且其变化主要与高血糖的持续时间有关[8]。本实验中各病程DM大鼠血糖均高于同批对照组,但相互之间却无显著差别,其肾组织NO水平,NOS活性则表现为由第2周的升高至第8,16周的下降过程;而在血糖水平较低且无差别的各相应对照组,NO水平及NOS活性无变化。在DM大鼠中,肾脏NO水平与血糖浓度关系不大,而与高血糖持续时间呈负相关。此结果表明高血糖是导致糖尿病肾组织NO改变的重要原因,且NO由早期升高到后期下降的动态变化又主要与高血糖的持续时间有关。
, 百拇医药
DM内源性NO变化机制与多种因素有关。有资料表明,高血糖所致氧自由基的产生是糖尿病NO变化的重要原因之一。Graier[3]研究发现,糖尿病初期,
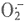 增多能刺激NO的生物合成,其机制可能是使Ca2+内流和释放增加,激活结构型NOS(cNOS)而使NO产生增多。然而,研究又表明,
增多能刺激NO的生物合成,其机制可能是使Ca2+内流和释放增加,激活结构型NOS(cNOS)而使NO产生增多。然而,研究又表明,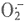 亦是NO的清除剂,且SOD等抗氧化酶活性的下降对NOS具有抑制作用。Ohishi[9]等通过观察STZ诱导的DM大鼠肾小球出球动脉在经SOD处理后对L-硝基-精氨酸(L-NNA)的反应性,发现SOD活性抑制可降低NO对肾动脉的影响。Graier[3]认为,DM早期,作为血管壁保护因子和自由基清除因子的NO的合成增多,主要是对
亦是NO的清除剂,且SOD等抗氧化酶活性的下降对NOS具有抑制作用。Ohishi[9]等通过观察STZ诱导的DM大鼠肾小球出球动脉在经SOD处理后对L-硝基-精氨酸(L-NNA)的反应性,发现SOD活性抑制可降低NO对肾动脉的影响。Graier[3]认为,DM早期,作为血管壁保护因子和自由基清除因子的NO的合成增多,主要是对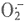 增多的一种代偿反应;随着DM发展,自由基不断增多,抗氧化酶活性减弱,NO的合成则表现为受抑制的趋势。本实验DM大鼠在两周病程时LPO水平升高,SOD和CAT活性下降不显著,而POD活性却高于对照组,肾组织NO产生增多。此现象表明病程初期,由于高血糖的影响,自由基产生已开始增多,脂质过氧化增强。但肾组织对氧化反应增强的一种适应性代偿反应可出现部分抗氧化酶活性的适度增高[4]。此时
增多的一种代偿反应;随着DM发展,自由基不断增多,抗氧化酶活性减弱,NO的合成则表现为受抑制的趋势。本实验DM大鼠在两周病程时LPO水平升高,SOD和CAT活性下降不显著,而POD活性却高于对照组,肾组织NO产生增多。此现象表明病程初期,由于高血糖的影响,自由基产生已开始增多,脂质过氧化增强。但肾组织对氧化反应增强的一种适应性代偿反应可出现部分抗氧化酶活性的适度增高[4]。此时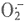 对肾脏的影响主要表现为刺激NO的合成作用。然而,在8和16周病程时,DM大鼠肾组织LPO水平进一步升高,SOD,POD及CAT活性均显著低于同批对照组,NO水平及NOS活性下降。表明病程后期自由基产生进一步增多,肾脏抗氧化酶活性逐渐下降,NO表现为受抑制的趋势。
对肾脏的影响主要表现为刺激NO的合成作用。然而,在8和16周病程时,DM大鼠肾组织LPO水平进一步升高,SOD,POD及CAT活性均显著低于同批对照组,NO水平及NOS活性下降。表明病程后期自由基产生进一步增多,肾脏抗氧化酶活性逐渐下降,NO表现为受抑制的趋势。, 百拇医药
总之,DM大鼠肾组织NO水平表现为随病程延长而先升高后下降的动态变化。这一变化与高血糖所致的肾组织抗氧化机能改变有关。提示NO与氧自由基的相互作用可能在DM的发生发展中起重要作用。
参 考 文 献
1 Cohen RA. Dysfunction of vascular endothelium in diabetes me llitus. Circulation, 1993,87(Suppl. V):v67~v76
2 Tolins JP, Shultz PJ, Raij L, et al. Abnormal renal hemodynamic response to reduced renal perfusions pressure in diabetic rats: role of NO. Am J Physiol, 1993,265:F886~F895
, 百拇医药
3 Graier WF, Simecek S, Kuokvetz WR, et al. High d-glucose-induced changes in endothelial Ca2+/EDRF signaling are due to generation of superoxide a rions. Diabetes, 1996,45:1386~1395
4 李才,张秀云,候方玉,等.实验性糖尿病大鼠肾脏自由基防御机能的改变及其意义.中国病理生理杂志,1995,11(6):638~640
5 Archer S. Measurement of nitric oxide in biological models. FASEB J, 1993,7:3 49~360
6 Knowles RG, Salter M, Brools SL, et al. Anti-inflammatory glucocorticoid s inhibit the induction by endotoxin of nitric oxide synthase in the lung, liver and aorta of the rat. Biochem Biophys Res Commun, 1990,172:1042~1048
, http://www.100md.com
7 Graven PA, Studer RK, Derubertis FR. Impaired nitric oxide release by glomeru li from diabetic rats. Metabolism, 1995,44(6):695~698
8 Washer TC, Graier WF, Bahadori B, et al. Time course of endothelial dysfu nction in diabetes mellitus. Circulation, 1994,90:1109
9 Ohishik, Carmines PK. Superoxide dismutase restores the influence of nitric o xide on renal arterioles in diabetes mellitus. J Am Soc Nephrol, 1995,5(8):1559 ~1566, 百拇医药